RESUMO
Racional:
O adenocarcinoma gástrico e da junção esofagogástrica é responsável por aproximadamente 13,5% das mortes relacionadas ao câncer. Dado que esses tumores não são normalmente detectados até que já estejam em estágios avançados, a neoadjuvância desempenha um papel fundamental na melhoria da sobrevida em longo prazo. A identificação daqueles com resposta patológica completa (pCR) após a quimioterapia neoadjuvante (NAC) é um grande desafio, com efeitos na preservação do órgão, extensão da ressecção e cirurgia adicional. Há pouca ou nenhuma informação na literatura sobre quais sinais endoscópicos devem ser avaliados após a NAC, ou mesmo quando essa reavaliação deve ocorrer.
Objetivo:
Descrever os aspectos endoscópicos de pacientes com adenocarcinoma gástrico e da junção esofagogástrica que foram submetidos à quimioterapia neoadjuvante e alcançaram pCR, e determinar a acurácia da esofagogastroduodenoscopia (EGD) em predizer a pCR.
Métodos:
Foram revisados os prontuários de pacientes submetidos à gastrectomia subtotal e total após NAC, com resultado anatomopatológico de pCR.
Resultados:
Vinte e nove pacientes que alcançaram pCR após NAC foram identificados no período estudado. As respostas endoscópicas foram usadas para classificar os pacientes em dois grupos: G1- achados endoscópicos consistentes com pCR, G2 - achados endoscópicos não consistentes com pCR. A avaliação endoscópica no G1 esteve presente em igual percentual (47,4%; p=0,28) na classificação de Borrmann II e III. Nesse grupo, a predominância foi no corpo gástrico (57,9%; p=0,14), subtipo intestinal com 42,1% (p=0,75), grau indiferenciado, 62,5% (p=0,78), Herb+ em 73,3% (p=0,68). O achado mais significativo, no entanto, foi que o intervalo de tempo entre NAC e EGD foi maior para G1 do que G2 (24,4 vs. 10,2 dias, p=0,008).
Conclusão:
A EGD após NAC, nessa pesquisa, sugeriu ser método útil para prever pCR, mediante uma classificação de resposta confiável. Além disso, o intervalo de tempo entre NAC e EGD parece influenciar significativamente a sua capacidade preditiva de diagnosticar a pCR.
DESCRITORES:
Terapia neoadjuvante; Neoplasias gástricas; Resultado do tratamento; Endoscopia do sistema digestório; Estadiamento de neoplasias
ABSTRACT
Background:
Gastric and esophagogastric junction adenocarcinoma are responsible for approximately 13.5% of cancer-related deaths. Given the fact that these tumors are not typically detected until they are already in the advanced stages, neoadjuvancy plays a fundamental role in improving long-term survival. Identification of those with complete pathological response (pCR) after neoadjuvant chemotherapy (NAC) is a major challenge, with effects on organ preservation, extent of resection, and additional surgery. There is little or no information in the literature about which endoscopic signs should be evaluated after NAC, or even when such re-evaluation should occur.
Aim:
To describe the endoscopic aspects of patients with gastric and esophagogastric junction adenocarcinomas who underwent NAC and achieved pCR, and to determine the accuracy of esophagogastroduodenoscopy (EGD) in predicting the pCR.
Methods:
A survey was conducted of the medical records of patients with these tumors who were submitted to gastrectomy after NAC, with anatomopathological result of pCR.
Results:
Twenty-nine patients were identified who achieved pCR after NAC within the study period. Endoscopic responses were used to classify patients into two groups: G1-endoscopic findings consistent with pCR and G2-endoscopic findings not consistent with pCR. Endoscopic evaluation in G1 was present in an equal percentage (47.4%; p=0.28) in Borrmann classification II and III. In this group, the predominance was in the gastric body (57.9%; p=0.14), intestinal subtype with 42.1% (p=0.75), undifferentiated degree, 62.5% (p=0.78), Herb+ in 73.3% (p=0.68). The most significant finding, however, was that the time interval between NAC and EGD was longer for G1 than G2 (24.4 vs. 10.2 days, p=0.008).
Conclusion:
EGD after NAC seems to be a useful tool for predicting pCR, and it may be possible to use it to create a reliable response classification. In addition, the time interval between NAC and EGD appears to significantly influence the predictive power of endoscopy for pCR.
HEADINGS:
Neoadjuvant therapy; Stomach neoplasms; Treatment outcome; Endoscopy, digestive system; Neoplasm staging
INTRODUÇÃO
Apesar da redução na incidência de adenocarcinoma gástrico (GC) na última década, ele continua sendo a terceira causa mais comum de morte relacionada ao câncer no mundo, com uma estimativa de 783.000 mortes por ano11 Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. DOI: 10.3322/caac.21492
https://doi.org/10.3322/caac.21492...
. A incidência de adenocarcinoma da junção esofagogástrica (GEJ) aumentou acentuadamente nos países ocidentais nos últimos anos55 Coimbra FJF, de Jesus VHF, Ribeiro HSC, Diniz AL, de Godoy AL, de Farias IC, Felismino T, Mello CAL, Almeida MF, Begnami MDFS et al. Impact of ypT, ypN, and adjuvant therapy on survival in gastric cancer patients treated with perioperative chemotherapy and radical surgery. Ann Surg Oncol. 2019;26:3618-26. DOI: 10.1245/s10434-019-07454-0
https://doi.org/10.1245/s10434-019-07454...
,1414 Papenfuss WA, Kukar M, Oxenberg J, Attwood K, Nurkin S, Malhotra U, Wilkinson NW. Morbidity and mortality associated with gastrectomy for gastric cancer. Ann Surg Oncol. 2014;21:3008-14. DOI: 10.1245/s10434-014-3664-z
https://doi.org/10.1245/s10434-014-3664-...
.
Análises populacionais nos Estados Unidos relataram um aumento de quase 2,5 vezes na incidência desde a década de 19701414 Papenfuss WA, Kukar M, Oxenberg J, Attwood K, Nurkin S, Malhotra U, Wilkinson NW. Morbidity and mortality associated with gastrectomy for gastric cancer. Ann Surg Oncol. 2014;21:3008-14. DOI: 10.1245/s10434-014-3664-z
https://doi.org/10.1245/s10434-014-3664-...
. No Brasil, o GC é o 5º câncer mais comum no geral (3º entre os homens e 5º entre as mulheres)33 Ministério da Saúde. Instituto Nacional de Câncer. Estimativa 2020. incidência de Câncer no Brasil. Rio de Janeiro: INCA; 2019.. Para cada ano de 2020 a 2022, foi projetado que haverá 13.360 novos casos em homens e 7.870 novos casos em mulheres por cem mil pessoas1515 Cho H, Nakamura J, Asaumi Y, Yabusaki H, Sakon M, Takasu N, Kobayashi T, Aoki T, Shiraishi O, Kishimoto H, Nunobe S, et al. Long-term survival outcomes of advanced gastric cancer patients who achieved a pathological complete response with neoadjuvant chemotherapy: a systematic review of the literature. Ann Surg Oncol. 2015;22:787-92. DOI: 10.1245/s10434-014-4084-9
https://doi.org/10.1245/s10434-014-4084-...
. Para o adenocarcinoma de esôfago no Brasil, espera-se que ocorram 8.690 novos casos em homens e 2.700 novos casos em mulheres a cada cem mil1515 Cho H, Nakamura J, Asaumi Y, Yabusaki H, Sakon M, Takasu N, Kobayashi T, Aoki T, Shiraishi O, Kishimoto H, Nunobe S, et al. Long-term survival outcomes of advanced gastric cancer patients who achieved a pathological complete response with neoadjuvant chemotherapy: a systematic review of the literature. Ann Surg Oncol. 2015;22:787-92. DOI: 10.1245/s10434-014-4084-9
https://doi.org/10.1245/s10434-014-4084-...
.
O desenvolvimento de GC pode ser induzido pelas interações de múltiplos fatores genéticos e ambientais de formas complexas2323 Redondo-Cerezo E, Martínez-Cara JG, Jiménez-Rosales R, Valverde-López F, Caballero-Mateos A, Puente J P, Fernández JLA, Muñoz MU, Hierro ML, Teresa J. Endoscopic ultrasound in gastric cancer staging before and after neoadjuvant chemotherapy. a comparison with PET-CT in a clinical series. United European Gastroenterol J. 2017;5:641-7. DOI: 10.1177/2050640616684697
https://doi.org/10.1177/2050640616684697...
. Atualmente, a abordagem terapêutica recomendada para tumores localmente avançados do estômago e GEJ é a quimioterapia perioperatória33 Ministério da Saúde. Instituto Nacional de Câncer. Estimativa 2020. incidência de Câncer no Brasil. Rio de Janeiro: INCA; 2019.,77 Felismino TC, de Oliveira ACF, Alves ACF, da Costa Junior WL, Coimbra FJF, de Souza Begnami MDF, Riechelmann RP, Jesus VHF, Mello CAL. Primary tumor location is a predictor of poor prognosis in patients with locally advanced esophagogastric cancer treated with perioperative chemotherapy. J Gastrointest Cancer. 2020;51:484-90. DOI: 10.1007/s12029-019-00258-1
https://doi.org/10.1007/s12029-019-00258...
.
Vários estudos demonstraram que essa estratégia produz taxas aumentadas de ressecção completa, redução do estadiamento, sobrevida global e sobrevida livre de progressão33 Ministério da Saúde. Instituto Nacional de Câncer. Estimativa 2020. incidência de Câncer no Brasil. Rio de Janeiro: INCA; 2019.,88 Tada K, Etoh T, Shitomi Y, Ueda Y, Tojigamori M, Shiroshita H, Shiraishi N, Inomata M. A case of advanced gastric cancer achieved a pathological complete response by chemotherapy. Surg Case Rep. 2017;3:68. DOI: 10.1186/s40792-017-0344-9
https://doi.org/10.1186/s40792-017-0344-...
. Também foi notado que alguns tumores apresentam melhor responsividade do que outros77 Felismino TC, de Oliveira ACF, Alves ACF, da Costa Junior WL, Coimbra FJF, de Souza Begnami MDF, Riechelmann RP, Jesus VHF, Mello CAL. Primary tumor location is a predictor of poor prognosis in patients with locally advanced esophagogastric cancer treated with perioperative chemotherapy. J Gastrointest Cancer. 2020;51:484-90. DOI: 10.1007/s12029-019-00258-1
https://doi.org/10.1007/s12029-019-00258...
,88 Tada K, Etoh T, Shitomi Y, Ueda Y, Tojigamori M, Shiroshita H, Shiraishi N, Inomata M. A case of advanced gastric cancer achieved a pathological complete response by chemotherapy. Surg Case Rep. 2017;3:68. DOI: 10.1186/s40792-017-0344-9
https://doi.org/10.1186/s40792-017-0344-...
. Portanto, métodos diagnósticos que podem predizer uma resposta patológica completa (pCR) têm importantes implicações clínicas77 Felismino TC, de Oliveira ACF, Alves ACF, da Costa Junior WL, Coimbra FJF, de Souza Begnami MDF, Riechelmann RP, Jesus VHF, Mello CAL. Primary tumor location is a predictor of poor prognosis in patients with locally advanced esophagogastric cancer treated with perioperative chemotherapy. J Gastrointest Cancer. 2020;51:484-90. DOI: 10.1007/s12029-019-00258-1
https://doi.org/10.1007/s12029-019-00258...
,8.
Vários esquemas de quimioterapia combinados mostraram boa eficácia para GC e GEJ não ressecável, permitindo uma gastrectomia curativa potencial2222 Park SR, Lee JS, Kim CG, Kim HK, Kook MC, Kim YW, Ryu KW, Lee JH, Bae JM, Choi IJ. Endoscopic ultrasound and computed tomography in restaging and predicting prognosis after neoadjuvant chemotherapy in patients with locally advanced gastric cancer. Cancer. 2008;112:2368-76. DOI: 10.1002/cncr.23483
https://doi.org/10.1002/cncr.23483...
. Dentre esses esquemas, o mais utilizado hoje é o esquema FLOT, composto por fluorouracil, leucovorina, oxaliplatina e docetaxel22 Lin D, Khan U, Goetze TO, Reizine N, Goodman KA, Shah MA, Catenacci VD, Al-Batran SE, Posey JA. Gastroesophageal junction adenocarcinoma: is there an optimal management? Am Soc Clin Oncol Educ Book. 2019;39:e88-e95. DOI: 10.1200/EDBK_236827
https://doi.org/10.1200/EDBK_236827...
. Em pacientes com lesão localmente avançada acima do tumor em estágio clínico (cT) 2 ou nódulos linfáticos comprometidos, a quimioterapia neoadjuvante (NAC) pode aumentar a probabilidade de cirurgia curativa, com taxas de resposta completa do tumor em torno de 10% e taxas aumentadas de ambos livres de progressão e geral sobrevivência99 Al-Batran SE, Homann N, Pauligk C, Goetze TO, Meiler J, Kasper S, Kopp HG, Mayer F, Haag GM, Lindig U et al. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised phase 2/3 trial. Lancet. 2019;393:1948-57. DOI: 10.1016/S0140-6736(18)32557-1
https://doi.org/10.1016/S0140-6736(18)32...
,2121 Japanese Gastric Cancer Association. Japanese classification of gastric carcinoma--2nd English edition--response assessment of chemotherapy and radiotherapy for gastric carcinoma: clinical criteria. Gastric Cancer. 2001;4:1-8. DOI: 10.1007/s101200100009
https://doi.org/10.1007/s101200100009...
. Além disso, o NAC pode oferecer opções de tratamento para pacientes para os quais a cirurgia é arriscada, como aqueles com progressão mais avançada da doença44 Zare M, Jafari-Nedooshan J, Aghili K, Ahrar H, Jarahzadeh MH, Seifi-Shalamzari N, Zare-Shehneh M, Neamatzadeh H. Association of MMP-7 -181a>g polymorphism with colorectal cancer and gastric cancer susceptibility: a systematic review and meta-analysis. Arq Bras Cir Dig. 2019;32(3):e1449. doi: 10.1590/0102-672020190001e1449.
https://doi.org/10.1590/0102-67202019000...
.
A identificação de pacientes com pCR após NAC pode, no futuro, se tornar uma ferramenta para selecionar aqueles que realmente se beneficiam da quimioterapia adjuvante e talvez até mesmo na supressão da cirurgia para pacientes de alto risco para o procedimento, tornando-se uma ferramenta útil na decisão terapia multidisciplinar99 Al-Batran SE, Homann N, Pauligk C, Goetze TO, Meiler J, Kasper S, Kopp HG, Mayer F, Haag GM, Lindig U et al. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised phase 2/3 trial. Lancet. 2019;393:1948-57. DOI: 10.1016/S0140-6736(18)32557-1
https://doi.org/10.1016/S0140-6736(18)32...
. Em geral, a taxa de morbidade das gastrectomias radicais é em torno de 33,5% e a mortalidade entre 0,6% a 4,7%11 Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. DOI: 10.3322/caac.21492
https://doi.org/10.3322/caac.21492...
11 Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. DOI: 10.3322/caac.21492
https://doi.org/10.3322/caac.21492...
,1616 Smyth EC, Verheij M, Allum W, Cunningham D, Cervantes A, Arnold D. Gastric cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2016;27(suppl 5):v38-v49. DOI: 10.1093/annonc/mdw350
https://doi.org/10.1093/annonc/mdw350...
. De acordo com um estudo de 2015, a sobrevida global de pacientes em estágio III/IV que se submeteram a NAC e que obtiveram pCR foi semelhante àqueles com estágio I/II que não receberam NAC66 Barchi LC, Ramos MFKP, Dias AR, Forones NM, Carvalho MP, Castro OAP, Kassab P, Costa-Júnior WLD, Weston AC, Zilberstein B et al. Brazilian Gastric Cancer Association guidelines (part 2): update on treatment. Arq Bras Cir Dig. 2021;34(1):e1563. doi: 10.1590/0102-672020210001e1563.
https://doi.org/10.1590/0102-67202021000...
.
Dados publicados recentemente demonstraram que o estadiamento patológico foi melhor do que o estadiamento convencional para predizer responsividade e sobrevida após neoadjuvância55 Coimbra FJF, de Jesus VHF, Ribeiro HSC, Diniz AL, de Godoy AL, de Farias IC, Felismino T, Mello CAL, Almeida MF, Begnami MDFS et al. Impact of ypT, ypN, and adjuvant therapy on survival in gastric cancer patients treated with perioperative chemotherapy and radical surgery. Ann Surg Oncol. 2019;26:3618-26. DOI: 10.1245/s10434-019-07454-0
https://doi.org/10.1245/s10434-019-07454...
. Outros estudos também indicaram que a localização em GEJ e TNM estão associadas a um pior prognóstico77 Felismino TC, de Oliveira ACF, Alves ACF, da Costa Junior WL, Coimbra FJF, de Souza Begnami MDF, Riechelmann RP, Jesus VHF, Mello CAL. Primary tumor location is a predictor of poor prognosis in patients with locally advanced esophagogastric cancer treated with perioperative chemotherapy. J Gastrointest Cancer. 2020;51:484-90. DOI: 10.1007/s12029-019-00258-1
https://doi.org/10.1007/s12029-019-00258...
.
A avaliação endoscópica pré-operatória de pacientes submetidos à NAC é recomendada em muitos serviços, mas até o momento da redação deste artigo não havia descrição publicada dos achados endoscópicos nesses pacientes e o intervalo de tempo ideal entre a NAC e a cirurgia ainda não estava claro. Portanto, no presente estudo, investigamos as seguintes questões: 1) Quais são as características endoscópicas que suportam a detecção de pCR após NAC? 2) Qual é a acurácia diagnóstica e a sensibilidade da esofagogastroduodenoscopia (EGD) na avaliação de pCR após NAC? e 3) Qual intervalo de tempo entre NAC e EGD oferece suporte à previsão de resposta ideal?
MÉTODOS
Este é um estudo retrospectivo em um único centro especializado no tratamento do câncer. Os prontuários médicos foram revisados de pacientes com adenocarcinoma do tipo GC e GEJ submetidos à gastrectomia após NAC com resultado anatomopatológico de pCR. De outubro de 2010 a setembro de 2018, identificamos 31 pacientes com idade > 18 anos submetidos à gastrectomia total ou subtotal após NAC para tratamento de CG e GEJ e que apresentavam pCR. Todos os pacientes foram atendidos no A.C. Camargo Cancer Center, São Paulo, SP, Brasil.
Os estádios clínicos dos pacientes variaram de cT2-cT4. Foram excluídos dois pacientes que perderam o seguimento. Este estudo foi aprovado pelo Comitê de Ética e Pesquisa do A.C. Camargo Cancer Center sob o número: 2892/20.
Desenho do estudo
Todos os EGDs foram realizados por dois endoscopistas seniores usando as linhas de vídeo endoscópicos 150 e 180 (Olympus Medical System Corporation, Hachioji-shi, Tóquio, Japão).
Esofagogastroduodenoscopia 1 (EGD1)
Os pacientes foram submetidos a diagnóstico de EGD com biópsia e estudo anatomopatológico que confirmou adenocarcinomas GC ou GEJ. Nesse momento, o aspecto macroscópico da lesão foi classificado de acordo com a classificação de Borrmann (BC) em: BC-I, lesão polipóide ou vegetante bem definida; BC-II, lesão ulcerada, bem delimitada com bordas claras; BC-III, lesão ulcerada, infiltrativa em parte ou em todas as suas bordas; BC-IV, lesão difusamente infiltrativa, sem limite entre o tumor e a mucosa normal.
Após o diagnóstico histológico, os pacientes foram estadiados por meio de tomografia computadorizada (TC) de tórax, abdômen e/ou pelve e tomografia/tomografia computadorizada por emissão de pósitrons fluoro-2-desoxiglicose (FDG-PET/CT).
Os pacientes foram submetidos a NAC com esquema a base de fluoracil e platina, com 8 ou 12 ciclos, sendo metade das sessões realizada antes da cirurgia e o restante no pós-operatório.
Esofagogastroduodenoscopia 2 (EGD2)
Após 30 dias ao término da NAC pré-operatório, todos os pacientes foram novamente submetidos à EGD e reclassificados de acordo com o aspecto macroscópico da lesão. Após a NAC, os pacientes foram submetidos à gastrectomia parcial ou total com linfadenectomia D2 e as amostras cirúrgicas foram processadas de acordo com os procedimentos padrão.
Os estudos histopatológicos das peças cirúrgicas foram realizadas utilizando o esquema de classificação da Organização Mundial de Saúde para tumores do sistema digestivo, bem como a classificação de Lauren, com as seguintes características registradas: subtipo, tipo de Lauren, profundidade de invasão na parede, status linfonodal, infiltração vascular e neural1919 Li B, Liu HY, Guo SH, Sun P, Gong FM, Jia BQ. Detection of microsatellite instability in gastric cancer and dysplasia tissues. Int J Clin Exp Med. 2015;8:21442-7. PMID: 26885089.
Todas as amostras cirúrgicas foram analisadas por dois patologistas independentes usando a pontuação de regressão do tumor, conforme recomendado pela National Comprehensive Cancer Network11 Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. DOI: 10.3322/caac.21492
https://doi.org/10.3322/caac.21492...
. De acordo com esta escala, uma pontuação de zero indica resposta completa e não compreende células cancerígenas viáveis, incluindo nos gânglios linfáticos. Todos os 29 pacientes incluídos neste estudo apresentaram escores zero e respostas anatomopatológicas completas.
Objetivos e definições
Os objetivos principais deste estudo foram descrever os aspectos endoscópicos de pacientes com adenocarcinoma gástrico ou GEJ submetidos a NAC que exibiram pCR e determinar a acurácia da EGD em predizer essa resposta nesses pacientes.
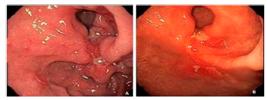
A resposta endoscópica completa (eCR) foi determinada pela presença de uma cicatriz endoscópica (avermelhada ou esbranquiçada) sem lesões ativas após NAC (Figura 1A/B). Os pacientes que atenderam a esse critério foram incluídos no grupo 1 (G1, n = 19). Pacientes que exibiram lesões ativas (úlceras) após NAC foram incluídos no grupo 2 (G2, n = 10; Figura 2A/B).
Os objetivos secundários deste estudo foram avaliar se fatores como sexo, idade, localização do tumor, BC, cT, status do linfonodo, subtipo histopatológico, grau de diferenciação, status do marcador Herb2 e intervalo de tempo entre NAC e EGD2 podem influenciar a sensibilidade de EGD para prever pCR.
Grupo 1: A) Esofagogastroduodenoscopia pré-quimioterapia neoadjuvante evidenciando lesão ulcerada classificação de Borrmann III localizada na cárdia; B) esofagogastroduodenoscopia pós-quimioterapia neoadjuvante evidenciando cicatriz.
Grupo 2: A) Esofagogastroduodenoscopia pré-quimioterapia neoadjuvante evidenciando lesão ulcerada classificação de Borrmann III localizada no antro; B) esofagogastroduodenoscopia pós-quimioterapia neoadjuvante mostrando lesão ativa.
Análise estatística
Todas as análises estatísticas foram realizadas com o software IBM SPSS versão 25. A significância estatística foi definida como p <0,05. As distribuições de frequência absoluta (n) e relativa (%) foram avaliadas para as variáveis qualitativas e as principais medidas de resumo (média, desvio padrão, mediana, mínimo, máximo) para as variáveis quantitativas. Os testes Qui-quadrado e Exato de Fisher foram usados para determinar a associação entre as variáveis qualitativas e a presença de cicatrizes. O teste não paramétrico de Mann-Whitney foi utilizado para associar variáveis quantitativas à presença de cicatriz. Caso fosse encontrada associação entre cicatriz e qualquer variável, a regressão logística era usada para calcular o odds ratio. Para avaliação da cicatriz em relação ao pCR, foram calculadas as principais medidas diagnósticas (sensibilidade, especificidade e acurácia).
RESULTADOS
As características dos pacientes e tumores estão resumidas na Tabela 1. Embora houvesse mais homens participantes do estudo do que mulheres, os gêneros foram distribuídos de forma semelhante entre os grupos (p = 0,22). Na avaliação do G1, em comparação ao G2, mais pacientes apresentaram CG (73,7%, p = 0,67) cT 3 (68,4%, p = 0,72) e linfonodo ausente (68,4%, p = 0,59). Após EGD, nesse grupo, as lesões foram classificadas em proporções iguais como BC-II e BC-III (47,4%, p = 0,28), mais no corpo gástrico (57,9%, p = 0,14) e o estudo histopatológico mostrou que, subtipo intestinal esteve presente em 42,1% (p: 0,75), grau indiferenciado, 62,5% (p = 0,78), Herb+ em 73,3% (p = 0,68).
O intervalo de tempo entre o último ciclo do NAC e a realização da reavaliação por EGD foi maior no G1 em relação ao G2. No G1 essa média foi de 24,4 dias [mínimo: 5 dias; máximo: 61 dias, desvio padrão (DP): 16] e no G2 a média foi de 10,2 (mínimo: 2, máximo: 5, DP: 10,4), (p: 0,008), odds ratio (OR) 1,12 e [intervalo de confiança (CI): 1,0-1,2]. O tempo ideal calculado para realização de EGD após NAC foi de 8,5 dias. Nesse momento, foi alcançada uma sensibilidade de 93% e especificidade: 66% (IC: 0,6-1,0). EGD após NAC mostrou acurácia em predizer resposta endoscópica completa (eCR) e sensibilidade, G1, em 65,5% dos casos analisados.
Todos os casos foram submetidos a tratamento cirúrgico com gastrectomia parcial, gastrectomia total com ou sem esofagectomia distal associada à linfadenectomia D2, com achado de pCR na peça cirúrgica em média de 43,8 dias em ambos os grupos, sendo a média no G1 de 52, e no G2 39 dias após o controle endoscópico.
DISCUSSÃO
O CG é uma das neoplasias mais comuns do mundo, com altas taxas de incidência e mortalidade2020 Kurokawa Y, Shibata T, Sasako M, Sano T, Tsuburaya A, Iwasaki Y, Fukuda H. Validity of response assessment criteria in neoadjuvant chemotherapy for gastric cancer (JCOG0507-A). Gastric Cancer. 2014;17:514-21. DOI: 10.1007/s10120-013-0294-2
https://doi.org/10.1007/s10120-013-0294-...
. A localização mais comum é o antro gástrico, embora a incidência de tumores GEJ esteja aumentando gradualmente1313 Jung MR, Park YK, Seon JW, Kim KY, Cheong O, Ryu SY. Definition and classification of complications of gastrectomy for gastric cancer based on the accordion severity grading system. World J Surg. 2012;36:2400-11. DOI: 10.1007/s00268-012-1693-y
https://doi.org/10.1007/s00268-012-1693-...
.
Os tumores GEJ são muito prevalentes em todo o mundo e estão entre os tumores mais agressivos do trato digestivo55 Coimbra FJF, de Jesus VHF, Ribeiro HSC, Diniz AL, de Godoy AL, de Farias IC, Felismino T, Mello CAL, Almeida MF, Begnami MDFS et al. Impact of ypT, ypN, and adjuvant therapy on survival in gastric cancer patients treated with perioperative chemotherapy and radical surgery. Ann Surg Oncol. 2019;26:3618-26. DOI: 10.1245/s10434-019-07454-0
https://doi.org/10.1245/s10434-019-07454...
. Além disso, na maioria dos países ocidentais, eles não são diagnosticados até os estadios mais avançados, quando o tratamento cirúrgico isolado é menos eficaz55 Coimbra FJF, de Jesus VHF, Ribeiro HSC, Diniz AL, de Godoy AL, de Farias IC, Felismino T, Mello CAL, Almeida MF, Begnami MDFS et al. Impact of ypT, ypN, and adjuvant therapy on survival in gastric cancer patients treated with perioperative chemotherapy and radical surgery. Ann Surg Oncol. 2019;26:3618-26. DOI: 10.1245/s10434-019-07454-0
https://doi.org/10.1245/s10434-019-07454...
.
O baixo índice de diagnóstico de câncer gástrico precoce está relacionado à falta de sintomas específicos1919 Li B, Liu HY, Guo SH, Sun P, Gong FM, Jia BQ. Detection of microsatellite instability in gastric cancer and dysplasia tissues. Int J Clin Exp Med. 2015;8:21442-7. PMID: 26885089. Tumores avançados exibem potencial metastático considerável e prognóstico geralmente pior, indicando a necessidade de tratamentos sistêmicos e locais combinados para reduzir o risco de recorrência do tumor1212 Bartlett EK, Roses RE, Kelz RR, Drebin JA, Fraker DL, Karakousis GC. Morbidity and mortality after total gastrectomy for gastric malignancy using the American College of Surgeons National Surgical Quality Improvement Program database. Surgery. 2014;156:298-304. DOI: 10.1016/j.surg.2014.03.022
https://doi.org/10.1016/j.surg.2014.03.0...
.
Os tratamentos complementares à cirurgia estão, portanto, se tornando mais comuns e têm demonstrado eficácia significativa quando combinados com o tratamento cirúrgico adequado22 Lin D, Khan U, Goetze TO, Reizine N, Goodman KA, Shah MA, Catenacci VD, Al-Batran SE, Posey JA. Gastroesophageal junction adenocarcinoma: is there an optimal management? Am Soc Clin Oncol Educ Book. 2019;39:e88-e95. DOI: 10.1200/EDBK_236827
https://doi.org/10.1200/EDBK_236827...
,77 Felismino TC, de Oliveira ACF, Alves ACF, da Costa Junior WL, Coimbra FJF, de Souza Begnami MDF, Riechelmann RP, Jesus VHF, Mello CAL. Primary tumor location is a predictor of poor prognosis in patients with locally advanced esophagogastric cancer treated with perioperative chemotherapy. J Gastrointest Cancer. 2020;51:484-90. DOI: 10.1007/s12029-019-00258-1
https://doi.org/10.1007/s12029-019-00258...
,1919 Li B, Liu HY, Guo SH, Sun P, Gong FM, Jia BQ. Detection of microsatellite instability in gastric cancer and dysplasia tissues. Int J Clin Exp Med. 2015;8:21442-7. PMID: 26885089. Para cânceres avançados, os tratamentos de maior sucesso são aqueles que combinam quimioterapia com cirurgia22 Lin D, Khan U, Goetze TO, Reizine N, Goodman KA, Shah MA, Catenacci VD, Al-Batran SE, Posey JA. Gastroesophageal junction adenocarcinoma: is there an optimal management? Am Soc Clin Oncol Educ Book. 2019;39:e88-e95. DOI: 10.1200/EDBK_236827
https://doi.org/10.1200/EDBK_236827...
,66 Barchi LC, Ramos MFKP, Dias AR, Forones NM, Carvalho MP, Castro OAP, Kassab P, Costa-Júnior WLD, Weston AC, Zilberstein B et al. Brazilian Gastric Cancer Association guidelines (part 2): update on treatment. Arq Bras Cir Dig. 2021;34(1):e1563. doi: 10.1590/0102-672020210001e1563.
https://doi.org/10.1590/0102-67202021000...
,2020 Kurokawa Y, Shibata T, Sasako M, Sano T, Tsuburaya A, Iwasaki Y, Fukuda H. Validity of response assessment criteria in neoadjuvant chemotherapy for gastric cancer (JCOG0507-A). Gastric Cancer. 2014;17:514-21. DOI: 10.1007/s10120-013-0294-2
https://doi.org/10.1007/s10120-013-0294-...
. No entanto, existem poucas ferramentas para o reestadiamento do paciente antes do procedimento cirúrgico1010 Ikoma N, Blum M, Estrella JS, Das P, Hofstetter WL, Fournier KF, Mansfield P, Ajani JA, Badgwell BD. Evaluation of the American Joint Committee on Cancer 8th edition staging system for gastric cancer patients after preoperative therapy. Gastric Cancer. 2018;21:74-83. DOI: 10.1007/s10120-017-0743-4
https://doi.org/10.1007/s10120-017-0743-...
.
Este estudo, descreve os achados endoscópicos pré-operatórios de 29 pacientes com GC e câncer da GEJ que foram submetidos a NAC e que alcançaram pCR após a cirurgia. Os métodos de avaliação da resposta tumoral após a quimioterapia incluem ultrassonografia endoscópica, TC e PET-TC, mas essas técnicas mostraram baixa acurácia e possibilidade de super ou subestadiamento1717 Ajani JA, D'Amico TA, Almhanna K, Bentrem DJ, Chao J, Das P, Denlinger CS, Fanta P, Farjah F, Fuchs CS, et al. Gastric Cancer, Version 3.2016, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2016;14:1286-12. DOI: 10.6004/jnccn.2016.0137
https://doi.org/10.6004/jnccn.2016.0137...
,1818 Song Z, Wu Y, Yang J, Yang D, Fang X. Progress in the treatment of advanced gastric cancer. Tumour Biol. 2017;39:1010428317714626. DOI: 10.1177/1010428317714626
https://doi.org/10.1177/1010428317714626...
.
O estudo incluiu EGD realizada por dois endoscopistas sênior independentes, após o tratamento neoadjuvante. Os exames foram realizados em até 30 dias após o término do NAC, e a cirurgia foi realizada de 4 a 8 semanas após o término do NAC. A EGD foi capaz de predizer pCR em 65,5% dos casos (G1). Além disso, o intervalo de tempo entre o final do NAC e a realização do EGD2 foi significativamente menor para o grupo em que o EGD não foi capaz de predizer o pCR (G2) e para cada dia adicional, houve um aumento de 12% na probabilidade de prever pCR.
O tempo ideal calculado para a realização da EGD foi de 8,5 dias após o término do NAC, momento em que a sensibilidade atingiu 93%. A presença de lesões ativas no G2 pode ser decorrente de respostas inflamatórias que ocorrem durante a cicatrização normal da mucosa. Nestes casos, a EGD realizada posteriormente pode ter revelado cicatriz compatível com a observada no G1.
CONCLUSÃO
O eCR, determinado pela presença de cicatriz endoscópica, avermelhada ou esbranquiçada, sem lesões ativas após NAC, foi consistente com o pCR. EGD após NAC mostrou acurácia em predizer eCR e sensibilidade em 65,5% dos casos analisados. O intervalo mínimo de tempo para realização de EGD após o término do NAC foi de 8,5 dias. Respeitar este intervalo pode aumentar a possibilidade de prever pCR com avaliação endoscópica e suporta a previsão de resposta ideal.
REFERENCES
-
1Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. DOI: 10.3322/caac.21492
» https://doi.org/10.3322/caac.21492 -
2Lin D, Khan U, Goetze TO, Reizine N, Goodman KA, Shah MA, Catenacci VD, Al-Batran SE, Posey JA. Gastroesophageal junction adenocarcinoma: is there an optimal management? Am Soc Clin Oncol Educ Book. 2019;39:e88-e95. DOI: 10.1200/EDBK_236827
» https://doi.org/10.1200/EDBK_236827 -
3Ministério da Saúde. Instituto Nacional de Câncer. Estimativa 2020. incidência de Câncer no Brasil. Rio de Janeiro: INCA; 2019.
-
4Zare M, Jafari-Nedooshan J, Aghili K, Ahrar H, Jarahzadeh MH, Seifi-Shalamzari N, Zare-Shehneh M, Neamatzadeh H. Association of MMP-7 -181a>g polymorphism with colorectal cancer and gastric cancer susceptibility: a systematic review and meta-analysis. Arq Bras Cir Dig. 2019;32(3):e1449. doi: 10.1590/0102-672020190001e1449.
» https://doi.org/10.1590/0102-672020190001e1449 -
5Coimbra FJF, de Jesus VHF, Ribeiro HSC, Diniz AL, de Godoy AL, de Farias IC, Felismino T, Mello CAL, Almeida MF, Begnami MDFS et al. Impact of ypT, ypN, and adjuvant therapy on survival in gastric cancer patients treated with perioperative chemotherapy and radical surgery. Ann Surg Oncol. 2019;26:3618-26. DOI: 10.1245/s10434-019-07454-0
» https://doi.org/10.1245/s10434-019-07454-0 -
6Barchi LC, Ramos MFKP, Dias AR, Forones NM, Carvalho MP, Castro OAP, Kassab P, Costa-Júnior WLD, Weston AC, Zilberstein B et al. Brazilian Gastric Cancer Association guidelines (part 2): update on treatment. Arq Bras Cir Dig. 2021;34(1):e1563. doi: 10.1590/0102-672020210001e1563.
» https://doi.org/10.1590/0102-672020210001e1563 -
7Felismino TC, de Oliveira ACF, Alves ACF, da Costa Junior WL, Coimbra FJF, de Souza Begnami MDF, Riechelmann RP, Jesus VHF, Mello CAL. Primary tumor location is a predictor of poor prognosis in patients with locally advanced esophagogastric cancer treated with perioperative chemotherapy. J Gastrointest Cancer. 2020;51:484-90. DOI: 10.1007/s12029-019-00258-1
» https://doi.org/10.1007/s12029-019-00258-1 -
8Tada K, Etoh T, Shitomi Y, Ueda Y, Tojigamori M, Shiroshita H, Shiraishi N, Inomata M. A case of advanced gastric cancer achieved a pathological complete response by chemotherapy. Surg Case Rep. 2017;3:68. DOI: 10.1186/s40792-017-0344-9
» https://doi.org/10.1186/s40792-017-0344-9 -
9Al-Batran SE, Homann N, Pauligk C, Goetze TO, Meiler J, Kasper S, Kopp HG, Mayer F, Haag GM, Lindig U et al. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised phase 2/3 trial. Lancet. 2019;393:1948-57. DOI: 10.1016/S0140-6736(18)32557-1
» https://doi.org/10.1016/S0140-6736(18)32557-1 -
10Ikoma N, Blum M, Estrella JS, Das P, Hofstetter WL, Fournier KF, Mansfield P, Ajani JA, Badgwell BD. Evaluation of the American Joint Committee on Cancer 8th edition staging system for gastric cancer patients after preoperative therapy. Gastric Cancer. 2018;21:74-83. DOI: 10.1007/s10120-017-0743-4
» https://doi.org/10.1007/s10120-017-0743-4 -
11Stark AP, Ikoma N, Chiang YJ, Estrella JS, Das P, Minsky BD, Blum MM, Ajani JA, Mansfield P, Badgwell BD. Characteristics and survival of gastric cancer patients with pathologic complete response to preoperative therapy. Ann Surg Oncol. 2019;26:3602-10. DOI: 10.1245/s10434-019-07638-8
» https://doi.org/10.1245/s10434-019-07638-8 -
12Bartlett EK, Roses RE, Kelz RR, Drebin JA, Fraker DL, Karakousis GC. Morbidity and mortality after total gastrectomy for gastric malignancy using the American College of Surgeons National Surgical Quality Improvement Program database. Surgery. 2014;156:298-304. DOI: 10.1016/j.surg.2014.03.022
» https://doi.org/10.1016/j.surg.2014.03.022 -
13Jung MR, Park YK, Seon JW, Kim KY, Cheong O, Ryu SY. Definition and classification of complications of gastrectomy for gastric cancer based on the accordion severity grading system. World J Surg. 2012;36:2400-11. DOI: 10.1007/s00268-012-1693-y
» https://doi.org/10.1007/s00268-012-1693-y -
14Papenfuss WA, Kukar M, Oxenberg J, Attwood K, Nurkin S, Malhotra U, Wilkinson NW. Morbidity and mortality associated with gastrectomy for gastric cancer. Ann Surg Oncol. 2014;21:3008-14. DOI: 10.1245/s10434-014-3664-z
» https://doi.org/10.1245/s10434-014-3664-z -
15Cho H, Nakamura J, Asaumi Y, Yabusaki H, Sakon M, Takasu N, Kobayashi T, Aoki T, Shiraishi O, Kishimoto H, Nunobe S, et al. Long-term survival outcomes of advanced gastric cancer patients who achieved a pathological complete response with neoadjuvant chemotherapy: a systematic review of the literature. Ann Surg Oncol. 2015;22:787-92. DOI: 10.1245/s10434-014-4084-9
» https://doi.org/10.1245/s10434-014-4084-9 -
16Smyth EC, Verheij M, Allum W, Cunningham D, Cervantes A, Arnold D. Gastric cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2016;27(suppl 5):v38-v49. DOI: 10.1093/annonc/mdw350
» https://doi.org/10.1093/annonc/mdw350 -
17Ajani JA, D'Amico TA, Almhanna K, Bentrem DJ, Chao J, Das P, Denlinger CS, Fanta P, Farjah F, Fuchs CS, et al. Gastric Cancer, Version 3.2016, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2016;14:1286-12. DOI: 10.6004/jnccn.2016.0137
» https://doi.org/10.6004/jnccn.2016.0137 -
18Song Z, Wu Y, Yang J, Yang D, Fang X. Progress in the treatment of advanced gastric cancer. Tumour Biol. 2017;39:1010428317714626. DOI: 10.1177/1010428317714626
» https://doi.org/10.1177/1010428317714626 -
19Li B, Liu HY, Guo SH, Sun P, Gong FM, Jia BQ. Detection of microsatellite instability in gastric cancer and dysplasia tissues. Int J Clin Exp Med. 2015;8:21442-7. PMID: 26885089
-
20Kurokawa Y, Shibata T, Sasako M, Sano T, Tsuburaya A, Iwasaki Y, Fukuda H. Validity of response assessment criteria in neoadjuvant chemotherapy for gastric cancer (JCOG0507-A). Gastric Cancer. 2014;17:514-21. DOI: 10.1007/s10120-013-0294-2
» https://doi.org/10.1007/s10120-013-0294-2 -
21Japanese Gastric Cancer Association. Japanese classification of gastric carcinoma--2nd English edition--response assessment of chemotherapy and radiotherapy for gastric carcinoma: clinical criteria. Gastric Cancer. 2001;4:1-8. DOI: 10.1007/s101200100009
» https://doi.org/10.1007/s101200100009 -
22Park SR, Lee JS, Kim CG, Kim HK, Kook MC, Kim YW, Ryu KW, Lee JH, Bae JM, Choi IJ. Endoscopic ultrasound and computed tomography in restaging and predicting prognosis after neoadjuvant chemotherapy in patients with locally advanced gastric cancer. Cancer. 2008;112:2368-76. DOI: 10.1002/cncr.23483
» https://doi.org/10.1002/cncr.23483 -
23Redondo-Cerezo E, Martínez-Cara JG, Jiménez-Rosales R, Valverde-López F, Caballero-Mateos A, Puente J P, Fernández JLA, Muñoz MU, Hierro ML, Teresa J. Endoscopic ultrasound in gastric cancer staging before and after neoadjuvant chemotherapy. a comparison with PET-CT in a clinical series. United European Gastroenterol J. 2017;5:641-7. DOI: 10.1177/2050640616684697
» https://doi.org/10.1177/2050640616684697
-
Fundos:
Nenhum -
Imagem
-
Mensagem Central
A esofagogastroduodenoscopia após quimioterapia neoadjuvante para adenocarcinomas gástrico e da junção esofagogástrica pode ser uma ferramenta útil para estadiamento tumoral e seleção de candidatos cirúrgicos. -
Perspectiva
Este é o primeiro estudo que descreve as características endoscópicas após a quimioterapia neoadjuvante para adenocarcinomas gástrico e da junção esofagogástrica e o intervalo de tempo ideal entre a quimioterapia neoadjuvante e a cirurgia. A identificação de pacientes com resposta patológica completa após quimioterapia neoadjuvante pode, no futuro, se tornar uma ferramenta para selecionar aqueles que realmente se beneficiam da quimioterapia adjuvante e talvez supressão da cirurgia para pacientes de alto risco para o procedimento.
Datas de Publicação
-
Publicação nesta coleção
05 Jan 2022 -
Data do Fascículo
2021
Histórico
-
Recebido
19 Jul 2021 -
Aceito
04 Set 2021