RESUMO
Racional:
Síndrome do intestino curto é condição clínica crítica e que precisa de pesquisa experimental.
Objetivo:
Avaliar o impacto da remoção da válvula ileocecal em um modelo de síndrome do intestino curto para investigar o comportamento do cólon nesta circunstância.
Método:
Quinze ratos Wistar foram divididos em três grupos de cinco: Controle (Sham), grupo I (enterectomia de 70% com preservação da válvula ileocecal), e grupo II (70% enterectomia de 70% excluindo a válvula ileocecal). Após a enterectomia foi restabelecido o trânsito com anastomose jejunoileal no grupo I e jejunocecal no grupo II. Os animais foram sacrificados no 30º dia do pós-operatório para histomorfometria do cólon. Durante este período, observou-se a evolução clínica semanal, incluindo a medição do peso corporal.
Resultados:
Grupos I e II apresentaram perda progressiva de peso. No grupo I houve diarreia, períneo hiperemiado e cor violácea do cólon durante a autópsia. A histomorfometria mostrou hipertrofia e hiperplasia da mucosa do cólon no grupo I. No grupo II a parede do cólon estava mais espessa devido à hipertrofia e hiperplasia das camadas muscular e mucosa onde a proliferação vascular e infiltração inflamatória foi intensa.
Conclusão:
Este modelo é factível e atingiu 100% de sobrevida. A perda de peso não foi alterada pela presença ou exclusão da válvula ileocecal. Animais com remoção de 70% do intestino delgado e presença da válvula ileocecal apresentaram melhor evolução clínica e adaptação histológica do cólon que os sem válvula ileocecal.
DESCRITORES:
Síndrome do intestino curto; Desnutrição proteico-calórica; Mucosa intestinal.
ABSTRACT
Background :
Short bowel syndrome is a harmful condition that needs experimental research.
Aim:
To assess the impact of the ileocecal valve removal in a model of short bowel syndrome, in order to investigate the evolution of the colon under this circumstance.
Method:
Fifteen Wistar rats were equitable divided into: Control (Sham), Group I (70% enterectomy preserving ileocecal valve) and Group II (70% enterectomy excluding ileocecal valve). After enterectomy was performed jejunoileal or jejunocecal anastomosis and sacrificed the animals on 30th postoperative day for histomorphometric study of the colon. During this period, was observed the clinical evolution of the animals weekly including body weight measurement.
Results:
Group I and II presented progressive loss of weight. In Group I was observed diarrhea, perineal hyperemia and purple color of the colon during autopsy. Histomorphometry assay showed hypertrophy and hyperplasia of colon mucosa in Group I. In Group II the colon wall was thicker due to hypertrophy and muscular hyperplasia, and in mucosa vascular proliferation and inflammatory infiltrate were intense.
Conclusion :
This short bowel syndrome model is relevant and achieve 100% of survival. Animal’s weight loss was not altered by the presence or exclusion of the ileocecal valve. Animals with 70% of small bowel removal and presence of the ileocecal valve attained a better clinical evolution and histological colon adaptation than those without ileocecal valve.
HEADINGS:
Short bowel syndrome; Protein malnutrition; Intestinal mucosa
INTRODUÇÃO
Síndrome do intestino curto ocorre quando mais de 50% do intestino delgado é ressecado. Esta condição causa má absorção, dor abdominal, diarreia, distúrbio hidroeletrolítico, perda de peso, desnutrição, desidratação, episódios de translocação bacteriana, sepse e morte99 Jeejeebhoy KN. Management of short bowel syndrome: avoidance of total parenteral nutrition. Gastroenterology. 2006; 130: S60-S66. 4.,2222 Warner BW, Ziegler MM. Management of the short bowel syndrome in the pediatric population. Pediatr Clin North Am. 1993; 40: 1335-1350. As causas mais frequentes no grupo pediátrico são enterite necrotisante, atresia intestinal e volvo do intestino delgado; em adultos são doenças inflamatórias intestinais, Isquemia mesentérica e obstrução do intestino delgado. Nesta situação, a superfície mucosa do intestino remanescente pode levar até dois anos para obter adaptação22 Barra AA, Silva AL, Rena Cde L, Furtado MC, Ferreira AB, Nagen M, Freitas Fde S. Analysis of the diversity of the intestinal microbiota of rats subjected to resection of the ileocecal valve and creation of artificial sphincter. Rev Col Bras Cir. 2012; 39:521-8..,2222 Warner BW, Ziegler MM. Management of the short bowel syndrome in the pediatric population. Pediatr Clin North Am. 1993; 40: 1335-1350.
O melhor preditor da expectativa de vida após a ressecção é a extensão do intestino restante. Em adultos com intestino delgado permanecendo menos de 50 cm, a probabilidade de dependência total de nutrição parenteral é de 83% e no grupo pediátrico; a extensão remanescente de menos de 10% do comprimento intestinal é preditivo de nutrição parenteral permanente1818 Spencer AU, Neaga A, West B, Safran J, Brown P, Btaiche I, Kuzma-O'Reilly B, Teitelbaum DH. Pediatric short bowel syndrome: redefining predictors of success. Ann Surg. 2005; 242: 403-409; discussion 403-409.. A presença de todo o cólon e válvula ileocecal no intestino remanescente geralmente indica possibilidade de adaptação intestinal e desmame da nutrição parenteral total1010 Lopes LP, Menezes TM, Toledo DO, DE-Oliveira ATT, Longatto-Filho A, Nascimento JEA. Early oral feeding post-upper gastrointestinal tract resection and primary anastomosis in oncology. Arq Bras Cir Dig. 2018 Jun 21;31(1):e1359... Em grandes ressecções intestinais, incluindo a válvula ileocecal, o tempo para a aceitação da dieta oral completa sem complementação da nutrição parenteral é de 18 meses, enquanto que no grupo onde a válvula ileocecal foi ressecado este período é 43 meses77 Goulet O. Short bowel syndrome in pediatric patients. Nutrition. 1998; 14: 784-787.,1111 Mazaki T, Ebisawa K. Enteral versus parenteral nutrition after gastrointestinal surgery: a systematic review and metaanalysis of randomized controlled trials in the English literature13.. Estas descobertas enfatizam a importância de manter a válvula ileocecal.
A resposta adaptativa no contexto de grandes resecções intestinais é caracterizada basicamente pela proliferação de enterócitos e pela hiperplasia vilosa, mas muitos aspectos deste processo permanecem incertos, principalmente o efeito da válvula ileocecal88 Hanson WR, Osborne J, Sharp JG. Compensation by residual intestine after intestinal resection in the rat. Gastroenterology. 1977; 72: 692-9..
O objetivo deste estudo foi analisar o efeito da remoção da válvula ileocecal após 70% de ressecção do intestino delgado, a fim de esclarecer as alterações patológicas colônicas e os aspectos clínicos após esta ressecção intestinal maciça.
MÉTODO
Animais
Foram usados 15 ratos Wistar machos, pesando entre 300-330 g do Biotério da Faculdade de Ciências Médicas da Santa casa de São Paulo, SP, Brasil. Os animais foram submetidos a jejum por 12 h antes da laparotomia. Foram seguidas as regras do Conselho Internacional de Investigação Científica para Animais de Laboratório e as do Conselho de Cuidados com Animais da instituição (nº 223/97).
Delineamento experimental
Foram distribuídos aleatoriamente três grupos contendo cinco ratos cada: Grupo I (GI) com laparotomia, ressecção de 70% do intestino delgado e anastomose jejunoileal; Grupo II (GIl), laparotomia, resseção de 70% do intestino delgado e anastomose jejunocecal; Grupo Sham com ratos submetidos à simulação do procedimento descrito anterior, realizando laparotomia e dissecção intestinal como os descritos anteriormente, mas sem ressecção intestinal e apenas uma biópsia intestinal do cólon direito na borda antimesentérica que foi fechada por pontos únicos e o intestino delgado permaneceu intacto. Os animais foram sacrificados no 30º dia do pós-operatório e removidos o intestino delgado e cólon para estudo histopatológico. Durante este período, foi realizada avaliação semanal do peso e presença de diarreia.
Anestesia e procedimentos cirúrgicos
A anestesia foi realizada pelo uso intraperitoneal de cloridrato de cetamina (50 mg/kg) e clorpromazina (50 mg/kg). Todos os animais foram submetidos à laparotomia mediana, como segue:
Grupo I - O comprimento do intestino delgado foi medido pela borda antimesentérica. A ressecção intestinal foi estendida de 28 cm distal ao ângulo duodenojejunal (margem de ressecção proximal) a 2 cm proximalmente à válvula ileocecal (margem distal de ressecção), correspondente a 70% do intestino. A anastomose jejunoileal foi realizada por uma sutura de seda contínua de 6-0 de camada única, usando lupa com 6-10 vezes para magnificação.
Grupo II - A margem proximal da ressecção intestinal foi a mesma que do GI. A margem distal foi também a mesma (2 cm proximal à válvula ileocecal), mas o coto distal do íleo foi fechado. O trato intestinal foi reconstruído por uma anastomose de término-lateral do jejuno ao ceco proximalmente, usando uma sutura contínua de seda 6-0 de camada única com 6-10 vezes de magnificação.
Grupo controle (Sham) - Os ratos foram submetidos à biópsia do cólon direito com extensão de 4 cm a 2 cm da transição ileocecal. A parede dos dois pontos foi suturada por uma sutura contínua de seda 6-0 de camada única, usando 6-10 vezes de magnificação.
Após a operação, a parede abdominal foi fechada em todos os grupos usando a sutura contínua de 4-0 nas camadas musculares e da pele.
No período pós-operatório, a dieta oral foi iniciada 24 h após a operação. A medição do peso e a evolução clínica foram realizadas semanalmente. No 30º dia do pós-operatório, os animais foram sacrificados e feita autópsia. Foi removido 1 cm de cólon ascendente 2 cm após a válvula ileocecal, abrindo-se na borda antimesentérica e lavado suavemente o lúmen com solução salina de 0,9%. O cólon aberto foi fixado em um cartão e fixado em 10% de solução formal para a coloração subsequente por H&E. As lâminas histológicas foram analisadas por dois patologistas independentes.
Peso dos animais
Todos os animais foram pesados imediatamente antes da operação e nos dias 7, 14, 21 e 30 do pós-operatório.
Avaliação macroscópica dos cólons
Foi realizada em todos os animais na necropsia, especialmente considerando a presença de mudança de cor e dilatação intestinal
Análise histopatológica dos cólons
O cólon direito foi fixado em 10% de formaldeído por 24 h e 10 amostras foram tomadas por cólon, dois em cada 0,3 cm de intervalo, a partir da região da válvula ileocecal. O material sofreu técnicas de corte e inclusão de rotina para microscopia de luz convencional. As secções de três micrômetros de espessura foram coradas com H&E. Análises histológicas foram realizadas com microscopia de luz convencional para estudos qualitativos e quantitativos.
O estudo qualitativo incluía a presença de infiltração inflamatória e seus componentes. Para o estudo quantitativo na histomorfometria foi utilizado uma ocular PZO K-15 Drum com graduação de oito unidades, cada unidade correspondente a 20,28 micrômetros no microscópio Zeiss convencional, no aumento de 100X. Foram realizadas as seguintes medições: espessura total da parede do cólon; espessura da mucosa; altura das criptas; e espessura da camada muscular. O infiltrado inflamatório contendo macrófagos, linfócitos e plasmócitos foi graduado de acordo com a seguinte pontuação: 0 correspondendo à ausência de células inflamatórias; I à leve; II à moderada; III à intensa.
RESULTADOS
Evolução pós-operatória
Todos os animais sobreviveram até o fim do experimento. Todos os animais GIl apresentaram períodos de diarreia a partir do 3º dia do pós-operatório e hiperemia moderada do períneo no final do estudo. Esta manifestação clínica não foi observada em animais GI.
Avaliação do peso pós-operatório
Os animais do GI e GIl apresentaram perda progressiva do peso que era significativa do 14º dia do pós-operatório quando comparado com a evolução ponderal do grupo controle. Não houve diferença estatística na perda de peso entre os animais GI e GIl em todos os tempos analisados. No final do experimento, a percentagem mediana de perda de peso foi de 11% para GI e 14% para GIl.
Avaliação macroscópica do cólon
Na necrópsia, o grupo Sham teve aparência normal (Figura 1A). Os animais do GIl mostraram importante dilatação do cólon (Figura 1B) e mudança de cor (aparência arroxeada, Figura 1C)). Nos animais do GI havia também o alargamento do cólon, mas não tinham a aparência roxa nem a dilatação no cólon remanescente (Figuras 1B e C).
Avaliação macroscópica do cólon: A) da esquerda para a direita: grupo Sham, GI e GII; B) dilatação do ceco e do cólon; C) mudança de cor (aspecto arroxeado)
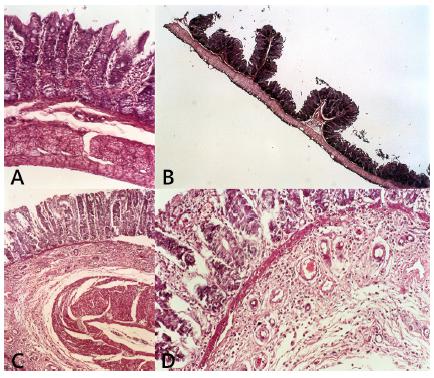
Análises histopatológica e morfométrica
Análise histopatológica mostrou infiltrado inflamatório mínimo nos animais dos grupos controle (Sham) e GI. Houve proliferação vascular, infiltração inflamatória e aumento da espessura da parede do cólon nos animais do GIl. O infiltrado inflamatório em todos os grupos foi composto por macrófagos, plasmócitos e linfócitos raros. Na análise morfométrica, foi observado aspecto normal das camadas do cólon no grupo controle (Figura 2A), e aumento estatisticamente significativo na espessura total da parede do cólon nos grupos GI e GII, devido à hipertrofia e hiperplasia (Tabelas 1 e 2). Curiosamente, havia padrão diferente na parede do cólon à morfometria. Em animais GI havia predominância significativa na altura e alargamento das criptas na túnica mucosa com pólipos hiperplásicos, um achado frequente (Figura 2B). No GIl, ambas as camadas muscular e mucosa foram ampliadas com predominância de camada muscular (Figura 2C e 2D, Tabela 3). Análise qualitativa do infiltrado em mucosa e submucosa nos três grupos mostrou presença de linfócitos, macrófagos e plasmócitos com maior intensidade no GII (Tabela 4).
Segmento de cólon corado por H&E e visualizado sob microscópio óptico: A) grupo controle que mostra criptas uniformes alinhadas por células caliciformes e apoiadas por lâmina própria proeminente infiltrada por um pequeno número de células linfomonucleares e a submucosa é contínua com fibras regulares da muscular da mucosa e muscular externa; B) GI apresentando glândulas e criptas bem formadas por células caliciformes epiteliais, com escassa lâmina própria; C e D) GII mostrando remodelação da submucosa por angiogênese proeminente e infiltração de células linfomonucleares, hipertrofia e hiperplasia do muscular circular e longitudinal (ampliação: Ax100; Bx40; Cx100; Dx400)
Análise estatística da espessura da túnica muscular do intestino grosso e comparação entre os diferentes grupos
DISCUSSÃO
No nosso conhecimento esta é a primeira pesquisa que avalia 70% da ressecção do intestino delgado com e sem válvula ileocecal. Foi escolhido 70% com base em um estudo piloto anterior em que se encontrou alta taxa de desconforto e mortalidade dos ratos com ressecção em 90%. Neste modelo, a perda de peso foi mais relacionada ao comprimento do intestino delgado removido em vez da exclusão da válvula ileocecal. Além disso, todos os animais sobreviveram até o final experimental, tornando este modelo relevante para estudar o efeito em longo prazo da síndrome do intestino curto e para criar experimentos de translação de novos modelos de transplante intestinais33 Brito MVH, Yasojima EY, Machado AA, Silveira MPPR, Teixeira RKC, Yamaki VN, Costa FLDS. Different protocols of postconditioning does not attenuate mesenteric ischemia-reperfusion injury after short-term reperfusion. Arq Bras Cir Dig. 2017 Jan-Mar;30(1):27-29,55 Galvao FH, Santos RM, Machado MA, Bacchella T, Machado MC. Simplified rat model of intestinal transplantation. Transplantation. 2005; 80:1522-3.,66 Galvão FH, Waisberg DR, De Mello Vianna RM, De Castro Galvão R, Seid VE, Andraus W, Chaib E, D'Albuquerque LA. Intestinal transplantation including anorectal segment in the rat. Microsurgery. 2012; 32:77-9.,2121 Waisberg DR, Lee AD, Santos RM, Mory EK, Costa AL, Montero EF, Chaib E, D'Albuquerque LA, Galvao FH. Small bowel transplantation in outbred rats. Acta Cir Bras. 2011; 26:496-502. usando como receptores os ratos com síndrome do intestino curto, como no manejo clínico humano.
Barra et al.22 Barra AA, Silva AL, Rena Cde L, Furtado MC, Ferreira AB, Nagen M, Freitas Fde S. Analysis of the diversity of the intestinal microbiota of rats subjected to resection of the ileocecal valve and creation of artificial sphincter. Rev Col Bras Cir. 2012; 39:521-8.. estudaram as consequências da ressecção da válvula ileocecal sem enterectomia na microbiota intestinal. Houve alteração dela apenas no grupo valvulado ileocecal ressecado, que foi maior no íleo terminal do que no cólon. Neste estudo, foi encontrado aumento na espessura e infiltrado inflamatório no cólon de animais GII. As alterações de microbiota demonstradas por Barra et al.22 Barra AA, Silva AL, Rena Cde L, Furtado MC, Ferreira AB, Nagen M, Freitas Fde S. Analysis of the diversity of the intestinal microbiota of rats subjected to resection of the ileocecal valve and creation of artificial sphincter. Rev Col Bras Cir. 2012; 39:521-8.. podem estar correlacionadas com este achado. Saad et al.1616 Saad Jr. R, Bianco AC, Minas RM, Chazanas JC, Oliveira AM, Hell NS, Rasslan S. Metabolic changes in rats submitted to extensive intestinal resection or jejuno-ileal shunting. Rev. Paul. Med. 1985; 103: 171-5. observaram que a ressecção intestinal prolongada não determinou perda significativa de peso após 60 dias do pós-operatório em comparação com o controle. O experimento atual teve um período de observação de 30 dias com perda de peso contínua. É razoável supor que possamos encontrar ganho de peso ou tendência de estabilização se o período de observação for superior a 30 dias. É compreensível que a ressecção de 70% do intestino delgado resulte em melhor absorção intestinal nos 30% da área preservada; isto não aconteceu no estudo em que 90% do intestino delgado foram ressecados. Além disso, na ressecção de 70% do intestino delgado, a papila ileal parece melhorar a função intestinal, sem diarreia, diferentemente do grupo sem preservação da válvula ileocecal.
Milone et al.12 usando diferentes extensões da ressecção intestinal, observaram que o cólon participou ativamente da resposta adaptativa do intestino delgado. Observamos também importante adaptação da mucosa do cólon, principalmente quando a válvula ileocecal foi preservada. Esta alteração morfológica pode estar relacionada à readaptação do cólon, assumindo função absortiva como o intestino delgado.
Obertop et al.1414 Obertop H, Nundy S, Malamud O, Malt R - Onset of cell proliferation in the shortened gut: rapid hiperplasia after jejunal resection. Gastroenterology, 1977; 72: 267-76. em um modelo de ressecção de um terço do intestino delgado proximal (jejunectomia) observaram manifestações precoces de proliferação celular no 2º dia com aumento de quantidades absolutas de RNA e DNA no intestino delgado distal e cólon que era persistente no intestino médio tendendo a ser menos intenso em segmentos distais. A hiperplasia atinge com maior intensidade o íleo na segunda semana do pós-operatório. Em nosso experimento observamos sinal de hiperplasia da mucosa no cólon apenas com a ressecção extensa do intestino delgado, principalmente quando a válvula ileocecal era preservada.
As repercussões morfológicas e funcionais encontradas na operação experimental foram confirmadas em estudos clínicos. Thompson2020 Thompson JS - Management of short bowel syndrome. Gastroenterol. Clin. North Am. 1994; 23: 403-20, estudando ressecções intestinais grandes, observou que a síndrome do intestino curto depende de alguns fatores como o comprimento do intestino ressecado, segmento ressecado (jejuno ou íleo), doença intestinal subjacente, presença ou ausência da válvula ileocecal e estado funcional dos outro órgãos do aparelho digestivo. Rasslan et al.1515 Rasslan S, Fava J, Mandia Neto J, Chaves AF. Side effects of extensive bowel resections. An. Paul. Med. Cir. 1984; 111: 13-21. observaram desnutrição e diarreia difíceis de controlar no início do pós-operatório de pacientes submetidos a 75% da ressecção do intestino delgado. As ressecções do jejuno foram melhor toleradas, apresentando menor trânsito intestinal, enquanto os pacientes com ressecções ileais obtiveram trânsito intestinal mais rápido e esteatorreia. Quando a válvula ileocecal foi ressecada, eles observaram maior perda hidroeletrolítica pelo estoma e maior dificuldade em se adaptar à dieta após a alimentação. Este estudo clínico apoia os resultados da nossa experiência do efeito da ressecção valvular ileocecal.
Goulet et al.77 Goulet O. Short bowel syndrome in pediatric patients. Nutrition. 1998; 14: 784-787. estudando pacientes pediátricos com aproximadamente 40 cm de intestino delgado restantes, compararam aqueles que mantiveram a válvula ileocecal com os cuja válvula tenha sido removida e concluiram que a inclusão ou não da válvula ileocecal não teve influência na mortalidade. No nosso experimento, também não houve diferença na mortalidade e perda de peso corporal entre os grupos com e sem válvula.
O cólon reage ativamente na resposta adaptativa da enterectomia extensa. Nundy et al.1313 Nundy S, Chir M, Malamud D, Obertop H, Sczrban J, Malt RA. Onset of cell proliferation in the shortened gut. Colonic hyperplasia after ileal resection. Gastroenterology. 1977; 72: 263-266. demonstraram que o aumento do cólon na grande ressecção ileal resulta em hiperplasia desde o 7º dia do pós-operatório, aumentando ao máximo em torno do 30º, mantendo um patamar até o 6º mês de observação. Em nosso experimento, também foi observada hiperplasia no 30º dia do pós-operatório.
Usando microscopia eletrônica de varredura, Tamames Gomez et al.1919 Tamames Gomez S, de vega Garcia D, Furio Bacete V, Tamames Escobar S. Ultrastructural study of the colon after massive intestinal resection in rats. Rev. Esp. Enferm. Ap. Dig. 1989; 75: 7-1315. observaram que a mucosa do cólon de ratos enterectomizados tinha protuberâncias de pós-operatório com aspecto folicular como a mucosa do intestino delgado. Milone et al.1212 Milone E, Ginnaneschi V, Smrekar V. Morphological and functional changes of the colon after massive resection of the small intestine in the rat. Min. Clin. 1982; 37: 641-9. relataram alterações semelhantes até o 5º mês do pós-operatório, quando as alterações foram estabilizadas. Observamos também estas alterações na histometria. Essas alterações histopatológicas causam um estímulo vicariante no cólon restante, devido ao mecanismo compensatório, tentando fornecer as necessidades metabólicas criadas pela extensa ressecção intestinal.
A espessura da parede aumentada do cólon restante após a ressecção extensa do intestino delgado é causada por aumento em todos os seus componentes. Como pode ser visto nas tabelas estatísticas, a exclusão da válvula ileocecal é determinante no aumento significativo da mucosa e da camada muscular em comparação entre GII e o grupo controle. Pesquisas adicionais devem ser seguidas para explicar se o conteúdo intestinal do intestino remanescente na ausência de válvula ileocecal, tem papel nesta resposta. Essa resposta, como a observada no intestino delgado remanescente1616 Saad Jr. R, Bianco AC, Minas RM, Chazanas JC, Oliveira AM, Hell NS, Rasslan S. Metabolic changes in rats submitted to extensive intestinal resection or jejuno-ileal shunting. Rev. Paul. Med. 1985; 103: 171-5., indica adaptação que provavelmente envolve todo o trato digestivo do grande enterectomizado. Neste experimento, observou-se proliferação vascular intensa no córion, vários mastócitos e importante proliferação conjuntiva no GII. Este aspecto do infiltrado e outras mudanças são como os indicados por Allen11 Allen AC. A unified concept of the vascular pathogenesis of enterocolitis of varied etiology. Am. J. Gastroenterology. 1971; 55: 347-378. no cólon de pacientes que sofreram isquemia. Atribuímos a cor avermelhada do cólon à hiperplasia celular intensa das várias camadas e a isquemia relativa relacionada à proliferação celular intensa não acompanhada de vascularização correspondente. Esse achado também foi observado por Milone et al.1212 Milone E, Ginnaneschi V, Smrekar V. Morphological and functional changes of the colon after massive resection of the small intestine in the rat. Min. Clin. 1982; 37: 641-9. e Tamames Gomes et al.1919 Tamames Gomez S, de vega Garcia D, Furio Bacete V, Tamames Escobar S. Ultrastructural study of the colon after massive intestinal resection in rats. Rev. Esp. Enferm. Ap. Dig. 1989; 75: 7-1315..
CONCLUSÕES
Este modelo é factível e atingiu 100% de sobrevida. A perda de peso não foi alterada pela presença ou exclusão da válvula ileocecal. Animais com remoção de 70% do intestino delgado e presença da válvula ileocecal apresentaram melhor evolução clínica e adaptação histológica do cólon que os sem válvula ileocecal.
REFERENCES
-
1Allen AC. A unified concept of the vascular pathogenesis of enterocolitis of varied etiology. Am. J. Gastroenterology. 1971; 55: 347-378.
-
2Barra AA, Silva AL, Rena Cde L, Furtado MC, Ferreira AB, Nagen M, Freitas Fde S. Analysis of the diversity of the intestinal microbiota of rats subjected to resection of the ileocecal valve and creation of artificial sphincter. Rev Col Bras Cir. 2012; 39:521-8..
-
3Brito MVH, Yasojima EY, Machado AA, Silveira MPPR, Teixeira RKC, Yamaki VN, Costa FLDS. Different protocols of postconditioning does not attenuate mesenteric ischemia-reperfusion injury after short-term reperfusion. Arq Bras Cir Dig. 2017 Jan-Mar;30(1):27-29
-
4Collins JB, Georgeson KE, Vicente Y, Kelly DR, Figueroa R. Short bowel syndrome. Semin Pediatr Surg. 1995; 4: 60-72.
-
5Galvao FH, Santos RM, Machado MA, Bacchella T, Machado MC. Simplified rat model of intestinal transplantation. Transplantation. 2005; 80:1522-3.
-
6Galvão FH, Waisberg DR, De Mello Vianna RM, De Castro Galvão R, Seid VE, Andraus W, Chaib E, D'Albuquerque LA. Intestinal transplantation including anorectal segment in the rat. Microsurgery. 2012; 32:77-9.
-
7Goulet O. Short bowel syndrome in pediatric patients. Nutrition. 1998; 14: 784-787.
-
8Hanson WR, Osborne J, Sharp JG. Compensation by residual intestine after intestinal resection in the rat. Gastroenterology. 1977; 72: 692-9.
-
9Jeejeebhoy KN. Management of short bowel syndrome: avoidance of total parenteral nutrition. Gastroenterology. 2006; 130: S60-S66. 4.
-
10Lopes LP, Menezes TM, Toledo DO, DE-Oliveira ATT, Longatto-Filho A, Nascimento JEA. Early oral feeding post-upper gastrointestinal tract resection and primary anastomosis in oncology. Arq Bras Cir Dig. 2018 Jun 21;31(1):e1359..
-
11Mazaki T, Ebisawa K. Enteral versus parenteral nutrition after gastrointestinal surgery: a systematic review and metaanalysis of randomized controlled trials in the English literature13.
-
12Milone E, Ginnaneschi V, Smrekar V. Morphological and functional changes of the colon after massive resection of the small intestine in the rat. Min. Clin. 1982; 37: 641-9.
-
13Nundy S, Chir M, Malamud D, Obertop H, Sczrban J, Malt RA. Onset of cell proliferation in the shortened gut. Colonic hyperplasia after ileal resection. Gastroenterology. 1977; 72: 263-266.
-
14Obertop H, Nundy S, Malamud O, Malt R - Onset of cell proliferation in the shortened gut: rapid hiperplasia after jejunal resection. Gastroenterology, 1977; 72: 267-76.
-
15Rasslan S, Fava J, Mandia Neto J, Chaves AF. Side effects of extensive bowel resections. An. Paul. Med. Cir. 1984; 111: 13-21.
-
16Saad Jr. R, Bianco AC, Minas RM, Chazanas JC, Oliveira AM, Hell NS, Rasslan S. Metabolic changes in rats submitted to extensive intestinal resection or jejuno-ileal shunting. Rev. Paul. Med. 1985; 103: 171-5.
-
17Saad Jr. R, Rasslan S, Bento JÁ, Dorgan Neto V. Study of intestinal motility in enterectomized rats. Acta Cir. Bras. 1990; 5: 99-103.
-
18Spencer AU, Neaga A, West B, Safran J, Brown P, Btaiche I, Kuzma-O'Reilly B, Teitelbaum DH. Pediatric short bowel syndrome: redefining predictors of success. Ann Surg. 2005; 242: 403-409; discussion 403-409.
-
19Tamames Gomez S, de vega Garcia D, Furio Bacete V, Tamames Escobar S. Ultrastructural study of the colon after massive intestinal resection in rats. Rev. Esp. Enferm. Ap. Dig. 1989; 75: 7-1315.
-
20Thompson JS - Management of short bowel syndrome. Gastroenterol. Clin. North Am. 1994; 23: 403-20
-
21Waisberg DR, Lee AD, Santos RM, Mory EK, Costa AL, Montero EF, Chaib E, D'Albuquerque LA, Galvao FH. Small bowel transplantation in outbred rats. Acta Cir Bras. 2011; 26:496-502.
-
22Warner BW, Ziegler MM. Management of the short bowel syndrome in the pediatric population. Pediatr Clin North Am. 1993; 40: 1335-1350
-
Fonte de financiamento:
não há
Datas de Publicação
-
Publicação nesta coleção
2019
Histórico
-
Recebido
10 Jul 2018 -
Aceito
25 Set 2018