RESUMO
Introdução:
O polimorfismo da matriz metaloproteinase-7 (MMP-7) -181A>G tem sido relatado como associado à suscetibilidade dos cânceres colorretal (CRC) e gástrico (GC), mas os resultados desses estudos anteriores foram inconsistentes ou controversos.
Objetivo:
Elaborar metanálise para avaliar a associação do polimorfismo -181A> G da MMP-7 com o risco de CRC e GC.
Métodos:
Revisão da literatura publicada avaliando essa associação no PubMed, Web of Science, Google Acadêmico e outras bases de dados até 25 de abril de 2018. Odds ratio (OR) e o intervalo de confiança de 95% (IC) foram calculados usando dados aleatórios ou modelo de efeitos fixos.
Resultados:
Um total de 19 estudos caso-controle, que incluíram 11 trabalhos sobre CRC (2.169 casos de CCR e 2.346 controles) e oito sobre GC (1.545 casos de GC e 2.366 controles) foram identificados. Houve associação significativa entre o polimorfismo MMP-7 -181A>G e o risco de GC sob o modelo homozigoto (GG vs. AA: OR=1,672, IC 95% 1,161-2,409, p=0,006) e o modelo recessivo (GG vs. GA + AA: OR=1,672, IC 95% 1,319-2,554, p=0,001), mas não com CRC. Por análise de subgrupos com base na etnia, um risco aumentado de CRC e GC foi encontrado apenas entre os asiáticos.
Conclusões:
Esta metanálise sugere que os polimorfismos MMP-7 -181A>G estão associados ao risco de GC, mas não ao CRC. No entanto, estes resultados mostraram claramente que o polimorfismo MMP-7 -181A>G aumentou significativamente o risco de CRC apenas em asiáticos.
DESCRITORES:
Metaloproteinase 7 da matriz; Neoplasias colorretais; Neoplasias gástricas; Polimorfismo de nucleotídeo único; Metanálise
ABSTRACT
Introduction:
The matrix metalloproteinase-7 (MMP-7) gene -181A>G polymorphism has been reported to be associated with colorectal cancer (CRC) and gastric cancer (GC) susceptibility, yet the results of these previous results have been inconsistent or controversial.
Aim:
To elaborate a meta-analysis to assess the association of -181A>G polymorphism of MMP-7 with CRC and GC risk.
Methods:
Published literature evaluating the association from PubMed, Web of Science, Google Scholar and other databases were retrieved up to April 25, 2018. Pooled odds ratio (OR) and 95% confidence interval (CI) were calculated using random- or fixed-effects model.
Results:
A total of 19 case-control studies, which included eleven studies on CRC (2,169 CRC cases and 2,346 controls) and eight studies on GC (1,545 GC cases and 2,366 controls) were identified. There was a significant association between MMP-7 -181A>G polymorphism and GC risk under the homozygote model (GG vs. AA: OR=1.672, 95% CI 1.161-2.409, p=0.006) and the recessive model (GG vs. GA+AA: OR=1.672, 95% CI 1.319-2.554, p=0.001), but not with CRC. By subgroup analysis based on ethnicity, an increased risk of CRC and GC was found only among Asians.
Conclusions:
This meta-analysis suggests that MMP-7 -181A>G polymorphisms is associated with GC risk, but not with CRC. However, our results clearly showed that the MMP-7 -181A>G polymorphism significantly increased the risk of CRC only in Asians.
HEADINGS:
Matrix metalloproteinase-7; Colorectal neoplasms; Stomach neoplasms; Polymorphism; Single nucleotide; Meta-analysis
INTRODUÇÃO
Atualmente, cânceres gastrintestinais, especialmente câncer gástrico (CG) e câncer colorretal (CCR), são as principais causas de morte relacionada ao câncer em todo o mundo77 Forat-Yazdi M, Gholi-Nataj M, Neamatzadeh H, Nourbakhsh P, Shaker-Ardakani H. Association of XRCC1 Arg399Gln polymorphism with colorectal cancer risk: A huge meta analysis of 35 studies. Asian Pacific J Cancer Prev [Internet]. 2015;16(8).,2222 Namazi A, Forat-Yazdi M, Jafari MA, Foroughi E, Farahnak S, Nasiri R, et al. Association between polymorphisms of ERCC5 gene and susceptibility to gastric cancer: A systematic review and meta-analysis. Asian Pacific J Cancer Prev. 2017;18(10).,2323 Namazi A, Forat-Yazdi M, Jafari M, Farahnak S, Nasiri R, Foroughi E, et al. Association of interleukin-10 -1082 A/G (rs1800896) polymorphism with susceptibility to gastric cancer: meta-analysis of 6,101 cases and 8,557 controls. Arq Gastroenterol. 2018 Mar;55(1):33-40.. Globalmente, o CCR e a GC são a terceira e quarta causa mais comum de câncer, correspondendo a 10% e 7% dos casos de todos os novos casos de câncer, respectivamente2323 Namazi A, Forat-Yazdi M, Jafari M, Farahnak S, Nasiri R, Foroughi E, et al. Association of interleukin-10 -1082 A/G (rs1800896) polymorphism with susceptibility to gastric cancer: meta-analysis of 6,101 cases and 8,557 controls. Arq Gastroenterol. 2018 Mar;55(1):33-40.,2727 Tak DH, Moon HS, Kang SH, Sung JK, Jeong HY. Prevalence and Risk Factors of Gastric Adenoma and Gastric Cancer in Colorectal Cancer Patients. Gastroenterol Res Pract. 2016 Dec 26;2016:1-7.. É bem conhecido que o desenvolvimento deles pode ser induzido pelas interações de múltiplos fatores genéticos e ambientais de maneiras complexas. No entanto, a patogênese do CCR difere do GC na medida em que é afetada por etnia, regional, estilo de vida, fatores ambientais e patogênese molecular2727 Tak DH, Moon HS, Kang SH, Sung JK, Jeong HY. Prevalence and Risk Factors of Gastric Adenoma and Gastric Cancer in Colorectal Cancer Patients. Gastroenterol Res Pract. 2016 Dec 26;2016:1-7.. Atualmente, vários genes têm sido relatados como estando associados ao CRC e GC, e os genes das metaloproteinases de matriz (MMPs) têm recebido crescente atenção1010 Ke P, Wu Z-D, Wen H-S, Ying M-X, Long H-C, Qing L-G. Current evidence on associations between the MMP-7 (-181A>G) polymorphism and digestive system cancer risk. Asian Pac J Cancer Prev. 2013;14(4):2269-72.,2929 Wu J, Guan X, Li Y-T, Bai P, Wu J. Matrix metalloproteinase7 -181A/G polymorphism is associated with increased cancer risk among high-quality studies: Evidence from a meta-analysis. Clin Biochem. 2013 Nov;46(16-17):1649-54.,3131 Yang X, Liu Y, Yang Y, Li B. Update meta-analysis on MMP-7 -181A>G polymorphism and cancer risk: Evidence from 25 studies. Gene. 2013 Jun 1;521(2):252-8..
As MMPs são classificadas como uma grande família de proteases contendo zinco, que envolvem processos fisiológicos e patológicos normais, como degradação e remodelação da matriz extracelular, desenvolvimento embrionário, reprodução e câncer66 Fanjul-Fernández M, Folgueras AR, Cabrera S, López-Otín C. Matrix metalloproteinases: Evolution, gene regulation and functional analysis in mouse models. Biochim Biophys Acta - Mol Cell Res. 2010 Jan 1;1803(1):3-19.,1313 Klein T, Bischoff R. Physiology and pathophysiology of matrix metalloproteases. Amino Acids. 2011 Jul;41(2):271-90.. MMP-7, o menor membro da família MMP, é uma endopeptidase com ampla especificidade de substrato, que quebra a matriz extracelular pela degradação de macromoléculas, incluindo caseína, gelatinas tipo I, II, IV e V, fibronectina e proteoglicano1818 Mittal R, Patel AP, Debs LH, Nguyen D, Patel K, Grati M, et al. Intricate Functions of Matrix Metalloproteinases in Physiological and Pathological Conditions. J Cell Physiol. 2016 Dec 1;231(12):2599-621.. Além disso, a MMP-7 é uma das principais enzimas reguladoras envolvidas na apoptose, liberando o ligante Fas (FasL) da membrana, induzindo a apoptose de células vizinhas ou diminuindo a apoptose de células cancerosas2121 Musial K, Zwolinska D. Matrix metalloproteinases and soluble Fas/FasL system as novel regulators of apoptosis in children and young adults on chronic dialysis. Apoptosis. 2011 Jul;16(7):653-9.. Assim, a MMP-7 promove a sobrevivência das células resistindo à apoptose através da clivagem do FasL. A MMP7 está potencialmente envolvida nas metástases tumorais e processos inflamatórios1010 Ke P, Wu Z-D, Wen H-S, Ying M-X, Long H-C, Qing L-G. Current evidence on associations between the MMP-7 (-181A>G) polymorphism and digestive system cancer risk. Asian Pac J Cancer Prev. 2013;14(4):2269-72.,3131 Yang X, Liu Y, Yang Y, Li B. Update meta-analysis on MMP-7 -181A>G polymorphism and cancer risk: Evidence from 25 studies. Gene. 2013 Jun 1;521(2):252-8..
O gene da MMP-7 (também conhecido como matrilisina) está localizado no cromossomo 11q21-q22 e contém 13 exons3535 Zhang Y, Chen Q. Relationship between matrix metalloproteinases and the occurrence and development of ovarian cancer. Brazilian J Med Biol Res = Rev Bras Pesqui medicas e Biol. 2017 May 18;50(6):e6104.. O polimorfismo de nucleotídeo único (SNP) -181A>G na região promotora do gene da MMP-7 tem sido considerado um candidato à SNP para várias condições, incluindo malignidades gastrointestinais relacionadas11 Adachi Y, Yamamoto H, Itoh F, Hinoda Y, Okada Y, Imai K. Contribution of matrilysin (MMP-7) to the metastatic pathway of human colorectal cancers. Gut. 1999 Aug 1;45(2):252-8.,1010 Ke P, Wu Z-D, Wen H-S, Ying M-X, Long H-C, Qing L-G. Current evidence on associations between the MMP-7 (-181A>G) polymorphism and digestive system cancer risk. Asian Pac J Cancer Prev. 2013;14(4):2269-72.,3131 Yang X, Liu Y, Yang Y, Li B. Update meta-analysis on MMP-7 -181A>G polymorphism and cancer risk: Evidence from 25 studies. Gene. 2013 Jun 1;521(2):252-8.. Há evidências claras de que a regulação positiva do gene da MMP-7 está significativamente relacionada à variação da atividade do promotor de -181A>G16. Estudos epidemiológicos moleculares relataram a associação do polimorfismo MMP-7 -181A>G com o risco de CRC e GC, mas os resultados permanecem conflitantes e não conclusivos. Diversos estudos já foram realizados sobre a associação do polimorfismo MMP-7 -181A>G com o risco de CRC e GC1010 Ke P, Wu Z-D, Wen H-S, Ying M-X, Long H-C, Qing L-G. Current evidence on associations between the MMP-7 (-181A>G) polymorphism and digestive system cancer risk. Asian Pac J Cancer Prev. 2013;14(4):2269-72.,3131 Yang X, Liu Y, Yang Y, Li B. Update meta-analysis on MMP-7 -181A>G polymorphism and cancer risk: Evidence from 25 studies. Gene. 2013 Jun 1;521(2):252-8.. No entanto, esses estudos tiveram observações opostas e estudos adicionais de caso-controle com amostras maiores foram publicados desde então. Assim, a associação do polimorfismo MMP-7 -181A>G permanece desconhecida.
Portanto, foi realizada esta metanálise com todos os estudos elegíveis para obter estimativa mais precisa da associação do polimorfismo MMP-7 -181A>G com o risco de CRC e GC.
MÉTODOS
Busca dos trabalhos
Seguindo a orientação PRISMA, pesquisamos os bancos de dados de literatura eletrônica incluindo PubMed, EMBASE, Elsevier, Science Direct, Wan Fang, a CNKI e a literatura biomédica chinesa para todos os artigos relevantes publicados até 25 de abril de 2018. As estratégias de busca foram baseadas em combinações das seguintes palavras-chave: (‘’ metaloproteinase de matriz-7 ‘’ OU ‘’ MMP-7 ‘’ OR ‘’ matrilisina ‘’ OU metaloproteinase uterina OR ‘’ bomba-1 protease ‘’ OR ‘’ PUMP-1 ‘’) E (‘’ -181A> G OR ‘’ rs11568818 ‘’) E (‘’ câncer colorretal ‘’ OU ‘’ CRC ‘’) E (‘’ adenocarcinoma gástrico ‹› OU ‹› câncer de estômago ‹› OU ‹ «cancro gástrico» OU «GC») E («gene» ou «alelo» ou «genótipo» ou «mutação» ou «variante» ou «variação» ou «polimorfismo»), sem qualquer restrição à linguagem. Artigos de revisão foram pesquisados manualmente para encontrar estudos elegíveis adicionais e apenas estudos publicados com artigos de texto completo foram incluídos. Foram excluídos estudos que não eram artigos completos de publicações ou em periódicos em inglês com revisão por pares. Quando a mesma população de pacientes foi incluída em diferentes artigos, selecionou-se aquele com a maior população de participantes ou o mais recente.
Critérios de inclusão e exclusão
Os critérios de inclusão foram definidos da seguinte forma: 1) estudos publicados e continham dados originais; 2) estudos caso-controle; 3) avaliação da associação do polimorfismo MMP-7 -181A>G com o risco de CRC e GC; e 4) dados publicados suficientes disponíveis para estimar odds ratio (OR) com intervalo de confiança de 95% (IC). As principais razões para a exclusão dos estudos foram as seguintes: 1) apenas estudos de população de caso, baseados em família ou de ligação; 2) estudos que não puderam oferecer o número de casos e controles ou outros dados essenciais; 3) revisões, resumos, cartas ao editor, relatos de casos ou estudos com animais; 4) duplicação de publicações anteriores ou estudos com populações de pacientes sobrepostas; e 5) estudos sem confirmação histológica de CRC e GC. Para mais de dois estudos com dados sobrepostos, o maior em número de assuntos ou os dados mais recentes publicados foi selecionado.
Extração de dados
Os dados foram cuidadosamente extraídos de todas as publicações elegíveis por dois dos autores de forma independente. Se o estudo forneceu informações sobre o estrato, os dados provenientes de estratos semelhantes foram adicionados para fazer uso total dos dados. Desacordos entre os dois autores foram resolvidos discutindo os resultados com um terceiro. Para cada estudo, foram coletadas as seguintes variáveis: nome do primeiro autor, ano de publicação, país, etnia dos participantes, número de casos e controles, métodos de genotipagem e número de alelos e distribuições genotípicas em casos e controles, frequências alélicas menores (MAFs) em controles, e os resultados do teste de equilíbrio de Hardy-Weinberg (HWE). Diferentes etnias foram categorizadas como asiáticas, caucasianas e latinas (mistas). Desenhos de estudo foram estratificados para estudos de base populacional e estudos baseados em hospitais.
Análise estatística
A força da associação do polimorfismo MMP-7 -181A>G com o risco de CRC e GC foi medida usando odds ratios (OR) com intervalos de confiança de 95% (IC). A significância estatística do OR agrupado foi avaliada com o teste Z e p<0,05 foi considerado significativo. As OR agrupadas foram realizadas sob cinco modelos genéticos, ou seja, alelo (G vs. A), heterozigoto (GA vs. AA), homozigoto (GG vs. AA), dominante (GG + GA vs. AA) e recessivo (GG vs. GA + AA). A heterogeneidade entre os estudos foi avaliada por um teste Q baseado no qui-quadrado, cujo valor de p para o teste Q menor que 0,10 indicava a heterogeneidade existente entre os estudos. Além disso, a estatística I2 foi usada para quantificar a proporção da variação total entre os estudos devido à heterogeneidade. Valor alto de I2 indicou maior probabilidade de existência de heterogeneidade (I2=0% a 25%, sem heterogeneidade; I2=25% a 50%, heterogeneidade moderada; I2=50% a 75%, grande heterogeneidade; e I2=75% a 100%, extrema heterogeneidade). Um modelo de efeitos aleatórios (método DerSimonian-Laird) ou de efeitos fixos (método de Mantel-Haenszel) foi usado para calcular as estimativas de efeito agrupado na presença ou ausência de heterogeneidade. A HWE da distribuição dos genótipos nos controles dos estudos incluídos foi realizada usando o teste x 2 de Pearson, em que o valor de p inferior a 0,05 foi considerado significativamente diferente do HWE. Análises de subgrupos foram realizadas por etnia, método de genotipagem, status de HWE, fonte de controles e tipo de câncer (CRC e GC). Além disso, para considerar as possíveis fontes de heterogeneidade, os estudos foram estratificados. Para validar a confiabilidade dos resultados, a análise de sensibilidade foi realizada, omitindo-se um estudo caso-controle de cada vez, assim como limitando esta metanálise a estudos que estavam em conformidade com o HWE. Gráficos de funil e teste de regressão linear de Egger foram usados para diagnosticar viés de publicação potencial (p<0,05). Todas as análises foram realizadas com o software abrangente de metanálise (CMA) 2.0 (Biostat, EUA).
RESULTADOS
Processo de extração e características do estudo
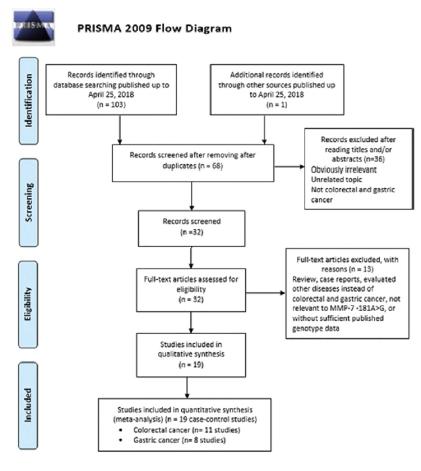
O diagrama de fluxo da pesquisa bibliográfica foi dado na Figura 1. A pesquisa inicial de bancos de dados resultou em 103 publicações relevantes com base em nossa estratégia de busca na literatura, e um estudo adicional foi identificado através da busca manual. No entanto, 36 deles foram descartados por causa dos resultados duplicados obtidos em vários bancos de dados, 68 artigos permaneceram. Além disso, após a revisão dos títulos e resumos dos 68 artigos, foram excluídos 49 estudos irrelevantes, em texto completo. Finalmente, 19 estudos de caso-controle elegíveis com 3.714 casos e 4.712 controles foram incluídos nesta metanálise. As características dos estudos incluídos na metanálise atual estão apresentadas na Tabela 1. Entre esses estudos, 11 com 2.169 casos de CCR e 2.346 controles foram sobre CRC22 Banday MZ, Sameer AS, Mir AH, Mokhdomi TA, Chowdri NA, Haq E. Matrix metalloproteinase (MMP) -2, -7 and -9 promoter polymorphisms in colorectal cancer in ethnic Kashmiri population - A case-control study and a mini review. Gene. 2016 Sep 1;589(1):81-9.
3 Dziki L, Przybylowska K, Majsterek I, Trzcinski R, Mik M, Sygut A. A/G Polymorphism of the MMP-7 Gene Promoter Region in Colorectal Cancer. Polish J Surg. 2011 Jan 1;83(11):622-6.-44 Fang W-L, Liang W-B, He H, Zhu Y, Li S-L, Gao L-B, et al. Association of Matrix Metalloproteinases 1, 7, and 9 Gene Polymorphisms with Genetic Susceptibility to Colorectal Carcinoma in a Han Chinese Population. DNA Cell Biol. 2010 Nov;29(11):657-61.,88 Ghilardi G, Biondi ML, Erario M, Guagnellini E, Scorza R. Colorectal carcinoma susceptibility and metastases are associated with matrix metalloproteinase-7 promoter polymorphisms. Clin Chem. 2003 Nov;49(11):1940-2.,1616 Lièvre A, Milet J, Carayol J, Le Corre D, Milan C, Pariente A, et al. Genetic polymorphisms of MMP1, MMP3 and MMP7gene promoter and risk of colorectal adenoma. BMC Cancer. 2006 Dec 24;6(1):270.,1919 Moreno-Ortiz JM, Gutierrez-Angulo M, Partida-Pérez M, Peregrina-Sandoval J, Ramírez-Ramírez R, Muñiz-Mendoza R, et al. Association of MMP7-181A/G and MMP13-77A/G polymorphisms with colorectal cancer in a Mexican population. Genet Mol Res. 2014 Feb 14;13(2):3537-44.,2020 Motovali-Bashi M, Sadeghi Z, Hemati S. Relationship between -181 (A/G) region single nucleotide polymorphisms of matrilysin gene promoter and the onset and prevalence of colorectal cancer using tetra-primer ARMS PCR and RFLP-PCR techniques [Internet]. Vol. 7, Basic & Clinical Cancer Research. Tehran University of Medical Sciences, Cancer Institute of Iran, Cancer Research Center; 2015. 20-31.,2424 Ohtani H, Maeda N MY. Functional polymorphisms in the promoter regions of matrix metalloproteinase-2,-3,-7,-9 and TNF- alpha genes, and the risk of colorectal neoplasm in Japanese. Yonago Acta Med. 2009;52:47-56.,2828 Woo M, Park K, Nam J, Kim JC. Clinical implications of matrix metalloproteinase-1, -3, -7, -9, -12, and plasminogen activator inhibitor-1 gene polymorphisms in colorectal cancer. J Gastroenterol Hepatol. 2007 Jul;22(7):1064-70.,3333 Yueh T-C, Wu C-N, Hung Y-W, Chang W-S, Fu C-K, Pei J-S, et al. The Contribution of MMP-7 Genotypes to Colorectal Cancer Susceptibility in Taiwan. Cancer Genomics Proteomics. 2018 Apr 24;15(3):207-12., e oito com 1.545 casos de GC e 2.366 controles estavam no GC55 Fang W-L, Liang W-B, Gao L-B, Zhou B, Xiao F-L, Zhang L. Genetic polymorphisms in Matrix Metalloproteinases -1 and -7 and susceptibility to gastric cancer: an association study and meta-analysis. Iran J Allergy Asthma Immunol. 2013 Jul 9;12(3):203-10.,1111 Kesh K, Subramanian L, Ghosh N, Gupta V, Gupta A, Bhattacharya S, et al. Association of MMP7 -181A?G Promoter Polymorphism with Gastric Cancer Risk. J Biol Chem. 2015 Jun 5;290(23):14391-406.,1212 Kim JH, Pyun JA, Lee KJ, Cho SW, Kwack KB. [Study on association between single nucleotide polymorphisms of MMP7, MMP8, MMP9 genes and development of gastric cancer and lymph node metastasis]. Korean J Gastroenterol. 2011 Nov 25;58(5):245-51.,1414 Kubben FJGM, Sier CFM, Meijer MJW, van den Berg M, van der Reijden JJ, Griffioen G, et al. Clinical impact of MMP and TIMP gene polymorphisms in gastric cancer. Br J Cancer. 2006 Sep 29;95(6):744-51.,1515 Li J, Tian M, Zhao A. T2028 Polymorphism in the Promoter Region of the Metalloproteinase-7 Increases Susceptibility and Risk of Metastasis of Gastric Adenocarcinoma. Gastroenterology. 2008 Apr 1;134(4):A-603.,1717 Malik MA, Zargar SA, Mittal B. Role of the metalloproteinase-7 (181A>G) polymorphism in gastric cancer susceptibility: a case control study in Kashmir valley. Asian Pac J Cancer Prev. 2011;12(1):73-6.,2626 Sugimoto M, Furuta T, Kodaira C, Nishino M, Yamade M, Ikuma M, et al. Polymorphisms of matrix metalloproteinase-7 and chymase are associated with susceptibility to and progression of gastric cancer in Japan. J Gastroenterol. 2008 Oct 29;43(10):751-61.,3434 Zhang J, Jin X, Fang S, Wang R, Li Y, Wang N, et al. The functional polymorphism in the matrix metalloproteinase-7 promoter increases susceptibility to esophageal squamous cell carcinoma, gastric cardiac adenocarcinoma and non-small cell lung carcinoma. Carcinogenesis. 2005 Oct 1;26(10):1748-53.. Por etnia, havia 13 estudos de asiáticos (países: Coréia, Japão, China, Irã, Caxemira, Taiwan e Índia), quatro estudos de caucasianos (países: Itália, França, Polônia e Holanda) e dois de latinos (países: Brasil e México). De acordo com a fonte de controle, dez estudos foram baseados em hospitais, oito na população e um estudo não icou claro. Os trabalhos utilizaram quatro diferentes métodos de genotipagem, incluindo sequenciamento direto, TaqMan, reação em cadeia da polimerase - polimorfismo do comprimento do fragmento de restrição (PCR-RFLP) e amplificação por tetra-primers da cadeia de polimerase do sistema de mutação refratária (ARMS-PCR). Todos os estudos indicaram que a distribuição dos genótipos nos controles foi consistente com o HWE, exceto por dois estudos (Tabela 1).
Síntese quantitativa
Estudo geral
A Tabela 2 listou os principais resultados da metanálise do polimorfismo MMP-7 -181A>G com risco de CRC e GC. Reuniu-se todos os 19 estudos de caso-controle para avaliar a associação global do polimorfismo MMP-7 -181A>G com o risco de CRC e GC. No geral, não foram observados efeitos principais significativos na suscetibilidade de CRC e GC na população geral sob todos os cinco modelos genéticos, isto é, alelo (G vs. A: OR=1,049, IC 95% 0,889-1,239, p=0,570, Figura 2A), heterozigoto (GA vs. AA: OR=1,083, IC 95% 0,813-1,443, p=0,586), homozigoto (GG vs. AA: OR=0,982, IC 95% 0,701-1,375, p=0,915), dominante (GG + AG vs. AA: OR=1,061, IC 95% 0,869-1,296, p=559) e recessivo (GG vs. GA + AA: OR=1,084, IC 95% 0,786-1,495, p=0,622).
Parcela florestal para a associação do polimorfismo MMP-7 -181A>G com risco de CRC e GC: A) modelo alélico (G vs. A) nas estimativas gerais; B) o modelo homozigoto (GG vs. AA) em estudos de GC
Câncer colorretal
A Tabela 2 também listou os principais resultados da metanálise do polimorfismo MMP-7 -181A>G com risco de CRC. Quando todos os 11 estudos elegíveis foram agrupados na metanálise do polimorfismo MMP-7 -181A>G, não encontramos evidências de polimorfismo significativo de MMP-7 -181A>G com risco de CRC em todos os cinco modelos genéticos. Na análise de subgrupo por etnia, risco significativamente aumentado de CCR foi observado em asiáticos sob três modelos genéticos, ou seja, alelo (G vs. A: OR=0,798, IC 95% 0,661-0,964, p=0,019, Figura 2A), homozigoto (GG vs. AA: OR=0,490, IC 95% 00,286-0,838, p=0,009) e modelo recessivo (GG vs. GA + AA: OR=0,530, IC 95% 0,340-0,826, p=0,005), mas não em caucasianos e latinos (Tabela 2).
Também realizamos análises de subgrupos com base na fonte do método de controle e genotipagem, quando disponível (Tabela 3). A análise do subgrupo hospitalar revelou que a presença do polimorfismo MMP-7 -181A>G estava relacionada a um maior risco de CRC sob o modelo homozigoto (GG vs. AA: OR=0,671, IC 95% 0,484-0,951, p=0,023). No grupo PCR-RFLP, associação significativamente maior entre o polimorfismo MMP-7 -181A>G e o risco de CCR foi encontrado no modelo homozigoto (GG vs. AA: OR=0,680, IC 95% 0,486-0,950, p=0,024, Tabela 3).
Câncer gástrico
A Tabela 2 também listou os principais resultados da metanálise do polimorfismo MMP-7 -181A>G com o risco de GC. Houve associação significativa entre o polimorfismo MMP-7 -181A>G e o risco de GC em dois modelos genéticos, homozigoto (GG vs. AA: OR=1,672, IC 95% 1,161-2,409, p=0,006, Figura 2B) e recessivo (GG vs. GA + AA: OR=1,835, IC 95% 1,319-2,554, p=0,001). Da mesma forma, quando estratificada por etnia, uma associação significativa entre o polimorfismo MMP-7 -181A>G e aumento do risco de GC foi detectada entre os asiáticos sob o modelo homozigoto (GG vs. AA: OR=1,975, IC 95% 1,331-2,934, p=0,006) e o modelo recessivo (GG vs. GA + AA: OR=2,022, IC 95% 1,416-2,886, p=0,001).
Os estudos foram ainda estratificados com base na fonte de controles (Tabela 3). Ao estratificar por fonte de controle, associação significativa entre o polimorfismo MMP-7 -181A>G e o risco aumentado de GC foi detectada em estudos de base populacional sob o modelo recessivo (GG vs. GA + AA: OR=1,819, IC 95% 1,173-2,819, p=0,008), e em estudos hospitalares sob dois modelos genéticos, ou seja, homozigoto (GG vs. AA: OR=1,884, 95% IC 1,107-3,204, p=0,020) e recessivo (GG vs. GA + AA: OR=1,858, IC 95% 1,124-3,069, p=0,016).
Análise de heterogeneidade
A heterogeneidade foi detectada entre os estudos em todos os cinco modelos genéticos, alelo (G vs. A: I2=70,90%, PH=0,001), heterozigoto (GA versus AA: I2=82,36%, PH=0,001), homozigoto (GG vs. AA: I2=54,65%, PH=0,006), dominante (GG + GA vs. AA: I2=65,43%, PH=0,001) e recessivo (GG vs. GA + AA: I2=65,4%, PH=0,001). Assim, para explorar as fontes potenciais de heterogeneidade entre os estudos, avaliamos as RUP agrupadas por estratificação por tipo de câncer, etnia, método de genotipagem, status de HWE e fonte de controles. Os resultados mostraram que a heterogeneidade foi efetivamente removida por análises de subgrupos baseados em etnia entre os estudos sobre CRC. Portanto, descobrimos que o método de genotipagem, o status de HWE e a fonte de controles não contribuíram para a substancial heterogeneidade entre as metanálises.
Análise sensitiva
Para avaliar o efeito do estudo individual nas OR agrupadas e estabilidade dos resultados da metanálise, excluímos um estudo de cada vez. No entanto, a omissão de um único estudo não apresentou diferença significativa, sugerindo que os resultados dessa metanálise foram estáveis. Além disso, a análise de sensibilidade foi realizada após a exclusão de estudos que violam HWE, e as correspondentes RUP agrupadas não foram qualitativamente alteradas (dados não mostrados).
Viés de publicação
Tanto o gráfico de funil de Begg quanto o teste de Egger foram realizados para avaliar o viés de publicação da literatura. Os gráficos em funil de Begg não revelaram nenhuma evidência de assimetria óbvia em todos os cinco modelos genéticos na metanálise geral. Por exemplo, a forma do gráfico de funil não indicou nenhuma evidência de assimetria óbvia no modelo de alelo (Figura 3), e o teste de Egger sugeriu a ausência de viés de publicação (PBeggs=0,293 e PEggers=0,483). No entanto, os resultados do teste de regressão de Egger mostraram evidências de viés de publicação entre os estudos de caucasiano sobre CRC sob o modelo recessivo (GG vs. GA + AA: PBegg=0,296, PEggers=0,001).
Gráfico em funil de Begg do polimorfismo MMP-7 -181A>G com risco de CRC e GC para teste de viés de publicação no modelo de alelos (G vs. A): cada ponto representa um estudo separado para a associação indicada
Frequências alélicas menores (MAFs)
As frequências alélicas menores (MAFs) do polimorfismo MMP-7 -181A>G são mostradas na Tabela 2. As distribuições de alelos e genótipos do polimorfismo MMP-7 -181A>G exibiram variações étnicas. O polimorfismo MMP-7 -181A>G MAF em populações globais, asiáticos, caucasianos e latinos foi de 37,4% (4,0% -70,8%), 37,4% (4,0% -70,8%), 43,65% (40,0% -47,30%), e 37,75% (37,1% -38,4%), respectivamente.
DISCUSSÃO
O gene MMP-7 está implicado na susceptibilidade e na metástase de uma variedade de cânceres relacionados ao aparelho digestivo1919 Moreno-Ortiz JM, Gutierrez-Angulo M, Partida-Pérez M, Peregrina-Sandoval J, Ramírez-Ramírez R, Muñiz-Mendoza R, et al. Association of MMP7-181A/G and MMP13-77A/G polymorphisms with colorectal cancer in a Mexican population. Genet Mol Res. 2014 Feb 14;13(2):3537-44.,1111 Kesh K, Subramanian L, Ghosh N, Gupta V, Gupta A, Bhattacharya S, et al. Association of MMP7 -181A?G Promoter Polymorphism with Gastric Cancer Risk. J Biol Chem. 2015 Jun 5;290(23):14391-406.. Na última década, vários estudos epidemiológicos moleculares foram realizados para avaliar a associação de MMP-7 -181A>polimorfismo G com CRC e risco de GC. No entanto, os resultados foram conflitantes. Assim, realizamos uma metanálise abrangente envolvendo dados publicados, para avaliar a força da associação entre o polimorfismo MMP-7 -181A>G e o risco de GC. Na atual metanálise, um total de 19 estudos de caso-controle incluindo 3.714 casos e 4.712 controles foram recrutados. A análise do subgrupo por tipo de câncer, mostrou que houve associação significativa entre o polimorfismo MMP-7 -181A>G e aumento do risco de GC nas estimativas gerais, mas não com o CRC. Em análise estratificada por etnia, nossos resultados indicaram que o polimorfismo MMP-7 -181A>G foi associado ao aumento significativo do risco de CRC e GC em asiáticos. Além disso, a análise estratificada de acordo com a fonte dos controles e método de genotipagem revelou risco significativamente aumentado de CRC e GC em participantes com o polimorfismo MP-7 -181A>G naqueles estudos envolvendo PCR-RFLP, baseados em população e hospitalar (Tabela 3).
Nossos resultados foram consistentes com as metanálises anteriores sobre o polimorfismo MMP-7 -181A>G e o risco de GC. Assim, o polimorfismo MMP-7 -181A>G pode servir como um marcador de suscetibilidade ao risco de GC. No entanto, nossos resultados são inconsistentes com as metanálises anteriores sobre o polimorfismo MMP-7 -181A>G e o risco de CCR. Em 2013, duas metanálises de Ke et al.1010 Ke P, Wu Z-D, Wen H-S, Ying M-X, Long H-C, Qing L-G. Current evidence on associations between the MMP-7 (-181A>G) polymorphism and digestive system cancer risk. Asian Pac J Cancer Prev. 2013;14(4):2269-72.,3131 Yang X, Liu Y, Yang Y, Li B. Update meta-analysis on MMP-7 -181A>G polymorphism and cancer risk: Evidence from 25 studies. Gene. 2013 Jun 1;521(2):252-8. e Yang et al.3131 Yang X, Liu Y, Yang Y, Li B. Update meta-analysis on MMP-7 -181A>G polymorphism and cancer risk: Evidence from 25 studies. Gene. 2013 Jun 1;521(2):252-8. foram conduzidas para examinar a associação entre o polimorfismo MMP-7 -181A>G e o risco de CCR 10,31. Ke et al.1010 Ke P, Wu Z-D, Wen H-S, Ying M-X, Long H-C, Qing L-G. Current evidence on associations between the MMP-7 (-181A>G) polymorphism and digestive system cancer risk. Asian Pac J Cancer Prev. 2013;14(4):2269-72. em metanálise de sete casos-controle encontraram associação significativa entre o polimorfismo MMP-7 -181A>G e o CRC sob o modelo homozigoto (GG vs. AA, OR=1,13, IC95%=1,01-1,26)1010 Ke P, Wu Z-D, Wen H-S, Ying M-X, Long H-C, Qing L-G. Current evidence on associations between the MMP-7 (-181A>G) polymorphism and digestive system cancer risk. Asian Pac J Cancer Prev. 2013;14(4):2269-72.. Da mesma forma, Yang et al.3131 Yang X, Liu Y, Yang Y, Li B. Update meta-analysis on MMP-7 -181A>G polymorphism and cancer risk: Evidence from 25 studies. Gene. 2013 Jun 1;521(2):252-8. em uma metanálise de sete estudos com 1.502 casos de CRC e 1.602 controles encontrou associação significativa entre a MMP-7 -181A> polimorfismo G e CRC sob o modelo homozigoto (OR=1,31, IC 95% 1.02- 1,69) 3131 Yang X, Liu Y, Yang Y, Li B. Update meta-analysis on MMP-7 -181A>G polymorphism and cancer risk: Evidence from 25 studies. Gene. 2013 Jun 1;521(2):252-8.. No entanto, suas descobertas sobre o polimorfismo MMP-7 -181A>G e o risco de CCR permanecem essencialmente em campo aberto, uma vez que o número de estudos é consideravelmente menor do que o necessário para produzir uma conclusão robusta. Além disso, as metanálises anteriores não realizaram análise estratificada por etnia para identificar a possível associação do polimorfismo MMP-7 -181A>G com o CCR entre diferentes grupos étnicos.
A heterogeneidade entre os estudos desempenha um papel importante ao realizar uma metanálise3232 Yazdi MM, Jamalaldini MH, Sobhan MR, Jafari M, Mazaheri M, Zare-Shehneh M, et al. Association of ESRa Gene Pvu II T>C, XbaI A>G and BtgI G>A Polymorphisms with Knee Osteoarthritis Susceptibility: A Systematic Review and Meta-Analysis Based on 22 Case-Control Studies. Arch bone Jt Surg. 2017 Nov;5(6):351-62.. Ela pode resultar do desenho do estudo, erro de genotipagem, viés de seleção, estratificação da população, tamanho da amostra, heterogeneidade alélica ou chance99 Gohari M, Neámatzadeh H, Jafari MA, Mazaheri M, Zare-Shehneh M, Abbasi-Shavazi E. Association between the p53 codon 72 polymorphism and primary open-angle glaucoma risk: Meta-analysis based on 11 case-control studies. Indian J Ophthalmol. 2016 Oct;64(10):756-61.,2525 Sobhan MR, Mahdinezhad-Yazdi M, Aghili K, Zare-Shehneh M, Rastegar S, Sadeghizadeh-Yazdi J, et al. Association of TNF-a-308?G?>?A and -238G?>?A polymorphisms with knee osteoarthritis risk: A case-control study and meta-analysis. J Orthop. 2018 Sep 1;15(3):747-53.. Portanto, encontrar a fonte de heterogeneidade é muito importante para o resultado final da metanálise. Através da realização de análise de subgrupo, descobrimos que a heterogeneidade não poderia ser explicada pelo método de genotipagem, status de HWE e fonte de controles nesta metanálise. No entanto, os resultados mostraram que a heterogeneidade foi efetivamente removida pela análise de subgrupos com base na etnia entre os estudos sobre CRC, indicando que estudos entre populações asiáticas sobre CRC podem ser uma fonte da heterogeneidade em nossa metanálise.
Esta metanálise teve três pontos fortes principais. Em primeiro lugar, ela é a maior e mais recente na associação do polimorfismo MMP-7 -181A>G com o risco de CRC e GC, e foi mais poderosa do que os estudos de caso-controle individuais anteriores. Segundo, ela é a primeira metanálise por análise de subgrupo que mostrou que o polimorfismo MMP-7 -181A>G estava associado ao risco de CRC em asiáticos. Em terceiro lugar, estratégia de busca abrangente de várias bases de dados eletrônicas com busca manual fez com que os estudos elegíveis fossem incluídos o máximo possível.
Apesar das forças claras desta metanálise, as limitações dela devem ser observadas. Primeiro, embora todos os estudos elegíveis tenham sido incluídos, o tamanho da amostra desses estudos não foi suficientemente grande, o que poderia aumentar a probabilidade de erros tipo I e tipo II. Portanto, houve falta de poder estatístico para avaliar melhor a associação do polimorfismo MMP-7 -181A>G com o risco de CRC e GC. Segundo, a maioria dos estudos incluídos na presente metanálise forneceu dados principalmente em asiáticos. Além disso, o tamanho da amostra foi relativamente pequeno para análises estratificadas por etnia e pode não ter fornecido poder suficiente para estimar a associação do polimorfismo MMP-7 -181A>G entre diferentes grupos étnicos. Terceiro, embora o gráfico de funil e o teste de Egger não tenham mostrado evidências de viés de publicação nas estimativas gerais, a influência do viés na presente análise não pôde ser completamente excluída. Por exemplo, os achados negativos são geralmente difíceis de serem publicados, ou nesta metanálise incluímos apenas estudos publicados em inglês, que produziram viés de seleção no início de nosso estudo. Quarto, a presente metanálise foi baseada principalmente em estimativas de efeitos não ajustados, porque a maioria dos estudos não forneceu o OR ajustado e 95% CI controlando potenciais fatores de confusão, assim, as estimativas de efeito foram relativamente imprecisas. Se dados individuais estivessem disponíveis, ORs ajustados poderiam ser obtidos para fornecer uma análise mais precisa. Por fim, é bem conhecido que CRC e GC são condições multifatoriais; no entanto, os efeitos das interações gene-gene e gene-ambiente não foram abordados na metanálise atual.
CONCLUSÃO
Esta metanálise indicou que o polimorfismo MMP-7 -181A>G pode ser um fator de risco para suscetibilidade ao GC em estimativas gerais e em asiáticos. No entanto, estes resultados mostraram claramente que o polimorfismo MMP-7 -181A>G aumentou significativamente o risco de CRC apenas em asiáticos. Considerando o tamanho da amostra e as etnias limitadas, estudos bem planejados que levem em consideração as interações gene-gene e gene-ambiente devem ser realizados para confirmar nossos resultados.
REFERENCES
-
1Adachi Y, Yamamoto H, Itoh F, Hinoda Y, Okada Y, Imai K. Contribution of matrilysin (MMP-7) to the metastatic pathway of human colorectal cancers. Gut. 1999 Aug 1;45(2):252-8.
-
2Banday MZ, Sameer AS, Mir AH, Mokhdomi TA, Chowdri NA, Haq E. Matrix metalloproteinase (MMP) -2, -7 and -9 promoter polymorphisms in colorectal cancer in ethnic Kashmiri population - A case-control study and a mini review. Gene. 2016 Sep 1;589(1):81-9.
-
3Dziki L, Przybylowska K, Majsterek I, Trzcinski R, Mik M, Sygut A. A/G Polymorphism of the MMP-7 Gene Promoter Region in Colorectal Cancer. Polish J Surg. 2011 Jan 1;83(11):622-6.
-
4Fang W-L, Liang W-B, He H, Zhu Y, Li S-L, Gao L-B, et al. Association of Matrix Metalloproteinases 1, 7, and 9 Gene Polymorphisms with Genetic Susceptibility to Colorectal Carcinoma in a Han Chinese Population. DNA Cell Biol. 2010 Nov;29(11):657-61.
-
5Fang W-L, Liang W-B, Gao L-B, Zhou B, Xiao F-L, Zhang L. Genetic polymorphisms in Matrix Metalloproteinases -1 and -7 and susceptibility to gastric cancer: an association study and meta-analysis. Iran J Allergy Asthma Immunol. 2013 Jul 9;12(3):203-10.
-
6Fanjul-Fernández M, Folgueras AR, Cabrera S, López-Otín C. Matrix metalloproteinases: Evolution, gene regulation and functional analysis in mouse models. Biochim Biophys Acta - Mol Cell Res. 2010 Jan 1;1803(1):3-19.
-
7Forat-Yazdi M, Gholi-Nataj M, Neamatzadeh H, Nourbakhsh P, Shaker-Ardakani H. Association of XRCC1 Arg399Gln polymorphism with colorectal cancer risk: A huge meta analysis of 35 studies. Asian Pacific J Cancer Prev [Internet]. 2015;16(8).
-
8Ghilardi G, Biondi ML, Erario M, Guagnellini E, Scorza R. Colorectal carcinoma susceptibility and metastases are associated with matrix metalloproteinase-7 promoter polymorphisms. Clin Chem. 2003 Nov;49(11):1940-2.
-
9Gohari M, Neámatzadeh H, Jafari MA, Mazaheri M, Zare-Shehneh M, Abbasi-Shavazi E. Association between the p53 codon 72 polymorphism and primary open-angle glaucoma risk: Meta-analysis based on 11 case-control studies. Indian J Ophthalmol. 2016 Oct;64(10):756-61.
-
10Ke P, Wu Z-D, Wen H-S, Ying M-X, Long H-C, Qing L-G. Current evidence on associations between the MMP-7 (-181A>G) polymorphism and digestive system cancer risk. Asian Pac J Cancer Prev. 2013;14(4):2269-72.
-
11Kesh K, Subramanian L, Ghosh N, Gupta V, Gupta A, Bhattacharya S, et al. Association of MMP7 -181A?G Promoter Polymorphism with Gastric Cancer Risk. J Biol Chem. 2015 Jun 5;290(23):14391-406.
-
12Kim JH, Pyun JA, Lee KJ, Cho SW, Kwack KB. [Study on association between single nucleotide polymorphisms of MMP7, MMP8, MMP9 genes and development of gastric cancer and lymph node metastasis]. Korean J Gastroenterol. 2011 Nov 25;58(5):245-51.
-
13Klein T, Bischoff R. Physiology and pathophysiology of matrix metalloproteases. Amino Acids. 2011 Jul;41(2):271-90.
-
14Kubben FJGM, Sier CFM, Meijer MJW, van den Berg M, van der Reijden JJ, Griffioen G, et al. Clinical impact of MMP and TIMP gene polymorphisms in gastric cancer. Br J Cancer. 2006 Sep 29;95(6):744-51.
-
15Li J, Tian M, Zhao A. T2028 Polymorphism in the Promoter Region of the Metalloproteinase-7 Increases Susceptibility and Risk of Metastasis of Gastric Adenocarcinoma. Gastroenterology. 2008 Apr 1;134(4):A-603.
-
16Lièvre A, Milet J, Carayol J, Le Corre D, Milan C, Pariente A, et al. Genetic polymorphisms of MMP1, MMP3 and MMP7gene promoter and risk of colorectal adenoma. BMC Cancer. 2006 Dec 24;6(1):270.
-
17Malik MA, Zargar SA, Mittal B. Role of the metalloproteinase-7 (181A>G) polymorphism in gastric cancer susceptibility: a case control study in Kashmir valley. Asian Pac J Cancer Prev. 2011;12(1):73-6.
-
18Mittal R, Patel AP, Debs LH, Nguyen D, Patel K, Grati M, et al. Intricate Functions of Matrix Metalloproteinases in Physiological and Pathological Conditions. J Cell Physiol. 2016 Dec 1;231(12):2599-621.
-
19Moreno-Ortiz JM, Gutierrez-Angulo M, Partida-Pérez M, Peregrina-Sandoval J, Ramírez-Ramírez R, Muñiz-Mendoza R, et al. Association of MMP7-181A/G and MMP13-77A/G polymorphisms with colorectal cancer in a Mexican population. Genet Mol Res. 2014 Feb 14;13(2):3537-44.
-
20Motovali-Bashi M, Sadeghi Z, Hemati S. Relationship between -181 (A/G) region single nucleotide polymorphisms of matrilysin gene promoter and the onset and prevalence of colorectal cancer using tetra-primer ARMS PCR and RFLP-PCR techniques [Internet]. Vol. 7, Basic & Clinical Cancer Research. Tehran University of Medical Sciences, Cancer Institute of Iran, Cancer Research Center; 2015. 20-31.
-
21Musial K, Zwolinska D. Matrix metalloproteinases and soluble Fas/FasL system as novel regulators of apoptosis in children and young adults on chronic dialysis. Apoptosis. 2011 Jul;16(7):653-9.
-
22Namazi A, Forat-Yazdi M, Jafari MA, Foroughi E, Farahnak S, Nasiri R, et al. Association between polymorphisms of ERCC5 gene and susceptibility to gastric cancer: A systematic review and meta-analysis. Asian Pacific J Cancer Prev. 2017;18(10).
-
23Namazi A, Forat-Yazdi M, Jafari M, Farahnak S, Nasiri R, Foroughi E, et al. Association of interleukin-10 -1082 A/G (rs1800896) polymorphism with susceptibility to gastric cancer: meta-analysis of 6,101 cases and 8,557 controls. Arq Gastroenterol. 2018 Mar;55(1):33-40.
-
24Ohtani H, Maeda N MY. Functional polymorphisms in the promoter regions of matrix metalloproteinase-2,-3,-7,-9 and TNF- alpha genes, and the risk of colorectal neoplasm in Japanese. Yonago Acta Med. 2009;52:47-56.
-
25Sobhan MR, Mahdinezhad-Yazdi M, Aghili K, Zare-Shehneh M, Rastegar S, Sadeghizadeh-Yazdi J, et al. Association of TNF-a-308?G?>?A and -238G?>?A polymorphisms with knee osteoarthritis risk: A case-control study and meta-analysis. J Orthop. 2018 Sep 1;15(3):747-53.
-
26Sugimoto M, Furuta T, Kodaira C, Nishino M, Yamade M, Ikuma M, et al. Polymorphisms of matrix metalloproteinase-7 and chymase are associated with susceptibility to and progression of gastric cancer in Japan. J Gastroenterol. 2008 Oct 29;43(10):751-61.
-
27Tak DH, Moon HS, Kang SH, Sung JK, Jeong HY. Prevalence and Risk Factors of Gastric Adenoma and Gastric Cancer in Colorectal Cancer Patients. Gastroenterol Res Pract. 2016 Dec 26;2016:1-7.
-
28Woo M, Park K, Nam J, Kim JC. Clinical implications of matrix metalloproteinase-1, -3, -7, -9, -12, and plasminogen activator inhibitor-1 gene polymorphisms in colorectal cancer. J Gastroenterol Hepatol. 2007 Jul;22(7):1064-70.
-
29Wu J, Guan X, Li Y-T, Bai P, Wu J. Matrix metalloproteinase7 -181A/G polymorphism is associated with increased cancer risk among high-quality studies: Evidence from a meta-analysis. Clin Biochem. 2013 Nov;46(16-17):1649-54.
-
30Yang T-F, Guo L, Wang Q. Meta-analysis of associations between four polymorphisms in the matrix metalloproteinases gene and gastric cancer risk. Asian Pac J Cancer Prev. 2014;15(3):1263-7.
-
31Yang X, Liu Y, Yang Y, Li B. Update meta-analysis on MMP-7 -181A>G polymorphism and cancer risk: Evidence from 25 studies. Gene. 2013 Jun 1;521(2):252-8.
-
32Yazdi MM, Jamalaldini MH, Sobhan MR, Jafari M, Mazaheri M, Zare-Shehneh M, et al. Association of ESRa Gene Pvu II T>C, XbaI A>G and BtgI G>A Polymorphisms with Knee Osteoarthritis Susceptibility: A Systematic Review and Meta-Analysis Based on 22 Case-Control Studies. Arch bone Jt Surg. 2017 Nov;5(6):351-62.
-
33Yueh T-C, Wu C-N, Hung Y-W, Chang W-S, Fu C-K, Pei J-S, et al. The Contribution of MMP-7 Genotypes to Colorectal Cancer Susceptibility in Taiwan. Cancer Genomics Proteomics. 2018 Apr 24;15(3):207-12.
-
34Zhang J, Jin X, Fang S, Wang R, Li Y, Wang N, et al. The functional polymorphism in the matrix metalloproteinase-7 promoter increases susceptibility to esophageal squamous cell carcinoma, gastric cardiac adenocarcinoma and non-small cell lung carcinoma. Carcinogenesis. 2005 Oct 1;26(10):1748-53.
-
35Zhang Y, Chen Q. Relationship between matrix metalloproteinases and the occurrence and development of ovarian cancer. Brazilian J Med Biol Res = Rev Bras Pesqui medicas e Biol. 2017 May 18;50(6):e6104.
-
Fonte de financiamento:
não há
Datas de Publicação
-
Publicação nesta coleção
21 Out 2019 -
Data do Fascículo
2019
Histórico
-
Recebido
11 Maio 2018 -
Aceito
16 Jan 2019