Resumos
Lacaziose ou doença de Jorge Lobo é micose crônica, granulomatosa, causada por implantação traumática do fungo Lacazia loboi - patógeno não cultivável até o presente - nos tecidos cutâneo e subcutâneo, manifestando-se clinicamente por lesões nodulares queloidianas predominantes, envolvendo sobretudo pavilhões auriculares, face, membros superiores e inferiores, e não comprometendo as mucosas. A maioria dos casos humanos está registrada em países da América do Sul. Entretanto, a enfermidade apresenta aspectos epidemiológicos destacados, como o aparecimento em tribo Caiabi, no Brasil Central e em mamíferos não humanos, golfinhos de duas espécies (Tursiops truncatus e Sotalia guianensis) capturados na costa da Flórida (EUA), na foz do rio Suriname, na costa de Santa Catarina (Brasil), no golfo de Gasconha (baía de Biscaia-Europa), com manifestações cutâneas e achados histopatológicos muito similares às encontradas no homem. O artigo objetiva abordar características do fungo e sua taxonomia, e aspectos históricos, ecoepidemiológicos, clínicos, imuno-histoquímicos, histopatológicos, ultra-estruturais e terapêuticos.
Doença granulomatosa crônica; Micoses; Quelóide
Lacaziosis, also known as Jorge Lobo’s disease, lobomycosis and keloidal blastomycosis, is a chronic cutaneous and subcutaneous fungal granulomatous disease, caused by Lacazia loboi - an uncultivated fungal pathogen - characterized by the development of nodular keloidal lesions, particularly on the pinnae, face, upper and lower limbs, and with no involvement of mucous membranes. Most cases in humans were reported in South America, including the Caiabi Indians, in Central Brazil. The disease was described in non-human mammals, such as two species of dolphins (Tursiops truncatus and Sotalia guianensis) inhabiting the coasts of Florida (USA), South America (Suriname River estuary, Santa Catarina-Brazil coast) and Gulf of Gascony (Biscaya Bay, in Europe). The histopathological findings in dolphins were very similar to those observed in humans. The aspects related to the history, etiology, epidemiology and ecology, clinical manifestations, differential diagnosis, immunohistochemistry, pathology, ultrastructural, laboratory diagnosis and therapy of lacaziosis, are presented.
Granulomatous disease, chronic; Keloid; Mycosis
ARTIGO DE REVISÃO
Lacaziose (doença de Jorge Lobo): revisão e atualização* * Trabalho realizado no Serviço de Dermatologia do Instituto de Ciências da Saúde da Universidade Federal do Pará (UFPA) Belém (PA), Brasil Conflito de interesse: Nenhum / Conflict of interest: None
Lacaziosis (Jorge Lobos disease): review and update
Arival Cardoso de BritoI; Juarez Antonio Simões QuaresmaII
IDoutor e livre-docente em Dermatologia da Universidade Federal do Pará (UFPA); professor do Programa de Pós-Graduação em Doenças Tropicais (Instituto de Medicina Tropical da UFPA); professor do Programa de Pós-Graduação em Biologia dos Agentes Infecciosos e Parasitários do Instituto de Ciências Biológicas da UFPA; chefe do Serviço de Dermatologia da UFPA Belém (PA), Brasil
IIDoutor em Patologia da Universidade de São Paulo (USP); professor do Programa de Pós-Graduação em Doenças Tropicais do Núcleo de Medicina Tropical da Universidade Federal do Pará (UFPA); professor do Programa de Pós-Graduação em Biologia dos Agentes Infecciosos e Parasitários do Instituto de Ciências Biológicas da UFPA Belém (PA), Brasil
Endereço para correspondência Endereço para correspondência Arival Cardoso de Brito Av. Generalíssimo Deodoro, 805, apt. 302 - Nazaré 66050 160 - Belém - PA Tel.: (91) 3222 9137 E-mail: acdebrito@uol.com.br
RESUMO
Lacaziose ou doença de Jorge Lobo é micose crônica, granulomatosa, causada por implantação traumática do fungo Lacazia loboi patógeno não cultivável até o presente nos tecidos cutâneo e subcutâneo, manifestando-se clinicamente por lesões nodulares queloidianas predominantes, envolvendo sobretudo pavilhões auriculares, face, membros superiores e inferiores, e não comprometendo as mucosas.
A maioria dos casos humanos está registrada em países da América do Sul. Entretanto, a enfermidade apresenta aspectos epidemiológicos destacados, como o aparecimento em tribo Caiabi, no Brasil Central e em mamíferos não humanos, golfinhos de duas espécies (Tursiops truncatus e Sotalia guianensis) capturados na costa da Flórida (EUA), na foz do rio Suriname, na costa de Santa Catarina (Brasil), no golfo de Gasconha (baía de Biscaia-Europa), com manifestações cutâneas e achados histopatológicos muito similares às encontradas no homem.
O artigo objetiva abordar características do fungo e sua taxonomia, e aspectos históricos, ecoepidemiológicos, clínicos, imuno-histoquímicos, histopatológicos, ultra-estruturais e terapêuticos.
Palavras-chave: Doença granulomatosa crônica; Micoses; Quelóide
ABSTRACT
Lacaziosis, also known as Jorge Lobos disease, lobomycosis and keloidal blastomycosis, is a chronic cutaneous and subcutaneous fungal granulomatous disease, caused by Lacazia loboi an uncultivated fungal pathogen characterized by the development of nodular keloidal lesions, particularly on the pinnae, face, upper and lower limbs, and with no involvement of mucous membranes.
Most cases in humans were reported in South America, including the Caiabi Indians, in Central Brazil. The disease was described in non-human mammals, such as two species of dolphins (Tursiops truncatus and Sotalia guianensis) inhabiting the coasts of Florida (USA), South America (Suriname River estuary, Santa Catarina-Brazil coast) and Gulf of Gascony (Biscaya Bay, in Europe). The histopathological findings in dolphins were very similar to those observed in humans.
The aspects related to the history, etiology, epidemiology and ecology, clinical manifestations, differential diagnosis, immunohistochemistry, pathology, ultrastructural, laboratory diagnosis and therapy of lacaziosis, are presented.
Keywords: Granulomatous disease, chronic; Keloid; Mycosis
INTRODUÇÃO
Lacaziose ou doença de Jorge Lobo é infecção fúngica profunda, crônica, granulomatosa, causada pela implantação traumática do fungo Lacazia loboi (ou Paracoccidioides loboi et Loboa loboi) nos tecidos cutâneo e subcutâneo, com aparecimento de lesões nodulares isoladas e coalescentes, em geral de aspecto queloidiano, localizadas principalmente no pavilhão auricular e nos membros dos pacientes, não havendo registro de lesões mucosas.
Freqüente nas Américas do Sul e Central, estendendo-se da Bolívia ao México (Yucatán), predominando em países da região amazônica, sendo exceções os casos da Europa, Estados Unidos e Canadá.
A enfermidade tem ampla sinonímia: doença ou micose de Jorge Lobo, blastomicose queloidiana, blastomicose tipo Jorge Lobo, granulomatose blastomicóide, blastomicose amazônica, miraip ou piraip (o que arde, em tupi), lepra-dos-caiabi, falsa-lepra e, recentemente, lacaziose.
ASPECTOS HISTÓRICOS
Em 1931, em Recife (PE), Brasil, o dermatologista Jorge Lobo1 descreveu o primeiro caso da micose, publicando-o na Revista Médica de Pernambuco sob o título "Um caso de blastomicose, produzido por uma espécie nova, encontrada em Recife". O paciente do sexo masculino (JB.) de 52 anos exercia atividades extrativistas nos seringais da Amazônia e apresentava havia cerca de 19 anos nódulos coalescentes, nas regiões lombossacral e glútea. Os exames direto e anatomopatológico evidenciaram corpúsculos parasitários, similares ao Paracoccidioides brasiliensis, sendo encaminhados ao Instituto Oswaldo Cruz, e internado o paciente no Hospital Carlos Chagas, no Rio de Janeiro (RJ), para novos exames.2
Após essa original descrição de Jorge Lobo1 outros casos foram registrados. Os 34 primeiros, por ordem de aparecimento: Amadeu Fialho (1938),3 em homem procedente da Amazônia, com nódulos auriculares, evoluindo há 12 anos; Rocha, Drolhe & Rutowitsch (1942);4 Fonseca Filho (1943);5,6 Livino Pinheiro (1948);7 Cerruti & Zamith (1949);8 Azevedo (1949),9 dois casos; Nery-Guimarães & Macedo (1950);10 Carneiro (1952);10 Trejos e Romero (1953, Costa Rica),11 primeiro caso fora do Brasil; Leite (1954),12 três casos; Lacaz, Sterman, Monteiro & Pinto (1955);13 Herrera (1955),14 primeiro caso do Panamá; Silva & Azevedo (1956);15 Azulay, Miranda, Azulay (1957);16 Campo-Aasen (1958),17 dois casos, os primeiros da Venezuela; Pelayo Correa (1958);18 Francisco Fialho (1958),19 dois casos; Fontan (1960),20 primeiro caso da Guiana Francesa; Teixeira (1961),21 dois casos; Moraes (1962),22 seis casos em Manaus (AM); Moraes & Oliveira (1962),23 dois casos no Amazonas, totalizando nove casos no estado. Outros registros serão abordados na epidemiologia.
Marco na história natural da doença é o registro em não humanos, pela primeira vez, em 1971, na costa da Flórida, por Migaki et al.,24 em golfinhos (Tursiops truncatus, Montagu, 1821) com lesões nódulo-ulceradas.
ETIOLOGIA
Denomina-se atualmente Lacazia loboi25 o agente etiológico da lacaziose. O parasito recebeu vários nomes: Glenosporella loboi,5,6 Blastomyces brasiliensis,26,27 Glenosporopsis amazonica,28 Blastomyces loboi,26,27 Loboa loboi,29 Paracoccidioides loboi (Fonseca Filho & Arêa Leão, 1940)30-32 e Lobomyces loboi.33,34
Em 1999 Taborda, Taborda & McGinnis25 propuseram colocar o fungoemnovo gênero, Lacazia, criando a espécie Lacazia loboi, adotada neste trabalho.
Os estudos de biologia molecular procedidos por Herr et al.,35 com a análise filogenética de Lacazia loboi utilizando a amplificação da subunidade 18S do DNA ribossomal (SSU rDNA) e 600 p.b. do gene da quitina sintetase-2 (CHS-2) do DNA genômico das células leveduriformes , colocam esse agente entre os patógenos fúngicos dimórficos sistêmicos, na ordem Onygenales, em que estão Blastomyces dermatitidis, Chrysosporium parvum e Histoplasma capsulatum tanto a variável capsulatum como a duboisii. Os autores ressaltam que a nova espécie L. loboi e o fungo P. brasiliensis apresentam, entre suas características individuais, algumas comuns.
À microscopia L. loboi é globóide, com espessas paredes de duplo contorno, refringentes, medindo 5 a 6 x 12 a 14µm e reproduzindo por gemulação simples. São freqüentes aspectos em rosário ou catenulados, em cadeias ramificadas ou não, de três, cinco, oito ou mais células, e formas em halteres, unidas por túbulo conector. Abundância de fungos nos exames a fresco e nas preparações histológicas. L.loboi pode ser realçado pelos métodos do ácido periódico de Schiff (PAS) e prata-metenamina (Grocott-Gomori).
Taborda et al.36 com a técnica de Fontana- Masson identificaram melanina constitutiva na parede de L.loboi, não observando o pigmento em P. brasiliensis e ascomicetos filogeneticamente relacionados da família Onygenaceae.
Estudos por microscopia eletrônica foram efetuados por Furtado et al.,37 Abreu et al.,38 Woodard,39 em golfinho T. truncatus, Grimaud et al.,26 Bhawan et al.,40 Sesso e Baruzzi,41 Sesso et al.,42 Brito et al.,43 Diniz et al.44 Análises ultra-estruturais revelaram membrana celular espessa, trilaminar e parasitos não seccionados, com superfície serreada.38 Sesso & Baruzzi,41,42 observaram macrófagos repletos de parasitos em cujo citoplasma havia mitocôndrias, ribossomas, retículo endoplasmático granular e vacúolos. Citados "formas ïnvolutivas" vazias, parasitos fagocitados com parede espessada e projeções lameliformes radiadas, e fragmentos da cápsula parasitária em vacúolos dos macrófagos.
L. loboi é patógeno não cultivado até o momento. Tem sido inoculado material em diferentes animais, membrana cório-alantóide de ovos embrionados de galinha e no próprio homem.
A inoculação em camundongos via cutânea, peritoneal, nasal e testicular e em outros animais, efetuada por Campo-Assen,17 foi negativa.
Inoculação em voluntário humano por Borelli45 causou lesão nodular após quatro anos. Nery- Guimarães46 obteve nódulo em testículo de hamster. Azulay et al.47-50 praticaram inóculo no homem e em animais de laboratório, sem êxito.
Leite,51 em monografia, relata auto-inoculação via intradérmica, por patologista, para estudo clínicoevolutivo da doença e obtenção de material para culturas e experimentos em animais. Após 19 meses surgiu lesão papulonodular que, acompanhada durante 22 anos, apresentou involução, atribuída ao uso prolongado de cloridrato de prazosina.
Sampaio e Dias52 inocularam na bolsa jugal de 22 hamsters (M. auratus), produzindo nódulos com resposta histiociticogigantocitária e numerosos fungos, também em tatu (E. sexcinctus),53 em quelônios, 54 e tentativas de cultura do patógeno,55 sem sucesso. Experimentações em animais de laboratório foram também efetuadas por Opromolla et al.56,57 e Madeira et al.58
EPIDEMIOLOGIA
A lacaziose tem distribuição geográfica quase exclusiva na zona intertropical, com exceções dos casos de Symmers,59 Burns et al.,60 e Elsayed et al.61 Na Amazônia brasileira e em países limítrofes há características geidrográficas e climatológicas favorecedoras da micose, que Borelli62 denominou reservária, representadas por floresta tropical, clima equatorial quente, ú mido, temperatura entre 19°C e 34°C média anual de 24°C , opulência hidrográfica e pluviosidade entre 1.000 e 2.500mm/ano.
A doença atinge qualquer grupo populacional humano, com prevalência no gênero masculino. As mulheres são pouco atingidas talvez por desenvolver atividades domiciliares e sofrer menos exposição a fatores de risco. A exceção é observada na tribo Caiabi, em que o gênero feminino representa 32%.26,27,63-66 A faixa etária mais atingida é a de 20 a 40 anos de idade, apesar de o diagnóstico da doença ter sido estabelecido muitas vezes em pacientes acima de 50 anos. Há relatos de ocorrência em indígena caiabi de cinco anos de idade, por Machado67 e Niemel,68 e em paciente com 83 anos, por Brun.69 Cerca de 90% dos casos incidem em pessoas com atividades na floresta (seringueiros, agricultores, garimpeiros, caçadores, mateiros).
Não há como estabelecer o número exato de portadores da enfermidade, que não é de notificação compulsória. Existe a possibilidade de os doentes procurarem diferentes serviços médicos, contribuindo para dados estatísticos incorretos, posto que computados mais de uma vez.
Além dos referidos, optamos por citar os registros da doença conforme constam em publicações no Brasil e no exterior. Almeida & Lacaz;30-32 Silva;70 Betancourt Osório & Correa Galindo;71 Reyes et al.; 72 Pelayo Correa;18 Silva;73 Convit & Escuder;74 Silva et al.;75 Silverie et al.;76 Michalany & Lagonegro;77 Destombes & Ravisse;78 Wiersema & Niemel;79 Battistini et al.;80 Silva;81 Barbosa & Doles;82 Robledo Villegas;83 Peña;84 Leite;85 Londoño;86 Pradinaud et al.;87,88 Dias et al.;89 Loureiro et al.;90 Rivas;91 Dujeu et al.;92 Moriya et al.;93 Vargas Montiel;94 Pecher;95 Bhawan et al.;40 Roche et al.;96 Jaramillo et al.;97 Azulay et al.;98 Zavala-Velásquez & Perez99 (México, caso ú nico); Tapia et al.;100 Talhari et al.;101 Talhari et al.;102 Rose & Hay;103 Recacoechea & Vargas;104 Mogollon;105 Symmers;59 Pradinaud;106 Talhari et al.;107 Avila Mayor et al.;108 Arrese Estrada et al.;109 Rodríguez Toro;110 Fuchs et al.;111 Cáceres & Rodríguez Toro;112 Rodríguez Toro;113 Nalovic & Pradinaud;114 Opromolla et al.;115 Burns et al.;60 Elsayed et al.61 (o primeiro caso no Canadá, em mulher, 2004).
Na história da lacaziose são relevantes as pesquisas na tribo Caiabi, por Souza;26,64,65 Pereira Filho;26,65 Nery-Guimarães;26 Machado;67 Baruzzi et al.26,63-66
"Em 1966 Machado et al. 67 relataram 12 casos entre os Caiabis ressaltando o fato de existirem à é poca, apenas 34 casos registrados. Baruzzi et al. 63 assinalaram 38 casos, sendo 29 brasileiros. Vinte e dois novos casos na tribo Caiabi foram apresentados por Baruzzi et al. ,65 elevando para 50 doentes, sendo 34 homens (68%) e 16 mulheres (32%)". Os indígenas foram transferidos para o Parque Indígena do Xingu (PIX) entre 1950 e 1970, e nenhum apresentou a micose na nova localidade.26,63-66
Destaca-se o caso de Symmers,59 único registro descrito na Europa até o momento, pois houve possível inoculação do parasito em humano. A micose manifestou-se por nódulos no dorso da mão, associados a linfonodopatia epitroclear, três meses após traumatismo com animal portando lesões nódulo-ulceradas, capturado na baía de Biscaia. O histopatológico das lesões do paciente e do golfinho demonstrou parasitos com morfologia idêntica aos da lacaziose.
Quanto à casuística há um número crescente de casos nas publicações.
Em 1962 Moraes & Oliveira23 mostravam casuística mundial de 31 casos; Lobo,116 34 casos; Azulay et al.,48-50 75 casos até 1968, com 46 no Brasil; Silva,117 98 casos de J. Lobo, dos quais 77 eram do Brasil. Estatística de 125 casos, sendo 78 brasileiros, foi relatada por Nazaré.118 De acordo com Pradinaud,68 até maio de 1976 havia 163 casos. Rodriguez Toro110 relata 25 doentes na Colômbia, 135 no Brasil e o total de 235 na América Latina. Esse autor assinala na Colômbia prevalência de 8,5% na tribo amorua, e o total de 304 casos, sendo 175 brasileiros. Silva & Neves119 citam 252 no Brasil e 385 casos no mundo. Segundo Pradinaud & Talhari120 em 1996 a estatística mundial era de 418 doentes, mantida inalterada até 1998, com 255 assinalados no Brasil.121
Novos registros por Opromolla et al.,115 que em 1999 estudaram 40 casos no Estado do Acre (BR), totalizavam 295 doentes no Brasil. De acordo com Lacaz et al.,27 a casuística da doença até 2000 foi de 465 casos, com 295 casos brasileiros (61 em meio aos Caiabi).
No Serviço de Dermatologia da UFPA (SDUFPA), de 1955 a 2005, foram registrados 109 pacientes de lacaziose, comprovados por histopatológico e/ou micológico, e 23 casos novos de 1996 a 2005. A atualização estatística no Brasil e no mundo está no quadro 1.
Lacaziose em não humanos
A doença foi identificada em golfinhos com lesões nodulares, úlcero-crostosas nas regiões cefálica e dorsocaudal, e é uma das excepcionais infecções fúngicas de acometimento humano e não humano. Nos oito relatos da doença em cetáceos há sete deles em T.truncatus e apenas uma vez na espécie S. guianensis, por Van Beneden, em 1862.
Migaki et al.,24 em 1971, descreveram pela primeira vez a doença em golfinho T. truncatus, procedente de Sarasota, costa da Florida. Caldwell et al.122 discutem alguns aspectos desse caso. Woodard39 observou lesões em golfinho apreendido em Marineland (EUA) e analisou o material por microscopia ó ptica e eletrônica. Identificados nódulos por De Vries & Laarman123 em S. guianensis capturado no estuário do rio Suriname. Lesões em T. truncatus na ilha de San Marco (Flórida), em 1974, relatadas por Poelma et al.124 Em Vero Beach (Flórida) Caldwell et al.,122 em 1975, observaram T. truncatus com lesões dorsais. Symmers,59 em 1983, relatou o primeiro golfinho T. truncatus encontrado na Europa. Em Fort Lauderdale (Flórida), Bossart,125 em 1984, observou T. truncatus com lesões nódulo-ulceradas. Simões Lopes et al.126 registraram, em 1993, a enfermidade em T. truncatus pela primeira vez no Brasil, na costa de Santa Catarina.
Em 1999 Miller & Owens,127 ao estudarem doença sistêmica em primatas Aotus sp, no Peru, observaram infecção por fungo leveduriforme ainda não classificado, com período de incubação de meses a anos, sintomatologia inespecífica, evolução lenta, cujas culturas foram negativas. O estudo de órgãos do primata por microscopia óptica e eletrônica revelou células leveduriformes em macrófagos, livres no tecido e grande similaridade com L. loboi. Esse achado inusitado é mais um desafio ao estudo da lacaziose.
PATOGENIA
Diante de doença cujo agente etiológico não foi cultivado em laboratório, e não tendo experimentos em animais mostrado resultados consistentes, compreende-se que sua patogenia ainda é obscura. É provável que o microorganismo se mantenha viável em vegetais, solo e água, tendo em vista a infecção no homem e em outros mamíferos.
Admite-se que a implantação traumática do fungo na pele seja a via pela qual o homem adquire a infecção.
O período de incubação não está bem-estabelecido, havendo evidências clínicas e laboratoriais de que ocorra entre um e dois anos.26,45,47-51,64-66 Há relatos de três meses, caso de Symmers,59 e outro de sete anos, no paciente de Burns.60 Este último registro sugere ser a água um hábitat do fungo.
"Especula-se a possibilidade de lacaziose infecção sem manifestações clinicas, similarmente ao que ocorre com a forma de paracoccidioidomicose infecção, mas com o diferencial de que nesta última há o recurso da diagnose pela reação intradérmica de paracoccidioidina positiva".
Mecanismos propostos para lesões disseminadas: contigüidade, via linfática (quando se trata de comprometimento de membros inferiores) e autoinoculação. 110,112,113,128
Ausência de transmissão inter-humana mesmo em situações de longo convívio 63,64,115 e em membros da mesma família.89
ASPECTOS HISTOPATOLÓGICOS
Os cortes histológicos de biópsias de lacaziose são corados de rotina pela hematoxilina-eosina (HE), eficaz para o diagnóstico. Técnicas histoquímicas são empregadas para demonstração de peculiaridades do parasito, composição do granuloma, do conjuntivo e outras estruturas teciduais, utilizando ácido periódico de Schiff (PAS), Gridley para fungos, prata-metenamina (PM), tricrômico de Gomori.
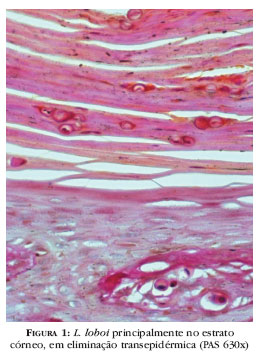
A epiderme apresenta aspecto normal, atrófico, hiperplásico ou ulcerado, tanto na mesma como em diferentes lesões. Hiperplasia irregular, às vezes pseudo- epiteliomatosa, é comum nas lesões vegetante-verrucosas e em bordas de úlceras. No estrato córneo observa-se, por mecanismo de eliminação transepidérmica, presença de L. loboi entre as escamas e escamocrostas traduzida por pontos negros na pele que recobre as lesões do tipo exúlcero-crostoso, como as de aspecto liso (Figura 1). Esse achado histopatológico tem sido registrado na cromoblastomicose129-131 e em lesões hiperceratósicas/verrucosas na lacaziose.121,132-134
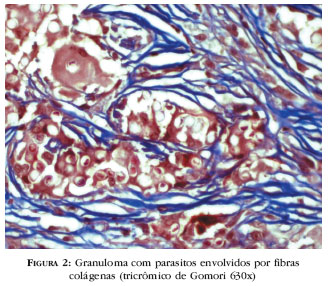
As alterações dérmicas são patognomônicas da doença, sem dificuldade para o diagnóstico.3,12,133,135 Uma faixa clara (Grenz), de espessura variável separa a epiderme do infiltrado; outras vezes, a reação produtiva contata a epiderme. O infiltrado inflamatório é granulomatoso, nodular e difuso, constituído por macrófagos e numerosas células multinucleadas, tipo Langhans e de corpo estranho, repletas de parasitos. 133 A reação exsudativa, não freqüente, é representada por agregados pontuais de linfócitos e plasmócitos entre as células fagocitárias ou em posição perivascular. Neutrófilos, quando presentes, ocupam a derme superior nas lesões ulceradas. Necrose quase sempre ausente nas preparações. Opromolla et al.,134 utilizando a proteína S-100, demonstraram integridade das estruturas nervosas nos granulomas.134 O estroma é fibroplásico, mais bem evidenciado pelo tricrômico de Gomori (Figura 2).
A micromorfologia do parasito está descrita em etiologia.
A reprodução é por gemulação simples e também por brotamento em dois ou mais pontos distintos da cápsula (Figuras 3A e 3B).
Nota-se importante número de parasitos anucleados, com aspecto de "cápsulas" vazias em macrófagos, gigantócitos e no tecido. Há relato de pseudohifas entre os aspectos morfológicos não habituais.89 Agregados nodulares de macrófagos com abundante citoplasma espumoso, similares às células de Gaucher, isolados ou contíguos ao infiltrado granulomatoso, são registrados em diversos estudos.3,113,135,136
Estudos de macrófagos utilizando Sudan III identificaram lipídios nas células do infiltrado inflamatório 3 e nos fungos.72 O Sudan negro confirmou presença de lipídios nos parasitos, mas não nos granulomas. 134
Na lacaziose e em outras doenças granulomatosas, corpos asteróides são encontrados em células multinucleadas tipo Langhans e de corpo estranho. 77,78,137-139 (Figura 4)
Sampaio et al.140 utilizaram azul tripan contrastado pelo Van Gieson.
A associação do diacetato de fluoresceína ao brometo de etídeo (DF-BE) constitui, segundo os autores, o melhor método para determinar a viabilidade do L. loboi (de 20% a 50%), considerando inviáveis parasitos com aspecto de cápsulas vazias.141 Análise de biópsias cutâneas e de suspensões fúngicas coradas pela PM é conclusiva quanto à viabilidade do fungo e precisão da coloração do patógeno em suspensão, pelo método DF-BE.142
A maioria das biópsias não costuma incluir o tecido subcutâneo exceto nos casos em que a remoção da lesão tem fins terapêuticos e é necessária cautela para conclusão quanto ao grau de comprometimento daquele tecido. Quando a hipoderme está representada, o infiltrado ocupa níveis variáveis do subcutâneo.22,23,134 Moraes22 e Opromolla134 observaram casos de lesões no pavilhão auricular sem comprometimento da cartilagem. Caso insólito foi registrado por Leite,12 em que o infiltrado se estendeu da derme até o músculo subjacente, dissociando as fibras musculares.
ASPECTOS IMUNO-HISTOQUÍMICOS
São poucos os trabalhos na literatura que caracterizam o padrão de resposta imune tecidual nas lesões e sua relação com a resposta citocínica.143 A análise imuno-histoquímica das lesões cutâneas em 25 casos de lacaziose do SD-UFPA revelou positividade para CD68, um marcador de atividade de macrófagos, bem como intensa marcação para TGF-β, citocina com forte efeito supressor de macrófagos, inibindo a expressão do óxido nítrico e IFN-γ, além de induzir fibrogênese e apoptose em algumas linhagens celulares. O padrão de imunomarcação para macrófagos mostrou positividade coincidente com o infiltrado inflamatório granulomatoso ao longo de toda a lesão. Não houve heterogeneidade quanto à intensidade de imunomarcação na extensão da lesão e entre os diversos espécimes examinados. A marcação para TGF-β foi observada em áreas focais do infiltrado inflamatório, não mostrando igualmente heterogeneidade no padrão geral de intensidade de imunomarcação na lesão entre os casos estudados.
Não há estudos que correlacionem a resposta imune da lacaziose a lócus HLA específico, o que reforça a importância da ecologia do fungo e sua relação com a resposta imune in situ nas lesões do hospedeiro. 144 Na lacaziose, Pecher145 sugere haver imunodeficiência celular à infecção, apesar da ocorrência de lesões predominantemente constituídas por macrófagos e células gigantes que fagocitam grande quantidade de fungos. Não há relatos de agravamento ou disseminação de lesões em casos associados à imunodeficiência celular grave nem evolução diferenciada das lesões,146 como ficou demonstrado em paciente HIV/Aids. Apesar desse aspecto histológico que em parte demonstra efetividade de resposta imune mediada por macrófagos, a análise da intensidade de imunomarcação para CD68 mostrou reatividade menor que a esperada em virtude da grande quantidade de células de linhagem macrofágica que compõem a lesão, o que pode traduzir menor atividade metabólica nessas células, uma vez que o CD68 é proteína transmembrana de 110kDa localizada principalmente nos lisossomas de macrófagos. Associada a esse quadro de fraca imunomarcação de macrófagos, há intensa reatividade para TGF-β nas lesões. A atividade imunossupressora do TGF-β tem sido descrita em diversos modelos de doenças infecciosas.147 Sua capacidade de induzir apoptose de células imunes, bem como de inibir a resposta celular imune, tem associado o TGF-β como marcador determinante de susceptibilidade a infecções crônicas e agudas, como ocorre na hanseníase,148 em hepatites crônicas e febre amarela.149,150 Sua intensa imunomarcação observada na lacaziose pode em parte explicar a fraca reatividade para o CD68, pois o TGF-β tem a capacidade de inibir fortemente a atividade de macrófagos, diminuindo sua eficácia microbicida. A ocorrência de extensas áreas colágenas na micose é coerente com a capacidade que tem o TGF-β de induzir fibrose em determinadas doenças infecciosas crônicas, como a hepatite C. A riqueza de faixas colágenas associada à fraca imunomarcação para CD68 em macrófagos tem apontado para efeito concomitante do TGF-β, inibindo macrófagos e induzindo fibrose, e que pode ser responsável pelo aspecto queloidiano que freqüentemente adquirem as lesões.
Finalmente, a ausência de granulomas bem-formados suporta a hipótese de que o TGF-β tem papel fundamental na etiopatogênese da infecção pelo L. loboi, seja inibindo a resposta imune celular, principalmente a mediada por macrófagos, seja induzindo fibrose.
ASPECTOS CLÍNICOS
A expressão clínica da enfermidade não é monomorfa, sendo mais comum o polimorfismo lesional, especialmente em casos crônicos: máculas discrômicas, pápulas, nódulos, gomas, placas nodulares,verruciformes, cicatrizes e úlceras, com predominância de nódulos de aspecto queloidiano. Machado151 ressaltou esse polimorfismo nos índios caiabis, detectando aspectos desde maculares até verruciformes, propondo dois grupos polares: hiperérgico (máculas e gomas) e hipoérgico (queloidiforme).
Com base na morfologia lesional foram propostas classificações clínicas: infiltrativa, queloidiforme, gomosa, ulcerada e verruciforme por Silva,117 Silva & Brito,152 e Brito.153-155 Segundo Baruzzi et al.65 e Lacaz et al.,26 para facilitar a abordagem cirúrgica, lesões foram classificadas quanto à distribuição:1) formas isoladas ou localizadas e 2) formas disseminadas.
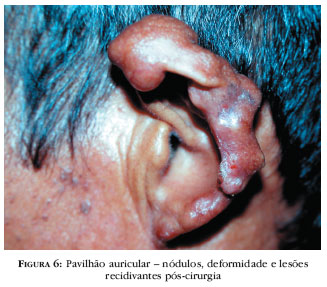
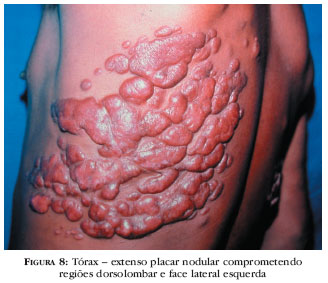
As lesões comprometem qualquer sítio anatômico, não sendo visualizadas nas mucosas. Uma de suas características é serem imperceptíveis no início do processo, dificultando o diagnóstico e, após meses/anos, evoluírem para pápulas, placas, nódulos, verruciformes, e lesões satélites, por contigüidade. Nódulos e placas são recobertos por pele íntegra, de cor eritemato-pardacenta, vinhosa, lisa, brilhante, com telangiectasias (Figuras 5-8).
Os membros inferiores são a localização preferencial. A casuística do SD-UFPA não é diferente, com acometimento dessas extremidades em 43 (39,5%) casos. Nessas regiões há freqüentes lesões polimórficas e algumas exulceradas com escamocrostas. A maior incidência nas extremidades justifica-se pelo fato de ficarem mais expostas às injúrias. Lesões verrucosas plantares são incomuns.106 O segundo local mais comprometido compõe-se dos pavilhões auriculares, com infiltração difusa, nódulos isolados e coalescentes, telangiectasias, podendo ulcerar e causar deformidade da região, representando 26 (23,8%) dos pacientes do SD-UFPA.
Leite156 relata doentes com 28 anos de evolução e lesões restritas a esse sítio anatômico, sem atingir a face. Outros pacientes, com pouco tempo de doença, desenvolvem lesões satélites ou a distância. Especulase sobre o hábito de as pessoas transportarem cargas nos ombros, fator traumático favorecedor da inoculação do fungo.22
Nos índios do PIX foram observados todos os tipos lesionais, mais freqüentes nas pernas, coxas e regiões glúteas. Nas áreas cicatriciais foram identificados parasitos à microscopia, apesar do aspecto morfológico involutivo.26
O estado geral do paciente é bom, e os sintomas locais são de distensão, prurido e sensação dolorosa à palpação.
Não há registro de invasão da mucosa, mesmo quando a lesão é no lábio,90 nem foi detectada regressão espontânea de lesões maculares nos pacientes do SD-UFPA, ao contrário do que referiu Machado157 em seus doentes. Ausência de relato de lesão no couro cabeludo é detalhe anotado por Pradinaud.106 Comprometimento de órgão interno é citado por Rodriguez Toro113 e Pradinaud121 como o primeiro caso da Costa Rica, em homem com lesões na perna esquerda há mais de 47 anos, associadas a linfangite e tumoração testícular. A histopatologia da peça cirúrgica da orquidectomia mostrou granuloma com abundantes L. loboi, evidenciando possibilidade da via hematogênica na disseminação da doença.
Comprometimento de linfonodos parece não ser comum, ou não tem sido bem investigado, considerando os poucos relatos na literatura: Brito et al.,43 Silverie et al.,76 Baruzzi et al.,63 Destombes et al.,78 Dias et al.,89 Wiersema,135 Leite et al.,156 Azulay98 e Opromolla et al.158
DIAGNOSE DIFERENCIAL
As características clínicas da lacaziose permitem o diagnóstico da doença, mesmo ao não especialista. Há entidades clínicas que se expressam com igual morfologia daí a diagnose diferencial com: hanseníase (todas as formas); leishmaniose tegumentar, em especial a forma cutânea difusa anérgica; paracoccidioidomicose; cromoblastomicose; feohifomicose; esporotricose; tuberculose cutânea; pioderma blastomicose-like; micetomas; histoplasmose; sarcoma de Kaposi; sarcoidose; histiocitoses não- Langerhans; melanoma; câncer de pele não-melanoma; dermatofibrossarcoma; neoplasias benignas de expressão nodular e metástases cutâneas.
COMPLICAÇÕES
Ulceração está quase sempre presente, como conseqüência de traumatismo, associada à infecção bacteriana.
Em dois caiabis com lacaziose há cerca de 40 anos, Baruzzi et al.159 diagnosticaram carcinoma espinocelular (CEC) sobre lesão preexistente. Um deles após a cirurgia e recidiva foi a óbito com metástase pulmonar. O outro, com CEC na perna esquerda sofreu amputação após recidiva do tumor. Rodrigues Toro110 registrou indígena colombiano com CEC após dois anos de evolução da micose, sem recidiva póscirúrgica.
CO-INFECÇÕES
Na evolução da lacaziose podem surgir coinfecções registradas na literatura médica, em que se incluem: hanseníase tuberculóide,160 cromoblastomicose, 26 paracoccidioidomicose,161 dermatofitose,110 tinea imbricata162 tuberculose ganglionar.26,27 Recentemente Xavier et al.146 relataram o primeiro caso na literatura de co-infecção HIV-lacaziose em paciente com lesões disseminadas, sem outros sinais de infecções oportunísticas classicamente associadas à Aids.
DIAGNÓSTICO LABORATORIAL
É realizado através dos exames micológico direto e histopatológico.
A pesquisa direta é feita em material obtido de lesões cutâneas por escarificação, raspagem, curetagem ou uso da fita gomada.163 L. loboi é observado em grande número com a micromorfologia descrita em etiologia (Figura 9).
TERAPÊUTICA
A cirurgia representa, até o momento, a melhor conduta terapêutica, principalmente em lesões isoladas, circunscritas, na fase inicial.26,27,106,121,164,165 O emprego da criocirurgia é também relatado com bons resultados. 112,113
Drogas utilizadas com sucesso em micoses profundas mostraram resultados insatisfatórios na lacaziose68,120,121: sulfadimetoxina,72 anfotericina B,86 sulfametoxazol-trimetoprim,121 5-fluorocitosina.120 A clofazimina foi usada pela primeira vez por Silva166 em três doentes, com melhora das lesões. Baruzzi et al.26,64-66 empregaram clofazimina em 12 índios caiabis, com recidiva. O cetoconazol foi pouco eficaz em tentativas terapêuticas.26,27,104,167,168 Associação de clofazimina e itraconazol durante um ano promoveu remissão clínica e histopatológica, segundo Fisher et al.169
Bustamante170 utilizou posaconazol durante 75 semanas em lacaziose com redução da lesão.
Recidivas são freqüentes, mesmo com tratamento cirúrgico, possivelmente por ressecção insuficiente. Moraes22,23 refere recidiva em lesões auriculares pela extensão do infiltrado granulomatoso até a cartilagem, embora sem a invadir, sugerindo a retirada de todo ou de parte do pavilhão atingido, a fim de impedir novo processo patológico.
A dificuldade terapêutica da micose reside nas formas disseminadas, ainda sem fármaco eficaz que, além da eficiência, apresente mínimos efeitos colaterais e baixo custo, salientando-se este último aspecto, já que a enfermidade prevalece nas camadas pobres da população.
Aprovado pelo Conselho editorial para publicação em 20.07.2007
Suporte financeiro: Nenhum / Financial funding: None
- 1. Lobo J. Um caso de blastomicose, produzido por uma espécie nova, encontrada em Recife. Rev Med Pernamb. 1931;1:763-75.
- 2. Carneiro LS. Contribuição ao estudo microbiológico do agente etiológico da doença de Jorge Lobo [tese]. Recife: Universidade Federal de Pernambuco; 1952.
- 3. Fialho A. Blastomicose do tipo "Jorge Lobo". Hospital (Rio J). 1938;14:903-18.
- 4. Rocha G, Drolhe E, Rutowitsch M. Doença de Jorge Lobo. An Bras Dermatol Sifilogr. 1942;17:54-5.
- 5. Fonseca Filho O, Area Leão AE. Contribuição para o conhecimento das granulomatoses blastomycoides: o agente etiológico da doença de Jorge Lobo. Rev Med Cirurg Brasil. 1940;48:147-58.
- 6. Fonseca Filho O. Parasitologia médica. Rio de Janeiro: Guanabara Koogan; 1943. p.706.
- 7. Pinheiro L. Considerações sobre um caso de blastomicíase tipo Jorge Lobo. Rev Paul Med. 1948;32:150.
- 8. Cerruti H, Zamith VA. Um caso de blastomicose, tipo Jorge Lobo. Rev Paul Med. 1949;34:210.
- 9. Azevedo PC. Algumas considerações sobre a micose de Jorge Lobo [tese]. Belém: Universidade Federal do Pará; 1949.
- 10. Nery-Guimarães F, Macedo DG. Contribuição ao estudo das blastomicoses na Amazônia (blastomicose queloidiana e blastomicose sul-americana). Hospital. 1950;38:223-53.
- 11. Trejos A, Romero A. Contribución al estudio de las blastomicosis en Costa Rica. Rev Biol Trop. 1953;1:63- 81.
- 12. Leite JM. Doença de Jorge Lobo. Contribuição ao seu estudo anátomo-patológico. [tese]. Belém: Universidade Federal do Pará; 1954.
- 13. Lacaz CS, Sterman L, Monteiro EVL, Pinto DO. Blastomicose que1oideana: comentários sobre novo caso. Rev Hosp Clin Fac Med Sao Paulo. 1955;10:254-64.
- 14. Herrera JM. Paracoccidioidosis brasiliense: estudio del primer caso observado en Panamá de blastomicosis sudamericana en su forma cutánea queloideana o enfermedad de Lobo, y propuesta de una variante técnica para la impregnación argéntica del parásito. ArchMed Panamenos. 1955;4:209-19.
- 15. Silva D, Azevedo P. Sobre um novo caso de micose de Jorge Lobo. Med Cir Farm. 1956;243:328-36.
- 16. Azulay RD, Miranda J, Azulay JD. Doença de Jorge Lobo: 15ş caso da literatura. Hospital (Rio J). 1957;51:685-91.
- 17. Campo-Aasen I. Blastomicosis queloidiana ó enferme dad de Jorge Lobo en Venezuela. Dermatol Venezol. 1958;2:215-40.
- 18. Correa P. Blastomicosis queloidiana. Rev Latinoam Anat Patol. 1958;2:139-43.
- 19. Fialho F. Dois casos de micose de Jorge Lobo. Rev Bras Cir. 1958;35:567-71
- 20. Fontan R. Premier cas de Maladie de Lobo (blastomycose chéloidienne) observé en Guyane Française. Arch Inst Pasteur Guyane (Fr). 1960;461:1-12.
- 21. Teixeira GA. Doença de Jorge Lobo. Aspectos micros cópicos. Hospital (Rio J). 1962;62 813-27.
- 22. Moraes MAP. Blastomicose tipo Jorge Lobo. Seis casos novos encontrados no estado do Amazonas, Brasil. Rev Inst Med Trop Sao Paulo. 1962;4:187-97.
- 23. Moraes MAP, Oliveira WR. Novos casos da micose de Jorge Lobo encontrados em Manaus, Amazonas (Brasil). Rev Inst Med Trop Sao Paulo. 1962;4:403-6.
- 24. Migaki G, Valério MG, Irvine B, Gardner FM. Lobo's disease in an Atlantic bottle-nosed dolphin. J Amer Vet Med Assoc. 1971;159:578-82.
- 25. Taborda PR, Taborda VA, McGinnis MR. Lacazia loboi gen.nov., comb. nov., the etiologic agent of lobomycosis. J Clin Microbiol. 1999;37:2031-3.
- 26. Lacaz CS, Baruzzi RG, Rosa MCB. Doença de Jorge Lobo. São Paulo: USP-IPSIS; 1986.
- 27. Lacaz CS, Porto E, Martins JEC, Heins-Vaccari EM, Melo NT. Tratado de Micologia Médica Lacaz. 9 ed. São Paulo: Savier; 2002. p.462-78.
- 28. Fonseca OJM, Lacaz CS. Estudo de culturas isoladas de blastomicose queloidiforme (doença de Jorge Lobo). Denominação ao seu agente etiológico. Rev Inst Med Trop Sao Paulo. 1971;13:225-51.
- 29. Ciferri R, Carneiro LS, Campos S, Azevedo PC. Advance in the knowledge of the fungus of Jorge Lobo's disease. J Trop Med Hyg. 1956;59:214-5.
- 30. Almeida FP, Lacaz CS. Blastomicose "tipo Jorge Lobo". An Fac Med Univ Sao Paulo. 1948;24:5-37.
- 31. Almeida FP, Lacaz CS. Blastomicose "tipo Jorge Lobo". Rev Paul Med. 1948;32:161-2.
- 32. Almeida FP. Considerações sobre a blastomicose sulamericana em sua forma queloideana. Rev Inst Adolfo Lutz. 1950;10:31-4.
- 33. Borelli D. Aspergillus, sorpresas em micopatologia. Bol Venez Lab Clinicos. 1958;3:47-8.
- 34. Borelli D. Lobomicosis: nomenclatura de su agente (revisión critica). Med Cutanea. 1968;3:151-6.
- 35. Herr RA, Tarcha EJ, Taborda PR, Taylor JW, Ajello L, Mendoza L. Phylogenetic analysis of Lacazia loboi places this previously uncharacterized pathogen within the dimorphic Onygenales. J Clin Microbiol. 2001;39:309-14.
- 36. Taborda VBA, Taborda PRO, McGinnis MR. Constitutive melanin in the cell wall of the etiologic agent of Lobo's disease. Rev Inst Med Trop Sao Paulo. 1999;41:9-12.
- 37. Furtado JS, De Brito T, Freymuller E. Structure and reproduction of Paracoccidioides loboi. Mycologia. 1967;59:286-94.
- 38. Abreu WM, Miranda JL. Microscopia eletrônica scanning: agente da micose de Jorge Lobo. An Bras Dermatol. 1972;47:115-24.
- 39. Woodard JC. Electron microscopic study of lobomyco sis (Loboa loboi). Lab Invest. 1972;27:606-12
- 40. Bhawan J, Bain RW, Purtilo DT, Gomez N, Dewan C, Whelan CF, et al. Lobomycosis. An electronmicroscopic, histochemical and immunological study. J Cutan Pathol. 1976;3:5-16.
- 41. Sesso A, Baruzzi RG. Interaction between macrophage and parasite cells in lobomycosis. The thickened cell wall of Paracoccidioides loboi exhibits apertures to the extracellular milieu. J Submicrosc Cytol Pathol. 1988;20:537-48.
- 42. Sesso A, Azevedo RA, Baruzzi RG. Lanthanum nitrate labelling of the outer cell wall surface of phagocytized Paracoccidioides loboi in human lobomycosis. J Submicrosc Cytol Pathol. 1988;20:769-72.
- 43. Brito AC, Enokihara MMSS, Miranda MFR, Carneiro FA, Faria FP, Dalur ES. Jorge Lobo's disease agent: observations by transmission and scanning electron microscopes. Acta Microsc. 1999;8(Suppl C):S407-8.
- 44. Diniz JAP, Teixeira CEC, Soares MCP, Brito AC, Silva JP. Ultrastructural aspects of Lacazia loboi. Acta Microsc. 2001;12(Suppl C):S103-4.
- 45. Borelli D. Lobomicosis experimental. Derm Venez. 1962;3:72-82.
- 46. Nery-Guimarães F. Inoculações em hamsters da blasto micose sul-americana (doença de Lutz), da blastomicose queloideana (doença de Lobo) e da blastomicose dos índios do Tapajós-Xingu. Hospital (Rio J). 1964;66:581-93.
- 47. Azulay RD, Andrade LC, Carneiro JA. Micose de Jorge Lobo. Contribuição ao seu estudo experimental. Inoculações no homem e animais de laboratório e investigação imunológica. Hospital (Rio J). 1968;73:1165-72.
- 48. Azulay RD, Andrade LC, Silva D, Carneiro J. Reprodução experimental da blastomicose de Jorge Lobo. An Bras Dermatol. 1968;43:261-6.
- 49. Azulay RD, Carneiro JA, Andrade LMC de. Lobo's blastomycosis: new experiments on culture, immunology and inoculation. Dermatol Int. 1969;8:3-35.
- 50. Azulay RD, Carneiro JA, Andrade LC. Blastomicose de Jorge Lobo. Contribuição ao estudo da etiologia, inoculação experimental, imunologia e patologia da doença. An Bras Dermatol. 1970;45:47-66.
- 51. Leite MC. Doença de Jorge Lobo (estudo de uma autoinoculação). Monografia. Belém: UFPA; 1993. p.34.
- 52. Sampaio MM, Dias LB. Experimental infection of Jorge Lobo's disease in the cheek-pouch of the golden hamster (Mesocricetus auratus). Rev Inst Med Trop Sao Paulo. 1970;12:115-20.
- 53. Sampaio MM, Dias LB. The armadillo Euphractus sexcinctus as a suitable animal for experimental studies of Jorge Lobo's disease. Rev Inst Med Trop Sao Paulo. 1977;19:215-20.
- 54. Sampaio MM, Dias LB, Scaff L. Bizarre forms of the aetiologic agent in experimental Jorge Lobo's disease in tortoises. Rev Inst Med Trop Sao Paulo. 1971;13:191-3.
- 55. Sampaio MM. A note on the cultivation of the aetiolo gical agent of Jorge Lobo's disease in 199 T.C. medium containing phytohaemagglutinin. Preliminary report. Rev Inst Med trop Sao Paulo. 1974;16:121-2.
- 56. Opromolla DVA, Madeira S, Belone AFF, Vilani- Moreno FR. Jorge Lobo's disease: experimental inocu lation in Swiss mice. Rev Inst Med Trop Sao Paulo. 1999;41:359-64.
- 57. Opromolla DVA, Nogueira MES. Inoculation of Lacazia chek pouch. Rev Inst Med Trop Sao Paulo. 2000;42:119-23.
- 58. Madeira S, Opromolla DVA, Belone AFF. Inoculation of Balb/C mice with Lacazia loboi. Rev Inst Med Trop Sao Paulo. 2000;42:239-43
- 59. Symmers WSTC. A possible case of Lobo's disease acquired in Europe from a bottle-nosed dolphin (Tursiops truncatus). Bull Soc Pathol Exot Filiales. 1983;76:777-84.
- 60. Burns RA, Roy JS, Woods C, Padhye AA, Warnock DW. Report of the first human case of lobomycosis in the United States. J Clin Microbiol. 2000;38:1283-5.
- 61. Elsayed S, Kuhn SM, Barber D, Church DL, Adams S, Kasper R. Human case of lobomycosis. Emerg Infect Dis. 2004;10:715-8.
- 62. Borelli D. La reservarea de la lobomicosis. Comentarios a un trabajo del Dr. Carlos Peña sobre dos casos colombianos. Mycopathologia. 1969;37:145-9.
- 63. Baruzzi RG, D'Andretta JrC, Carvalhal S, Ramos OL, Pontes PL. Ocorrência de blastomicose queloideana entre índios Caiabí. Rev Inst Med Trop Sao Paulo. 1967;9:135-42.
- 64. Baruzzi RG, Castro RM, D'Andretta Jr C, Carvalhal S, Ramos OL, Pontes PL. Occurrence of Lobo's blastomycosis among "Caiabi" Brazilian indians. Int J Dermatol. 1973;12:95-8.
- 65. Baruzzi RG, Lacaz CS, Souza FAA. História natural da doença de Jorge Lobo. Ocorrência entre os índios Caiabí (Brasil Central). Rev Inst Med Trop Sao Paulo. 1979;21:302-38.
- 66. Baruzzi RG, Marcopito LF. Doença de Jorge Lobo. In: Veronesi R, Focaccia R, eds. Tratado de Infectologia. São Paulo: Atheneu; 1996. p.1116-9.
- 67. Machado PA, Silveira DF. Piraip, a falsa lepra dos Caiabis. Rev Bras Leprol. 1966;34:60.
- 68. Pradinaud R. Lobomycose, Maladie de Jorge Lobo. Encycl Med Chir (Paris) Maladies Infectieuses. 1977;8126 A 10:1-6.
- 69. Brun AM. Lobomycosis in three Venezuelan patients. Int J Dermatol. 1999;38:298-305.
- 70. Silva D. Sur un nouveau cas de la mycose de Jorge Lobo. Arch Belg Dermatol. 1957;13:26-35.
- 71. Betancourt Osorio J, Correa Galindo E. Blastomicosis queloidiana o enfermedad de Jorge Lobo. Arch Argent Dermatol. 1958;8:231-2.
- 72. Reyes O, Goihman M, Goldstein C. Blastomicosis que loidiana o enfermedad de Jorge Lobo. Comunicación previa sobre un caso observado. Derm Venez. 1960;2:245-55.
- 73. Silva D. Micose de Lobo. Rev Soc Bras Med Trop. 1972;6:86-9.
- 74. Convit J, Escuder R. Blastomicose queloidiana ó enfermedad de Jorge Lobo. Derm Venez. 1958;2:115-20.
- 75. Silva D, Ferreira JLS, Pinto MNS, Brito AC. Considerações preliminares sobre dois novos casos da micose de Jorge Lobo. Rev Fac Med Univ Ceará. 1963;3:19-21.
- 76. Silverie R, Ravisse P, Vilar JP, Moulins C. La blastomy cose chéloidienne ou maladie de Jorge Lobo en Guyane Française. Bull Soc Pathol Exot. 1963;56:29-35.
- 77. Michalany J, Lagonegro B. Corpos asteróides na blastomicose de Jorge Lobo. A propósito de um novo caso. Rev Inst Med Trop Sao Paulo. 1963;5:33-6.
- 78. Destombes P, Ravisse P. Étude histologique de 2 cas guyanais de blastomycose chéloidienne (maladie de J. Lobo). Bull Soc Pathol Exot. 1964;57:1018-24.
- 79. Wiersema JP, Niemel PLA. Lobo's disease in Surinam patients. Trop Geogr Med. 1965;17:89-111.
- 80. Battistini F, Gracia Jover S, Perfetti O. Dos casos de blastomicosis queloidiana o enfermedad de Jorge Lobo. Derm Venez. 1965;5:30-6.
- 81. Silva D. Oito casos novos da micose queloidiforme de Jorge Lobo. An Bras Dermatol Sifilogr. 1965;40:307- 26.
- 82. Barbosa W, Doles J. Blastomicose queloidiforme (doença de Jorge Lobo). Apresentação do 1.° caso encontrado no Estado de Goiás. Rev Goiana Med. 1965;11:11-20.
- 83. Robledo Villegas M. Enfermedad de Jorge Lobo (blastomicosis queloidiana). Presentación de un nuevo caso colombiano. Mycopathologia. 1965;25:373-80.
- 84. Peña CE. Blastomicosis queloide en Colombia. Presentación de dos casos. Mycopathologia. 1967;33:313-20.
- 85. Leite JM. Doença de Jorge Lobo. (Estudo clínico patológico, com apresentação de cinco casos). Atas do Simpósio sobre a Biota Amazônica. 1967;6:161-76.
- 86. Londoño F. Blastomicosis queloidiana. A propósito de un caso tratado con anfotericina B. Med Cutan Ibero Lat Am. 1968;2:521-4.
- 87. Pradinaud R, Grosshans E, Basset M. Un nouveau cas de maladie de Jorge Lobo en Guyane Française. Bull Soc Fr Dermatol Syphiligr. 1969;76:837-40.
- 88. Pradinaud R, Joly F, Basset M, Basse A, Grosshans E. Les chromomycoses et la maladie de Jorge Lobo en Guyane Française. Bull Soc Pathol Exot. 1969;62:1054- 63.
- 89. Dias LB, Sampaio MM, Silva D. Jorge Lobo's disease. Observations on its epidemiology and some unusual morphologica1 forms of the fungus. Rev Inst Med Trop Sao Paulo. 1970;12:8-15.
- 90. Loureiro AAP, Brito AC, Silva D. Micose de Jorge Lobo de localização insólita. An Bras Dermatol. 1971;46:1-6.
- 91. Rivas OR. Enfermedad de Jorge Lobo: primer caso diagnosticado en el Peru. Arch Peruanos Pat Clin. 1972;26:63-86.
- 92. Dujeu G, Carret L, Destombes P. Nouveau cas de mala die de Jorge Lobo (BIastomycose cheloidienne) en Guyane Française. Arch Inst Pasteur Guyane Fr. 1972;23:105-8.
- 93. Moriya T, Pereira LFG, Oliveira JAM, Ruffino Netto A. Blastomicose queloidiforme. Registro de um novo caso no município de Boca do Acre, estado do Amazonas, Brasil. Rev Pat Trop. 1973;2:87-93.
- 94. Vargas Montiel H. Lobomicosis oriunda del sudoeste del Lago de Maracaibo. Primer caso en el Estado Zulia (Venezuela). Kasmera. 1974;5:181-90.
- 95. Pecher SA. Considerações sobre cinco casos de lobomicose. An Bras Dermatol. 1976;51:23-8
- 96. Roche JC, Monod L. A propos du 10e cas de lobomycose observé en Guyane Française. Bull Soc Pathol Exot. 1976;69:540-6.
- 97. Jaramillo D, Cortés A, Restrepo A, Builes M, Robledo M. Lobomycosis. Report of the eighth Colombian case and review of the literature. J Cutan Pathol. 1976;3:180-9.
- 98. Azulay RD, Carneiro JA, Cunha MGS, Reis LT. Keloidal blastomycosis (Lobo's disease) with lymphatic involve ment: a case report. Int J Dermatol. 1976;15:40-2.
- 99. Zavala-Velásquez J, Pérez AR. Enfermedad de Lobo (Lobomicosis). Primer caso mexicano. Dermatol Rev Mex. 1978;22:5-12.
- 100. Tapia A, Torres-Calcindo A, Arosemena R. Keloidal blastomycosis (Lobo's disease) in Panama. Int J Dermatol. 1978;17:572-4.
- 101. Talhari S, Gadelha AR, Cunha MGS, Fernandes G, Paes MG. Micoses profundas na Amazônia. Estudo dos casos diagnosticados em Manaus, Estado do Amazonas, no período de 1973 a 1978. An Bras Dermatol. 1980;55:133-6.
- 102. Talhari S, Cunha MGS, Barros MLB, Gadelha AR. Doença de Jorge Lobo. Estudo de 22 casos novos. Med Cutan Ibero Lat Am. 1981;9:87-96.
- 103. Rose P, Hay RJ. Lobomycosis (Lobo's disease); report of a case from Guyana. Am J Trop Med Hyg. 1981;30:903-4.
- 104. Recacoechea M, Vargas J. Experiencia con el ketoconazole en el primer caso de lobomicosis en Bolivia. Bol Inf CENETROP. 1982;8:23-6.
- 105. Mogollón TJ. Lobomicosis. Presentación de un caso y revisión de la literatura colombiana. Mycopathologia. 1982;80:65-72.
- 106. Pradinaud R. Entre le Yucatan, la Floride et la Guyane Française, la lobomycose existe-t-el1e aux Antilles? Bull Soc Pathol Exot. 1984;77:392-400.
- 107. Talhari S, Caparo AB, Ganter B. Enfermedad de Jorge Lobo. Segundo caso peruano. Med Cut ILA. 1985;13:201-4
- 108. Avila Mayor A, Vargas Montiel H, Vargas De Caminos N, Chac ón N, Sanchez NU, Campos R. Lobomicosis. Informe biopsico de un nuevo caso en el Zulia. Bol Inf Micosis Venez. 1985;1:10-1.
- 109. Arrese Estrada J, Rurangirwa A, Pierard GE. Lobomycose. Ann Pathol. 1988;8:325-7.
- 110. Rodriguez-Toro G. Enfermedad de Jorge Lobo o blas tomicosis queloidiana. Nuevos aspectos de la entidad en Colombia. Revisión Biomédica (Bogota). 1989;9:133-46.
- 111. Fuchs J, Milbradt R, Pecher SA. Lobomycosis (keloidal blastomycosis): case reports and overview. Cutis. 1990;46:227-34.
- 112. Cáceres S, Rodriguez-Toro G. Lobomicosis de 35 ãnos de evolución. Rev Soc Col Dermatol. 1991;1:43-5.
- 113. Rodriguez-Toro G. Lobomycosis. Int J Dermatol. 1993;32:324-32.
- 114. Nalovic K, Pradinaud R. Anergic cutaneous leishmaniasis versus lobomycosis. Int J Dermatol. 1996;35:438-40.
- 115. Opromolla DVA, Taborda PRO, Taborda VBA, Viana S, Furtado JF. Lobomicose: relato de 40 casos novos. An Bras Dermatol. 1999;74:135-41.
- 116. Lobo J. Blastomicose queloidiforme. Doença de Jorge Lobo. J Bras Med. 1966;11:120-37.
- 117. Silva D. Micose de Lobo. Ars Curandi. 1974;7:54-63.
- 118. Nazaré IP. Micose de Lobo [tese]. Belém: ` Universidade Federal do Pará; 1976.
- 119. Silva D, Neves C. Dois casos novos de micose de Lobo: atualização estatística. An Bras Dermatol. 1995;70:127-9.
- 120. Pradinaud R, Talhari S. Lobomycose. In: Encycl Med Chir, Paris, Maladies Infectieuses, Paris. 1996;608A10:1-6.
- 121. Pradinaud R. Loboa loboi. In: Collier L, Balows A, Sussman M, eds. Topley and Wilson's microbiology and microbial infections. New York: Oxford University Press; 1998. p.585-94.
- 122. Caldwell DK, Caldwell MC, Woodard JC, Ajello L, Kaplan W, McClure HM. Lobomycosis as a disease of the Atlantic bottle-nosed dolphin (Tursiops truncatus Montagu, 1821). Am J Trop Med Hyg. 1975;24:105-14.
- 123. De Vries GA, Laarman JJ. A case of Lobo's disease in the dolphin Sotalia guianensis. Aquatic Mammals. 1973;1:26-33.
- 124. Poelma FG, De Vries GA, Blythe-Russell EA, Luykx MHF. Lobomycosis in an Atlantic bottle-nosed dolphin in the Dolphinarium Harderwijk. Aquatic Mammals. 1974;2:11-5.
- 125. Bossart GD. Suspected acquired immunodeficiency in an Atlantic bottlenosed dolphin with chronic-active hepatitis and lobomycosis. J Am Vet Med Assoc. 1984;185:1413-4.
- 126. Lopes PCS, Paula GS, Both MC, Xavier FM, Scaramello AC. First case of lobomycosis in a bottleno se dolphin from Southern Brazil. Marine Mammal Sci. 1993;9:329-31.
- 127. Miller GF, Owens JW. Ultrastructural characterization of the agent of systemic yeast infection of owl monkeys. Med Mycol. 1999;37:139-45.
- 128. Rodriguez-Toro G, Téllez N. Lobomycosis in Colombian Amer Indian patients. Mycopathologia. 1992;120:5-9.
- 129. Uribe JF, Zuluaga AI, Leon W, Restrepo A. Histopathology of chromoblastomycosis. Mycopathologia. 1989;105:1-6.
- 130. Batres E, Wolf JE Jr, Rudolph AH, Knox JM. Transepithelial elimination of cutaneous chromomycosis. Arch Dermatol. 1978;114:1231-2.
- 131. Goette DK, Robertson D. Transepithelial elimination in chromomycosis. Arch Dermatol. 1984;120:400-1
- 132. Gadelha AR, Bandeira V. Micoses Profundas. In: Silva IM. Dermatopatologia. Rio de Janeiro: Atheneu; 1983. p.125-34.
- 133. Andrade LMC, Azulay RD, Carneiro J. Micose de Jorge Lobo. (Estudo histopatológico). Hospital (Rio de Janeiro). 1968;73:1173-84.
- 134. Opromolla DVA, Belone AFF, Taborda PRO, Taborda VBA. Correlação clinicopatológica em 40 casos novos de lobomicose. An Bras Dermatol. 2000;75:425-34.
- 135. Wiersema JP. Lobo's disease (keloidal blastomycosis). In: Baker RD, eds. The pathologic anatomy of mycosis. Human infection with fungi, actinomycetes and algae. New York: Springer-Verlag; 1971.
- 136. Bhawan J, Malhotra R, Naik DR. Gaucher-like cells in a granular cell tumor. Hum Pathol. 1983;14:730-3.
- 137. Michalany J. Corpos asteróides nas lesões granuloma tosas, com especial referência à blastomicose ou doen ça de Jorge Lobo. Rev Assoc Med Bras. 1955;2:61-8.
- 138. Rodríguez G, Barrera GP. The asteroid bodies of lobomycosis. Mycopathologia. 1996-97;136:71-4.
- 139. Rodríguez G, Sarmiento L. The asteroid bodies of Sporothrichosis. Am J Dermatopathol. 1998;20:246-9.
- 140. Sampaio MM, Dias LB, Scaff L. Staining of pathogenic fungi with trypan blue. Rev Inst Med Trop Sao Paulo. 1971;13:223-4.
- 141. Vilani-Moreno FR, Opromolla DVA. Determinação da viabilidade do Paracoccidioides loboi em biópsias de pacientes portadores de doença de Jorge Lobo. An Bras Dermatol. 1997;72:433-7.
- 142. Opromolla DVA, Vilani-Moreno FR, Belone AFF. A doença de Jorge Lobo e a coloração pela prata-metenamina. An Bras Dermatol. 1999;74:345-9.
- 143. Vilani-Moreno FR, Belone AF, Soares CT, Opromolla DVA. Immunohistochemical characterization of the cellular infiltrate in Jorge Lobo's disease. Rev Iberoam Micol. 2005;22:44-9.
- 144. D'Ávila SCG, Pagliari C, Duarte MIS. The cell-mediated immune reaction in the cutaneous lesion of chromoblastomycosis and their correlation with different clinical forms of the disease. Mycopathologia. 2003;156:51-60.
- 145. Pecher SA, Fuchs J. Cellular immunity in lobomycosis (keloidal blastomycosis). Allergol Immunopathol. 1988;16:413-5.
- 146. Xavier MB, Ferreira MMR, Quaresma JAS, Brito AC. HIV and Lacaziosis, Brazil. Emerg Infect Dis. 2006;12:526-7.
- 147. Smeltz RB, Chen J, Shevach EM. Transforming growth factor-beta1 enhances the interferon-gamma-dependent, interleukin-12-independent pathway of T helper 1 cell differentiation. Immunology. 2005;114:484-92.
- 148. Andersson AK, Chaduvula M, Atkinson SE, Khanolkar- Young S, Jain S, Suneetha L, et al. Effects of prednisolone treatment on cytokine expression in patients with leprosy type 1 reactions. Infect Immun. 2005;73:3725- 33.
- 149. Flisiak R, Jaroszewicz J, Lapinski TW, Flisiak I, Rogalska M, Prokopowicz D. Plasma transforming growth factor beta1, metalloproteinase-1 and tissueinhibitor of metalloproteinases-1 in acute viral hepatitis type B. Regul Pept. 2005;131:54-8.
- 150. Piekarska A, Piekarski J, Szymczak W, Kubiak R. Expression of Ki-67, transforming growth factor beta1, and B-cell lymphoma-leukemia-2 in liver tissue of patients with chronic liver diseases. J Gastroenterol Hepatol. 2006;21:700-10.
- 151. Machado PA. Polimorfismo das lesões dermatológicas na blastomicose de Jorge Lobo entre os índios Caiabi. Acta Amaz. 1972;2:93-7.
- 152. Silva D, de Brito A. Formas clínicas não usuais de micose de Lobo. An Bras Dermatol. 1994;69:133-6.
- 153. Brito AC. Lobomicose. In: Sampaio SAP, Rivitti EA. Dermatologia. Sao Paulo: Artes Médicas; 2000. p.544-5.
- 154. Brito AC. Lobomicose. In: Diogenes MJN, Sá- Gonçalves H, Talhari S, Neves RG, eds. Atlas de Dermatopatologia Tropical. Rio de Janeiro: MEDSI; 2001. p.217-23.
- 155. Brito AC. Lobomycosis. In: Tyring SK, Lupi O, Hengge UR, eds. Tropical Dermatology. São Paulo: Elsevier; 2006. p.207-9.
- 156. Leite JM, Dias LB, Araujo R. Blastomicose queloidiana amazônica (Doença de Jorge Lobo). Rev Univ Fed Pará. 1971;1:281-98.
- 157. Machado PA. Regressão espontânea de lesões maculosas na blastomicose de Jorge Lobo. Acta Amaz. 1972;2:47-50.
- 158. Opromolla DVA, Belone AFF, Taborda PR, Rosa PS. Lymph node involvement in Jorge Lobo's disease: report of two cases. Int J Dermatol. 2003;42:938-41.
- 159. Baruzzi RG, Rodriguez DA, Michalany NS, Salomão R. Squamous-cell carcinoma and lobomycosis (Jorge Lobo's disease). Int J Dermatol. 1989;28:183-5.
- 160. Talhari S, Neves RG. Manifestações cutâneas e diagnóstico diferencial. In: Talhari S, Neves RG. Hansenologia. 3 ed. Manaus: Gráfica Tropical; 1997. p.5-40.
- 161. Lacaz CS, Ferri RG, Raphael A, Fava Netto C, Minami PS, Castro RM, et al. Blastomicose queloideana associada a blastomicose sul-americana. Registro de um caso. Hospital (RJ). 1967;71:1-11.
- 162. Baruzzi RG, Marcopito LF, Vicente LS, Michalany NS. Jorge Lobo's disease (keloidal blastomycosis) and tinea imbricata in Indians from the Xingu National Park, Central Brazil. Trop Doct. 1982;12:13-5.
- 163. Miranda MF, Silva AJ. Vinyl adhesive tape also effective for direct microscopy diagnosis of chromomycosis, lobomycosis and paracoccidioidomycosis. Diagn Microbiol Infect Dis. 2005;52:39-43.
- 164. Baruzzi RG, Marcopito LF, Michalany NS, Livianu J, Pinto NRS. Early diagnosis and prompt treatment by surgery in Jorge Lobo's disease (Keloidal blastomyco sis). Mycopathologia.1981;74:51-4.
- 165. Golcman B, Yagima ME. Blastomicose queloideana de Jorge Lobo. Tratamento cirúrgico de 2 casos. An Bras Dermatol. 1973;48:1-5.
- 166. Silva D. Traitement de la maladie de Jorge Lobo par la c1ofazimine (B 663). Bull Soc Pathol Exot. 1978;71:409-12.
- 167. Cucé LC, Wroclawski EL, Sampaio SAP. Treatment of paracoccidioidomycosis, candidosis, chromomycosis, lobomycosis and mycetoma with ketoconazole. Int J Dermatol. 1980;19:405-8.
- 168. Lawrence DN, Ajello L. Lobomycosis in western Brazil: report of a clinica1 trial with ketoconazole. Am J Trop Med Hyg. 1986;35:162-6.
- 169. Fischer M, Talhari AC, Reinel D, Talhari S. Lobomykose. Hautarzt. 2002;53:677-81.
- 170. Bustamante B. Posaconazole therapy for lobomycosis: Preliminary report of a peruvian case. P-0199. Presented at the 16th Congress of the International Society for Human and Animal Mycology, Paris, France, June 25-29, 2006.
Datas de Publicação
-
Publicação nesta coleção
01 Abr 2008 -
Data do Fascículo
Out 2007