Resumos
A síndrome da deficiência de hormônio de crescimento (DGH) no adulto e o conseqüente aumento no risco cardiovascular têm sido bastante estudados nos últimos anos. Com o objetivo de avaliar as alterações na composição corporal e a presença de resistência à insulina em adultos com DGH, estudamos 27 pacientes comparados a 27 indivíduos saudáveis pareados por idade, sexo e índice de massa corporal, através de tomografia computadorizada de abdômen para medida da gordura visceral e teste de tolerância oral à glicose (TTOG), com curva de glicose e insulina e estimativa da resistência à insulina pelo Homeostasis Model Assessment (HOMA). Observamos, nos pacientes, aumento do tecido adiposo visceral (p= 0,008) sem aumento da freqüência de alterações no TTOG. As glicemias e insulinemias basais e após 2 horas de sobrecarga oral de glicose e as áreas sob as curvas de glicose e insulina foram semelhantes ao grupo controle (p> 0,05). Não houve diferença na sensibilidade à insulina pelo método HOMA (p= 0,989). Houve correlação positiva significativa da medida de gordura visceral nos pacientes com as dosagens de glicemia (r= 0,583; p= 0,001) e insulina (r= 0,728; p= 0,001) após sobrecarga de glicose e as áreas sob a curvas de glicose (r= 0,403; p= 0,040) e insulina (r= 0,713; p= 0,001), porém sem correlação significativa nos controles (r< 0,40; p> 0,05). Em conclusão, não houve alteração significativa no metabolismo glicídico, apesar do aumento da adiposidade visceral observada em adultos DGH.
Deficiência de GH; Adultos; Resistência à insulina; Tecido adiposo visceral
Growth hormone deficiency (GHD) syndrome in adults and the resulting increased cardiovascular risk have been extensively studied in recent years. To evaluate body composition abnormalities and insulin resistance in GHD adults, we studied 27 patients using abdominal CT, considering glucose and insulin responses during an oral glucose tolerance test (OGTT) and the Homeostasis Model Assessment (HOMA). The group of patients was compared to a control group of 27 healthy individuals matched by age, gender and body mass index. GHD patients showed increase in the amount of visceral adipose tissue (p= 0.008). The frequency of abnormalities indicated by OGTT was similar to that found within the control group. Fasting and after-oral glucose load plasma glucose and insulin levels were similar to those identified within the control group (p>0.05). The areas under the glucose and insulin curves were also similar (p>0.05) and there were no differences in the insulin sensitivity measured by HOMA (p= 0.989). There was a strong positive correlation between increased visceral adipose tissue with after-oral glucose load plasma glucose (r= 0.58; p= 0.001) and insulin (r= 0.72; p= 0.001) levels and the areas under the glucose (r= 0.40; p= 0.040) and insulin (r= 0.71; p= 0.001) curves on the patient group, but not within the control group (r< 0.40; p>0.05). In conclusion, it was not observed any significant difference in glucose metabolism, despite the increased amount of visceral fat found in GHD patients.
GH deficiency; Adults; Insulin resistance; Adipose visceral tissue
artigo original
Avaliação do Metabolismo Glicídico e da Gordura Visceral em Adultos Deficientes de Hormônio de Crescimento
Luciana D.C. Spina
Débora V. Soares
Flávia L. Conceição
Rosane R.L.O. Brasil
Eliana M.C. da Silva
Priscila M. Lobo
Antônio José L. Costa
Mário Vaisman
Serviço de Endocrinologia, Hospital
Universitário e Faculdade de
Medicina da Universidade
Federal do Rio de Janeiro (UFRJ),
Rio de Janeiro, R.J.
Recebido em 30/11/01
Revisado em 17/05/02
Aceito em 12/07/02
RESUMO
A síndrome da deficiência de hormônio de crescimento (DGH) no adulto e o conseqüente aumento no risco cardiovascular têm sido bastante estudados nos últimos anos. Com o objetivo de avaliar as alterações na composição corporal e a presença de resistência à insulina em adultos com DGH, estudamos 27 pacientes comparados a 27 indivíduos saudáveis pareados por idade, sexo e índice de massa corporal, através de tomografia computadorizada de abdômen para medida da gordura visceral e teste de tolerância oral à glicose (TTOG), com curva de glicose e insulina e estimativa da resistência à insulina pelo Homeostasis Model Assessment (HOMA). Observamos, nos pacientes, aumento do tecido adiposo visceral (p= 0,008) sem aumento da freqüência de alterações no TTOG. As glicemias e insulinemias basais e após 2 horas de sobrecarga oral de glicose e as áreas sob as curvas de glicose e insulina foram semelhantes ao grupo controle (p> 0,05). Não houve diferença na sensibilidade à insulina pelo método HOMA (p= 0,989). Houve correlação positiva significativa da medida de gordura visceral nos pacientes com as dosagens de glicemia (r= 0,583; p= 0,001) e insulina (r= 0,728; p= 0,001) após sobrecarga de glicose e as áreas sob a curvas de glicose (r= 0,403; p= 0,040) e insulina (r= 0,713; p= 0,001), porém sem correlação significativa nos controles (r< 0,40; p> 0,05). Em conclusão, não houve alteração significativa no metabolismo glicídico, apesar do aumento da adiposidade visceral observada em adultos DGH. (Arq Bras Endocrinol Metab 2002;46/5:536-543)
Descritores: Deficiência de GH; Adultos; Resistência à insulina; Tecido adiposo visceral
ABSTRACT
Evaluation of Glucose Metabolism and Visceral Adiposity in Growth Hormone Deficient Adults.
Growth hormone deficiency (GHD) syndrome in adults and the resulting increased cardiovascular risk have been extensively studied in recent years. To evaluate body composition abnormalities and insulin resistance in GHD adults, we studied 27 patients using abdominal CT, considering glucose and insulin responses during an oral glucose tolerance test (OGTT) and the Homeostasis Model Assessment (HOMA). The group of patients was compared to a control group of 27 healthy individuals matched by age, gender and body mass index. GHD patients showed increase in the amount of visceral adipose tissue (p= 0.008). The frequency of abnormalities indicated by OGTT was similar to that found within the control group. Fasting and after-oral glucose load plasma glucose and insulin levels were similar to those identified within the control group (p>0.05). The areas under the glucose and insulin curves were also similar (p>0.05) and there were no differences in the insulin sensitivity measured by HOMA (p= 0.989). There was a strong positive correlation between increased visceral adipose tissue with after-oral glucose load plasma glucose (r= 0.58; p= 0.001) and insulin (r= 0.72; p= 0.001) levels and the areas under the glucose (r= 0.40; p= 0.040) and insulin (r= 0.71; p= 0.001) curves on the patient group, but not within the control group (r< 0.40; p>0.05). In conclusion, it was not observed any significant difference in glucose metabolism, despite the increased amount of visceral fat found in GHD patients. (Arq Bras Endocrinol Metab 2002;46/5:536-543)
Keywords: GH deficiency; Adults; Insulin resistance; Adipose visceral tissue
O HORMÔNIO DE CRESCIMENTO (GH) possui papel importante na regulação do metabolismo protéico, lipídico, glicídico e ósseo. Seus efeitos na composição corporal através de sua ação anabólica, lipolítica e anti-natriurética são bem conhecidos. Na acromegalia esses efeitos resultam em aumento do peso corporal, da massa celular corporal e do volume extracelular (1). Crianças com deficiência de GH (DGH) são relativamente obesas e a diminuição do tecido adiposo é uma das primeiras modificações percebidas com a reposição (2). As conseqüências na composição corporal da deficiência de GH dos adultos são semelhantes às encontradas nas crianças. Há nesses indivíduos um aumento da gordura corporal total com distribuição anormal da mesma e diminuição da massa magra (3-6). O aumento da massa gordurosa é predominante na gordura visceral abdominal e está associado com aumento da relação cintura-quadril (RC/Q) (4).
No metabolismo glicídico e lipídico, o GH possui dois grandes efeitos gerais de ação anti-insulínica: diminuição da utilização de glicose e aumento da lipólise com aumento da concentração de ácidos graxos livres (7). Na acromegalia existe aumento no risco de desenvolvimento de hiperinsulinemia com glicemia normal, tolerância oral à glicose diminuída ou mesmo diabetes mellitus tipo 2 (8). Crianças com DGH são mais propensas ao desenvolvimento de hipoglicemia, devido à diminuição da produção hepática de glicose. A reposição de GH restabelece a glicemia de jejum (9). Apesar desses achados, estudos recentes demonstraram que adultos com DGH podem apresentar diminuição da sensibilidade à insulina, provavelmente causada pelas alterações da composição corporal e talvez, também, por reposição inadequada de outros hormônios deficitários (10).
A resistência à insulina (RI), freqüentemente sugerida por alterações dos níveis de glicemia e insulina de jejum e após o teste de tolerância oral à glicose (TTOG), pode ser avaliada mais precisamente através da técnica do clamp euglicêmico hiperinsulinêmico descrita por DeFronzo e cols. (11). Essa técnica é considerada método de referência (padrão-ouro) para uma avaliação acurada da sensibilidade insulínica in vivo, porém a complexidade e o custo elevado limitam seu uso. Vários métodos alternativos para a avaliação da sensibilidade à insulina têm sido propostos nos últimos 20 anos, tais como a infusão contínua de glicose com emprego de um modelo matemático (Continuous Infusion of Glucose with Model Assessment - CIGMA), o teste de tolerância à glicose endovenosa (Modelo Mínimo de Bergman), o teste de supressão da insulina e o teste de tolerância insulínica (12). O Homeostasis Model Assessment (HOMA) foi proposto por Matthews e cols., há cerca de 15 anos, como uma alternativa simples e de baixo custo às técnicas mais sofisticadas. Esse método estima a sensibilidade insulínica através de um modelo matemático baseado em concentrações de glicemia e insulina de jejum (13). Níveis séricos de insulina de jejum e após sobrecarga oral de glicose são usados há muito tempo como uma maneira prática de se avaliar a presença de RI. Concentrações elevadas de insulina na presença de níveis normais de glicose sugerem resistência (14).
A importância da deficiência de GH em adultos se tornou aparente no fim da década de 80, quando estudos clínicos pioneiros demonstraram os efeitos benéficos da sua reposição, tornando a síndrome de DGH em adultos bem caracterizada (6,15). Após o reconhecimento dessa síndrome surgiu a suspeita de que esses pacientes apresentassem um aumento na incidência de doenças cardiovasculares (16) e mais recentemente, aumento na mortalidade por doença cérebro-vascular (17).
Esses achados evidenciam a similaridade entre a síndrome de DGH em adultos e a síndrome plurimetabólica, que se caracteriza por uma constelação de sinais e sintomas clínicos, principalmente obesidade do tipo abdominal-visceral e resistência insulínica, associada a um elevado risco cardiovascular.
Levando-se em consideração as alterações na composição corporal com aumento da adiposidade visceral, é possível que a presença da resistência insulínica seja causada por essas alterações, mais do que pela própria deficiência de GH.
Esse trabalho tem como objetivos avaliar a composição corporal através de medidas antropométricas e tomografia computadorizada de abdômen, a freqüência de alterações no teste de tolerância oral à glicose e a presença de resistência à insulina em adultos deficientes de GH, comparando-os a um grupo controle formado por indivíduos saudáveis.
PACIENTES E MÉTODOS
Foram avaliados 27 pacientes deficientes de hormônio de crescimento, 13 homens e 14 mulheres, com idade variando de 20 a 58 anos (média de 39), e 27 indivíduos saudáveis (controles) pareados por idade, sexo e índice de massa corporal (IMC) (tabela 1).
Todos os pacientes apresentavam deficiência de hormônio de crescimento por mais de um ano. Seis com deficiência desde a infância, com diagnóstico de hipopituitarismo idiopático e 21 hipopituitarismo adquirido durante a vida adulta. Dentre as causas de hipopituitarismo adquirido, 7 mulheres tiveram diagnóstico de necrose hipofisária pós-parto (Síndrome de Sheehan) e 14 pacientes hipopituitarismo após cirurgia e/ou radioterapia hipofisária. Dois com déficit isolado de GH e 25 com mais de uma deficiência hormonal.
Foram incluídos os pacientes que apresentaram pico de GH menor que 3ng/ml em pelo menos 2 testes de estímulo farmacológicos: a) Teste de tolerância à insulina (0,1-0,15UI de insulina regular/Kg de peso, EV). Todos manifestaram sintomas de hipoglicemia e/ou níveis de glicemia com queda de 50% em relação ao nível basal ou menor que 40mg/dl; b) Teste do glucagon (1mg, IM).
Os pacientes estavam em terapia de substituição com glicocorticóides, tiroxina e esteróides gonadais com doses estáveis por pelo menos três meses antes de iniciar o estudo, e tiveram atestada a correta reposição através de dosagens hormonais.
Adotamos como critérios de exclusão: presença de doença mental, gravidez, diabetes mellitus, hipertensão arterial descompensada, uso de GH nos últimos 12 meses, doença aguda severa, doença hepática ou renal crônica, história de malignidade e acromegalia prévia.
Os controles saudáveis foram selecionados entre os parentes e amigos dos pacientes e funcionários do hospital, sendo que as mulheres em menopausa estavam obrigatoriamente em uso de terapia de reposição hormonal.
Os objetivos e métodos do estudo foram explicados aos pacientes e controles e todos assinaram um termo de consentimento livre e esclarecido, aprovado pelo comitê de ética em pesquisa do HUCFF e da Faculdade de Medicina da UFRJ.
Os pacientes e os controles foram avaliados ambulatorialmente, com entrevista e exame físico completo, e em seguida encaminhados para realização do TTOG, após 12 horas de jejum noturno, com administração de 300ml de solução com 75g de glicose (18). Foram colhidas amostras de sangue venoso para dosagens de glicose e insulina nos tempos basal, 30, 60, 90 e 120 minutos. As alíquotas foram encaminhadas para dosagem imediata de glicose no laboratório do HUCFF, sendo uma parte armazenada em freezer a menos 20ºC, por no máximo 6 meses, para posterior dosagem de insulina no laboratório Dr. Sérgio Franco - Rio de Janeiro.
O GH foi dosado através de ensaio imunométrico por quimioluminescência IMMULITE - DPC®, United Kingdom (coeficiente de variação - cv - intra-ensaio de 5,3% e inter-ensaio de 5,7%, valor de referência de 0,06 a 5,0ng/ml e limite de detecção de 0,01ng/ml). A insulina foi dosada por ensaio imunofluorimétrico AutoDELFIA- WALLAC®, USA (cv intra-ensaio de 2,4% e inter de 3,5%, reação cruzada com pró-insulina intacta e 32-33 split pró-insulina <1%, valor de referência de 2,34 a 26,40µU/ml e limite de detecção de 0,5µU/ml) e a glicose por método automatizado pela rotina do laboratório de análises clínicas do HUCCF.
Nessa ocasião os pacientes e controles foram pesados com roupas leves, sem sapatos, em balança mecânica Filizola® e medidos com estadiômetro, assim como avaliadas a menor circunferência abdominal e a medida do quadril com fita métrica não elástica. Essas medidas foram realizadas sempre na mesma balança e pelo mesmo avaliador. O IMC foi calculado de acordo com a fórmula peso (Kg) / altura (m)2 e a relação cintura-quadril (RC/Q) dividindo-se o valor da menor circunferência abdominal pelo quadril.
Posteriormente, todos foram encaminhados para realização de tomografia computadorizada helicoidal de abdômen, sem contraste venoso ou oral, para quantificação da gordura visceral e subcutânea no Hospital Pró Cardíaco - Rio de Janeiro. O equipamento usado, modelo PRO-SPEED, da marca GE®, foi o mesmo em todas avaliações, assim como o mesmo examinador. Para a avaliação da gordura abdominal total, visceral e subcutânea, realizamos pequena hélice 4 de cortes, com 10mm de espessura e espaçamento, selecionando-se a imagem abdominal de maior diâmetro.
O metabolismo glicídico foi avaliado através dos valores de glicose e insulina, no jejum e após sobrecarga oral de glicose, e através dos cálculos das áreas sob a curva de glicose e de insulina, de acordo com a regra trapezóide.
A resistência à insulina foi estimada através do índice de resistência insulínica pelo Homeostasis Model Assessment (HOMA), de acordo com a equação proposta por Matthews e cols. (13):
HOMA-IR = Glicemia de jejum (mg/dl) X insulina de jejum (µU/ml) / 22,5.
ANÁLISE ESTATÍSTICA
Os resultados das variáveis analisadas serão apresentados como média e desvio-padrão. O teste utilizado para comparar as variáveis contínuas do grupo de pacientes com o grupo de controles foi o teste t de Student pareado. A correlação entre as variáveis estudadas foi avaliada pelo teste de correlação de Pearson. O nível de significância estatística considerado foi de 5% (p< 0,05).
RESULTADOS
Os pacientes foram pareados com os controles por IMC e apresentaram médias semelhantes de menor circunferência abdominal, porém com aumento da relação cintura-quadril, principalmente no sexo masculino. A medida do tecido adiposo visceral foi significativamente maior nos pacientes (tabela 2).
De acordo com os novos critérios da Associação Americana de Diabetes de 1997 (19), encontramos 5 em 27 (18,5%) pacientes deficientes de GH com tolerância à glicose diminuída no TOTG. No grupo controle o achado foi o mesmo: 5 em 27 (18,5%) com tolerância à glicose diminuída. Todos os pacientes e controles apresentaram glicemias de jejum normais e eram assintomáticos.
Os pacientes apresentaram glicemia basal em média menor que os controles (79,85 x 86,44mg/dl, p= 0,01). A glicemia após sobrecarga de glicose (aos 120 minutos) e área sob a curva de glicose foram semelhantes (tabela 3).
Os pacientes apresentaram níveis de insulina basal, após sobrecarga de glicose (aos 120 minutos) e a área sob a curva de insulina sem diferença significativa do ponto de vista estatístico em relação aos controles. Os níveis médios de insulina foram um pouco maiores em todos os tempos da curva, porém, com grande dispersão de valores e também sem significado estatístico (tabela 4 e figura 1). O índice de resistência à insulina pelo método HOMA (HOMA-IR) foi semelhante entre os pacientes e os controles (tabela 4).
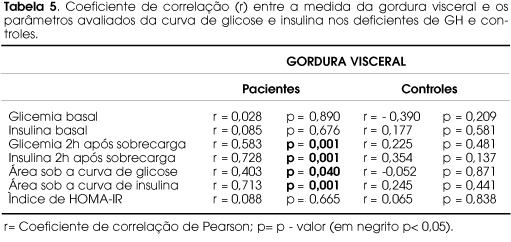
Houve correlação positiva significativa da medida de gordura visceral nos pacientes com as dosagens de glicemia (r= 0,583; p= 0,001) e insulina (r= 0,728; p= 0,001) após sobrecarga oral de glicose (aos 120 minutos) e valores de área sob a curva de glicose (r= 0,403; p= 0,040) e insulina (r= 0,713; p= 0,001). Porém não houve com a glicemia e insulina basais e com o índice de HOMA IR. No grupo controle, não encontramos correlação da gordura visceral com nenhum parâmetro avaliado do metabolismo glicídico (tabela 5). Não houve correlação da idade e IMC com os resultados do TOTG e HOMA-IR em ambos os grupos (r< 0,40 e p>0,05; dados não mostrados).
DISCUSSÃO
Estudamos as conseqüências da deficiência de hormônio de crescimento em adultos sobre o metabolismo glicídico e o tecido adiposo visceral em 27 pacientes e 27 indivíduos controles. Devido à influência de fatores reconhecidamente relacionados com o desenvolvimento de alterações no metabolismo glicídico, como idade e grau de obesidade, tivemos o cuidado de utilizar um grupo controle constituído de indivíduos saudáveis, cuidadosamente pareados por idade, sexo e IMC.
A idade média dos nossos pacientes (39 anos) foi semelhante à maioria dos trabalhos publicados. Observamos que os pacientes deficientes de GH avaliados apresentaram sobrepeso (IMC de 27,28kg/m2), com aumento da RC/Q (0,94 nos homens e 0,87 nas mulheres). Quando comparados com um grupo controle de mesmo IMC apresentaram aumento de tecido adiposo visceral, avaliado por tomografia computadorizada de abdômen, o que caracteriza uma distribuição anormal de gordura corporal com predomínio central. Esses achados estão de acordo com a literatura (6,20-22) e são características comumente encontradas na síndrome de deficiência de GH (6,15).
No TTOG não observamos diferença em relação à freqüência de alterações encontradas nos pacientes comparados aos controles. Houve uma diferença, já esperada, no IMC médio dos pacientes com tolerância à glicose diminuída, que apresentavam grau maior de obesidade (25,90 x 30,82kg/m2).
Nosso achado de freqüência semelhante de alterações da tolerância à glicose difere de Beshyah e cols. (23), que com uma metodologia semelhante encontraram aumento (44% nos pacientes x 21% nos controles) nas alterações da tolerância à glicose pelos critérios da Organização Mundial de Saúde (OMS). A casuística avaliada por eles foi maior (63 pacientes) e os pacientes apresentavam idade média mais elevada (48 x 39 anos nos nossos pacientes) com IMC semelhante (27,8 x 27,28kg/m2 nos nossos pacientes).
Na avaliação da curva glicêmica encontramos glicemia basal em média menor que os controles. Tal achado está em acordo com os estudos de Kamarudin e cols. (24), Beshyah e cols. (25) e Christopher e cols. (26), porém difere de outros (20,23,27,28), onde a glicemia basal foi semelhante aos controles avaliados. A diminuição da glicemia basal, dosada após 12 horas de jejum noturno, pode refletir uma menor tolerância ao jejum pela própria deficiência de GH, devido a uma provável redução nos estoques de glicogênio (29,30). No entanto, esse achado não parece ter relevância clínica, uma vez que os níveis de glicemia se encontram dentro da normalidade. A glicemia após sobrecarga de glicose e a área sob a curva de glicose semelhantes aos controles também foram encontradas por Beshyah e cols. (23) e Kamarudin e cols. (24).
Em relação à curva de insulina encontramos dosagens de jejum dentro dos valores de referência para o método. Comparados ao grupo controle, os níveis de insulina basal, insulina após sobrecarga e área sob a curva de insulina foram em média absoluta um pouco maiores, porém sem significado estatístico. O desvio-padrão encontrado foi elevado, o que, provavelmente devido à grande dispersão de valores, associado ao limitado número da amostra, deve ter contribuído para uma não significância estatística.
Weaver e cols. (21) relataram concentrações de insulina elevadas em relação aos níveis de referência para o método utilizado, pórem não avaliaram indivíduos saudáveis como grupo controle. Fedou e cols. (20) encontraram níveis de insulina de jejum aumentados em relação aos controles, porém outros autores não (22-28). A insulina após sobrecarga e a área sob a curva de insulina aumentadas foram descritas apenas por Beshyah e cols. (23).
Na estimativa da resistência à insulina pelo método HOMA, não encontramos diferença entre os pacientes e controles, sugerindo uma não influência da deficiência de GH na sensibilidade hepática à insulina. Esses dados devem ser vistos com cautela devido ao grande desvio-padrão encontrado. Apenas dois trabalhos que utilizaram o HOMA em deficientes de GH foram encontrados (21,31). No entanto, os dois usaram métodos de dosagem de insulina diferentes, com maior reação cruzada com pró-insulina, e não avaliaram um grupo controle, impossibilitando a comparação com nossos resultados.
Na avaliação das correlações das variáveis estudadas nos pacientes, não encontramos correlação da medida do tecido adiposo visceral com os níveis de glicemia e insulina de jejum e conseqüentemente com o índice de HOMA-IR. No entanto, os níveis de glicemia e insulina após sobrecarga e as áreas sob a curva de glicose e insulina apresentaram forte correlação positiva com o aumento da gordura visceral. Tal achado não foi encontrado nos controles e a idade e o IMC não apresentaram correlação com os resultados do TOTG e HOMA-IR em ambos os grupos, mostrando a não interferência deles nos parâmetros avaliados.
Em resumo, encontramos aumento do tecido adiposo visceral em adultos com DGH e a tolerância oral à glicose foi normal, sem aumento significativo dos níveis de insulina. Não houve diferença na sensibilidade à insulina avaliada pelo método HOMA e houve correlação positiva entre a medida da gordura visceral e os níveis de glicose e insulina após sobrecarga oral de glicose apenas nos pacientes. Concluindo, não houve alteração significativa no metabolismo glicídico, apesar do aumento da adiposidade visceral observada em adultos DGH.
AGRADECIMENTOS
Os autores agradecem à Dra. Maria Fernanda M.C. Pinheiro do Laboratório Dr. Sérgio Franco pelas dosagens de insulina e à Dra. Denise M. Moreira do Hospital Pró-Cardíaco pelo estudo tomográfico.
Endereço para correspondência:
Luciana Diniz Carneiro Spina
Rua José Linhares, 244 / 205
22430-220 Rio de Janeiro, RJ
Fax: (21) 2590-2958
e.mail: endocrinologia@hucff.ufrj.br
- 1. Bengtsson B-A, Brummer RJM, Eden S. Body composition in acromegaly. Clin Endocrinol 1989;30:121-30.
- 2. Collipp PJ, Curti V, Thomas J. Body composition changes in children receiving human growth hormone. Metabolism 1973;22:589-95.
- 3. Bengtsson B-A, Brummer RJ, Bosaeus I. Growth hormone and body composition. Horm Res 1990;33:19-24.
- 4. De Boer H, Blok GJ, Voerman HJ, De Vries PMJM, Van Der Veen EA. Body composition in adult growth hormone-deficient men, assessed by anthropometry and bioimpedance analysis. J Clin Endocrinol Metab 1992;75(3):833-7.
- 5. De Boer H, Blok G, Van Der Veen EA. Clinical aspects of growth hormone deficiency in adults. Endocr Rev 1995;16(1):63-86.
- 5. Salomon F, Cuneo RC, Hesp R, Sönksen PH. The effects of treatment with recombinant human growth hormone on body composition and metabolism in adults with growth hormone deficiency. N Eng J Med 1989;321(26):1797-803.
- 7. Davidson MB. Effect of growth hormone on carbohydrate and lipid metabolism. Endocr Rev 1987;8(2):115-31.
- 8. Hansen I, Tsalikian E, Beaufrere B, Gerich J, Haymond M, Rizza R. Insulin resistance in acromegaly: defects in both hepatic and extrahepatic insulin action. Am J Physiol 1986;250:E269-73.
- 9. Bougneres P-F, Artavia-Loria E, Ferre P, Chaussain J-L, Job J-C. Effects of hypopituitarism and growth hormone replacement therapy on the production and utilization of glucose in childhood. J Clin Endocrinol Metab 1985;61(6):1152-7.
- 10. Jorgensen JOL. Fasting metabolism in GHD adults before and after GH replacement. Int Growth Monit 2000;10(1):16-8.
- 11. DeFronzo RA, Tobin JD, Andres R. Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am J Physiol 1979;237(3):E214-23.
- 12. Wajchenberg BL, Santomauro ATMG, Nery M, Santos RF, Rossi Silva MEL, Ursich MJM, et al. Resistência à insulina: Métodos diagnósticos e fatores que influenciam a ação da insulina. Arq Bras Endocrinol Metab 1999;43(2):76-85.
- 13. Mathews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and ?-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 1985;28:412-9.
- 14. American Diabetes Association. Consensus development conference on insulin resistance. Diabetes Care 1998;21(2):310-4.
- 15. Jorgensen JOL, Pedersen AS, Thuesen L, Jorgensen J, Ingemann-Hansen T, Skakkebaer NE, et al. Beneficial effects of growth hormone treatment in GH-deficient adults. Lancet 1989;1:1221-4.
- 16. Rosén T, Bengtsson B-A. Premature mortality due to cardiovascular disease in hypoituitarism. Lancet 1990;336:285-8.
- 17. Bülow B, Hagmar L, Mikoczy Z, Nordström CH, Erfurth EM. Increased cerebrovascular mortality in patients with hypopituitarism. Clin Endoclinol 1997;46:75-81.
-
18Organización Mundial de la Salud. Diabetes mellitus: Informe de un grupo de estudio de la OMS. Organización Mundial de la Salud 1985 (Serie de informes Técnicos, n.727, Genebra).
- 19. The Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Report of the expert committee on the diagnosis and classification of diabetes mellitus. Diabetes Care 1997;20:1183-97.
- 20. Fédou C, Brun J, Raynaud E, Boyer P, Rodier M, Boisvilliers F, et al. Insulin sensitivity and glucose effectiveness measured with the minimal model in adults with GH deficiency. Endocrinol Metab 1996;3:99-104.
- 21. Weaver JU, Monson JP, Noonan K, Jonh WG, Edwards A, Evans KA, et al. The effect of low dose recombinant human growth hormone replacement on regional fat distribution, insulin sensitivity, and cardiovascular risk factors in hypopituitarism adults. J Clin Endocrinol Metab 1995;80(1):153-9.
- 22. Snel YEM, Doerga ME, Brummer RM, Zelissen PMJ, Koppeschaar HPF. Magnetic resonance imaging-assessed adipose tissue and serum lipid and insulin concentrations in growth hormone deficient adults. Arterioscler Thromb Vasc Biol 1995;15(10):1543-8.
- 23. Beshyah SA, Henderson A, Niththyanathan R, Sharp P, Richmond W, Johnston D. Metabolic abnormalities in growth hormone deficient adults: II. Carbohydrate tolerance and lipid metabolism. Endocrinol Metab 1994;1:173-80.
- 24. Kamarudin N, Hew FL, Christopher M, Alford J, Rantzau C, Wards G, et al. Insulin secretion in growth hormone deficient adults: effects of 24 months of therapy and five days of acute withdrawal of recombinant human growth hormone. Metabolism 1999;48(11):1387-96.
- 25. Beshyah SA, Gelding SV, Andres C, Johnston DG, Gray IP. ?-cell function in hypopituitary adults before and during growth hormone treatment. Clin Sci 1995;89:321-8.
- 26. Christopher M, Hew FL, Oakley M, Rantzau C, Alford F. Defects of insulin action and skeletal muscle glucose metabolism in growth hormone-deficient adults persist after 24 months of recombinant human growth hormone therapy. J Clin Endocrinol Metab 1998;83(5):1668-81.
- 27. Hew FL, Koschmann M, Christopher M, Rantzau C, Vaag A, Wards G, et al. Insulin resistance in growth hormone deficient adults: Defects in glucose utilization and glycogen synthase activity. J Clin Endocrinol Metab 1996;81(2):555-64.
- 28. Johansson J-O, Fowelin J, Landin K, Lager I, Bengtsson B-A. Growth hormone deficient adults are insulin resistant. Metabolism 1995;44(9):1126-9.
- 29. Merimee TJ, Felig P, Marliss E, Fineberg SG, Cahill GG. Glucose and lipid homeostasis in the absence of human growth hormone. J Clin Invest 1971;50:574-82.
- 30. Salomon F, Cuneo RC, Umpleby AM, Sönken PH. Glucose and fat metabolism in adults with growth hormone deficiency. Clin Endocrinol 1994;41:315-22.
- 31. Rosenfalck AM, Maghsoudi S, Fisker S, Jorgensen JOL, Christiansen JS, Hilsted J, et al. The effect of 30 months of low dose replacement therapy with recombinant human growth hormone (rhGH) on insulin and C-peptide kinetics, insulin secretion, insulin sensitivity, glucose effectiveness, and body composition in GH-deficient adults. J Clin Endocrinol Metab 2000;85(11):4173-81.
Datas de Publicação
-
Publicação nesta coleção
29 Jan 2003 -
Data do Fascículo
Out 2002
Histórico
-
Aceito
12 Jul 2002 -
Revisado
17 Maio 2002 -
Recebido
30 Nov 2001