O objetivo deste estudo foi avaliar a influência do plasma rico (PRP) e pobre (PPP) em plaquetas na proliferação celular e expressão de metaloproteinases de matriz (MMPs), durante a reparação de úlceras corneais profundas. Foram utilizadas 45 coelhas, distribuídas em 3 grupos (G) experimentais (n=15), designados como grupos PRP (GR), PPP (GP) e Controle (GC), de acordo com o tratamento. Todos os animais foram submetidos à indução cirúrgica unilateral de úlcera corneal. No GR e GP, o sangue autólogo foi centrifugado, utilizando-se protocolo padronizado, e foram confeccionados os colírios de PRP e PPP, e instilados cinco vezes ao dia. No GC, foi utilizado colírio lubrificante. Cada grupo foi subdividido (n=5), segundo o momento final de avaliação, sendo 4 (M4), 7 (M7) e 30 dias (M30). As córneas dos animais foram processadas para avaliação morfológica e imuno-histoquímica para PCNA, MMP1, MMP2, MMP9, MT1-MMP e TIMP1. No M4, os níveis de MMP2 foram maiores no GP e GR, sendo que, no M7, esse comportamento foi observado apenas no GP. No M30, no GR, verificou-se maior número de células epiteliais e marcação para MMP1 que o GP. No GR, a proliferação celular foi maior no M4 que nos demais momentos, e a marcação para MMP2 foi maior no M4 que no M30. O PRP estimula a proliferação celular na fase inicial (M4) do tratamento quando comparado aos demais momentos, diferentemente dos demais tratamentos. O uso de colírios de plasma rico e pobre em plaquetas influencia a expressão de metaloproteinases de matriz envolvidas no processo de reparação corneal.
plasma pobre em plaquetas; MMP; PRP; cicatrização; corneal
ABSTRACT
The aim of this study was to evaluate the influence of platelet-rich (PRP) and poor (PPP) plasma in cell proliferation and matrix metalloproteinases (MMPs) expression during the repair of deep corneal ulcers. Forty-five female rabbits were distributed in 3 experimental groups (G) (n = 15), referred to as PRP (GR), PPP (GP) and Control (GC) groups, in accordance with the treatment. All animals underwent surgical induction of unilateral corneal ulcer. PRP and PPP eye drops were made by using centrifuged blood through standardized protocol, and instilled five times a day. In GC, lubricant eye drops were used. Each group was subdivided (n = 5) according to the final time point, 4 (M4), 7 (M7) and 30 days (M30). The animals' corneas were processed for morphological and immunohistochemical analysis for PCNA, MMP1, MMP2, MMP9, MT1-MMP and TIMP1. In M4, the levels of MMP2 were higher in GP and GR, and in M7, this behavior was only observed in the GP. In M30, more epithelial cells and MMP1 expression were found in GR than GP. In GR, cell proliferation was higher in M4 than at other time points and MMP2 expression was higher in M4 than M30. The PRP stimulates cell proliferation in the early phase (M4) of treatment when compared to other time points, different from other treatments. The use of eye drops of platelet-rich and poor plasma influences the expression of matrix metalloproteinases involved in the corneal repair process.
platelet-poor plasma; MMP; PRP; healing; corneal
INTRODUÇÃO
Quando a córnea é lesionada, múltiplos sistemas são ativados, produzindo uma série de processos celulares complexos e coordenados que resultam na sua completa reparação. Estes envolvem várias proteinases e seus inibidores, fatores de crescimento e citocinas (Ollivier et al., 2007OLLIVIER, F.J.; GILGER, B.C.; BARRIE, K.P. et al. Proteinases of the cornea and preocular tear film. Vet. Ophthalmol, v.10, p.199-206, 2007.). As principais proteinases presentes na córnea são as metaloproteinases de matriz (MMPs) e as proteinases serinas (Gilger et al., 2007GILGER, B.C.; BENTLEY, E.; OLLIVIER, F.J. Diseases and surgery of the canine cornea and sclera. In: GELATT, K.N. Veterinary ophthalmology. 4.ed. Iowa: Blackwell Publishing, 2007. chap.15, p.690-752.).
As MMPs são uma família de enzimas proteolíticas que têm a função de manutenção e remodelamento da arquitetura tecidual. Elas atuam sobre componentes da matriz extracelular, secretam citocinas e moléculas da superfície ocular, e têm sido relacionadas a uma série de processos fisiológicos e doenças, como úlceras corneais (Sivak e Fini, 2002SIVAK, J.M.; FINI, M.E. MMPs in the eye: emerging roles for matrix metalloproteinases in ocular physiology. Prog. Retin. Eye Res., v.21, p.1-14, 2002.). A sua expressão e atuação na córnea pode ser influenciada por fatores de crescimento (Gilger et al., 2007GILGER, B.C.; BENTLEY, E.; OLLIVIER, F.J. Diseases and surgery of the canine cornea and sclera. In: GELATT, K.N. Veterinary ophthalmology. 4.ed. Iowa: Blackwell Publishing, 2007. chap.15, p.690-752.), secretados pelas plaquetas (Wang e Avila, 2007WANG, H.; AVILA, G. Platelet rich plasma: myth or reality? Eur. J. Dent., v.1, p.192-194, 2007.), que se encontram em maior concentração no plasma rico em plaquetas (PRP) (Alió et al., 2007ALIÓ, J.L.; ABAD, M.; ARTOLA, A. et al. Use of autologous platelet-rich plasma in treatment of dormant corneal ulcers. Ophthalmology, v.114, p.1286-1293, 2007.).
O PRP tem sido utilizado no tratamento de diversas doenças, destacando-se como adjuvante no tratamento de fraturas ósseas, implantes dentários e úlceras de pele (Alió et al., 2007ALIÓ, J.L.; ABAD, M.; ARTOLA, A. et al. Use of autologous platelet-rich plasma in treatment of dormant corneal ulcers. Ophthalmology, v.114, p.1286-1293, 2007.). Na oftalmologia, os estudos são mais recentes e direcionados para o tratamento de úlceras corneais. O uso do PRP, sob a forma de colírio em humanos, demonstrou melhora na regeneração epitelial e redução do tempo de cicatrização corneal de úlceras refratárias ao tratamento convencional (Geremicca et al., 2010GEREMICCA, W.; FONTE, C.; VECCHIO, S. Blood components for topical use in tissue regeneration: evaluation of corneal lesions treated with platelet lysate and considerations on repair mechanisms. Blood Transfus., v.8, p.107-112, 2010.). Devido ao aumento na concentração de fatores de crescimento no PRP, ocorre um aumento no índice de proliferação celular e consequente aceleração da reparação tecidual (Liu et al., 2006LIU, L.; HARTWIG, D.; HARLOFF, S. et al. Corneal epitheliotrophic capacity of three different blood-derived preparations. Invest. Ophth. Vis. Sci., v.47, p.2438-2444, 2006.). Donatti et al. (2013DONATTI, C.; BRANDÃO, C.V.S.; RANZANI, J.J.T. et al. Uso do plasma rico em plaquetas no reparo de úlceras de córnea profundas induzidas em coelhos. Avaliação clínica e histomorfométrica. Arq. Bras. Med. Vet. Zootec., v.65, p.809-818, 2013.) realizaram o tratamento com colírio de PRP de úlceras corneais em coelhos, e observaram maior epitelização no período inicial da reparação, além da aceleração da cicatrização e menor opacidade corneal após o término do tratamento.
Os fatores de crescimento produzidos pelas plaquetas provavelmente influenciam a concentração e atividade de MMPs na córnea, assim como a proliferação celular. Porém, na literatura consultada, não foram encontrados estudos avaliando e comparando a expressão de PCNA (Proliferating Cell Nuclear Antigen), e de MMPs e seus inibidores, frente ao tratamento de úlceras corneais com colírio de PRP, justificando o desenvolvimento deste trabalho. O objetivo deste trabalho é identificar a influência do PRP por avaliação dos aspectos histológicos, proliferação celular (PCNA) e expressão de matriz metaloproteinas em úlcera corneal, bem como estudar comparativamente ao tratamento com plasma pobre em plaquetas (PPP).
MATERIAL E MÉTODOS
Foram utilizadas 45 fêmeas da espécie leporina (Oryctolagus cuniculus) pertencentes ao grupo genético Botucatu, com idade variando entre 300 e 400 dias e peso entre 3,5 e 4,5kg, saudáveis e sem alterações oculares, selecionadas após exames clínicos e oftalmológicos.
Os procedimentos experimentais desenvolvidos seguiram as normas daAssociation for Research in Vision and Ophthalmology (ARVO) e foram submetidos à Câmara de Ética em Experimentação Animal da Faculdade de Medicina Veterinária e Zootecnia - UNESP - Campus de Botucatu, sendo aprovados pela Comissão de Ética em Experimentação Animal (CEUA), sob o protocolo número 48/2011-CEUA.
Os animais foram anestesiados com quetamina (Ketamin(r), Cristália) (20mg/kg) associada à xilazina (Anasedan(r), Vetbrands) (1mg/kg) e à morfina (Dimorf(r), Cristália) (0,5mg/kg), todas por via intramuscular (IM). A anestesia tópica ocular foi realizada por meio do colírio de cloridrato de proximetacaína 0,5% (Anestalcon(r), Alcon).
Para obtenção dos colírios de PRP e PPP, foi utilizado o protocolo descrito por Donatti et al. (2013DONATTI, C.; BRANDÃO, C.V.S.; RANZANI, J.J.T. et al. Uso do plasma rico em plaquetas no reparo de úlceras de córnea profundas induzidas em coelhos. Avaliação clínica e histomorfométrica. Arq. Bras. Med. Vet. Zootec., v.65, p.809-818, 2013.), baseado na obtenção do sangue via artéria central da orelha e duas etapas de centrifugação a 22˚C. Os colírios foram acondicionados na temperatura de 4°C, durante sete dias. O incremento plaquetário foi analisado utilizando-se contagem em câmara de Newbauer (Donatti et al.,2013DONATTI, C.; BRANDÃO, C.V.S.; RANZANI, J.J.T. et al. Uso do plasma rico em plaquetas no reparo de úlceras de córnea profundas induzidas em coelhos. Avaliação clínica e histomorfométrica. Arq. Bras. Med. Vet. Zootec., v.65, p.809-818, 2013.).
A seguir, os animais foram submetidos ao procedimento cirúrgico unilateral, realizado com auxílio de microscópio cirúrgico, após antissepsia com solução de polivinilpirrolidona 1:50 e colocação de panos fenestrados oftálmicos estéreis.
Para a indução experimental da úlcera de córnea, realizou-se incisão cirúrgica circular na região corneal central, com auxílio de trépano a vácuo (Hessburg-Barron Vacuum Trephine, JEDMED) de 6 milímetros de diâmetro e com profundidade de 0,25 milímetros, seguido da delaminação da mesma, utilizando-se bisturi crescente angulado (Bisturi crescente angulado, Alcon).
Os animais foram distribuídos, aleatoriamente, em três grupos experimentais (n=15), designados Grupo Plasma Rico em Plaquetas (GR), Grupo Plasma Pobre em Plaquetas (GP) e Grupo Controle (GC). No pós-cirúrgico imediato e após 24 horas, foi administrado o anti-inflamatório meloxicam (Movatec(r), Boehringer Ingelheim) (0,2mg/kg) IM, e morfina (2mg/kg) IM, visando maximizar o conforto pós-operatório.
No GR e GP, os coelhos foram tratados com colírio autólogo de PRP e PPP, respectivamente; no GC foi instilado colírio substituto da lágrima (Lacribell, Latinofarma); todos os colírios foram instilados cinco vezes ao dia, durante sete dias.
Cada grupo foi dividido em três subgrupos (n=5), de acordo com os períodos finais de avaliação, ou seja, M4 (4 dias), M7 (7 dias) e M30 (30 dias) de pós-operatório. No final do período de avaliação, os animais foram eutanasiados, por meio de anestesia com acepromazina (Acepran(r), Univet) (1,5mg/kg) e quetamina (20mg/kg), ambas IM, seguida pela administração intravenosa de tiopental (Thiopentax(r), Cristália) (25mg/kg) e de cloreto de potássio 19,1% (Cloreto de potássio 19,1%, Halexlstar) (2mL/kg), sendo então realizada a enucleação.
Os bulbos oculares foram fixados em formaldeído 10% (Formol, Rioquímica), durante 48 horas e, a seguir, as córneas foram fixadas em solução de álcool 70% (Rialcool 70, Rioquímica) e submetidas ao processamento histológico de rotina com inclusão em parafina, cortadas por microtomia (4µm) e coradas pelo método de hematoxilina/eosina (HE) (Corantes Merck). A análise descritiva do material foi feita em microscópio de luz. As lâminas foram numeradas de 1 a 45 e avaliadas por um patologista veterinário sem o conhecimento do tratamento.
O número de camadas de células epiteliais da região central e da borda da úlcera foi contado. A região da úlcera foi fotografada e a espessura estromal, medida em três pontos da região central da mesma, obtendo-se a média das três mensurações; para tal procedimento, foi utilizado o software de captura de imagens Opton(r) acoplado ao microscópio Nikon E-200(r).
A presença de neoformação vascular também foi avaliada e os vasos presentes no estroma, quantificados em escores, sendo (0) ausente, (1) 1 a 3 vasos, (2) 4 a 6 vasos, (3) 7 ou mais. Infiltrado inflamatório, necrose tecidual e edema corneal foram avaliados e qualiquantificados em: (0) ausente; (1) leve; (2) moderado e (3) intenso. A extensão interna da úlcera foi classificada de acordo com a reepitelização corneal, sendo classificadas em (0) reepitelização total da região ulcerada, (1) reepitelização de 3/4 a 1/2, (2) reepitelização inferior a 1/2 até 1/4 e (3) reepitelização inferior a 1/4 da úlcera.
Para a imuno-histoquímica, utilizaram-se cortes histológicos de 3µm de espessura, em lâminas carregadas (lâminas carregadas, Amitel) tratadas com solução adesiva (Vectabond(r), Vector Laboratories). Estas foram colocadas em estufa a 60°C por 72 horas. Posteriormente, as amostras foram desparafinizadas, reidratadas e submetidas à imunomarcação para PCNA, MMP-1, MMP-2, MMP-9, MMP-14 e TIMP-1 (Anticorpos policlonal, goat IgG, Santa Cruz) por meio do kit de detecção baseado na tecnologia de polímeros (Novolink Polymer DS).
As lâminas imunomarcadas foram analisadas no microscópio biológico Olympus BX53(r), com câmera digital com 17MP(RGB), software MPC para captura de imagens e medidas básicas. Para a avaliação quantitativa foram capturadas 5 imagens da borda da lesão e 5 imagens do centro da úlcera, no aumento de 40x, que foram analisadas no programa AvSoft-Bioview. A quantificação da marcação imuno-histoquímica foi realizada em todas as imagens, mensurada empixels quadrados (unidade de área, fornecida pelo programa AvSoft-Bioview), obtendo-se a média de cada região (borda e centro da úlcera). A análise qualitativa foi feita ao microscópio de luz, identificando a localização das MMPs e do TIMP no epitélio e/ou estroma corneal.
Para a análise estatística da espessura estromal, foi utilizada a técnica de análise de variância para o modelo com dois fatores complementada com o teste de comparações múltiplas de Tukey. Para os demais resultados obtidos, utilizou-se a técnica da análise de variância não paramétrica para o modelo com dois fatores complementada com o teste de Dunn (Zar, 2009ZAR, J.H. Biostatiscal analysis. 5.ed. New Jersey: Prentice Hall, 2009.).
RESULTADOS E DISCUSSÃO
Estudos clínicos com o uso de PRP em úlceras refratárias ao tratamento convencional em humanos demonstraram a redução do tempo de cicatrização (Alió et al., 2012ALIÓ, J.L.; ARNALICH-MONTIEL, F.; RODRIGUEZ, A.E. The role of "eye platelet rich plasma" (E-Prp) for wound healing in ophthalmology. Curr. Pharm. Biotechnol., v.13, p.1257-1265, 2012.). Entretanto, na oftalmologia veterinária, poucos estudos clínicos e imuno-histoquímicos são encontrados utilizando o PRP, assim como o seu mecanismo de ação no epitélio e estroma durante a reparação corneal ainda é pouco esclarecido.
Para a obtenção do PRP em coelhos, utilizou-se protocolo com duas centrifugações refrigeradas, como descrito por Donatti et al. (2013DONATTI, C.; BRANDÃO, C.V.S.; RANZANI, J.J.T. et al. Uso do plasma rico em plaquetas no reparo de úlceras de córnea profundas induzidas em coelhos. Avaliação clínica e histomorfométrica. Arq. Bras. Med. Vet. Zootec., v.65, p.809-818, 2013.) e diferente de Alió et al. (2012ALIÓ, J.L.; ARNALICH-MONTIEL, F.; RODRIGUEZ, A.E. The role of "eye platelet rich plasma" (E-Prp) for wound healing in ophthalmology. Curr. Pharm. Biotechnol., v.13, p.1257-1265, 2012.), que utilizam apenas uma centrifugação, em humanos. A contagem de plaquetas no sangue total variou de 262.600 a 462.075 plaquetas/μL, com média de 359.223 plaquetas/μL. No PRP, o número de plaquetas por microlitro variou de 1.212.000 a 2.525.000, média de 1.952.330. O incremento plaquetário obtido variou de 4,06 a 7,68 vezes, com média de 5,5 vezes, atingindo a concentração necessária para a resposta celular adequada ao PRP, que, segundo Marx (2004MARX, R.E. Platelet-rich plasma: evidence to support its use. J. Oral Maxillofac. Surg., v.62, p.489-496, 2004.), inicia-se quando há aumento no número basal de plaquetas de quatro a cinco vezes. Entretanto, Alióet al. (2012) referem boa resposta terapêutica com aumento na concentração de plaquetas de 1,6 a 2,5; assim como Kim et al. (2012KIM, K.M.; SHIN, Y.T.; KIM, H.K. Effect of autologous platelet rich plasma on persistent corneal epithelial defect after infectious keratitis. Jpn. J. Ophthalmol., v.56, p.544-550, 2012.), com incremento plaquetário de apenas 1,5 vezes.
Em defeitos estromais profundos, além do edema corneal, ocorre infiltração de neutrófilos e linfócitos provenientes do filme lacrimal, e posteriormente vascularização (Gilger et al., 2007GILGER, B.C.; BENTLEY, E.; OLLIVIER, F.J. Diseases and surgery of the canine cornea and sclera. In: GELATT, K.N. Veterinary ophthalmology. 4.ed. Iowa: Blackwell Publishing, 2007. chap.15, p.690-752.), como pôde ser verificado na maioria os animais do presente estudo. Também foi observada necrose em áreas do estroma de alguns animais, entretanto não foram verificadas diferenças estatísticas quanto ao edema e necrose da córnea entre os tratamentos. Já o infiltrado inflamatório foi maior nos animais tratados com PPP do que no GC após 30 dias da indução da úlcera de córnea. Segundo Gan et al. (1999GAN, L.; FAGERHOLM, P.; KIM, H.J. Effect of leukocytes on corneal cellular proliferation and wound healing. Invest. Ophth.. Vis. Sci., v.40, p.575-581, 1999.), a presença de leucócitos na fase inicial do processo de reparação pode favorecer a proliferação celular, diminuindo o tempo de cicatrização da úlcera. Entretanto, no GP observou-se aumento de leucócitos em relação ao GC no processo final da cicatrização, o que pode denotar retardo na cicatrização frente aos demais tratamentos, porém a reparação corneal não foi comprometida, como verificado na análise estatística do tamanho da úlcera.
No último momento de avaliação, os animais tratados com colírio de plasma rico em plaquetas apresentaram mais vascularização estromal do que os animais que receberam apenas colírio lubrificante. Provavelmente essa diferença ocorreu pelo efeito dos fatores de crescimento presentes no PRP, dentre eles o fator de crescimento do endotélio vascular (VEGF) (Wang e Avila, 2007WANG, H.; AVILA, G. Platelet rich plasma: myth or reality? Eur. J. Dent., v.1, p.192-194, 2007.), que é o principal mediador do processo de vascularização, favorecendo a cicatrização da córnea (Sun et al., 2013SUN, Y.; SU, L.; ZHONGXIAO, W. et al. H-RN, a peptide derived from hepatocyte growth factor, inhibits corneal neovascularization by inducing endotelial apoptosis and arresting the cell cycle. Cell Biol., v.14, p.1-10, 2013.).
No último momento de avaliação, os animais do GR apresentaram maior quantidade de células epiteliais na borda da úlcera do que o GP, evidenciando o efeito dos fatores de crescimento presentes nas plaquetas que são liberados logo após a sua ativação e agem de forma imediata e prolongada, promovendo efeito duradouro da sua ação (Alió et al., 2012ALIÓ, J.L.; ARNALICH-MONTIEL, F.; RODRIGUEZ, A.E. The role of "eye platelet rich plasma" (E-Prp) for wound healing in ophthalmology. Curr. Pharm. Biotechnol., v.13, p.1257-1265, 2012.). No PRP são descritos o fator de crescimento derivado de plaquetas (PDGF), dois fatores de crescimento transformador-β (TGFβ1 e TGFβ2), VEGF, fator de crescimento epidermal (EGF), fator de crescimento semelhante à insulina (IGF) (Wang e Avila, 2007WANG, H.; AVILA, G. Platelet rich plasma: myth or reality? Eur. J. Dent., v.1, p.192-194, 2007.), fator de crescimento dos fibroblastos (FGF) (Floryan e Berghoff, 2004FLORYAN, K.M.; BERGHOFF, W.J. Intraoperative use of autologous platelet-rich and platelet-poor plasma for orthopedic surgery pacients. AORN J., v.80, p.667-674, 2004.) e fator plaquetário 4 (PF-4) (Alió et al., 2007ALIÓ, J.L.; ABAD, M.; ARTOLA, A. et al. Use of autologous platelet-rich plasma in treatment of dormant corneal ulcers. Ophthalmology, v.114, p.1286-1293, 2007.), que são fundamentais no processo de cicatrização corneal (Reinach e Pokorny, 2008REINACH, P.S.; POKORNY, K.S. The corneal epithelium: clinical relevance of cytokine-mediated responses to maintenance of corneal health. Arq. Bras. Oftalmol., v.71, p.80-88, 2008.). A ação imediata desses fatores pôde ser observada no centro da lesão dos animais do GR, em que se verificou maior expressão de PCNA no M4 do que nos demais momentos. O PCNA é uma proteína expressa durante a mitose celular (Milleret al., 2010MILLER, A.; CHEN, J.; TAKASUKA, T.E. et al. Proliferating cell nuclear antigen (pcna) is required for cell-cycle regulated silent chromatin on replicated and nonreplicated genes. J. Biol. Chem., v.285, p.35142-35154, 2010.), sendo um valioso marcador de proliferação celular em córneas humanas e de animais (Gan et al., 1999GAN, L.; FAGERHOLM, P.; KIM, H.J. Effect of leukocytes on corneal cellular proliferation and wound healing. Invest. Ophth.. Vis. Sci., v.40, p.575-581, 1999.).
Os animais do GC obtiveram maior número de células na borda da lesão no M7 do que no M30, sendo estes semelhantes ao primeiro dia de avaliação (M4). O número de células epiteliais no centro da úlcera foi semelhante nos diferentes grupos, assim como a extensão da úlcera. Embora o GR tenha apresentado melhor proliferação celular na borda do que o GP, considerando os momentos, a migração celular em direção ao centro da lesão foi similar entre os grupos, já que tanto a extensão quanto a profundidade da úlcera, assim como a reepitelização central, não diferiram entre os diferentes tratamentos. A média da espessura estromal entre os grupos e momentos variou de 200,14μm a 411,03μ, porém sem diferenças significativas.
A MMP1 foi a matriz metaloproteinase que apresentou os maiores índices de marcação imuno-histoquímica (Fig. 1), tendo a sua presença apenas no estroma dos animais do GP, ao passo que, nos demais grupos, pôde ser observada tanto no epitélio quanto no estroma, indicando que o tratamento com PPP provavelmente inibiu a sua ação no epitélio, já que substâncias como citocinas e fatores de crescimento presentes no plasma (Alióet al., 2012ALIÓ, J.L.; ARNALICH-MONTIEL, F.; RODRIGUEZ, A.E. The role of "eye platelet rich plasma" (E-Prp) for wound healing in ophthalmology. Curr. Pharm. Biotechnol., v.13, p.1257-1265, 2012.) podem induzir ou inibir a produção de MMPs (Sivak e Fini, 2002SIVAK, J.M.; FINI, M.E. MMPs in the eye: emerging roles for matrix metalloproteinases in ocular physiology. Prog. Retin. Eye Res., v.21, p.1-14, 2002.).
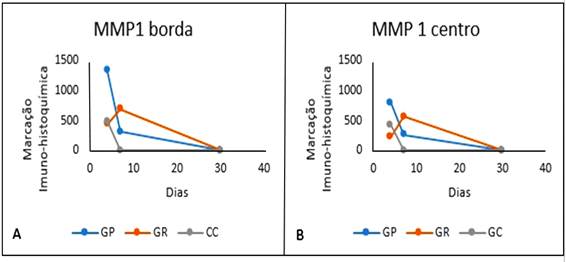
Gráfico representando as medianas da marcação imuno-histoquímica para MMP1 (em pixels²) na borda (A) e no centro (B) da úlcera de córnea de coelhos no GP (Grupo Plasma Pobre em Plaquetas), GR (Grupo Plasma Rico em Plaquetas) e GC (Grupo Controle) de acordo com o momento de avaliação (em dias).
No M4, os animais tratados com plasma pobre em plaquetas apresentaram maior expressão de MMP1 na borda da lesão do que os do GR e GC, ao passo que, após 30 dias, os animais do GR tiveram mais marcação para MMP1, na borda e no centro, do que os do GP, sendo similares ao GC. O tratamento com PPP proporcionou maior expressão de MMP1 no M4 em relação ao M30, enquanto no GC a quantidade dessa enzima foi maior no M4 do que no M7. Já o PRP foi o único tratamento capaz de proporcionar níveis de MMP1 similares durante todo o processo de cicatrização (Fig. 3).
Gráfico representando as medianas da marcação imuno-histoquímica para MMP2 (em pixels²) na borda (A) e no centro (B) da úlcera de córnea de coelhos no GP (Grupo Plasma Pobre em Plaquetas), GR (Grupo Plasma Rico em Plaquetas) e GC (Grupo Controle) de acordo com o momento de avaliação (em dias).
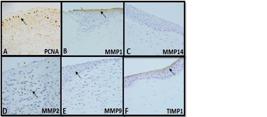
Fotomicrografia de cortes histológicos submetidos à imuno-histoquímica. Amostras positivas para marcação imuno-histoquímica são observadas, sob o microscópio de luz, com coloração marrom (setas). A) PCNA: região do centro da úlcera de córnea de coelho do Grupo Plasma Rico em Plaquetas (GR), após 4 dias do procedimento cirúrgico (M4). B) MMP1: região da borda da lesão de córnea de coelho do GR M4. C) MMP14 negativo: região da borda da úlcera de coelho do GR, após 7 dias de tratamento (M7). D) MMP2: região do centro da lesão de córnea de coelho do Grupo Plasma Pobre em Plaquetas (GP) (M7). E) MMP9: região da borda da lesão de córnea de coelho do GP M7. F) TIMP1: região da borda da úlcera de córnea de coelho do GP M4.
A MMP2 é umas das principais enzimas envolvidas na degradação e remodelação do colágeno estromal, estando presente tanto em córneas saudáveis como em ulceradas (Gilger et al., 2007GILGER, B.C.; BENTLEY, E.; OLLIVIER, F.J. Diseases and surgery of the canine cornea and sclera. In: GELATT, K.N. Veterinary ophthalmology. 4.ed. Iowa: Blackwell Publishing, 2007. chap.15, p.690-752.). No primeiro momento de avaliação, a marcação para MMP2 no centro da lesão foi significativamente maior nos grupos GP e GR do que no controle, indicando um efeito positivo do plasma rico e pobre em plaquetas na expressão de MMP2. No segundo momento, apenas o GP manteve altas quantidades significativas dessa enzima tanto na borda quanto no centro (Fig. 3), quando comparado ao GR, e na região central quando comparado ao GC. No centro da lesão, os animais tratados com PPP também apresentaram maior marcação no M7 do que no M30, enquanto o GR demonstrou maior marcação no M4 do que no M30 (Fig. 2). Os resultados obtidos indicam que tanto o PRP quanto o PPP promovem estímulo na produção e liberação de MMP2 nos primeiros dias da reparação corneal, acelerando a degradação do colágeno estromal danificado. Porém, com a evolução da cicatrização, os níveis de MMP2 diminuíram primeiro nas córneas que receberam o PRP, sugerindo que a fase de desbridamento da lesão foi mais rápida no GR do que no GP.
A MMP9 é tão importante quanto a MMP2 na reparação corneal, entretanto só pode ser visualizada em córneas ulceradas (Gilger et al., 2007GILGER, B.C.; BENTLEY, E.; OLLIVIER, F.J. Diseases and surgery of the canine cornea and sclera. In: GELATT, K.N. Veterinary ophthalmology. 4.ed. Iowa: Blackwell Publishing, 2007. chap.15, p.690-752.). Assim como Ollivier (2004OLLIVIER, F. Matrix metalloproteinase 2, matrix metalloproteinase 9, connective tissue growth factor in the equine tear fluid: possible implications in corneal wound healing 2004. 158f. Dissertação (PhD) - Universidade da Florida, Gainesville.) em equinos, também se observou a presença de MMP2 e 9 em toda a extensão da lesão, tanto no epitélio quanto no estroma corneal dos coelhos submetidos ao estudo.
A MMP9 é a primeira MMP a ser sintetizada e secretada por células epiteliais após lesão corneal, sendo detectado um rápido aumento logo após a lesão e declínio após poucas semanas (Sivak e Fini, 2002SIVAK, J.M.; FINI, M.E. MMPs in the eye: emerging roles for matrix metalloproteinases in ocular physiology. Prog. Retin. Eye Res., v.21, p.1-14, 2002.), como observado no presente estudo, em que, após 4 dias da indução da úlcera, todos os animais expressaram a MMP9, ao passo que, no M7, alguns não apresentaram marcação e, no M30, a maioria foi negativa para essa enzima. No GP esse padrão de expressão ficou bastante evidente, pois os animais do M4 e M7 apresentaram quantidades significativamente maiores de MMP9 do que os do M30 (Fig. 3). A expressão de MMP9 é associada à degradação da membrana basal e o seu desaparecimento coincide com a reabsorção da matriz provisória e com a restauração dos complexos de adesão (Matsubaraet al., 1991MATSUBARA, M.; GIRARD, M.T.; KUBLIN, C.L. et al. Differential roles for two gelatinolytic enzymes of the matrix metalloproteinase family in the remodeling cornea. Dev. Biol. v.147, p.425-439, 1991. ).
As metaloproteinases de matriz tipo membrana (MT-MMPs) estão associadas às membranas celulares e têm funções importantes na sinalização celular e proteólises pericelulares. A MT1-MMP (MMP14) é a melhor caracterizada e uma das responsáveis pela ativação da MMP2 (Fillmore et al., 2001FILLMORE, H.L.; VANMETER, T.E.; BROADDUS, W.C. Membrane-type matrix metalloproteinases (MT-MMPs): expression and function during glioma invasion. J. Neurooncol., v.53, p.187-202, 2001.). Ye et al. (2000YE, H.Q.; MAEDA, M.; YU, F.X.; AZAR, D.T. Differential expression of MT1-MMP (MMP-14) and collagenase III (MMP-13) genes in normal and wounded rat corneas. Invest. Ophthalmol. Vis. Sci., v.41, p.2894-2899, 2000.) relataram a presença de MMP14 em córneas saudáveis e em ulceradas de ratos, e Sakimotoet al. (2004SAKIMOTO, T.; SHOJI, J.; KANNO, H.; SAWA, M. Gelatinase expression in ocular surface disorders., Jpn. J. Ophthalmol. v.48, p.17-22, 2004.) observaram o seu aumento em córneas humanas ulceradas. Entretanto, no presente estudo com coelhos, a MMP14 não foi expressa na maioria dos animais (Fig. 3), não apresentando resultados significativos, independentemente do tratamento, indicando uma possível menor importância na cicatrização corneal e na ativação da MMP2 em coelhos.
Os inibidores teciduais de MMPs (TIMPs) estão presentes no meio extracelular e têm a capacidade de ligarem-se ao sítio ativo das MMPs, inativando-as (Brew et al., 2000BREW, K.; DINAKARPANDIAN, D.; NAGASE, H. Tissue inhibitors of metalloproteinases: evolution, structure and function. Biochim. Biophys. Acta, v.1477, p.267-283, 2000.). Além da função de inibir as MMPs, têm papel importante no crescimento celular, diferenciação e apoptose (Sivak e Fini, 2002SIVAK, J.M.; FINI, M.E. MMPs in the eye: emerging roles for matrix metalloproteinases in ocular physiology. Prog. Retin. Eye Res., v.21, p.1-14, 2002.), como foi observado nos animais de todos os grupos, em que o TIMP1 se apresentou na grande maioria dos cortes histológicos avaliados, localizando-se principalmente na superfície do epitélio (Fig. 3) e, em alguns animais com úlcera, também no estroma, comprovando a sua função na homeostase corneal, assim como sua importância no controle da atividade proteolítica das MMPs.
O GP apresentou maior expressão de TIMP-1 no M4 do que no M30. Esse aumento ocorreu pela necessidade do controle da atividade das MMPs 1, 2 e 9, que estavam em maior quantidade no primeiro momento de avaliação do que no último no GP, permitindo a reparação corneal sem que ocorresse a degradação excessiva do estroma corneal.
O PRP é o único produto disponível que contém altos níveis de diversos fatores de crescimento e vitaminas que favorecem a cicatrização corneal (Alió et al., 2007ALIÓ, J.L.; ABAD, M.; ARTOLA, A. et al. Use of autologous platelet-rich plasma in treatment of dormant corneal ulcers. Ophthalmology, v.114, p.1286-1293, 2007.). O uso do PRP, assim como do PPP, no tratamento de úlceras corneais, influenciou a expressão de metaloproteinases de matriz, quando comparado aos animais que receberam apenas colírio lubrificante. Essa diferença se deu possivelmente pela ação dos fatores de crescimento e proteínas bioativas do sangue encontradas no PPP e, em maior quantidade, no PRP (Alió et al., 2012ALIÓ, J.L.; ARNALICH-MONTIEL, F.; RODRIGUEZ, A.E. The role of "eye platelet rich plasma" (E-Prp) for wound healing in ophthalmology. Curr. Pharm. Biotechnol., v.13, p.1257-1265, 2012.). Sabe-se que as metaloproteinases de matriz são fundamentais no processo de reparação corneal; entretanto, um desequilíbrio na quantidade de MMPs produzidas e a sua inibição pode provocar úlceras persistentes (Ollivier et al., 2007OLLIVIER, F.J.; GILGER, B.C.; BARRIE, K.P. et al. Proteinases of the cornea and preocular tear film. Vet. Ophthalmol, v.10, p.199-206, 2007.). No presente estudo, não foram observadas diferenças significativas na extensão e profundidade da úlcera entre os grupos, não sendo possível estabelecer se essa alteração na expressão de MMPs provocada pelo tratamento com PPP e PRP foi benéfica ou prejudicial à cicatrização corneal. Sendo assim, mais estudos são necessários e devem ser estimulados para a compreensão da ação do PRP sobre as células epiteliais e estromais e constituintes da matriz extracelular durante o processo de reparação tecidual.
CONCLUSÕES
No período final de avaliação, o tratamento à base de colírio de plasma rico em plaquetas promove aumento na vascularização corneal e número de células epiteliais na região da borda da úlcera, em comparação aos tratamentos utilizando-se lubrificantes e plasma pobre em plaquetas, respectivamente. O PPP induz a maior infiltrado inflamatório do que a utilização de lubrificantes. O PRP estimula a proliferação celular na fase inicial do tratamento (4 dias) em comparação aos outros momentos de avaliação, diferentemente dos demais tratamentos. O uso de colírios de plasma rico e pobre em plaquetas influencia a expressão de metaloproteinases de matriz envolvidas no processo de reparação corneal, na maioria das vezes aumentando a sua expressão.
AGRADECIMENTOS
À FAPESP (Fundação de Amparo à Pesquisa e Ensino do Estado de São Paulo) pelo apoio financeiro (Processo n°2011/23107-0) e ao CNPq .
REFERÊNCIAS
- ALIÓ, J.L.; ABAD, M.; ARTOLA, A. et al. Use of autologous platelet-rich plasma in treatment of dormant corneal ulcers. Ophthalmology, v.114, p.1286-1293, 2007.
- ALIÓ, J.L.; ARNALICH-MONTIEL, F.; RODRIGUEZ, A.E. The role of "eye platelet rich plasma" (E-Prp) for wound healing in ophthalmology. Curr. Pharm. Biotechnol, v.13, p.1257-1265, 2012.
- BREW, K.; DINAKARPANDIAN, D.; NAGASE, H. Tissue inhibitors of metalloproteinases: evolution, structure and function. Biochim. Biophys. Acta, v.1477, p.267-283, 2000.
- DONATTI, C.; BRANDÃO, C.V.S.; RANZANI, J.J.T. et al. Uso do plasma rico em plaquetas no reparo de úlceras de córnea profundas induzidas em coelhos. Avaliação clínica e histomorfométrica. Arq. Bras. Med. Vet. Zootec., v.65, p.809-818, 2013.
- FILLMORE, H.L.; VANMETER, T.E.; BROADDUS, W.C. Membrane-type matrix metalloproteinases (MT-MMPs): expression and function during glioma invasion. J. Neurooncol., v.53, p.187-202, 2001.
- FLORYAN, K.M.; BERGHOFF, W.J. Intraoperative use of autologous platelet-rich and platelet-poor plasma for orthopedic surgery pacients. AORN J., v.80, p.667-674, 2004.
- GAN, L.; FAGERHOLM, P.; KIM, H.J. Effect of leukocytes on corneal cellular proliferation and wound healing. Invest. Ophth.. Vis. Sci., v.40, p.575-581, 1999.
- GEREMICCA, W.; FONTE, C.; VECCHIO, S. Blood components for topical use in tissue regeneration: evaluation of corneal lesions treated with platelet lysate and considerations on repair mechanisms. Blood Transfus., v.8, p.107-112, 2010.
- GILGER, B.C.; BENTLEY, E.; OLLIVIER, F.J. Diseases and surgery of the canine cornea and sclera. In: GELATT, K.N. Veterinary ophthalmology. 4.ed. Iowa: Blackwell Publishing, 2007. chap.15, p.690-752.
- KIM, K.M.; SHIN, Y.T.; KIM, H.K. Effect of autologous platelet rich plasma on persistent corneal epithelial defect after infectious keratitis. Jpn. J. Ophthalmol., v.56, p.544-550, 2012.
- LIU, L.; HARTWIG, D.; HARLOFF, S. et al. Corneal epitheliotrophic capacity of three different blood-derived preparations. Invest. Ophth. Vis. Sci., v.47, p.2438-2444, 2006.
- MARX, R.E. Platelet-rich plasma: evidence to support its use. J. Oral Maxillofac. Surg., v.62, p.489-496, 2004.
- MATSUBARA, M.; GIRARD, M.T.; KUBLIN, C.L. et al. Differential roles for two gelatinolytic enzymes of the matrix metalloproteinase family in the remodeling cornea. Dev. Biol. v.147, p.425-439, 1991.
- MILLER, A.; CHEN, J.; TAKASUKA, T.E. et al. Proliferating cell nuclear antigen (pcna) is required for cell-cycle regulated silent chromatin on replicated and nonreplicated genes. J. Biol. Chem., v.285, p.35142-35154, 2010.
- OLLIVIER, F. Matrix metalloproteinase 2, matrix metalloproteinase 9, connective tissue growth factor in the equine tear fluid: possible implications in corneal wound healing 2004. 158f. Dissertação (PhD) - Universidade da Florida, Gainesville.
- OLLIVIER, F.J.; GILGER, B.C.; BARRIE, K.P. et al. Proteinases of the cornea and preocular tear film. Vet. Ophthalmol, v.10, p.199-206, 2007.
- REINACH, P.S.; POKORNY, K.S. The corneal epithelium: clinical relevance of cytokine-mediated responses to maintenance of corneal health. Arq. Bras. Oftalmol., v.71, p.80-88, 2008.
- SAKIMOTO, T.; SHOJI, J.; KANNO, H.; SAWA, M. Gelatinase expression in ocular surface disorders., Jpn. J. Ophthalmol. v.48, p.17-22, 2004.
- SIVAK, J.M.; FINI, M.E. MMPs in the eye: emerging roles for matrix metalloproteinases in ocular physiology. Prog. Retin. Eye Res., v.21, p.1-14, 2002.
- SUN, Y.; SU, L.; ZHONGXIAO, W. et al. H-RN, a peptide derived from hepatocyte growth factor, inhibits corneal neovascularization by inducing endotelial apoptosis and arresting the cell cycle. Cell Biol., v.14, p.1-10, 2013.
- WANG, H.; AVILA, G. Platelet rich plasma: myth or reality? Eur. J. Dent., v.1, p.192-194, 2007.
- YE, H.Q.; MAEDA, M.; YU, F.X.; AZAR, D.T. Differential expression of MT1-MMP (MMP-14) and collagenase III (MMP-13) genes in normal and wounded rat corneas. Invest. Ophthalmol. Vis. Sci., v.41, p.2894-2899, 2000.
- ZAR, J.H. Biostatiscal analysis. 5.ed. New Jersey: Prentice Hall, 2009.
Datas de Publicação
-
Publicação nesta coleção
Nov-Dec 2015
Histórico
-
Recebido
06 Fev 2015 -
Aceito
18 Jun 2015