Resumos
Foram estudadas 42 amostras de fígado de camundongos inoculados com cercárias do Schistosoma mansoni, obtidas 40, 60, 80 e 120 dias após a infecção e processadas rotineiramente. As lâminas obtidas foram coradas pela HE para análise qualitativa e morfométrica do número e área dos granulomas e pelo MGP para quantificação de células apoptóticas. Os animais com 40 dias de inoculação possuíam menos granulomas/lâmina (<img src="http:/img/fbpe/abmvz/v52n6/a06img01.gif" alt="a06img01.gif (532 bytes)" align="absmiddle" > ou = 11,78±4,01), com áreas pequenas (<img src="http:/img/fbpe/abmvz/v52n6/a06img01.gif" alt="a06img01.gif (532 bytes)" align="absmiddle" > ou = 52.713,88±5.244,34<FONT FACE="Symbol">m</font>m²) e as menores médias de apoptose (<img src="http:/img/fbpe/abmvz/v52n6/a06img01.gif" alt="a06img01.gif (532 bytes)" align="absmiddle" > ou = 7,50±0.99). Os animais com 60 dias de inoculação tiveram os maiores granulomas (<img src="http:/img/fbpe/abmvz/v52n6/a06img01.gif" alt="a06img01.gif (532 bytes)" align="absmiddle" > ou = 114.851,20±5.517,20mim²), em maior número (<img src="http:/img/fbpe/abmvz/v52n6/a06img01.gif" alt="a06img01.gif (532 bytes)" align="absmiddle" > ou = 92,88±10,62) e freqüente apoptose (<img src="http:/img/fbpe/abmvz/v52n6/a06img01.gif" alt="a06img01.gif (532 bytes)" align="absmiddle" > ou = 18,73±1,35). Os com 80 dias de inoculação apresentaram diminuição no tamanho dos granulomas (<img src="http:/img/fbpe/abmvz/v52n6/a06img01.gif" alt="a06img01.gif (532 bytes)" align="absmiddle" > ou = 89.305,57±6.162,79mim²), mas grande quantidade deles (<img src="http:/img/fbpe/abmvz/v52n6/a06img01.gif" alt="a06img01.gif (532 bytes)" align="absmiddle" > ou = 131,09±15,60) e freqüência maior de apoptose (<img src="http:/img/fbpe/abmvz/v52n6/a06img01.gif" alt="a06img01.gif (532 bytes)" align="absmiddle" > ou = 19,93±1,49). Com 120 dias, a apoptose continuou freqüente (<img src="http:/img/fbpe/abmvz/v52n6/a06img01.gif" alt="a06img01.gif (532 bytes)" align="absmiddle" > ou = 19,84±1,88), os granulomas eram mais numerosos (<img src="http:/img/fbpe/abmvz/v52n6/a06img01.gif" alt="a06img01.gif (532 bytes)" align="absmiddle" > ou = 231,20±34,57), porém menores (<img src="http:/img/fbpe/abmvz/v52n6/a06img01.gif" alt="a06img01.gif (532 bytes)" align="absmiddle" > ou = 41.556,58±2.043,60mim²). A ocorrência de apoptose ajuda a explicar a redução na celularidade e a conseqüente diminuição da área dos granulomas. A apoptose foi confirmada histologicamente pela técnica de "tunel". Assim, a apoptose participa da modulação do fenômeno inflamatório do tipo granulomatoso, reacional à embolização de ovos do parasito no fígado. Com a evolução da doença, desenvolve-se uma tolerância imunológica aos antígenos do ovo do Schistosoma mansoni, evidenciada morfologicamente pela diminuição da área média dos granulomas e pela maior freqüência de apoptose nas células componentes do granuloma.
Schistosoma mansoni; apoptose; morte celular programada; modulação da inflamação; granuloma
Forty two samples of liver, obtained from mice inoculated with Schistosoma mansoni cercariae, were studied morphometrically. Samples were collected from mice at 40, 60, 80 and 120 days after inoculation and processed according to routine procedures. Four m m sections were stained by hematoxiline-eosine for microscopic evaluation, and morphometry of number and area of granulomas, and by MGP for apoptotic cells quantification, considering the age of inoculation. Forty days after inoculation the animals presented less granulomas (<img src="http:/img/fbpe/abmvz/v52n6/a06img02.gif" alt="a06img02.gif (533 bytes)" align="absmiddle" > or = 11.78 ± 4.01), less apoptosis (<img src="http:/img/fbpe/abmvz/v52n6/a06img02.gif" alt="a06img02.gif (533 bytes)" align="absmiddle" > or = 7.50 ± 0.99) and smaller granulomas (<img src="http:/img/fbpe/abmvz/v52n6/a06img02.gif" alt="a06img02.gif (533 bytes)" align="absmiddle" > or = 52,713.88 ± 5,244.34mum²). At 60 days of inoculation they presented the largest granulomas (<img src="http:/img/fbpe/abmvz/v52n6/a06img02.gif" alt="a06img02.gif (533 bytes)" align="absmiddle" > or = 114,851.20 ± 5,517.20mum²), increased numbers of granulomas (<img src="http:/img/fbpe/abmvz/v52n6/a06img02.gif" alt="a06img02.gif (533 bytes)" align="absmiddle" > or = 92.88 ± 10.62) and of apoptosis (<img src="http:/img/fbpe/abmvz/v52n6/a06img02.gif" alt="a06img02.gif (533 bytes)" align="absmiddle" > or = 18.73 ± 1.35). After 80 days of inoculation the number of granulomas had increased (<img src="http:/img/fbpe/abmvz/v52n6/a06img02.gif" alt="a06img02.gif (533 bytes)" align="absmiddle" > or = 131.09 ± 15.60), presenting smaller area (<img src="http:/img/fbpe/abmvz/v52n6/a06img02.gif" alt="a06img02.gif (533 bytes)" align="absmiddle" > or = 89,305.57 ± 6,162.79mum²) and increased apoptosis (<img src="http:/img/fbpe/abmvz/v52n6/a06img02.gif" alt="a06img02.gif (533 bytes)" align="absmiddle" > or = 19.93 ±1.49). Mice at 120 days after inoculation showed the greatest quantity of granulomas (<img src="http:/img/fbpe/abmvz/v52n6/a06img02.gif" alt="a06img02.gif (533 bytes)" align="absmiddle" > or = 231.20 ± 34.57), almost the same frequency of apoptosis (<img src="http:/img/fbpe/abmvz/v52n6/a06img02.gif" alt="a06img02.gif (533 bytes)" align="absmiddle" > or = 19.84 ± 1.88), but with the smallest areas (<img src="http:/img/fbpe/abmvz/v52n6/a06img02.gif" alt="a06img02.gif (533 bytes)" align="absmiddle" > or = 41,556.58 ± 2,043.60mum²). Apoptosis was confirmed by TUNEL technique. The occurrence of apoptosis helps to explain the decrease in both cellularity and area of granulomas. It was concluded that apoptosis participates in the modulation of the granulomatous inflammatory process in Schistosomiasis as a reaction to embolization and deposition of eggs of the parasite in liver. As Schistosomiasis progresses, some immunological tolerance to Schistosoma mansoni egg antigens develops, which is detected morphologically and morphometrically by decrease in the area of the granulomas and by increase in the occurrence of apoptosis in granuloma cells.
Schistosomiasis; apoptosis; programmed cell death; modulation of inflammation; granuloma
Schistosoma mansoni
[Apoptosis in the modulation of the inflammatory response to the eggs of Schistosoma mansoni]
A.R. Tristão, A.L. Melo, A.C. Vasconcelos**Autor para correspondência E-mail: anilton@mono.icb.ufmg.br, F.M. Grossi
Instituto de Ciências Biológicas da UFMG
Caixa Postal 486
31270-010 Belo Horizonte, MG
Recebido para publicação, após modificação, em 7 de julho de 2000.
RESUMO
Foram estudadas 42 amostras de fígado de camundongos inoculados com cercárias do Schistosoma mansoni, obtidas 40, 60, 80 e 120 dias após a infecção e processadas rotineiramente. As lâminas obtidas foram coradas pela HE para análise qualitativa e morfométrica do número e área dos granulomas e pelo MGP para quantificação de células apoptóticas. Os animais com 40 dias de inoculação possuíam menos granulomas/lâmina ( =11,78±4,01), com áreas pequenas (
=11,78±4,01), com áreas pequenas ( =52.713,88±5.244,34mm2) e as menores médias de apoptose (
=52.713,88±5.244,34mm2) e as menores médias de apoptose ( =7,50±0.99). Os animais com 60 dias de inoculação tiveram os maiores granulomas (
=7,50±0.99). Os animais com 60 dias de inoculação tiveram os maiores granulomas ( =114.851,20±5.517,20mm2), em maior número (
=114.851,20±5.517,20mm2), em maior número ( =92,88±10,62) e freqüente apoptose (
=92,88±10,62) e freqüente apoptose ( =18,73±1,35). Os com 80 dias de inoculação apresentaram diminuição no tamanho dos granulomas (
=18,73±1,35). Os com 80 dias de inoculação apresentaram diminuição no tamanho dos granulomas ( =89.305,57±6.162,79mm2), mas grande quantidade deles (
=89.305,57±6.162,79mm2), mas grande quantidade deles ( =131,09±15,60) e freqüência maior de apoptose (
=131,09±15,60) e freqüência maior de apoptose ( =19,93±1,49). Com 120 dias, a apoptose continuou freqüente (
=19,93±1,49). Com 120 dias, a apoptose continuou freqüente ( =19,84±1,88), os granulomas eram mais numerosos (
=19,84±1,88), os granulomas eram mais numerosos ( =231,20±34,57), porém menores (
=231,20±34,57), porém menores ( =41.556,58±2.043,60mm2). A ocorrência de apoptose ajuda a explicar a redução na celularidade e a conseqüente diminuição da área dos granulomas. A apoptose foi confirmada histologicamente pela técnica de "tunel". Assim, a apoptose participa da modulação do fenômeno inflamatório do tipo granulomatoso, reacional à embolização de ovos do parasito no fígado. Com a evolução da doença, desenvolve-se uma tolerância imunológica aos antígenos do ovo do Schistosoma mansoni, evidenciada morfologicamente pela diminuição da área média dos granulomas e pela maior freqüência de apoptose nas células componentes do granuloma.
=41.556,58±2.043,60mm2). A ocorrência de apoptose ajuda a explicar a redução na celularidade e a conseqüente diminuição da área dos granulomas. A apoptose foi confirmada histologicamente pela técnica de "tunel". Assim, a apoptose participa da modulação do fenômeno inflamatório do tipo granulomatoso, reacional à embolização de ovos do parasito no fígado. Com a evolução da doença, desenvolve-se uma tolerância imunológica aos antígenos do ovo do Schistosoma mansoni, evidenciada morfologicamente pela diminuição da área média dos granulomas e pela maior freqüência de apoptose nas células componentes do granuloma.
Palavras-chave: Schistosoma mansoni, apoptose, morte celular programada, modulação da inflamação, granuloma
ABSTRACT
Forty two samples of liver, obtained from mice inoculated with Schistosoma mansoni cercariae, were studied morphometrically. Samples were collected from mice at 40, 60, 80 and 120 days after inoculation and processed according to routine procedures. Four m m sections were stained by hematoxiline-eosine for microscopic evaluation, and morphometry of number and area of granulomas, and by MGP for apoptotic cells quantification, considering the age of inoculation. Forty days after inoculation the animals presented less granulomas (
= 11.78 ± 4.01), less apoptosis (= 7.50 ± 0.99) and smaller granulomas (= 52,713.88 ± 5,244.34mm2). At 60 days of inoculation they presented the largest granulomas (= 114,851.20 ± 5,517.20mm2), increased numbers of granulomas (= 92.88 ± 10.62) and of apoptosis (= 18.73 ± 1.35). After 80 days of inoculation the number of granulomas had increased (= 131.09 ± 15.60), presenting smaller area (= 89,305.57 ± 6,162.79mm2) and increased apoptosis (= 19.93 ±1.49). Mice at 120 days after inoculation showed the greatest quantity of granulomas (= 231.20 ± 34.57), almost the same frequency of apoptosis (= 19.84 ± 1.88), but with the smallest areas (= 41,556.58 ± 2,043.60mm2). Apoptosis was confirmed by TUNEL technique. The occurrence of apoptosis helps to explain the decrease in both cellularity and area of granulomas. It was concluded that apoptosis participates in the modulation of the granulomatous inflammatory process in Schistosomiasis as a reaction to embolization and deposition of eggs of the parasite in liver. As Schistosomiasis progresses, some immunological tolerance to Schistosoma mansoni egg antigens develops, which is detected morphologically and morphometrically by decrease in the area of the granulomas and by increase in the occurrence of apoptosis in granuloma cells.Keywords: Schistosomiasis, apoptosis, programmed cell death, modulation of inflammation, granuloma
INTRODUÇÃO
A esquistossomose mansônica é uma parasitose cujas lesões mais significativas estão associadas à reação inflamatória granulomatosa que se forma em torno dos ovos depositados pelas fêmeas do Schistosoma mansoni nas veias mesentéricas do hospedeiro (Colley, 1981). Os ovos chegam até a luz do intestino e são eliminados nas fezes para dar continuidade ao ciclo. No entanto, parte dos ovos não alcança o exterior e são conduzidos embolicamente até outros órgãos, como fígado e pulmões (Boros, 1989). Nesses órgãos, ocorre uma reação de hipersensibilidade tardia do tipo granulomatosa, que tem por função proteger o hospedeiro de produtos tóxicos liberados pelo ovo e destruir ou isolar o antígeno (Goes et al., 1994). Na fase inicial da esquistossomose mansônica, logo após a produção dos ovos, os granulomas são volumosos, não modulados. Com o passar do tempo e a cronicidade da infecção, ainda que a ovoposição persista e o número de ovos e/ou granulomas aumente, há uma redução gradual da reatividade celular e do tamanho dos granulomas (Rezende et al., 1995a). Ocorre mudança no padrão de produção de linfocinas de TH1 (formação de granulomas maiores) para TH2, com redução gradual do tamanho da reação granulomatosa que se forma em torno dos ovos (Pearce et al., 1991; Stadecker & Flores-Villanueva, 1994; Rezende et al., 1995b, 1995c; Wynn & Cheever, 1995; Brunet et al., 1998).
Este trabalho tem como objetivo averiguar se a apoptose, definida como morte celular programada, está envolvida na diminuição da resposta celular aos antígenos de ovo do Schistosoma mansoni e no decréscimo da celularidade nos granulomas. Adicionalmente, procura-se verificar se a ocorrência de apoptose nas células inflamatórias aumenta ao longo do tempo, de maneira a explicar a menor reatividade celular (imunotolerância?), já observada em pacientes esquistossomóticos crônicos (Stadecker, 1992).
MATERIAL E MÉTODOS
Foram estudadas 42 amostras de fígados colhidos de camundongos BALB/c inoculados experimentalmente com cercárias do Schistosoma mansoni. Nove fragmentos do fígado obtidos com 40, 17 com 60, 11 com 80 e 5 com 120 dias de inoculação foram processados rotineiramente (Luna, 1968), blocados em parafina e cortados a 4mm. As lâminas foram coradas pela hematoxilina-eosina (HE) e por uma coloração específica para ácidos nucléicos - methyl green pyronin (MGP) (McElroy, 1992), visando facilitar a identificação da cromatina condensada das células em apoptose e de corpos apoptóticos. Em seguida, foram examinadas ao microscópio óptico, quantificando-se o número de granulomas por lâmina. Na avaliação morfométrica determinou-se, em HE, a área média dos granulomas. Em MGP, quantificou-se o número médio de células em apoptose de cinco granulomas de cada lâmina, com objetiva de 40´.
Para a confirmação da ocorrência de apoptose, uma amostragem (3 lâminas dos grupos de 80 e 120 dias) foi corada pela técnica descrita por Gavrieli et al. (1992), denominada "tunel", que identifica in situ a fragmentação do genoma característica das células em apoptose. Para tal, foi utilizado um kit comercial (apoptag- peroxidase /oncor) que identifica a apoptose baseado na incorporação de nucleotídeos marcados nos sítios de fragmentação do genoma pela ação da enzima deoxinucleotidil transferase terminal. Posteriormente, a inserção dos nucleotídeos é revelada pela reação da peroxidase com a diaminobenzidina.
A contagem das células em apoptose e a obtenção da área média dos granulomas foram feitas aleatoriamente em cinco granulomas de cada lâmina. Para que os granulomas a serem estudados tivessem sempre o plano de secção mais mediano possível, optou-se por aqueles que mostrassem o ovo do parasito na região central. Utilizou-se um analisador de imagens digitalizadas (KS300 versão 2.0; Kontron Elektronik). As imagens foram geradas por um microscópio (Zeiss Axiolab; Zeiss. Germany) com câmera (JVC/ TK- 1270 Color Video Camera; Germany) conectada a um computador por meio de placa digitalizadora (MiroMOVIE PRO, Germany) durante todo o processo. Quantificou-se o total de células apoptóticas por granuloma/ lâmina, analisadas com aumento de 400C. Além disso, delinearam-se os limites externos do granuloma, obtendo-se a área de cinco granulomas de cada lâmina.
As variáveis estudadas foram: contagem do número de granulomas por lâmina (granulomas/lâmina), área média dos granulomas (área de granulomas) e contagem do número de células apoptóticas no granuloma (apoptose). Os dados obtidos foram submetidos à estatística descritiva e à análise de variância (ANOVA- fator único), com verificação de significância a 5%, no programa Microsoft Excel 97.
RESULTADOS E DISCUSSÃO
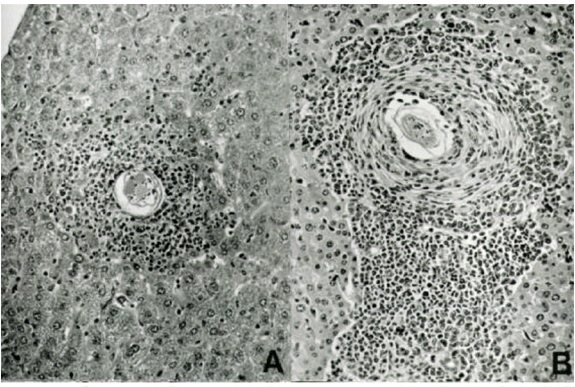
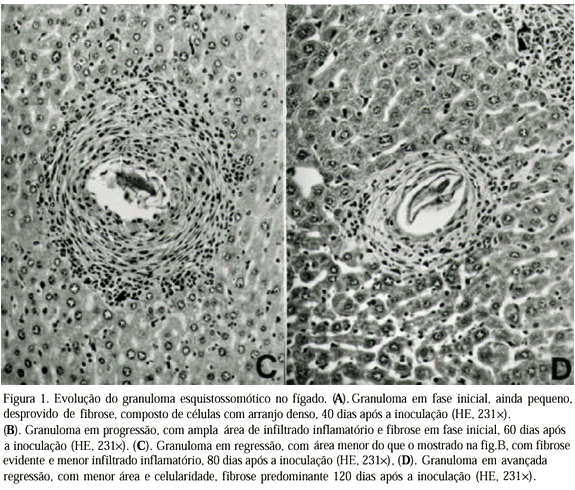
Os granulomas esquistossomóticos aos 40 e 60 dias após a inoculação consistiam de massas densas de células inflamatórias (inicialmente polimorfonucleares e mononucleares, posteriormente com predomínio de mononucleares), dispostas concentricamente em torno do ovo do Schistosoma mansoni (Fig. 1A), sustentadas por uma delgada camada de tecido conjuntivo (Fig. 1B). À medida que a infecção se tornava crônica (80 e 120 dias após a inoculação), a quantidade de mononucleares diminuía enquanto a fibrose aumentava (Fig. 1C e 1D). Esses aspectos morfológicos são clássicos e estão em concordância com os relatos de vários autores (Colley, 1981; Boros, 1989; Stadecker, 1992).
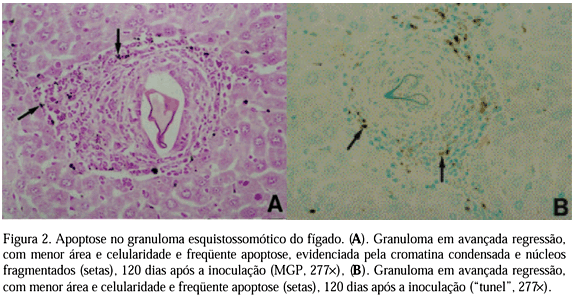
Os resultados mostram que a apoptose ocorreu nas células do granuloma esquistossomótico do fígado. Segundo a Fig. 2, granulomas aos 120 dias após a inoculação mostram regressão avançada, com área e celularidade menores e freqüente apoptose, evidenciada pela condensação da cromatina e fragmentação do núcleo, identificada pela coloração MGP (Fig. 2A) e pela de "tunel" (Fig. 2B).
A técnica MGP, apesar de menos precisa que a técnica de "tunel" para detecção de apoptose (Gavrieli et al., 1992), mostrou padrão de coloração similar. A técnica de "tunel" confirmou a ocorrência de morte celular programada nos granulomas esquistossomóticos.
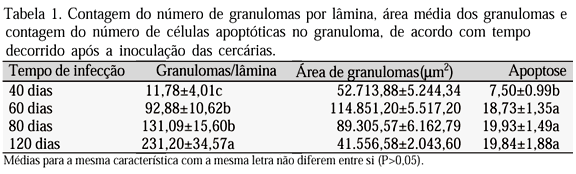
Os resultados da análise morfométrica estão sumariados na Tab. 1. Os animais com 40 dias de inoculação mostraram menor número de granulomas/lâmina, com áreas bem reduzidas e as menores médias de apoptose. Os animais com 60 dias de inoculação apresentaram os maiores granulomas, grande número por lâmina e freqüente apoptose. Os com 80 dias de inoculação apresentaram diminuição no tamanho dos granulomas, mas grande quantidade deles e freqüência maior de apoptose. Com 120 dias, a apoptose continuou freqüente, os granulomas eram mais numerosos, porém de menor tamanho. Os resultados com 120 dias de inoculação representaram o maior número e a menor área média de granulomas, quando comparados com os resultados de 60 (P<0,0001) e de 80 dias (P<0,0038).
A análise de variância revelou diferenças significativas com relação ao número de granulomas por lâmina entre os diferentes tempos de duração da infecção. Os animais com 40 dias de inoculação apresentaram o menor número de granulomas no fígado. Os com 60 e 80 dias mostraram valores intermediários e os de 120 dias apresentaram o maior número. Para a contagem de células em apoptose, a análise estatística revelou diferenças significativas entre os animais com 60, 80 e 120 dias (com os maiores valores) e os de 40 dias de inoculação (com os menores). Na análise da área dos granulomas, os animais com 60 e 80 dias de inoculação apresentaram a maior área, enquanto os animais com 40 e 120 dias tiveram o menor valor médio.
Assim, o número de granulomas e a freqüência de apoptose são menores na fase inicial da infecção (aos 40 dias) e aumentam significativamente com a evolução temporal da doença. Enquanto isso, a área do granuloma, inicialmente pequena aos 40 dias, atinge o seu pico aos 60 dias, começa a diminuir aos 80 dias (ainda que sem diferença estatística com os de 60 dias) e depois atinge o menor valor aos 120 dias.
Esses resultados indicam que a apoptose participa na modulação da reação inflamatória do tipo granulomatoso que se forma devido à presença dos antígenos do ovo do Schistosoma mansoni nos tecidos. Isso confirma resultados anteriores, obtidos com a técnica de granuloma in vitro, utilizando-se mononucleares periféricos isolados de pacientes crônicos (Rezende et al., 1995a,b,c).
Portanto, além dos mecanismos de recrutamento de novas células inflamatórias, que são mobilizadas pela liberação de citocinas e outros mediadores inflamatórios (Pearce et al., 1991; Goes et al., 1994; Stadecker & Flores-Villanueva, 1994; Rezende et al., 1995b, c; Wynn & Cheever, 1995; Brunet et al., 1998), a evolução do granuloma também depende da duração das células que o compõem (Liles, 1997; Winoto, 1997). Algumas citocinas presentes na reação inflamatória participam na indução de apoptose nas células do granuloma (Rezende et al., 1995b, c; Wynn & Cheever, 1995; Winoto, 1997).
AGRADECIMENTOS
À FAPEMIG (Fundação de Amparo à Pesquisa do Estado de Minas Gerais) (Ref. CBS 1216/95), pelo apoio financeiro, essencial no desenvolvimento deste trabalho. Ao CNPq, pelas bolsas de iniciação científica concedidas a dois dos autores. Ao colega Santiago Oliva, pelo apoio.
REFERÊNCIAS BIBLIOGRÁFICAS
BOROS, D.L. Immunopathology of
Schistosoma mansoni infection.
Clin. Microbiol. Rev., v.2, p.250, 1989.
BRUNET, L.R., DUNNE, D.W., PEARCE, E.J. Cytokine interaction and immune responses during Schistosoma mansoni infection. Parasitol. Today, v.14, p.422-427, 1998.
COLLEY, D.G. Immune responses and immunoregulation in experimental and clinical schistosomiasis. In: MANSFIELD, J.M. Parasitologic diseases., New York: Marcel Decker, 1981, v.1, p.1-83.
GAVRIELI, Y., SHERMAN, Y., BEN-SASSON, S.A. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. J. Cell Biol., v.119, p.493-501, 1992.
GOES, A.M., REZENDE, S.A., GAZZINELLI, G. et al. Granulomatous hypersensitivity to Schistosoma mansoni egg antigens in human schistosomiasis. IV. A role for prostaglandin induced inhibition of in vitro granuloma formation. Parasite Immunol., v.16, p.11-18, 1994.
LILES, W.C. Apoptosis - role in infection and inflammation. Curr. Opin. Infect. Dis., v.10, p.165-170, 1997.
LUNA, L.G. Manual of histologic staining methods of the Armed Forces Institute of Pathology. 3.ed. New York: McGraw-Hill, 1968. 258p.
McELROY, D.A. Methyl green-pyronin method for DNA and RNA. In: PROPHET, E.B., MILLS, B., ARRINGTON, J.B. et al. Laboratory methods in histotechnology. Washington: American Registry of Pathology, 1992. p.143-144.
PEARCE, E.J., CASPAR, P., GRZYCH, J. et al. Downregulation of Th1 cytokine production accompanies induction of Th2 responses by a parasitic helminth, Schistosoma mansoni. J. Exp. Med., v.173, p.159-166, 1991.
REZENDE, S.A., VASCONCELOS, A.C., GOES, A.M. Apoptose na supressão da reatividade celular ao Schistosoma mansoni por imunocomplexos. In: ENCONTRO NACIONAL DE PATOLOGIA VETERINÁRIA, 7, 1995, Belo Horizonte. Anais... Belo Horizonte: Escola de Veterinária da UFMG, 1995a. p.128.
REZENDE, S.A., VASCONCELOS, A.C., GOES, A.M. Role of lymphokines and apoptosis on in vitro granuloma modulation induced by immune complexes in human Schistosomiasis mansoni. In: SIMPÓSIO INTERNACIONAL DE ESQUISTOSSOMOSE - REUNIÃO NACIONAL DE ESQUISTOSSOMOSE. 1995, Salvador, Resumos... Salvador. s.d., 1995b.
REZENDE, S.A., SILVA-TEIXEIRA, D.N., NASCIMENTO, E. et al. Esquistossomose mansoni humana: Efeito de imunocomplexos na regulação da reatividade celular aos antígenos do Schistosoma mansoni. Participação de linfocinas e de mecanismos de apoptose. In: CONGRESSO DA SOCIEDADE BRASILEIRA DE IMUNOLOGIA, 20, Angra dos Reis. Resumos... Angra dos Reis: SBI, 1995a. Resumo 48.
STADECKER, M.J. The role of T-cell anergy in the immunomodulation of schistosomiasis. Parasitol. Today, v.8, p.199-204, 1992.
STADECKER, M.J., FLORES-VILLANUEVA, P.O. Accessory cell signals regulate Th-cell responses: from basic immunology to a model of helminthic disease. Immunol. Today, v.15, p.571-574, 1994.
WINOTO, A. Cell death in the regulation of immune responses. Curr. Opin. Immunol., v.9, p.365-370, 1997.
WYNN, A.T., CHEEVER, A.W. Cytokine regulation of granuloma formation in schistosomiasis. Curr. Opin. Immunol., v.7, p.505-511, 1995.
- BOROS, D.L. Immunopathology of Schistosoma mansoni infection. Clin. Microbiol. Rev., v.2, p.250, 1989.
- BRUNET, L.R., DUNNE, D.W., PEARCE, E.J. Cytokine interaction and immune responses during Schistosoma mansoni infection. Parasitol. Today, v.14, p.422-427, 1998.
- COLLEY, D.G. Immune responses and immunoregulation in experimental and clinical schistosomiasis. In: MANSFIELD, J.M. Parasitologic diseases., New York: Marcel Decker, 1981, v.1, p.1-83.
- GAVRIELI, Y., SHERMAN, Y., BEN-SASSON, S.A. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. J. Cell Biol., v.119, p.493-501, 1992.
- GOES, A.M., REZENDE, S.A., GAZZINELLI, G. et al. Granulomatous hypersensitivity to Schistosoma mansoni egg antigens in human schistosomiasis. IV. A role for prostaglandin induced inhibition of in vitro granuloma formation. Parasite Immunol., v.16, p.11-18, 1994.
- LILES, W.C. Apoptosis - role in infection and inflammation. Curr. Opin. Infect. Dis., v.10, p.165-170, 1997.
- LUNA, L.G. Manual of histologic staining methods of the Armed Forces Institute of Pathology 3.ed. New York: McGraw-Hill, 1968. 258p.
- McELROY, D.A. Methyl green-pyronin method for DNA and RNA. In: PROPHET, E.B., MILLS, B., ARRINGTON, J.B. et al. Laboratory methods in histotechnology. Washington: American Registry of Pathology, 1992. p.143-144.
- PEARCE, E.J., CASPAR, P., GRZYCH, J. et al. Downregulation of Th1 cytokine production accompanies induction of Th2 responses by a parasitic helminth, Schistosoma mansoni J. Exp. Med., v.173, p.159-166, 1991.
- REZENDE, S.A., VASCONCELOS, A.C., GOES, A.M. Apoptose na supressăo da reatividade celular ao Schistosoma mansoni por imunocomplexos. In: ENCONTRO NACIONAL DE PATOLOGIA VETERINÁRIA, 7, 1995, Belo Horizonte. Anais.. Belo Horizonte: Escola de Veterinária da UFMG, 1995a. p.128.
- REZENDE, S.A., VASCONCELOS, A.C., GOES, A.M. Role of lymphokines and apoptosis on in vitro granuloma modulation induced by immune complexes in human Schistosomiasis mansoni. In: SIMPÓSIO INTERNACIONAL DE ESQUISTOSSOMOSE - REUNIĂO NACIONAL DE ESQUISTOSSOMOSE. 1995, Salvador, Resumos... Salvador. s.d., 1995b.
- REZENDE, S.A., SILVA-TEIXEIRA, D.N., NASCIMENTO, E. et al. Esquistossomose mansoni humana: Efeito de imunocomplexos na regulaçăo da reatividade celular aos antígenos do Schistosoma mansoni Participaçăo de linfocinas e de mecanismos de apoptose. In: CONGRESSO DA SOCIEDADE BRASILEIRA DE IMUNOLOGIA, 20, Angra dos Reis. Resumos.. Angra dos Reis: SBI, 1995a. Resumo 48.
- STADECKER, M.J. The role of T-cell anergy in the immunomodulation of schistosomiasis. Parasitol. Today, v.8, p.199-204, 1992.
- STADECKER, M.J., FLORES-VILLANUEVA, P.O. Accessory cell signals regulate Th-cell responses: from basic immunology to a model of helminthic disease. Immunol. Today, v.15, p.571-574, 1994.
- WINOTO, A. Cell death in the regulation of immune responses. Curr. Opin. Immunol., v.9, p.365-370, 1997.
- WYNN, A.T., CHEEVER, A.W. Cytokine regulation of granuloma formation in schistosomiasis. Curr. Opin. Immunol., v.7, p.505-511, 1995.
Datas de Publicação
-
Publicação nesta coleção
08 Fev 2001 -
Data do Fascículo
Dez 2000
Histórico
-
Recebido
07 Jul 2000