Resumos
Com este trabalho objetivou-se avaliar o processo de cicatrização do tendão em coelhos, utilizando-se no grupo tratamento o filme de quitosana, por meio de uma análise clínico-cirúrgica e histológica. Foram utilizados 12 coelhos adultos, separados em grupo controle (GC) e grupo tratamento (GT), nos quais se realizou uma secção parcial do tendão gastrocnêmio de ambos os membros pélvicos. A avaliação clínica baseou-se na presença de reação inflamatória, infecção, dor e deiscência da sutura. Para a avaliação histológica, foi realizado um estudo comparativo do processo cicatricial por meio do tipo de células, da quantidade de tecido conjuntivo e da organização das fibras colágenas entre os grupos e os momentos. Nas feridas cirúrgicas, não foram observadas secreção, dor ou deiscência. Na histologia comparativa entre os grupos, o GC apresentou melhor processo cicatricial em relação ao GT, aos 60 dias. Aos 90 dias, no GT a cicatrização já esboça recuperação do tendão, com reorganização da celularidade e das fibras colágenas no tecido conjuntivo denso modelado. Concluiu-se que a quitosana estimula rápido crescimento celular, mas de forma desorganizada, e que a cicatrização completa só ocorre após 90 dias da sua implantação no tecido.
coelho; biomaterial; cicatrização; cirurgia
This work aimed to evaluate the process of tendon healing in rabbits, using the treatment group in chitosan film through a clinical, surgical and histological analysis. In the experiment, 12 adult rabbits were used, divided into control group (CG) and treatment group (TG), which were held in the partial section of the gastrocnemius tendon of both limbs. Clinical assessment was based on the presence of inflammation, infection, pain and suture dehiscence. For histological evaluation a comparative study of the healing process through the cell type, amount of connective tissue and collagen fiber organization was performed between groups and times. In surgical wounds no secretion, pain or dehiscence were observed. In the comparative histology between groups, the CG showed better healing compared to TG, at 60 days. On day 90 the TG already outlines tendon recovery with reorganization of cellularity and collagen fibers in the dense connective tissue modeled. It was concluded that chitosan stimulates faster cell growth, but it is haphazardly, and that complete healing occurs after 90 days of their implantation in tissue.
rabbit; biomaterial; healing; surgery
INTRODUÇÃO
Os biomateriais são definidos como aqueles materiais não vivos utilizados na área médica ou biomédica, objetivando a interação com o sistema biológico. Muitos deles são alternativas efetivas para a substituição de tecidos, inclusive do tecido ósseo, pois não representam riscos de transmissão de doenças ou rejeição imunológica, além de apresentarem disponibilidade ilimitada (Spin-Neto et al., 2008SPIN-NETO, R.; PAVONE, C.; FREITAS, R.M. et al. Biomateriais à base de quitosana com aplicação médica e odontológica: revisão de literatura. Rev. Odontol. UNESP, v.37, p.155-161, 2008.).
A quitosana é um polímero natural derivado do processo de desacetilação da quitina, que é assumido como o segundo polissacarídeo mais abundante da natureza, atrás apenas da celulose (Assis et al., 2007ASSIS, O.B.G.; LEONI, A.M.; NOVAES, A.P. Avaliação do efeito cicatrizante da quitosana por aplicação tópica em ratos. São Carlos: Embrapa Instrumentação Agropecuária, v.29, p.16, 2007.). Pode ser extraída da carapaça dos crustáceos, do exoesqueleto de insetos e até mesmo da parede celular dos fungos (Khan e Peh, 2003KHAN, T.A.; PEH, K.K. A preliminary investigation of chitosan film as dressing for punch biopsy wounds in rats. J. Pharmacy & Pharmaceutical Sci., v.6, p.20-26, 2003.). As carapaças de crustáceos são resíduos abundantes e rejeitados pela indústria pesqueira, que em muitos casos as consideram poluentes. Sua utilização reduz o impacto ambiental causado pelo acúmulo nos locais onde é gerado ou estocado (Goosen, 1996).
Recentemente, muita atenção tem sido dada à quitina, à quitosana e aos seus oligômeros como materiais bioativos naturais, devido a sua atoxicidade, biocompatibilidade e biodegradabilidade. Esses materiais têm importantes propriedades estruturais e funcionais que os tornam atrativos para uma grande variedade de aplicações em muitos campos, tais como alimentos e nutrição, biomedicina, biotecnologia, agricultura, veterinária e proteção ambiental. Entre os biomateriais citados, a quitosana é muito discutida em relação às aplicações biomédicas e de alimentos (Laranjeira e Fávere, 2009LARANJEIRA, M.C.M.; FÁVERE, V.T. Quitosana: biopolímero funcional com potencial industrial biomédico. Quím. Nova, v.32, p.672-678, 2009.).
Em um estudo que avaliou fosfato de cálcio, quitosana e medula óssea em reparação óssea em coelhos, na avaliação histológica, aos 30 dias de pós-operatório, na interface osso-implante que recebeu a quitosana, foram observados endósteo e periósteo irregulares com reação celular intensa, muitos osteoblastos e osteoclastos ativos, grande quantidade de fibroblastos e tecido conjuntivo, intensa neoformação vascular, tecido ósseo imaturo em volta de todo o implante com cicatrização avançada da lesão e presença de células mesenquimais em processo de diferenciação. Além disso, na avaliação morfométrica, concluiu-se que a quitosana associada à medula óssea foi superior no processo de cicatrização óssea (Azevedo et al., 2013AZEVEDO, A.S; SÁ, M.J.C; FOOK, M.V.L. et al. Hidroxiapatita e quitosana isoladas e associadas à medula óssea no reparo do tecido ósseo em coelhos. Estudo histológico e morfométrico. Cienc. Rural, v.43, p.1265-1270, 2013.).
A lesão tendínea geralmente é causada por traumatismo, por tenotomia cirúrgica ou devido a condições clínicas que comprometem o colágeno (por exemplo, síndrome de Cushing iatrogênica ou espontânea) (Nikollaou, 1987NIKOLLAOU, P.K. Biomechanical and histological evaluation of muscle after controlled strain injury. Am. J. Sports Med., v.15, p.14-19, 1987.). No tratamento de feridas traumáticas envolvendo tendões, é importante minimizar o comprometimento de estruturas adjacentes, pois o tendão é relativamente avascular e depende delas para sua reparação (Clark, 1993CLARK, D.M. Tendon injury and repair. In: BOJRAB, M.J. Disease mechanisms in small animal surgery. 2.ed. Philadelphia: Lea e Febiger, cap.142., 1993. p.1079-1082.). Nos primeiros 21 dias após sutura, recomenda-se associar imobilização externa, pois sua estrutura com fibras orientadas em sentido longitudinal não sustenta adequadamente os pontos de síntese (Raiser, 2001RAISER, A.G. Reparação do tendão calcâneo em cães. Cienc. Rural, v.31, p.351-359, 2001.).
Raiser (2001)RAISER, A.G. Reparação do tendão calcâneo em cães. Cienc. Rural, v.31, p.351-359, 2001. verificou que, aos 22 dias, implantes homógenos ortotópicos estão envolvidos por densa proliferação conjuntiva, que confere estabilidade à sustentação do apoio, e, aos 44 dias, não requerem restrição de exercício. Nesse período, o enxerto já está em fase de substituição e envolvido por uma cápsula conjuntiva proliferante bem desenvolvida. Em 1980, Vaughan recomendou o uso de fibra de carbono, fixada com ácido poliglicólico, para substituir perdas tendíneas e relatou como complicação a formação de sinus pelas fibras de carbono. Moore e colaboradores (2010)MOORE, T.; ANDERSON, B.; SEILER, J.G. Flexor Tendon Reconstruction. J. Hand Surg, v.35, p.1025-1030, 2010. avaliaram a reconstrução do tendão flexor e concluíram que a engenharia de tecidos pode criar vários métodos para reparo tendíneo.
A constante preocupação em tentar minimizar os danos decorrentes das injúrias tendíneas tem levado ao desenvolvimento de inúmeras pesquisas com o intuito de encontrar um material adequado à cicatrização tendínea, com resistência suficiente, sem alterar seu comprimento e a fim de manter a capacidade de deslizamento, principalmente em situações em que há perda de substância, com consequente não união das extremidades tendíneas. A ruptura do tendão calcâneo, que figura como uma das mais frequentes injúrias tendíneas observadas no cão, geralmente apresenta esse tipo de problema (Costa Neto, 1999COSTA NETO, J.M.; DALECK, C.R.; ALESSI, A.C. Tenoplastia experimental do calcâneo em cães com peritônio bovino conservado em glicerina. Cienc. Rural, v.29, p.697-703, 1999.).
Interações celulares de quitosana com os tecidos dos mamíferos têm sido positivas na reparação tecidual e no ponto de vista de regeneração. Uma das mais promissoras características da quitosana é a sua excelente capacidade para ser processada em estruturas porosas para utilização no transplante de células e regeneração de tecidos (Khor e Lim, 2003KHOR, E; LIM, L.Y. Implantable applications of chitin and chitosan, Biomaterials, v.24, p.2339-2349, 2003.). Dessa forma, com o intuito de encontrar um melhor substituto para reparar danos tendíneos, objetivou-se avaliar o processo de cicatrização do tendão calcâneo utilizando-se a quitosana, em dois momentos, 60 e 90 dias, por meio de análises clínico-cirúrgica e histológica.
MATERIAL E MÉTODOS
O experimento foi realizado no Hospital Veterinário (HV) do Centro de Saúde e Tecnologia Rural (CSTR) da Universidade Federal de Campina Grande (UFCG), em Patos, Paraíba, e foi aprovado pelo Comitê de Ética em Pesquisa desta instituição (CEP - Protocolo Nº 16/2012).
Foram utilizados 12 coelhos jovens, seis machos e seis fêmeas, da raça Nova Zelândia, pesando 3,0±2,35kg (média±desvio-padrão), provenientes da Fazenda Experimental do Campus de Bananeiras da Universidade Federal da Paraíba, situado no município de Bananeiras, PB. Os animais foram trazidos ao local do experimento sete dias antes do início deste e, ao chegarem, foram vermifugados com albendazol 10% (20mg/kg, VO) (Albendazole 10% - Labovet - Feira de Santana, BA). Durante o experimento, os coelhos foram alocados em gaiolas individuais, alimentados com ração comercial para coelhos duas vezes ao dia e água à vontade.
Foram formados, ao acaso, dois grupos de seis animais cada: controle (GC) e tratamento (GT). No grupo controle, o membro operado foi o pélvico direito, enquanto no grupo tratamento operou-se o membro pélvico esquerdo, implantando-se o filme de quitosana no tendão calcâneo, após secção parcial deste. Em cada grupo, três animais foram eutanasiados aos 60 dias, e os outros três aos 90 dias após a cirurgia.
Os filmes de quitosana foram confeccionados pela equipe do Prof. Dr. Marcos Vinícius Lia Fook, no Departamento de Engenharia de Materiais do Programa de Pós-Graduação da UFCG, Campus de Campina Grande.
Para a obtenção dos filmes de quitosana, foram utilizados béquer de 500mL, agitador magnético, funil de buchner, kitassato, bomba de vácuo e estufa de secagem de materiais. Quitosana na forma de pó, com grau de desacetilação 98,15%, foi adquirida da empresa Polymar Indústria, Comércio, Importação e Exportação Ltda. Ácido acético P.A., hidróxido de sódio P.A. e ácido sulfúrico P.A. foram adquiridos da empresa Vetec Química Fina Ltda. A água destilada foi obtida no Laboratório de Materiais, da Unidade Acadêmica de Engenharia de Materiais/UFCG.
Os filmes de quitosana foram preparados pelo método de evaporação de solvente, por meio da dissolução do polímero em uma solução de ácido acético (2% v/v), para uma concentração final da solução polimérica 1% (m/v), sob agitação magnética, por um período de 24 horas. Em seguida, filtração a vácuo foi aplicada para remoção de substâncias insolúveis. Após a filtração, a solução foi vertida em placas de Petri com diâmetro de 11cm, com um volume final de 30mL de solução em cada placa. As placas de Petri foram colocadas em estufa, com uma temperatura constante de 50°C, por um período de 24 horas, para evaporação completa do solvente. Uma solução de hidróxido de sódio 1mol/L foi adicionada aos filmes, ainda dentro das placas, por um período de duas horas, para completa remoção de resíduos ácidos. Após a reação alcalina, os filmes foram imersos em água destilada (dois litros por membrana) para eliminação do excesso de base. Após um período de 48 horas imersos em água destilada, os filmes foram submetidos a estiramento e secagem em moldes cerâmicos circulares, em uma temperatura controlada de 25ºC, por 24 horas. Após esse procedimento, os filmes foram esterilizados pelo método de autoclavagem (Fidéles, 2010FIDÉLES, T.B. Filmes Reticulados de Quitosana para Aplicação como Biomaterial. 2010. 92f. Dissertação (Mestrado em Ciência e Engenharia de Materiais) - Universidade Federal de Campina Grande. ).
No pré-operatório realizou-se a tricotomia de ambos os membros pélvicos, desde a articulação femorotibial até a articulação metatarsofalangeana. Após a tricotomia, os animais foram anestesiados com propofol 1% (Propovan 1% - Cristália Produtos Químicos Farmacêuticos Ltda. - São Paulo, SP), na dose de 3mg/kg, via intravenosa (IV), e, ato contínuo, realizou-se a anestesia epidural lombossacra com articaína 4% (2 mg/kg) (Articaína HCI 4% com epinefrina 1:100.000 - Dental ABS - São Paulo, SP).
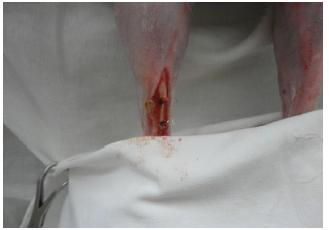
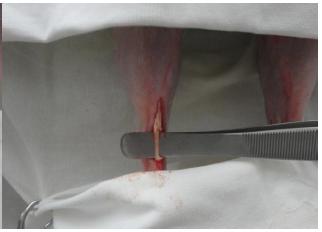
O animal foi colocado em decúbito esternoabdominal, com os membros pélvicos pendidos fora da mesa cirúrgica. Após a antissepsia da área operatória com clorexidina 0,5% (Riohex 0,5% - Rioquímica Indústria Farmacêutica Ltda. - São José do Rio Preto, SP) e colocação dos panos de campo, foi realizada a incisão cutânea na face caudal do terço distal da região tibial, divulsão do tecido subcutâneo e acesso ao tendão calcâneo. Após o isolamento do tendão, este foi seccionado parcialmente, longitudinal e transversalmente, e removeu-se um fragmento de 1,4cm. No grupo controle apenas foi removido o fragmento tendíneo (Fig. 1). No grupo tratamento, após a remoção do fragmento tendíneo, a lesão foi envolvida com um filme de quitosana de 2cm de comprimento, fixado com fio náilon 4-0 em pontos simples separados (Fig. 2). Em seguida, realizou-se a redução do espaço morto subcutâneo com fio vycril 3-0 e dermorrafia com pontos simples separados e fio náilon 3-0.
Foi administrada, pela via subcutânea, enrofloxacina (Floxiclin 10% - Biofarma Química e Farmacêutica Ltda. - Jaboticabal, SP), na dose de 10mg/kg uma vez ao dia, durante sete dias de pós-operatório (PO), e meloxicam (Maxicam injetável 2% - Ouro Fino Saúde Animal Ltda. - Cravinhos, SP), na dose de 0,2mg/kg no primeiro dia de PO e 0,1mg/kg nos quatro dias subsequentes.
Durante os primeiros 10 dias de PO, as feridas cirúrgicas foram avaliadas clinicamente, quando se observaram presença de reação inflamatória, infecção, dor e deiscência da sutura.
Após o período de observação destinado aos grupos (60 e 90 dias após a cirurgia), os animais foram anestesiados com propofol 1% (Propofol 10mg/mL - Cristália), e, em seguida, eutanasiados com administração de cloreto de potássio 19,1% (Solução de cloreto de potássio 19,1% - Isofarma), quando tiveram parada cardiorrespiratória. Após eutanásia, realizou-se tricotomia da região tibial distal de cada membro, dissecou-se e removeu-se o tendão calcâneo desde a musculatura até a junção osteotendínea. Para o estudo histológico dos fragmentos, as peças foram fixadas em solução de formol tamponado a 10%, durante 10 dias, após o que se realizaram a clivagem e o processamento histotécnico rotineiro. Posteriormente, incluiu-se o material em parafina para a confecção de lâminas histológicas, que foram coradas pela hematoxilina e eosina para avaliação. As principais alterações avaliadas foram quanto à morfologia das células formadas no local da tenotomia, sua semelhança às células do tecido normal, bem como a disposição das fibras colágenas e da quantidade da matriz tendínea neoformada.
RESULTADOS E DISCUSSÃO
Quando o efeito da anestesia epidural cessou , os animais deambularam normalmente, sem claudicação, provavelmente devido à rapidez do procedimento e ao mínimo trauma aos tecidos adjacentes, apesar de ambos os membros pélvicos terem sido operados. Esses achados estão de acordo com os relatados por Azevedo et al. (2012)AZEVEDO, A.S; SÁ, M.J.C; NETO, P.I.N. et al. Avaliação de diferentes proporções de fosfato de cálcio na regeneração do tecido ósseo de coelhos: estudo clínicocirúrgico, radiológico e histológico. Braz. J. Vet. Res. Anim. Sci., v.49, p.12-18, 2012. e Filgueira (2012)FILGUEIRA, F.G.F. Hidroxiapatita associada à quitosana na reparação óssea - revisão de literatura e estudo experimental em coelhos. 2012. 69f. Dissertação. (Mestrado em Medicina Veterinária) Universidade Federal de Campina. .
Na avaliação clínica realizada, diariamente, durante os 10 primeiros dias de PO, observou-se que nenhum animal, de ambos os grupos, apresentou claudicação ou outro sinal clínico de alteração na deambulação. Não foram observadas deiscências das feridas ou outra manifestação indicativa de reações locais, como fístulas ou secreções patológicas, com exceção de dois animais do grupo tratamento, que apresentaram um aumento de volume acentuado na ferida cirúrgica, do sexto ao 13º dias de PO. A análise histológica das feridas destes dois animais não revelou achados diferentes dos demais. Segundo Senel e Mcclure (2004)SENEL, S.; MCCLURE, S.J. Potential applications of chitosan in veterinary medicine. Adv. Drug Deliv. Reviews, v.56, p.1467-1480, 2004., a quitosana atua como agente cicatrizante, antimicrobiano, hemostático e analgésico. Se durante o procedimento cirúrgico desses animais tivesse ocorrido alguma contaminação, a quitosana poderia ter auxiliado no controle da infecção, já que estimula a liberação de macrófagos, tendo ação antimicrobiana. Entretanto, aparentemente, ocorreu apenas uma inflamação exacerbada.
Segundo Junqueira e Carneiro (2004)JUNQUEIRA, L.C.; CARNEIRO, J. Tecido conjuntivo. In: Histologia básica. 10.ed. Rio de Janeiro: Guanabara Koogan, 2004., o tecido conjuntivo é responsivo às injúrias causadas, com sinais inflamatórios de calor, rubor, edema e dor, sinais estes que se apresentam devido à reação imunológica de hiperemia. Células migram para a região de forma a tentar reparar os danos causados, produzindo um maior aporte sanguíneo localizado. Desta forma, pôde-se observar que os grupos controle e tratamento demonstraram-se morfologicamente diferentes, sendo a parede vascular mais espessa no grupo tratamento do que no controle. Isso torna o grupo tratamento vantajoso em relação ao controle, tendo em vista que o tendão é extremamente pouco vascularizado, o que dificulta o processo de reparo e, consequentemente, no grupo tratamento o suporte vascular acelerou a cicatrização tendínea.
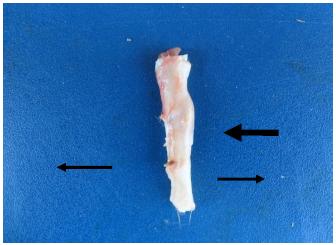
Macroscopicamente, os animais do grupo tratamento apresentaram um espessamento na região do implante, o qual foi mais evidente aos 60 dias (Fig. 3) do que aos 90. Esses achados também foram encontrados por Tovar (2009)TOVAR, M.C.H. Implantes de matrizes de colágeno isoladas ou associadas às células estromais mesenquimais multipotentes autólogas na reparação tendínea em ovinos. 2009. 96f. Tese (Doutorado em cirurgia veterinária) - Faculdade de Ciências Agrárias e Veterinárias - UNESP, Campus de Jaboticabal . ao utilizar células-tronco na reparação tendínea em ovinos. Isso implica, provavelmente, que os animais do grupo tratamento apresentaram maior reposta inflamatória, possivelmente devido à quitosana, que estimula a liberação de citocinas e macrófagos.
Fotografia demonstrando a remoção do fragmento de 1,4cm (seta) no tendão calcâneo do membro pélvico esquerdo em coelho.
Fotografia demonstrando a fixação do filme de quitosana na falha do tendão calcâneo (seta) do membro pélvico esquerdo em coelho.
Fotografia demonstrando o espessamento do tendão calcâneo (seta) de coelho, na região onde o filme de quitosana foi implantado. Grupo tratamento, 60 dias pós-operatório.
Durante a coleta dos espécimes do grupo tratamento, observou-se que a quitosana já não estava mais presente aos 60 dias de PO, tendo sido totalmente absorvida. Este achado corrobora as características de biocompatibilidade e biodegradabilidade da quitosana, citadas por Senel e Mcclure (2004)SENEL, S.; MCCLURE, S.J. Potential applications of chitosan in veterinary medicine. Adv. Drug Deliv. Reviews, v.56, p.1467-1480, 2004.. Igualmente, não foram observados sinais de rejeição à quitosana, o que também foi relatado por Brito et al. (2009)BRITO, M.K.M; SCHELLINI, S.A; PADOVANI, C.R. et al. Inclusões de quitosana no subcutâneo de rato: avaliação clínica, histológica e morfométrica. Anais Bras. Dermatol., v.84, p.35-40, 2009.. A utilização da quitosana como biomaterial é interessante devido à sua compatibilidade com organismos vivos, além de economicamente ser muito viável por derivar-se de um material abundante na natureza.
No grupo controle, aos 60 dias de PO, as fibras colágenas apresentaram-se sem orientação definida, com maior quantidade de células arredondadas (fibroblastos) e pequena quantidade de tecido conjuntivo (Fig. 4). Aos 90 dias, as fibras colágenas estavam organizadas longitudinalmente, semelhantes ao tendão normal, com células, em sua maioria, de forma achatada, com núcleos alongados (fibrócitos) e maior quantidade de tecido conjuntivo (Fig. 5), quando comparadas aos 60 dias.
No grupo tratamento, aos 60 dias de PO, observou-se grande número de células jovens, pequenas e arredondadas (fibroblastos), distribuídas de forma desorganizada, com poucas fibras colágenas e tecido conjuntivo. Também se observou a presença de neovascularização e neutrófilos (Fig. 6).
Aos 90 dias, no grupo tratamento, observou-se uma organização das células achatadas (fibrócitos), orientação das fibras colágenas em feixes longitudinais, maior quantidade de tecido conjuntivo denso modelado, comparado ao grupo controle, e intensa presença de neovascularização, macrófagos e neutrófilos (Fig. 7). Essa vascularização acentuada também foi observada em um estudo realizado por Gianini et al. (2006)GIANINI, C.G; HUSSNI, C.A; ALVES, A.L.G. et al. Restabelecimento funcional do tendão extensor digital longo submetido a ressecção parcial em equinos: observação macroscópica, histopatológica e ultra-sonográfica. Braz. J. Vet. Res. Anim. Sci., v.43, p.728-733, 2006., que avaliaram o restabelecimento funcional do tendão extensor digital longo submetido à ressecção parcial em equinos. Esses achados são vantajosos para a técnica de reparo tendíneo, pois ela estimula a neoformação de células e a neovascularização, consequentemente o processo de reparo ocorre com menos aderências e de forma funcional, que são os principais objetivos num reparo tendíneo.
Fotomicrografia do tendão de coelho do grupo controle aos 60 dias pós-operatório. As setas indicam as fibras colágenas sem orientação definida, com mais células arredondadas (fibroblastos) e com pouca quantidade de tecido conjuntivo. Aumento de 4x.
Fotomicrografia do tendão de coelho do grupo controle aos 90 dias pós-operatório. As setas indicam as fibras colágenas organizadas longitudinalmente. As células, em sua maioria, são achatadas, com núcleos alongados (fibrócitos) e maior quantidade de tecido conjuntivo. Aumento de 10x.
Fotomicrografia do tendão de coelho do grupo tratamento aos 60 dias pós-operatório. As setas indicam a presença de grande número de células jovens, pequenas e arredondadas (fibroblastos), distribuídas de forma desorganizada, com poucas fibras colágenas e tecido conjuntivo. Presença de neovascularização e neutrófilos. Aumento de 4x.
Fotomicrografia do tendão de coelho do grupo tratamento aos 90 dias pós-operatório. As setas indicam uma organização das células achatadas (fibrócitos), as fibras colágenas se orientam em feixes longitudinais e há maior quantidade de tecido conjuntivo denso modelado. Intensa presença de neovascularização, macrófagos e neutrófilos. Aumento de 10x.
Nos animais tratados com quitosana, observou-se maior número de macrófagos e neutrófilos. Gorzelanny et al. (2010)GORZELANNY, C.; PÖPPELMANN, B.; PAPPELBAUM, K. et al. Human macrophage activation triggered by chitotriosidase mediated chitin and chitosan degradation. Biomaterials, v.31, p.8556-8563, 2010. afirmam que a quitosana tem a capacidade de ativar macrófagos, porém não se sabe ao certo como ocorre esse processo. A hipótese mais provável foi proposta por Feng et al. (2004)FENG, J.; ZHAO, L.; YU, Q. Receptor-mediated stimulatory effect of oligochitosan in macrophages. Biochem. and Biophy. Rese. Commun., v.317, p.414-420, 2004., os quais relatam que este processo é mediado por receptores presentes na estrutura do biopolímero, estimulando dessa forma os macrófagos. Essas células, em contato com a quitosana, liberam citocinas e outros fatores de crescimento que atuam no processo de proliferação celular, promovendo a cicatrização dos tecidos (Ueno et al., 2001UENO, H.; NAKAMURA, F.; MURAKAMI, M. et al. Evaluation efects of chitosan for the extracellular matrix production by fibroblasts and the growth factors production by macrophages. Biomaterials., v.22, p.2125-2130, 2001.). Diante do exposto acima, a quitosana tem boa aplicação em tecidos pouco celularizados, como o tendão, numa tentativa de acelerar o processo cicatricial.
Tanto a avaliação macroscópica quanto a avaliação histológica, realizadas nos momentos experimentais preestabelecidos, permitiram maior compreensão do processo de regeneração do tendão calcâneo, sendo observado que, aos 90 dias de pós-operatório, o tendão neoformado constituía-se de tecido conjuntivo denso e de espessura semelhante ao tendão normal. Com isso, pode-se observar que, nesse período, o tendão está reparado, assemelhando-se ao padrão de normalidade, e, por conseguinte, clinicamente o membro está funcional.
Vulcani et al. (2009)VULCANI, V.A.S; MACORIS, D.G; PLEPIS, A.M.G. Biomateriais para reparação cirúrgica da parede abdominal em animais domésticos revisão. Arq. Cienc. Vet. Zool., v.12, p.141-147, 2009. relatam que os melhores biomateriais para reparação cirúrgica da parede abdominal em animais domésticos são os bioativos, biocompatíveis e reprodutíveis, independentemente de serem naturais, sintéticos ou híbridos. Desta forma, a busca por métodos de obtenção e preservação de biomembranas deve ser norteada pelos conhecimentos complexos da interface materiais e tecidos e principalmente por aqueles que visam à regeneração tecidual. No presente estudo, a quitosana comprovou possuir as características relatadas por Vulcani et al. (2009)VULCANI, V.A.S; MACORIS, D.G; PLEPIS, A.M.G. Biomateriais para reparação cirúrgica da parede abdominal em animais domésticos revisão. Arq. Cienc. Vet. Zool., v.12, p.141-147, 2009. e, portanto, pode ser mais uma opção para reparação do tendão, contanto que se aguarde pelo menos 90 dias para que ocorra a recuperação do tendão.
CONCLUSÕES
Com base nos dados obtidos, pode-se concluir que a quitosana é um biopolímero com potencial para utilização em reparos tendíneos, por favorecer o processo de cicatrização tecidual sem complicações para o paciente.
AGRADECIMENTOS
À Capes, pela concessão da bolsa de mestrado.
Ao Laboratório de Engenharia de Biomateriais da UFCG, Campina Grande, pela confecção do filme de quitosana.
REFERÊNCIAS
- ASSIS, O.B.G.; LEONI, A.M.; NOVAES, A.P. Avaliação do efeito cicatrizante da quitosana por aplicação tópica em ratos. São Carlos: Embrapa Instrumentação Agropecuária, v.29, p.16, 2007.
- AZEVEDO, A.S; SÁ, M.J.C; NETO, P.I.N. et al. Avaliação de diferentes proporções de fosfato de cálcio na regeneração do tecido ósseo de coelhos: estudo clínicocirúrgico, radiológico e histológico. Braz. J. Vet. Res. Anim. Sci., v.49, p.12-18, 2012.
- AZEVEDO, A.S; SÁ, M.J.C; FOOK, M.V.L. et al. Hidroxiapatita e quitosana isoladas e associadas à medula óssea no reparo do tecido ósseo em coelhos. Estudo histológico e morfométrico. Cienc. Rural, v.43, p.1265-1270, 2013.
- BRITO, M.K.M; SCHELLINI, S.A; PADOVANI, C.R. et al. Inclusões de quitosana no subcutâneo de rato: avaliação clínica, histológica e morfométrica. Anais Bras. Dermatol., v.84, p.35-40, 2009.
- CLARK, D.M. Tendon injury and repair. In: BOJRAB, M.J. Disease mechanisms in small animal surgery. 2.ed. Philadelphia: Lea e Febiger, cap.142., 1993. p.1079-1082.
- COSTA NETO, J.M.; DALECK, C.R.; ALESSI, A.C. Tenoplastia experimental do calcâneo em cães com peritônio bovino conservado em glicerina. Cienc. Rural, v.29, p.697-703, 1999.
- FENG, J.; ZHAO, L.; YU, Q. Receptor-mediated stimulatory effect of oligochitosan in macrophages. Biochem. and Biophy. Rese. Commun., v.317, p.414-420, 2004.
- FIDÉLES, T.B. Filmes Reticulados de Quitosana para Aplicação como Biomaterial. 2010. 92f. Dissertação (Mestrado em Ciência e Engenharia de Materiais) - Universidade Federal de Campina Grande.
- FILGUEIRA, F.G.F. Hidroxiapatita associada à quitosana na reparação óssea - revisão de literatura e estudo experimental em coelhos. 2012. 69f. Dissertação. (Mestrado em Medicina Veterinária) Universidade Federal de Campina.
- GIANINI, C.G; HUSSNI, C.A; ALVES, A.L.G. et al. Restabelecimento funcional do tendão extensor digital longo submetido a ressecção parcial em equinos: observação macroscópica, histopatológica e ultra-sonográfica. Braz. J. Vet. Res. Anim. Sci., v.43, p.728-733, 2006.
- GORZELANNY, C.; PÖPPELMANN, B.; PAPPELBAUM, K. et al. Human macrophage activation triggered by chitotriosidase mediated chitin and chitosan degradation. Biomaterials, v.31, p.8556-8563, 2010.
- GOOSEN, M.E.A. Applications of chitin and chitosan. Tech. Publ. Comp., v.61, p.3-29, 1996.
- JUNQUEIRA, L.C.; CARNEIRO, J. Tecido conjuntivo. In: Histologia básica. 10.ed. Rio de Janeiro: Guanabara Koogan, 2004.
- KHAN, T.A.; PEH, K.K. A preliminary investigation of chitosan film as dressing for punch biopsy wounds in rats. J. Pharmacy & Pharmaceutical Sci., v.6, p.20-26, 2003.
- KHOR, E; LIM, L.Y. Implantable applications of chitin and chitosan, Biomaterials, v.24, p.2339-2349, 2003.
- LARANJEIRA, M.C.M.; FÁVERE, V.T. Quitosana: biopolímero funcional com potencial industrial biomédico. Quím. Nova, v.32, p.672-678, 2009.
- MOORE, T.; ANDERSON, B.; SEILER, J.G. Flexor Tendon Reconstruction. J. Hand Surg, v.35, p.1025-1030, 2010.
- NIKOLLAOU, P.K. Biomechanical and histological evaluation of muscle after controlled strain injury. Am. J. Sports Med., v.15, p.14-19, 1987.
- RAISER, A.G. Reparação do tendão calcâneo em cães. Cienc. Rural, v.31, p.351-359, 2001.
- SENEL, S.; MCCLURE, S.J. Potential applications of chitosan in veterinary medicine. Adv. Drug Deliv. Reviews, v.56, p.1467-1480, 2004.
- SPIN-NETO, R.; PAVONE, C.; FREITAS, R.M. et al. Biomateriais à base de quitosana com aplicação médica e odontológica: revisão de literatura. Rev. Odontol. UNESP, v.37, p.155-161, 2008.
- TOVAR, M.C.H. Implantes de matrizes de colágeno isoladas ou associadas às células estromais mesenquimais multipotentes autólogas na reparação tendínea em ovinos. 2009. 96f. Tese (Doutorado em cirurgia veterinária) - Faculdade de Ciências Agrárias e Veterinárias - UNESP, Campus de Jaboticabal .
- UENO, H.; NAKAMURA, F.; MURAKAMI, M. et al. Evaluation efects of chitosan for the extracellular matrix production by fibroblasts and the growth factors production by macrophages. Biomaterials., v.22, p.2125-2130, 2001.
- VAUGHAN, L.C. Tendon injuries in dogs. California Vet., v.1, p.15-19, 1980.
- VULCANI, V.A.S; MACORIS, D.G; PLEPIS, A.M.G. Biomateriais para reparação cirúrgica da parede abdominal em animais domésticos revisão. Arq. Cienc. Vet. Zool., v.12, p.141-147, 2009.
Datas de Publicação
-
Publicação nesta coleção
Ago 2014
Histórico
-
Recebido
15 Fev 2013 -
Aceito
19 Fev 2014