Resumos
Com o objetivo de verificar se o uso da pilocarpina produz diferença na velocidade da regeneração hepática empreendemos um estudo experimental. Sabe-se que em ratos salivectomizados a regeneração do fígado fica diminuída. Sabe-se também que a pilocarpina aumenta a salivação destes animais. Na primeira etapa determinamos a dose de pilocarpina a ser utilizada. Na segunda etapa do projeto foram realizadas as hepatectomias ressecando em média 52,8% do fígado. Nossos resultados demonstraram que a pilocarpina diminui a perda de peso corporal total ao final de 48 horas pós hepatectomia parcial ( p=0,55 ) e também diminui o edema hepático durante sua regeneração (p= 0,11 ), mas observamos um peso maior do fígado em regeneração no grupo controle no primeiro dia (p= 0,016).
pilocarpina; regeneração hepática
We performed an experimental study with the purpose to verify if the use of pilocarpine produces a difference in the velocity of the hepatic regeneration. It’s known that in salivectomized rats the regeneration of the liver gets decreased. It’s also known that the pilocarpine increases the salivation of this animals. In the first phase we determined the dose of pilocarpine to be used. In the second phase of the project we realized the hepactomies, parching 52,8% of the liver on average. Our results demonstrated that the pilocarpine decreases the total loss of body wheight at the end of 48 hours after partial hepactomies (p=0,55) and also decreases the hepatic edema during its regeneration (p= 0,11), but we observed a greater wheight of the liver in regeneration in the control group in the first day (p=0,016).
Pilocarpine; Hepatic regeneration
EFEITO DA PILOCARPINA NA REGENERAÇÃO HEPÁTICA PÓS HEPATECTOMIA PARCIAL EM RATOS11 Trabalho realizado no departamento de pós-graduação da FFFCMPA com apoio da FAPERGS..
Antonio Nocchi Kalil21 Trabalho realizado no departamento de pós-graduação da FFFCMPA com apoio da FAPERGS.
Daniel Sperb31 Trabalho realizado no departamento de pós-graduação da FFFCMPA com apoio da FAPERGS.
Eduardo Lichtenfels41 Trabalho realizado no departamento de pós-graduação da FFFCMPA com apoio da FAPERGS.
KALIL, A.N.; SPERB, D.; LICHTENFELS, E. Efeito da pilocarpina na regeneração hepática pós hepatectomia parcial em ratos. Acta Cir. Bras., 13(4):222-6, 1998.
RESUMO: Com o objetivo de verificar se o uso da pilocarpina produz diferença na velocidade da regeneração hepática empreendemos um estudo experimental. Sabe-se que em ratos salivectomizados a regeneração do fígado fica diminuída. Sabe-se também que a pilocarpina aumenta a salivação destes animais. Na primeira etapa determinamos a dose de pilocarpina a ser utilizada. Na segunda etapa do projeto foram realizadas as hepatectomias ressecando em média 52,8% do fígado. Nossos resultados demonstraram que a pilocarpina diminui a perda de peso corporal total ao final de 48 horas pós hepatectomia parcial ( p=0,55 ) e também diminui o edema hepático durante sua regeneração (p= 0,11 ), mas observamos um peso maior do fígado em regeneração no grupo controle no primeiro dia (p= 0,016).
DESCRITORES : pilocarpina, regeneração hepática.
INTRODUÇÃO
Um aspecto de particular interesse do fígado é sua capacidade regenerativa e de reserva funcional, tornando-o um órgão ímpar na economia orgânica nos mamíferos em geral.
JONES e col.8 observaram que em ratos que tiveram sua maior glândula salivar removida, ou sua drenagem venosa ligada, a regeneração hepática pós hepatectomia parcial ficou prejudicada em relação ao grupo controle. Demonstraram desta forma a necessidade do fator de crescimento epidermal, secretado pela glândula salivar, para a regeneração do fígado.
A pilocarpina, um alcalóide natural colinomimético com ação muscarínica dominante, tem a propriedade de produzir salivação aumentada continuamente17.Uma vez que o aumento da salivação é descrito também em ratos 3,5,16, esperamos uma secreção também maior de fator de crescimento epidermal nestes animais.
O objetivo do presente estudo é verificar se o uso de pilocarpina produz diferença na velocidade da regeneração hepática em ratos.
MÉTODO
Foram utilizados ratos Wistar, entre 6 e 12 semanas de vida, criados no biotério da disciplina de Farmacologia da Fundação Faculdade Federal de Ciências Médicas de Porto Alegre, sendo mantidos 6 por gaiola e recebendo ração padronizada e água ad libitum . Todos os ratos foram operados e manipulados no mesmo horário para evitar efeitos do ciclo circadiano.
O estudo foi dividido em 2 etapas. Na primeira etapa determinamos a dose a ser utilizada , uma vez que não encontrou-se trabalho similar e queríamos uma dose que inicialmente alterasse menos os parâmetros a serem medidos. Em estudos de glândulas salivares são utilizadas doses de 0,31mg/kg a 5mg/kg com posologia de 8 em 8 horas da medicação. Doses acima de 30mg/kg são epileptogênicas 3,5,12,15,16,18 .
Resolveu-se então comparar doses de 1mg/kg e 4mg/kg e soro fisiológico nos modelos animais. As diluições da pilocarpina foram feitas de tal maneira que cada rato recebeu 0,1% de seu peso como volume subcutâneo de 8 em 8 horas.
Foram medicados 12 ratos, pesando entre 185 e 265 gramas divididos em 3 grupos, um grupo recebendo 1mg/kg de pilocarpina, outro recebendo 4 mg/kg de pilocarpina e grupo controle recebendo soro fisiológico 0,9%.
Durante as 24 h os ratos foram observados quanto a seu comportamento. Após foram pesados e anestesiados com éter etílico em campânula até seu sacrifício, sendo então feitas as hepatectomias para verificarmos o peso dos fígados.
Após pesados, os fígados foram secos em estufa a 80o C por 24h para obtermos sua massa seca e porcentagem de umidade.
Comparando os grupos, verificamos que aquele que recebeu 4mg/kg de pilocarpina se assemelhou mais ao grupo controle, tanto na variação de peso pré e pós medicação, como na porcentagem de umidade do fígado após 24 horas de administração dos medicamentos.
O gráfico demonstra que o grupo que recebeu 4 mg/kg apresentou características mais parecidas com o grupo controle, perda de 1,9% e 1,6% respectivamente contra 0,4% do grupo que recebeu 1mg/kg de pilocarpina ( p=0,79 )
Observamos a semelhança do grupo controle com o grupo de 4mg/kg. (p=0,14)
Como não houve diferença comportamental ( sono, diarréia, sede...) entre os grupos, e o objetivo do estudo é comparar a regeneração hepática e não a ação do medicamento sobre o fígado , optamos pela dose cujos resultados foram os mais próximos do grupo controle, apesar de estatisticamente não significativo, ou seja, 4 mg/kg de pilocarpina de 8/8 horas.
Na segunda etapa do projeto iniciaram-se as hepatectomias parciais.
Foram operados 15 ratos pesando entre 218g e 298g, sendo retirado em média 52,8% do fígado.
Verificamos o padrão linear entre o peso da fração hepática retirada e o peso do rato. Em média 2,43 +/- 0,14%. (correção=0,76)
Os ratos foram divididos randomicamente em 4 grupos da seguinte maneira: grupo 1- recebendo soro fisiológico subcutâneo (s.c.). 8 em 8 horas por 24 horas, grupo 2- recebendo pilocarpina s.c. 8 em 8 horas por 24 horas, grupo 3- recebendo soro fisiológico s.c. 8 em 8 horas por 48 horas, grupo 4- recebendo pilocarpina s.c. 8 em 8 horas por 48 horas.
A administração das soluções eram iniciadas 30 minutos antes das hepatectomias parciais.
As cirurgias foram realizadas através de uma incisão mediana sob anestesia. O éter etílico foi usado como agente anestésico devido a sua praticidade e pelo fato de não possuir potencial hepatotóxico como os gases anestésicos halogenados e não induzir o metabolismo de drogas ao nível do sistema microssomial hepático como os barbitúricos1. A incisão mediana se estendeu do apêndice xifóide por aproximadamente 4 cm em direção caudal. Após a abertura da parede muscular e peritônio foi realizada hepatectomia envolvendo a ressecção de 52%, em média, do fígado, retirando os lobos mediano e esquerdo 2,7. O fechamento da parede muscular foi feito com fio prolene 3-0 e o fechamento da pele com mononylon 4-0.
Para monitorar a regeneração hepática utilizou-se a medida do peso do rato 14 e o peso úmido e seco do fígado regenerado após o sacrifício do animal 9,19.
Após 24h para os grupos 1 e 2, ou 48 h para os grupos 3 e 4, os animais foram pesados e sacrificados durante a cirurgia para retirada do fígado em regeneração com uso continuado do próprio anestésico.
Os fígados foram então pesados, secos e pesados novamente.
RESULTADOS
Analisando alguns dados obtidos observamos que, nas primeiras 24h o grupo que recebeu soro fisiológico teve menor perda de peso, fato que se inverte ao final de 48h, não significativos estatisticamente.
Ambos os gráficos demonstraram uma perda de peso mais acentuada no grupo que recebeu pilocarpina no primeiro dia de regeneração, porém ao final de 2 dias o grupo da pilocarpina teve uma melhor evolução. Peso final 4,9% menor no grupo da pilocarpina contra 5,5% menor no grupo controle (p=0,178 no dia 0; p=0,177 no dia 1; p=0,55 no dia 2)
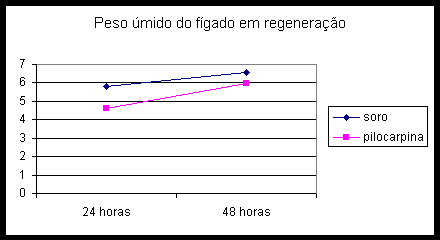
O fígado em regeneração do grupo controle obteve um maior peso úmido, principalmente nas primeiras 24 horas (21% maior; p=0,002 contra p= 0,08 nas 48h).
O fígado em regeneração do grupo controle obteve um maior peso seco, significativo apenas no primeiro dia (p=0,016 no dia 1 e p=0,33 no dia 2).
Os fígados em regeneração do grupo controle apresentam maior peso, estatisticamente significativo apenas nas primeiras 24 horas. Porém a pilocarpina tende a proteger o fígado do edema reacional causado pela hepatectomia, principalmente nas primeiras 24 horas.
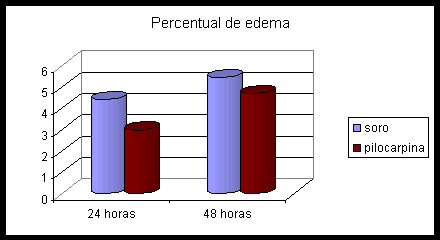
Observamos o aumento de umidade dos fígados em regeneração em relação ao fígado normal, onde a pilocarpina previne em parte este aumento.
Admitindo que o aumento de umidade seja edema, verificamos uma tendência de proteção por parte da pilocarpina, principalmente no primeiro dia.
2,9% de edema contra 4,4% no primeiro dia (p=0,11) e 4,7% contra 5,4% no segundo dia (p=0,54).
DISCUSSÃO
O fígado tem uma enorme capacidade de crescimento por hipertrofia e hiperplasia compensatórias após perda de tecido funcional. No animal jovem, o fígado cresce até que a relação peso do fígado/peso corporal atinja um "plateau", variável de acordo com a espécie animal. No rato adulto, somente um hepatócito entre 10 a 20.000 apresenta atividade mitótica.
A regeneração hepática após hepatectomia parcial é uma resposta fisiológica observada em animais4, dependendo da extensão da ressecção20.
Substâncias endógenas controladoras da regeneração do fígado instalam-se rapidamente 11 (em cinco minutos após hepatectomia parcial ocorre despolarização da membrana do hepatócito21), promovendo um ou dois ciclos de replicação dos hepatócitos até que voltem a seu estado não proliferativo 6.
A hepatopoetina A, ou fator de crescimento do hepatócito, é bem conhecido como mitogênico para o hepatócito 10,11,13,19,21.
O fator de crescimento epidermal 8,10,21 age, porém, numa fase mais precoce (GO - G1 - S) da replicação celular do fígado4, sendo secretado também pelas glândulas salivares.
JONES e col.8 observaram que o pico de síntese de DNA 24 horas depois da hepatectomia ficou dramaticamente diminuído nos ratos salivectomizados, salientando a importância de estimular a glândula salivar. TAYLOR17 acredita que a pilocarpina é um fármaco seguro e clinicamente utilizável para tal fim, uma vez que ela tem a propriedade de produzir salivação aumentada continuamente, sendo até utilizada para tratamento de xerostomia grave.
Em nosso trabalho verificamos que a pilocarpina tem um efeito sobre o fígado, independente da dose utilizada. Ao observarmos a primeira fase do estudo, a dose de 1mg/kg de pilocarpina causava menor perda de peso e maior diminuição da umidade hepática em relação a dosagem de 4mg/kg e ao grupo controle. Ainda que estatisticamente não significante, este dado nos parece relevante, pois são efeitos que procuramos num fármaco adjuvante da recuperação pós hepatectomia: conservação de peso do paciente e proteção do edema provocado.
A pesquisa abre portanto novos horizontes, possibilitando ajustes na dose a ser utilizada e incentivando a busca de novos medicamentos .
CONCLUSÃO
Nossos resultados demonstraram que a pilocarpina diminui a perda de peso corporal total ao final de 48 horas pós hepatectomia parcial e também diminui o edema hepático durante sua regeneração, mas observamos um peso maior do fígado em regeneração no grupo controle no primeiro dia (p= 0,016).
REFERÊNCIAS
1. BERTELLI, M.S.B. -Toxicidade do acetominofen em ratos submetidos à hepatectomia parcial. 1993. (Tese de mestrado em farmacologia clínica apresentada à Fundação Faculdade Federal de Ciências Médicas de Porto Alegre).
2. BISMUTH, H.- Surgical anatomy and anatomical surgery of the liver. World Journal of Surgery, 6(1): 3-9, 1982.
3. CASTLE, J.D. & CASTLE, A.M. - Two regulated secretory pathways for newly synthesized parotid salivary proteins are distinguished by doses of secretagogues. J. Cell. Sci. 109 ( Pt 10): 2591-9, 1996.
4. CRESSMAN, D.E.; DIAMOND, R.H.; TAUB, R.- Rapid activatin of the Stat3 transcription complex in the liver regeneration. Hepatology, 21 (5) :1443-9, 1995.
5. DEHPOUR, A.R.; NOUHNEJAD, P.; MOUSAVIZADEH, K.; GHAFOURIFAR, P.; DJAMALI, M.; BORHANIMOGHADAM, B. -Cyclosporin A-induced functional and morphological changes in pilocarpine treated rat submandibular glands. Toxicology 15 108 :65-71, 1996.
6. FAUSTO, M.; LAIRD, A.D.; WEBBER, E.M. - Liver regeneretion .Role of growth factors and cytokines in hepatic regeneration. FASEB J. 9 (15) :1527-36, 1995.
7. HIGGINS, G.M.& ANDERSON, R.M. - Experimental pathology of the liver - restoration of the liver of the white rat following partial surgical removal. Arch. Pathology 7 : 187-202, 1931.
8. JONES, D.E. JR.; TRAN-PATTERSON, R.; CUI, D.M.; DAVIN, D.; ESTELL, K.P. ; MILLER, D.M. -Epidermal growth factor secreted from the salivary gland is necessary for liver regeneration.Am. J. Physiol. 268 (5Pt 1) :G872-8,1995.
9. JOYEUX, H. ; MATIAS, J.; SAINT-AUBERT, B.; ASTRE, C.; GOUTEBEL, M.C.; VEDRENNE, J.B.; DENEUX, l. - Un marqueur serique de la masse hepatique fonctionelle apres hepatectomie elargie. Le rapport des acides amines ramifies (AAR) sur les aromatiques (AAA).Etudes experimentales et cliniques. Chirurgie 95 120 (5) :283-8,1994.
10. KISO, S.; KAMATA, S.; TAMURA, S.; HIGASHIYAMA, S.; ITO, N.; TSUSHIMA, H.; TANIGUCHI, N.; MATSUZAWA, Y.- Role of heparin-binding epidermal growth factor-like growth factor as a hepatotrophic factor in rat liver regeneration after partial hepatectomy. Hepatology 22(5) :1584-90,1995.
11. KYPRIANIDIS, K.G.; MYKONIATIS, M.G.; PAPADIMITRIOU, D.G.; VALSAMIDOU, A. -Effect of subtotal pancreatectomy on the rate of liver regeneration : the role of hepatic stimulator substance. J. Surg. Res. 62(2) :267-72,1996.
12. MELLO, L.E. & COVOLAN, L. -Spontaneous seizures preferentially injure interneurons in the pilocarpine model of chronic spontaneous seizures. Epilepsy Res. 26(1) :123-9,1996.
13. NISHIZAKI, T.; TAKENAKA, K. ;YOSHIZUMI, T.; YANAGA, K.; SOEJIMA, Y.; SHIRABE, K.; SUGIMACHI, K. -Alteration in levels of human hepatocyte growth factor following hepatectomy. J. Am. Coll. Surg. 181 (1) :6-10 , 1995.
14. OGAWA, K.; HOSOKAWA, T.; OTANI, Y. ; KAJIWARA, T. - Influence of chronic liver damage on regeneration of the organ in rats. Res. Exp. Med. 195 (1) :6-15, 1995.
15. SANKAR, R.; SHIN, D.H.; WASTERLAIN, C.G. -GABA metabolism during status epilepticus in the developing rat brain. Brain. Res. Dev. Brain. Res 98(1) : 60-4,1997.
16. SETOGUTI, T.; INOUE, Y.; WILD, P. -The biological significance of storage in rat parathyroid cells. Microsc. Res. Tech. 32 (2) :148-63,1995.
17. TAYLOR, P. Cholinergic agonist. In: GOODMAN, L.S. & GILMAN, A.- The Pharmacological Basis of Therapeutics . 9th ed., McGram Hill, 1996, pg. 146-148.
18. TROY, E. D. Doenças da boca e das glândulas salivares. In: WYNGAARDEN, J.B. ; SMITH, L.H. ; BENNET J.C.- Cecil textbook of medicine . W.B. Saunders Company 20th ed. Philadelphia 1996 pg 650.
19. TOMIKAWA, M.; HASHIZUME, M.; HIGHASHI, H.; OHTA, M.; SUGIMACHI, K .- The role of the spleen , platelets, and plasma hepatocyte grwth factor activity on hepatic regeneration in rats . J. Am. Coll. Surg. 182 (1) :12-61,1996.
20. WESTWICK, J.K.; WEITZEL, C.; LEFFERT, H.L.; BRENNER, D.A.- Activation of Jun kinase is na early event in hepatic regeneration. J. Clin. Invest. 95 (2):803-10,1995.
21. ZHANG, X.K. ; GAUTHIER, T.; BURCZYNSKI, F.J.; WANG, G.Q.; GONG, Y.W.; MINUK, G.Y . -Changes in liver membrane potentials after partial hepatectomy in rats. Hepatology 23(3) :549-51,1996.
KALIL, A.N.; SPERB, D.; LICHTENFELS, E. Effect of pilocarpine in hepatic regeneration post partial hepatectomy in rats. Acta Cir. Bras., 13(4):222-6, 1998.
SUMMARY: We performed an experimental study with the purpose to verify if the use of pilocarpine produces a difference in the velocity of the hepatic regeneration. Its known that in salivectomized rats the regeneration of the liver gets decreased. Its also known that the pilocarpine increases the salivation of this animals. In the first phase we determined the dose of pilocarpine to be used. In the second phase of the project we realized the hepactomies, parching 52,8% of the liver on average. Our results demonstrated that the pilocarpine decreases the total loss of body wheight at the end of 48 hours after partial hepactomies (p=0,55) and also decreases the hepatic edema during its regeneration (p= 0,11), but we observed a greater wheight of the liver in regeneration in the control group in the first day (p=0,016).
SUBJECT HEADINGS: Pilocarpine. Hepatic regeneration.
Endereço para correspondência:
Daniel Sperb
Praça Dom Feliciano, 126 apartamento 22
90020 160 Porto Alegre RS
Telefone : (051) 225 9015
Data do recebimento:08.07.98
Data da revisão: 12.08.98
Data da aprovação: 15.09.98
2 Professor adjunto do Departamento de Cirurgia da FFFCMPA, Mestre e Doutor em Medicina.
3 Doutorando e bolsista da FAPERGS.
4 Acadêmico de medicina da FFFCMPA.
- 1. BERTELLI, M.S.B. -Toxicidade do acetominofen em ratos submetidos ŕ hepatectomia parcial. 1993. (Tese de mestrado em farmacologia clínica apresentada ŕ Fundaçăo Faculdade Federal de Cięncias Médicas de Porto Alegre).
- 2. BISMUTH, H.- Surgical anatomy and anatomical surgery of the liver. World Journal of Surgery, 6(1): 3-9, 1982.
- 3. CASTLE, J.D. & CASTLE, A.M. - Two regulated secretory pathways for newly synthesized parotid salivary proteins are distinguished by doses of secretagogues J. Cell. Sci. 109 ( Pt 10): 2591-9, 1996.
- 4. CRESSMAN, D.E.; DIAMOND, R.H.; TAUB, R.- Rapid activatin of the Stat3 transcription complex in the liver regeneration. Hepatology, 21 (5) :1443-9, 1995.
- 5. DEHPOUR, A.R.; NOUHNEJAD, P.; MOUSAVIZADEH, K.; GHAFOURIFAR, P.; DJAMALI, M.; BORHANIMOGHADAM, B. -Cyclosporin A-induced functional and morphological changes in pilocarpine treated rat submandibular glands. Toxicology 15 108 :65-71, 1996.
- 6. FAUSTO, M.; LAIRD, A.D.; WEBBER, E.M. - Liver regeneretion .Role of growth factors and cytokines in hepatic regeneration FASEB J. 9 (15) :1527-36, 1995.
- 7. HIGGINS, G.M.& ANDERSON, R.M. - Experimental pathology of the liver - restoration of the liver of the white rat following partial surgical removal Arch. Pathology 7 : 187-202, 1931.
- 8. JONES, D.E. JR.; TRAN-PATTERSON, R.; CUI, D.M.; DAVIN, D.; ESTELL, K.P. ; MILLER, D.M. -Epidermal growth factor secreted from the salivary gland is necessary for liver regenerationAm. J. Physiol. 268 (5Pt 1) :G872-8,1995.
- 9. JOYEUX, H. ; MATIAS, J.; SAINT-AUBERT, B.; ASTRE, C.; GOUTEBEL, M.C.; VEDRENNE, J.B.; DENEUX, l. - Un marqueur serique de la masse hepatique fonctionelle apres hepatectomie elargie. Le rapport des acides amines ramifies (AAR) sur les aromatiques (AAA).Etudes experimentales et cliniques Chirurgie 95 120 (5) :283-8,1994.
- 10. KISO, S.; KAMATA, S.; TAMURA, S.; HIGASHIYAMA, S.; ITO, N.; TSUSHIMA, H.; TANIGUCHI, N.; MATSUZAWA, Y.- Role of heparin-binding epidermal growth factor-like growth factor as a hepatotrophic factor in rat liver regeneration after partial hepatectomy Hepatology 22(5) :1584-90,1995.
- 11. KYPRIANIDIS, K.G.; MYKONIATIS, M.G.; PAPADIMITRIOU, D.G.; VALSAMIDOU, A. -Effect of subtotal pancreatectomy on the rate of liver regeneration : the role of hepatic stimulator substance J. Surg. Res. 62(2) :267-72,1996.
- 12. MELLO, L.E. & COVOLAN, L. -Spontaneous seizures preferentially injure interneurons in the pilocarpine model of chronic spontaneous seizures Epilepsy Res. 26(1) :123-9,1996.
- 13. NISHIZAKI, T.; TAKENAKA, K. ;YOSHIZUMI, T.; YANAGA, K.; SOEJIMA, Y.; SHIRABE, K.; SUGIMACHI, K. -Alteration in levels of human hepatocyte growth factor following hepatectomy J. Am. Coll. Surg. 181 (1) :6-10 , 1995.
- 14. OGAWA, K.; HOSOKAWA, T.; OTANI, Y. ; KAJIWARA, T. - Influence of chronic liver damage on regeneration of the organ in rats Res. Exp. Med. 195 (1) :6-15, 1995.
- 15. SANKAR, R.; SHIN, D.H.; WASTERLAIN, C.G. -GABA metabolism during status epilepticus in the developing rat brain. Brain. Res. Dev. Brain. Res 98(1) : 60-4,1997.
- 16. SETOGUTI, T.; INOUE, Y.; WILD, P. -The biological significance of storage in rat parathyroid cells Microsc. Res. Tech. 32 (2) :148-63,1995.
- 17. TAYLOR, P. Cholinergic agonist. In: GOODMAN, L.S. & GILMAN, A.- The Pharmacological Basis of Therapeutics 9th ed., McGram Hill, 1996, pg. 146-148.
- 19. TOMIKAWA, M.; HASHIZUME, M.; HIGHASHI, H.; OHTA, M.; SUGIMACHI, K .- The role of the spleen , platelets, and plasma hepatocyte grwth factor activity on hepatic regeneration in rats . J. Am. Coll. Surg. 182 (1) :12-61,1996.
- 20. WESTWICK, J.K.; WEITZEL, C.; LEFFERT, H.L.; BRENNER, D.A.- Activation of Jun kinase is na early event in hepatic regeneration J. Clin. Invest. 95 (2):803-10,1995.
- 21. ZHANG, X.K. ; GAUTHIER, T.; BURCZYNSKI, F.J.; WANG, G.Q.; GONG, Y.W.; MINUK, G.Y . -Changes in liver membrane potentials after partial hepatectomy in rats Hepatology 23(3) :549-51,1996.
Datas de Publicação
-
Publicação nesta coleção
14 Jan 1999 -
Data do Fascículo
Out 1998