Resumo
Objetivo:
Avaliar a influência do tempo de exposição e calibre na formação de biofilme em cateteres urinários de Foley (CUFs).
Método:
Pesquisa in vitro com amostras de fragmentos de CUFs em látex siliconizado de diferentes calibres (n° 14 e n° 16 Frenchs). A urina artificial foi confeccionada, inoculada com bactérias-padrão Staphylococcus aureus (ATCC 25923) e Pseudomonas aeruginosa (ATCC 27853) e incubada a 37 °C por 24 horas e 72 horas. As análises foram realizadas por meio de cultura (carga bacteriana) e microscopia eletrônica de varredura.
Resultados:
Não houve diferença na carga bacteriana dos biofilmes formados nas superfícies dos CUFs com relação aos diferentes calibres (p > 0,05). Por outro lado, o tempo de exposição (24 horas e 72 horas) foi o fator determinante para formação do biofilme de P. aeruginosa nos CUFs (p < 0,05).
Conclusão:
O tempo de exposição influenciou a formação do biofilme de P. aeruginosa nos CUFs, independentemente dos calibres.
Descritores
Biofilmes; Cateteres urinários; Infecções urinárias; Staphylococcus aureus; Pseudomonas aeruginosa
Resumen
Objetivo:
Evaluar la influencia del tiempo de exposición y calibre en la formación de biofilm en catéteres urinarios de Foley (CUFs).
Método:
Investigación in vitro con muestras de fragmentos de CUFs en látex siliconizado de diferentes calibres (n ° 14 y n° 16 Frenchs). La orina artificial fue confeccionada, inoculada con bacterias estándar Staphylococcus aureus (ATCC 25923) y Pseudomonas aeruginosa (ATCC 27853) e incubada a 37 °C durante 24 horas y 72 horas. Los análisis se realizaron por medio de cultivo (carga bacteriana) y microscopía electrónica de exploración.
Resultados:
No hubo diferencia en la carga bacteriana de los biofilmes formados en las superficies de los CUFs en relación con los diferentes calibres (p> 0,05). Por otro lado, el tiempo de exposición (24 horas y 72 horas) fue el factor determinante para la formación del biofilm de P. aeruginosa en los CUFs (p <0,05).
Conclusión:
El tiempo de exposición influenció la formación del biofilm de P. aeruginosa en los CUFs, independientemente de los calibres.
Descriptores
Biopelículas; Catéteres urinarios; Infecciones urinarias; Staphylococcus aureus; Pseudomonas aeruginosa
Abstract
Objective:
To assess the effects of exposure time and gauge of Foley catheters in biofilm formation.
Method:
In vitro study with samples of Foley catheter fragments made of siliconized latex of different gauges (#14 and #16 French gauge). Artificial urine was produced, which was inoculated with Staphylococcus aureus (ATCC 25923) and Pseudomonas aeruginosa (ATCC 27853) standard bacteria, incubated at 37 °C for 24 hours and 72 hours. The material was analyzed by means of culture (bacterial load) and scanning electron microscopy.
Results:
There was no difference in bacterial load of biofilms formed in Foley catheter surfaces with regard to different gauges (p > 0.05). On the other hand, exposure time (24 hours and 72 hours) was a determining factor for P. aeruginosa biofilm formation in Foley catheters (p < 0.05).
Conclusion:
Exposure time had an effect on P. aeruginosa biofilm formation in Foley catheters, regardless of gauges.
Keywords
Biofilm; Urinary catheters; Urinary tract infections; Staphylococcus aureus; Pseudomonas aeruginosa
Introdução
As infecções relacionadas à assistência à saúde (IRAS) representam uma problemática de saúde mundial com impactos significativos, sobretudo quando ocorrem em ambiente hospitalar e com indivíduos imunocomprometidos. Dentre as diversas topografias, a infecção de trato urinário (ITU) é uma das mais prevalentes e preocupantes em idosos devido à taxa elevada de morbidade.(11. Sousa ÁF, Queiroz AA, Oliveira LB, Moura LK, Andrade D, Watanabe E, et al. Deaths among the elderly with ICU infections. Rev Bras Enferm. 2017;70(4):733–9.)
A infecção do trato urinário associada a cateter urinário (ITU-AC) é definida como qualquer manifestação de ITU em cliente que faz uso de cateter urinário por mais de dois dias e que na data da infecção estava com o cateter inserido ou que havia sido removido no dia anterior.(22. Agência Nacional de Vigilância Sanitária (ANVISA). Medidas de prevenção de infecção relacionada à assistência à saúde [Internet]. 2a ed. Brasília (DF): ANVISA; 2017. [citado 2018 Set 12]. Disponível em: https://www20.anvisa.gov.br/segurancadopaciente/index.php/publicacoes/item/caderno-5
https://www20.anvisa.gov.br/segurancadop...
)
Como informação alarmante, infere-se que 15% a 25% dos clientes hospitalizados são submetidos ao cateterismo urinário, na maioria das vezes sem a indicação adequada.(33. Barbadoro P, Labricciosa FM, Recanatini C, Gori G, Tirabassi F, Martini E, et al. Catheter-associated urinary tract infection: role of the setting of catheter insertion. Am J Infect Control. 2015;43(7):707–10.)
Com relação aos cateteres urinários confeccionados em látex ou silicone, a frequência de risco de ITU-AC em clientes hospitalizados foi similar, entretanto o uso de dispositivos revestidos com prata ou nitrofurazona demonstrou uma redução nas taxas desse tipo de infecção.(44. Pickard R, Lam T, Maclennan G, Starr K, Kilonzo M, McPherson G, et al. Types of urethral catheter for reducing symptomatic urinary tract infections in hospitalised adults requiring short-term catheterisation: multicentre randomised controlled trial and economic evaluation of antimicrobial- and antiseptic-impregnated urethral catheters (the CATHETER trial). Health Technol Assess. 2012;16(47):1–197.)
Os agentes etiológicos mais relacionados à ITU-AC são: Pseudomonas aeruginosa, Proteus mirabilis, Candida spp., Escherichia coli e Klebsiella pneumoniae,(55. Tan CW, Chlebicki MP. Urinary tract infections in adults. Singapore Med J. 2016 Sep;57(9):485–90.,66. Schulz L, Hoffman RJ, Pothof J, Fox B. Top ten myths regarding the diagnosis and treatment of urinary tract infections. J Emerg Med. 2016;51(1):25–30.) que podem estar presentes na forma de uma “comunidade” embutida em uma matriz de substâncias poliméricas extracelulares composta por carboidratos, proteínas e ácidos nucleicos, denominada biofilme.
O impacto dos biofilmes nas IRAS é objeto de pesquisa em todo o mundo, sobretudo em produtos para saúde de uso prolongado. Dessa forma, estratégias para o controle da formação de biofilme nesses dispositivos ainda permanecem como desafio.(77. Sousa AF, Marques DM, Monteiro RM, Queiroz AA, Andrade D, Watanabe E. Prevention of biofilm formation on artificial pacemakers: is it feasible? Acta Paul Enferm. 2017;30(6):644–50.) Na urologia, o tratamento da colonização microbiana e da consequente infecção tendo como fonte os biofilmes é complexo e requer, na maioria das vezes, a remoção dos cateteres urinários.(88. Flores-Mireles AL, Walker JN, Caparon M, Hultgren SJ. Urinary tract infections: epidemiology, mechanisms of infection and treatment options. Nat Rev Microbiol. 2015;13(5):269–84.,99. Melzer M, Welch C. Outcomes in UK patients with hospital-acquired bacteraemia and the risk of catheter-associated urinary tract infections. Postgrad Med J. 2013;89(1052):329–34.)
A literatura científica reporta a importância da escolha adequada do calibre do cateter urinário de Foley para prevenção, principalmente, de traumas uretrais,(1010. Lo E, Nicolle LE, Coffin SE, Gould C, Maragakis LL, Meddings J, et al. Strategies to prevent catheter-associated urinary tract infections in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol. 2014;35(5):464–79.,1111. Azar R, Shadpour P. In Vivo Trial of a Novel Atraumatic Urinary Catheter Design for Prevention of Catheter-Induced Trauma. J Endourol. 2016;30(7):822–7.) porém não há relatos de pesquisas que abordem a correlação entre o tempo de exposição na formação dos biofilmes e os calibres desses dispositivos.
Assim, esta pesquisa teve como questões de pesquisa: Como o tempo de exposição e os calibres dos cateteres urinários de Foley em urina artificial (UA) contaminados com Staphylococcus aureus e Pseudomonas aeruginosa podem influenciar na formação do biofilme? Qual a carga bacteriana e a morfologia microscópica dos biofilmes formados nos cateteres em contato com UA, em condições experimentais diversas (tipo do inóculo bacteriano, tempo de exposição e calibre do cateter)?
Para responder a esses questionamentos, o objetivo desta pesquisa foi avaliar a influência do tempo de exposição e calibre na formação de biofilme em cateteres urinários de Foley.
Métodos
Esta pesquisa experimental/laboratorial foi realizada in vitro com o emprego de cateteres urinários de Foley (CUFs) de duas vias (Teleflex, Kamunting, Perak, Malaysia) compostos por látex e silicone (siliconizado), de calibres n° 14 e n° 16 Frenchs (Fr). Vale ressaltar que a escolha desses tipos de cateteres de diferentes calibres foi embasada na prática clínica, em decorrência da maior frequência de uso por clientes adultos. Com o intuito de simular a realidade do CUF no trato urinário, bem como as condições químicas e nutricionais para o desenvolvimento dos biofilmes, uma urina artificial (UA) com pH = 6,1 foi confeccionada conforme Levering,(1212. Potter P, Perry A, Stockert P, Hall A, Ochs A. Fundamentals of nursing - text and study guide package. 9th ed. Saint Louis: Elsevier Health Sciences; 2017.) sendo que o processo de esterilização dos componentes foi modificado e realizado com auxílio de filtros de 0,22 μm (ureia) e autoclave vertical (Phoenix, Araraquara, SP, Brasil) a 120 °C por 20 minutos (gelatina e demais componentes da UA).
Todo o experimento microbiológico foi realizado em quintuplicata segundo as técnicas assépticas e de biossegurança em cabine de segurança biológica classe II tipo A1 (Grupo VECO, Campinas, SP, Brasil), no laboratório do Núcleo de Estudos de Prevenção e Controle de Infecção nos Serviços de Saúde (NEPECISS) da Escola de Enfermagem de Ribeirão Preto – USP.
Fragmentos dos cateteres (FC) cortados de forma transversal (3 cm) e longitudinal foram transferidos para tubos Falcon (15 ml) contendo 7 ml de UA e 1% do inóculo bacteriano padronizado (~108 UFC/ml – unidades formadoras de colônia por mililitro) de Staphylococcus aureus (ATCC 25923) e Pseudomonas aeruginosa (ATCC 27853), separadamente, por meio de espectrofotômetro (Spectrumlab, China; λ = 625 nm e absorbância entre 0,08 a 0,100). A incubação foi realizada em estufa com agitação orbital (Quimis, Diadema, SP, Brasil) a 37°C por 24 horas e 72 horas, sendo que, a cada 24 horas, os FCss foram transferidos para tubos Falcon (15 ml) com 7 ml de UA, mas sem inóculo bacteriano, para permitir o desenvolvimento adequado dos biofilmes.
Decorrido o período de incubação, os FCs foram enxaguados, por três vezes, com 5 ml de solução salina a 0,85% (SF) esterilizada, antes de serem transferidos para tubos Falcon contendo 7 ml de SF. Em seguida, os FCs foram homogeneizados com pérolas de vidro em agitador de tubos (Phoenix Luferco, Araraquara, SP, Brasil) por 2 minutos, submetidos às diluições decimais seriadas em microtubos com 450 μl de SF até a ordem de 10-5 (24 horas) e 10-7 (72 horas); e alíquotas de 50 μl das amostras in natura e diluídas foram semeadas na superfície de placas de Petri com Mannitol Salt Agar (BD Difco™, Sparks, MD, EUA) para S. aureus e Cetrimide Agar (BD Difco™, Sparks, MD, EUA) para P. aeruginosa. Após incubação a 37 °C por 48 horas em estufa (Quimis, Diadema, SP, Brasil), a carga bacteriana (UFC/FC) foi determinada com auxílio de estereomicroscópio sob luz refletida. Ainda, controles negativos (sem os inóculos bacterianos) foram utilizados para avaliar a esterilidade dos meios de cultura, UA, materiais e reagentes após incubação a 37 °C por 14 dias.
A mensuração do pH da UA antes e após 24 horas e 72 horas de incubação com as bactérias foi realizada com tiras de pH (Kasvi, Curitiba, PR, Brasil). Para a análise dos biofilmes formados nos FCs por meio da microscopia eletrônica de varredura (MEV), as amostras do material biológico (biofilme) foram fixadas com glutaraldeído a 2,5% por no mínimo 12 horas, desidratadas em séries de álcoois (15%, 30%, 50%, 70%, 95% e 100%) durante 15 minutos para cada concentração, impregnadas com ouro e submetidas à análise por MEV Zeiss EVO 50 no Laboratório de Microscopia Eletrônica de Varredura do Departamento de Química da Faculdade de Filosofia, Ciências e Letras de Ribeirão Preto – USP, pertencente ao Programa de Equipamentos Multiusuários da Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) – Processo n° 04/09320-9.
Os dados coletados foram submetidos à codificação apropriada, à validação por dupla digitação, à exportação para o software BioEstat® (versão 5.3) e analisados por estatística descritiva (média, desvio-padrão, valores mínimos e máximos) e teste não paramétrico de Kruskall-Wallis seguido do teste de Student-Newman-Keuls. Ainda, empregou-se o nível de significância de 5%.
Resultados
Conforme a figura 1, a avaliação das médias das cargas bacterianas (logUFC/FC) revelou que não houve diferença na formação de biofilme de S. aureus em decorrência do tempo de exposição e dos calibres dos FCs (p = 0,5651).
Comparação da formação de biofilme por meio das médias das cargas bacterianas (logUFC/FC) de Staphylococcus aureus em fragmentos de cateteres urinários (Foley) - (FC) com calibres (n° 14 e n° 16) e tempos de exposição (24 horas e 72 horas) diferentes
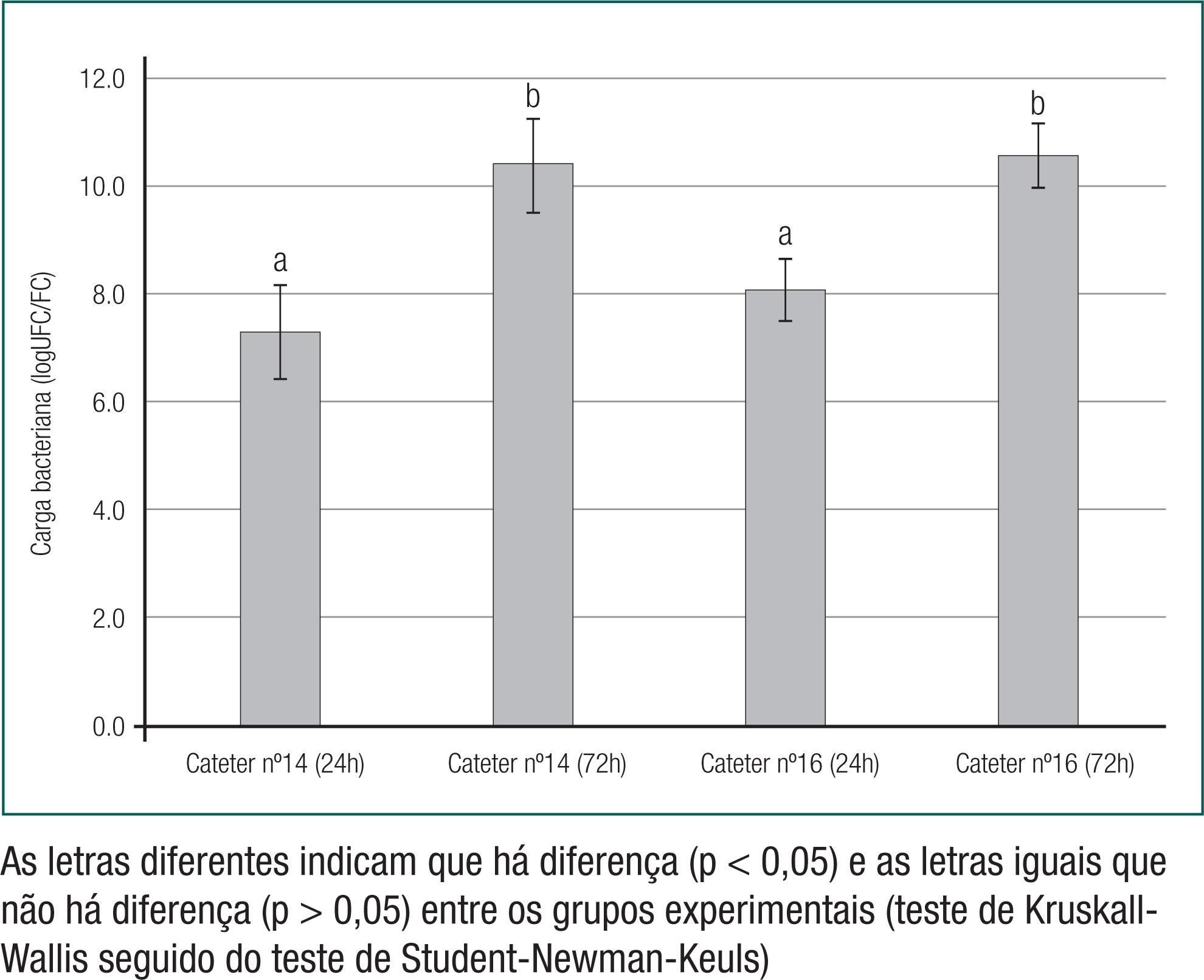
Por outro lado, de acordo com a figura 2, houve diferença entre as médias das cargas bacterianas (logUFC/FC) de P. aeruginosa no biofilme com relação aos diferentes tempos de exposição (24 horas e 72 horas) para os calibres n° 14 (p = 0,0046) e n° 16 (p = 0,0162) dos FCs. Entretanto, os calibres dos FCs não influenciaram na formação do biofilme de P. aeruginosa em ambos os tempos de exposição de 24 horas (p = 0,5212) e 72 horas (p = 0,8307).
Comparação da formação de biofilme por meio das médias das cargas bacterianas (logUFC/FC) de Pseudomonas aeruginosa em fragmentos de cateteres urinários (Foley) - (FC) com calibres (n° 14 e n° 16) e tempos de exposição (24 horas e 72 horas) diferentes
Com relação aos valores de pH das amostras de UA antes e após o tempo de exposição para formação dos biofilmes nos FCs, eles permaneceram inalterados durante todo o experimento (pH = 6,1). As eletromicrografias (10.000×) obtidas por MEV exibiram a formação de biofilmes constituídos de matrizes densas e extensas de substâncias poliméricas extracelulares e cocos agrupados como estafilococos (S. aureus) (Figura 3), bem como bastonetes (P. aeruginosas) (Figura 4) em todas as amostras de FC. Segundo a figura 3, não foi constatada diferença na formação de biofilmes (S. aureus) em comparação ao tempo de exposição (24 horas e 72 horas) e ao calibre dos FCs (n° 14 e n° 16).
Eletromicrografias por MEV de fragmentos de cateter urinário (FC) de Foley com formação de biofilme de S. aureus
Eletromicrografias por MEV de fragmentos de cateter urinário (FC) de Foley com formação de biofilme de P. aeruginosa
Além disso, a diferença na formação de biofilmes (P. aeruginosas) foi observada apenas quanto ao tempo de exposição (24 horas e 72 horas) e não ao calibre dos FCs (n° 14 e n° 16) (Figura 4).
Discussão
A literatura científica apresenta uma série de recomendações acerca da importância da escolha adequada do calibre do CUF para prevenção, principalmente, de traumas uretrais, embora as pesquisas sejam escassas na abordagem da correlação entre os calibres desses dispositivos com a formação de biofilmes.(1414. Nicolle LE. Catheter associated urinary tract infections. Antimicrob Resist Infect Control. 2014 Jul 25;3:23. doi: 10.1186/2047-2994-3-23. eCollection 2014. Review.
https://doi.org/10.1186/2047-2994-3-23...
,1515. Mandakhalikar KD, Rahmat JN, Chiong E, Neoh KG, Shen L, Tambyah PA. Extraction and quantification of biofilm bacteria: method optimized for urinary catheters. Sci Rep. 2018;8(1):8069.) Nesta pesquisa, não houve influência dos calibres de FC (n° 14 e n° 16) nas médias das cargas bacterianas (logUFC/FC) nos biofilmes de S. aureus (p = 0,5651) (Figura 1) e P. aeruginosa, tempos de exposição de 24 horas (p = 0,5212) e 72 horas (p = 0,8307) (Figura 2), bem como na análise por MEV (Figuras 3 e 4). Os CUFs utilizados na prática clínica podem permitir a incrustação de cristais e, consequentemente, o bloqueio do lúmen desses dispositivos, pois são constituídos basicamente de látex, material propício para essa problemática e para a formação de biofilme.(1616. Stickler DJ. Clinical complications of urinary catheters caused by crystalline biofilms: something needs to be done. J Intern Med. 2014;276(2):120–9.) Como alternativa para a redução da inflamação uretral, o uso de CUF de silicone demonstrou eficiência, porém não foi capaz de minimizar a formação de biofilme.(1717. Verma A, Bhani D, Tomar V, Bachhiwal R, Yadav S. Differences in Bacterial Colonization and Biofilm Formation Property of Uropathogens between the Two most Commonly used Indwelling Urinary Catheters. J Clin Diagn Res. 2016;10(6):PC01–03.) Em contrapartida, outros autores relataram a diminuição dos riscos de incrustação e formação de biofilme nos CUFs de silicone quando comparados com os de látex, dependendo do tipo de microrganismo.(22. Agência Nacional de Vigilância Sanitária (ANVISA). Medidas de prevenção de infecção relacionada à assistência à saúde [Internet]. 2a ed. Brasília (DF): ANVISA; 2017. [citado 2018 Set 12]. Disponível em: https://www20.anvisa.gov.br/segurancadopaciente/index.php/publicacoes/item/caderno-5
https://www20.anvisa.gov.br/segurancadop...
,1818. Tamura NK, Gasparetto A, Svidzinski TI. Evaluation of the adherence of Candida species to urinary catheters. Mycopathologia. 2003;156(4):269–72.)
Assim, o biofilme pode ser constituído por um único tipo bacteriano ou por múltiplas espécies com possibilidade de formar estruturas tridimensionais, heterogêneas e altamente resistentes aos agentes físico-químicos.(1919. Santos AL, Galdino AC, Mello TP, Ramos LS, Branquinha MH, Bolognese AM, et al. What are the advantages of living in a community? A microbial biofilm perspective! Mem Inst Oswaldo Cruz. 2018;113(9):e180212.,2020. De Souza PR, De Andrade D, Cabral DB, Watanabe E. Endotracheal tube biofilm and ventilator-associated pneumonia with mechanical ventilation. Microsc Res Tech. 2014;77(4):305–12.) Na presente pesquisa, todas as amostras de FC constituídos de látex e silicone apresentaram formação de biofilmes de S. aureus e P. aeruginosa, separadamente. A colonização microbiana e a formação de biofilme no CUF pode ter início logo após a sua inserção, em uma proporção de 5% a 10% ao dia, sendo que, ao final de 4 semanas, todos os dispositivos dos clientes estarão colonizados. Estima-se que 50% dos clientes com CUF de curta duração (até 7 dias) adquirem ITU-AC.(2121. Mandakhalikar KD, Chua RR, Tambyah PA. New technologies for prevention of catheter associated urinary tract infection. Curr Treat Options Infect Dis. 2016;8(1):24–41.,2222. Ramanathan R, Duane TM. Urinary tract infections in surgical patients. Surg Clin North Am. 2014;94(6):1351–68.) A formação de biofilmes em CUF é um processo que depende de uma série de fatores físico-químicos, como a presença de nutrientes e o fluxo urinário, o design e o tempo de exposição ao dispositivo.(2323. Maeda T, García-Contreras R, Pu M, Sheng L, Garcia LR, Tomás M, et al. Quorum quenching quandary: resistance to antivirulence compounds. ISME J. 2012;6(3):493–501.)
Pesquisadores demonstraram que o tempo de exposição do CUF para formação de biofilme é variável e depende do tipo de consórcio microbiano e do material. Assim, pode ocorrer imediatamente após a inserção do dispositivo, ou até 24 horas, ou de 3 a 7 dias.(1616. Stickler DJ. Clinical complications of urinary catheters caused by crystalline biofilms: something needs to be done. J Intern Med. 2014;276(2):120–9.,2424. Alves MJ, Barreira JC, Carvalho I, Trinta L, Perreira L, Ferreira IC, et al. Propensity for biofilm formation by clinical isolates from urinary tract infections: developing a multifactorial predictive model to improve antibiotherapy. J Med Microbiol. 2014;63(Pt 3):471–7.
25. Gould CV, Umscheid CA, Agarwal RK, Kuntz G, Pegues DA; Healthcare Infection Control Practices Advisory Committee. Guideline for prevention of catheter-associated urinary tract infections 2009. Infect Control Hosp Epidemiol. 2010;31(4):319–26.
26. Tenke P, Mezei T, Bőde I, Köves B. Catheter-associated Urinary Tract Infections. Eur Urol Suppl. 2017;16(4):138–43.-2727. Tenke P, Köves B, Nagy K, Hultgren SJ, Mendling W, Wullt B, et al. Update on biofilm infections in the urinary tract. World J Urol. 2012;30(1):51–7.) Na presente pesquisa, o tempo de exposição (24 horas e 72 horas) influenciou somente a formação do biofilme de P. aeruginosa em ambos os calibres n° 14 (p = 0,0046) e n° 16 (p = 0,0162) dos FCs. Esses resultados sugerem que o tempo de exposição pode influenciar a formação de biofilmes, dependendo do tipo bacteriano.
A urina humana de um indivíduo saudável exibe aproximadamente um valor de pH = 6,0. Em virtude do metabolismo bacteriano, o pH da urina pode se elevar e ocasionar a incrustação de cristais de cálcio e magnésio, bem como a formação de biofilmes nos CUFs.(2828. Milo S, Thet NT, Liu D, Nzakizwanayo J, Jones BV, Jenkins AT. An in-situ infection detection sensor coating for urinary catheters. Biosens Bioelectron. 2016;81:166–72.) No entanto, nesta pesquisa, os valores de pH das amostras de UA antes e após o tempo de exposição para formação dos biofilmes nos FCs permaneceram inalterados durante todo o experimento (pH = 6,1). Talvez esse resultado possa ser explicado pela renovação constante da UA a cada 24 horas, que teve como intuito a nutrição e o desenvolvimento dos biofilmes de forma adequada. Dessa forma, este tipo de pesquisa é fundamental por sua contribuição para o avanço do conhecimento cientifico acerca da influência das variáveis tempo e calibre na formação dos biofilmes em CUF. Destaca-se ainda o pioneirismo na área da enfermagem, ao analisar por MEV a morfologia microscópica dos biofilmes nesses dispositivos mais comumente utilizados na prática clínica.
Então, cuidados na inserção e manutenção do CUF, além da identificação dos microrganismos mais prevalentes, são essenciais, pois proporcionam à equipe de enfermagem, bem como de assistência à saúde, o desenvolvimento de estratégias de prevenção da ITU-AC. Além disso, a influência do tempo de exposição do CUF revelou a necessidade de monitoramento constante, principalmente em períodos prolongados, com a retirada desse dispositivo o mais precocemente possível. Esta pesquisa apresenta limitações inerentes a um experimento in vitro. Por não se tratar de uma pesquisa com seres humanos (utilizou-se urina artificial), as cepas bacterianas padrão na formação dos biofilmes com uma única espécie bacteriana (monoespécie), tempo de exposição e calibres foram estabelecidos. Assim, os resultados podem não retratar com fidelidade a realidade clínica.
Conclusão
Todos os fragmentos de cateteres de Foley, independentemente do calibre (n° 14 e n° 16 Frenchs) e tipo bacteriano (S. aureus e P. aeruginosa), apresentaram formação de biofilme em urina artificial com valor de pH inalterado. No entanto, os calibres não demonstraram diferenças na formação dos biofilmes, e o tempo de exposição influenciou apenas o biofilme de P. aeruginosa.
Referências
-
1Sousa ÁF, Queiroz AA, Oliveira LB, Moura LK, Andrade D, Watanabe E, et al. Deaths among the elderly with ICU infections. Rev Bras Enferm. 2017;70(4):733–9.
-
2Agência Nacional de Vigilância Sanitária (ANVISA). Medidas de prevenção de infecção relacionada à assistência à saúde [Internet]. 2a ed. Brasília (DF): ANVISA; 2017. [citado 2018 Set 12]. Disponível em: https://www20.anvisa.gov.br/segurancadopaciente/index.php/publicacoes/item/caderno-5
» https://www20.anvisa.gov.br/segurancadopaciente/index.php/publicacoes/item/caderno-5 -
3Barbadoro P, Labricciosa FM, Recanatini C, Gori G, Tirabassi F, Martini E, et al. Catheter-associated urinary tract infection: role of the setting of catheter insertion. Am J Infect Control. 2015;43(7):707–10.
-
4Pickard R, Lam T, Maclennan G, Starr K, Kilonzo M, McPherson G, et al. Types of urethral catheter for reducing symptomatic urinary tract infections in hospitalised adults requiring short-term catheterisation: multicentre randomised controlled trial and economic evaluation of antimicrobial- and antiseptic-impregnated urethral catheters (the CATHETER trial). Health Technol Assess. 2012;16(47):1–197.
-
5Tan CW, Chlebicki MP. Urinary tract infections in adults. Singapore Med J. 2016 Sep;57(9):485–90.
-
6Schulz L, Hoffman RJ, Pothof J, Fox B. Top ten myths regarding the diagnosis and treatment of urinary tract infections. J Emerg Med. 2016;51(1):25–30.
-
7Sousa AF, Marques DM, Monteiro RM, Queiroz AA, Andrade D, Watanabe E. Prevention of biofilm formation on artificial pacemakers: is it feasible? Acta Paul Enferm. 2017;30(6):644–50.
-
8Flores-Mireles AL, Walker JN, Caparon M, Hultgren SJ. Urinary tract infections: epidemiology, mechanisms of infection and treatment options. Nat Rev Microbiol. 2015;13(5):269–84.
-
9Melzer M, Welch C. Outcomes in UK patients with hospital-acquired bacteraemia and the risk of catheter-associated urinary tract infections. Postgrad Med J. 2013;89(1052):329–34.
-
10Lo E, Nicolle LE, Coffin SE, Gould C, Maragakis LL, Meddings J, et al. Strategies to prevent catheter-associated urinary tract infections in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol. 2014;35(5):464–79.
-
11Azar R, Shadpour P. In Vivo Trial of a Novel Atraumatic Urinary Catheter Design for Prevention of Catheter-Induced Trauma. J Endourol. 2016;30(7):822–7.
-
12Potter P, Perry A, Stockert P, Hall A, Ochs A. Fundamentals of nursing - text and study guide package. 9th ed. Saint Louis: Elsevier Health Sciences; 2017.
-
13Levering V, Wang Q, Shivapooja P, Zhao X, López GP. Soft robotic concepts in catheter design: an on-demand fouling-release urinary catheter. Adv Healthc Mater. 2014;3(10):1588–96.
-
14Nicolle LE. Catheter associated urinary tract infections. Antimicrob Resist Infect Control. 2014 Jul 25;3:23. doi: 10.1186/2047-2994-3-23. eCollection 2014. Review.
» https://doi.org/10.1186/2047-2994-3-23 -
15Mandakhalikar KD, Rahmat JN, Chiong E, Neoh KG, Shen L, Tambyah PA. Extraction and quantification of biofilm bacteria: method optimized for urinary catheters. Sci Rep. 2018;8(1):8069.
-
16Stickler DJ. Clinical complications of urinary catheters caused by crystalline biofilms: something needs to be done. J Intern Med. 2014;276(2):120–9.
-
17Verma A, Bhani D, Tomar V, Bachhiwal R, Yadav S. Differences in Bacterial Colonization and Biofilm Formation Property of Uropathogens between the Two most Commonly used Indwelling Urinary Catheters. J Clin Diagn Res. 2016;10(6):PC01–03.
-
18Tamura NK, Gasparetto A, Svidzinski TI. Evaluation of the adherence of Candida species to urinary catheters. Mycopathologia. 2003;156(4):269–72.
-
19Santos AL, Galdino AC, Mello TP, Ramos LS, Branquinha MH, Bolognese AM, et al. What are the advantages of living in a community? A microbial biofilm perspective! Mem Inst Oswaldo Cruz. 2018;113(9):e180212.
-
20De Souza PR, De Andrade D, Cabral DB, Watanabe E. Endotracheal tube biofilm and ventilator-associated pneumonia with mechanical ventilation. Microsc Res Tech. 2014;77(4):305–12.
-
21Mandakhalikar KD, Chua RR, Tambyah PA. New technologies for prevention of catheter associated urinary tract infection. Curr Treat Options Infect Dis. 2016;8(1):24–41.
-
22Ramanathan R, Duane TM. Urinary tract infections in surgical patients. Surg Clin North Am. 2014;94(6):1351–68.
-
23Maeda T, García-Contreras R, Pu M, Sheng L, Garcia LR, Tomás M, et al. Quorum quenching quandary: resistance to antivirulence compounds. ISME J. 2012;6(3):493–501.
-
24Alves MJ, Barreira JC, Carvalho I, Trinta L, Perreira L, Ferreira IC, et al. Propensity for biofilm formation by clinical isolates from urinary tract infections: developing a multifactorial predictive model to improve antibiotherapy. J Med Microbiol. 2014;63(Pt 3):471–7.
-
25Gould CV, Umscheid CA, Agarwal RK, Kuntz G, Pegues DA; Healthcare Infection Control Practices Advisory Committee. Guideline for prevention of catheter-associated urinary tract infections 2009. Infect Control Hosp Epidemiol. 2010;31(4):319–26.
-
26Tenke P, Mezei T, Bőde I, Köves B. Catheter-associated Urinary Tract Infections. Eur Urol Suppl. 2017;16(4):138–43.
-
27Tenke P, Köves B, Nagy K, Hultgren SJ, Mendling W, Wullt B, et al. Update on biofilm infections in the urinary tract. World J Urol. 2012;30(1):51–7.
-
28Milo S, Thet NT, Liu D, Nzakizwanayo J, Jones BV, Jenkins AT. An in-situ infection detection sensor coating for urinary catheters. Biosens Bioelectron. 2016;81:166–72.
Datas de Publicação
-
Publicação nesta coleção
2018
Histórico
-
Recebido
19 Jul 2018 -
Aceito
15 Nov 2018