Resumos
A distribuição e abundância da ictiofauna na zona de arrebentação de praias arenosas do Município do Rio de Janeiro, Brasil, foram estudadas objetivando detectar variações sazonais ou influências do grau de exposição na estrutura da comunidade de peixes jovens. Amostras trimestrais foram realizadas em 10 praias sendo agrupadas de acordo com o nível de exposição (abrigada, exposta e muito exposta), entre Janeiro e Novembro de 2004, com os arrastos tendo sido efetuados perpendiculares à linha de costa. Foram registrados 6.464 peixes, distribuídos em 38 espécies e 22 famílias, com o predomínio de formas juvenis ou de pequeno porte. As famílias Clupeidae, Carangidae e Sciaenidae representaram 79% do número total de indivíduos e 61% da biomassa total. As espécies de maior participação na biomassa, representando 81% do peso total, foram Harengula clupeola (36%), Orthopristis ruber (14%), Mugil liza (10%), Trachinotus goodei (8%), Trachinotus carolinus (7%) e Umbrina coroides (6%). Três espécies apresentaram maior abundância relativa, tendo cada uma, contribuído acima de 10% do número total (Harengula clupeola, Umbrina coroides e Trachinotus carolinus), mas somente T. carolinus apresentou um padrão bem definido, sendo mais abundante nas zonas abrigadas. As maiores CPUEs (número de indivíduos e biomassa) e o número de espécies foram encontradas nas zonas abrigadas (p < 0,05); sazonalmente nenhum destes indicadores apresentou diferença significativa (p > 0,05). O grau de exposição às ondas foi confirmado como um fator primário na estruturação da comunidade de peixes, com os locais mais abrigados provavelmente associados à maior disponibilidade de organismos planctônicos, menores turbulências e maior estabilidade do substrato.
praia arenosa; zona de arrebentação; peixe; ictiofauna; Rio de Janeiro
Distribution and abundance of the ichthyofauna of surf zone in sandy beaches of the Rio de Janeiro Municipality, Brazil, were studied aiming to detect seasonal and wave exposure gradient influences on the fish community structure. Quarterly samplings were performed at 10 sites according to the exposure degree (sheltered, exposed and very exposed) between January and November 2004, by using beach seines with hauls carried out perpendicular to the coastline. A total of 6,464 fishes in 38 species and 22 families were identified, mainly juveniles or small sized individuals. The families Clupeidae, Carangidae and Sciaenidae amounted to 79% of the total fish number and 61% of the total biomass. The following species amounted to 81% of the total weight were: Harengula clupeola (36%), Orthopristis ruber (14%), Mugil liza (10%), Trachinotus goodei (8%), Trachinotus carolinus (7%) and Umbrina coroides (6%). Three species showed the highest relative abundance, contributing each one more than 10% of the total number (Harengula clupeola, Umbrina coroides, e Trachinotus carolinus); but only T. carolinus showed a clear pattern, being more abundant in the sheltered beaches. The highest CPUEs (number of individuals and biomass) and number of species values occurred in the sheltered beaches (p < 0.05); none of these indicators showed significant seasonal differences (p > 0.05), although some trends were detected. The wave exposure degree was confirmed as a primary factor influencing the fish community structure, with sheltered sites probably associated to higher plankton availability, lesser turbulence and more substrate stability.
sandy beach; surf zone; fish; ichthyofauna; Rio de Janeiro
ARTIGOS
Efeito do grau de exposição às ondas sobre a comunidade de peixes juvenis em praias arenosas do Município do Rio de Janeiro, Brasil
Effect of the wave exposure gradient on juvenile fish community in sandy beaches of the Rio de Janeiro City, Brazil
Ruan Managna Vasconcellos; Joaquim Neto de Sousa Santos; Márcio de Araújo Silva; Francisco Gerson Araújo1 1 Autor para correspondência: Francisco Gerson Araújo, e-mail: gerson@ufrrj.br, www.ufrrj.br
Programa de Pós Graduação em Biologia Animal PPGBA, Universidade Federal Rural do Rio de Janeiro, Laboratório de Ecologia de Peixes, IB/DBA, BR 465 Km 7, CEP 23890-000, Seropédica, RJ, Brasil
RESUMO
A distribuição e abundância da ictiofauna na zona de arrebentação de praias arenosas do Município do Rio de Janeiro, Brasil, foram estudadas objetivando detectar variações sazonais ou influências do grau de exposição na estrutura da comunidade de peixes jovens. Amostras trimestrais foram realizadas em 10 praias sendo agrupadas de acordo com o nível de exposição (abrigada, exposta e muito exposta), entre Janeiro e Novembro de 2004, com os arrastos tendo sido efetuados perpendiculares à linha de costa. Foram registrados 6.464 peixes, distribuídos em 38 espécies e 22 famílias, com o predomínio de formas juvenis ou de pequeno porte. As famílias Clupeidae, Carangidae e Sciaenidae representaram 79% do número total de indivíduos e 61% da biomassa total. As espécies de maior participação na biomassa, representando 81% do peso total, foram Harengula clupeola (36%), Orthopristis ruber (14%), Mugil liza (10%), Trachinotus goodei (8%), Trachinotus carolinus (7%) e Umbrina coroides (6%). Três espécies apresentaram maior abundância relativa, tendo cada uma, contribuído acima de 10% do número total (Harengula clupeola, Umbrina coroides e Trachinotus carolinus), mas somente T. carolinus apresentou um padrão bem definido, sendo mais abundante nas zonas abrigadas. As maiores CPUEs (número de indivíduos e biomassa) e o número de espécies foram encontradas nas zonas abrigadas (p < 0,05); sazonalmente nenhum destes indicadores apresentou diferença significativa (p > 0,05). O grau de exposição às ondas foi confirmado como um fator primário na estruturação da comunidade de peixes, com os locais mais abrigados provavelmente associados à maior disponibilidade de organismos planctônicos, menores turbulências e maior estabilidade do substrato.
Palavras-chave: praia arenosa, zona de arrebentação, peixe, ictiofauna, Rio de Janeiro.
ABSTRACT
Distribution and abundance of the ichthyofauna of surf zone in sandy beaches of the Rio de Janeiro Municipality, Brazil, were studied aiming to detect seasonal and wave exposure gradient influences on the fish community structure. Quarterly samplings were performed at 10 sites according to the exposure degree (sheltered, exposed and very exposed) between January and November 2004, by using beach seines with hauls carried out perpendicular to the coastline. A total of 6,464 fishes in 38 species and 22 families were identified, mainly juveniles or small sized individuals. The families Clupeidae, Carangidae and Sciaenidae amounted to 79% of the total fish number and 61% of the total biomass. The following species amounted to 81% of the total weight were: Harengula clupeola (36%), Orthopristis ruber (14%), Mugil liza (10%), Trachinotus goodei (8%), Trachinotus carolinus (7%) and Umbrina coroides (6%). Three species showed the highest relative abundance, contributing each one more than 10% of the total number (Harengula clupeola, Umbrina coroides, e Trachinotus carolinus); but only T. carolinus showed a clear pattern, being more abundant in the sheltered beaches. The highest CPUEs (number of individuals and biomass) and number of species values occurred in the sheltered beaches (p < 0.05); none of these indicators showed significant seasonal differences (p > 0.05), although some trends were detected. The wave exposure degree was confirmed as a primary factor influencing the fish community structure, with sheltered sites probably associated to higher plankton availability, lesser turbulence and more substrate stability.
Keywords: sandy beach, surf zone, fish, ichthyofauna, Rio de Janeiro.
Introdução
A zona de arrebentação é a área entre o limite externo de quebra das ondas e a linha de costa da praia (Carter 1988, Brown & McLachlan 1990), representando uma importante área de criação para vários peixes. A ação das ondas, considerada como sinônimo de exposição, é um dos fatores primários mais importantes no controle das características físico-químicas na zona de arrebentação (McLachlan 1980). Essa variável ambiental tem uma importante contribuição na composição e estrutura da comunidade íctica (McLachlan et al. 1984, Dexter 1990, Clark et al. 1996, Clark 1997), devido ao estresse físico local decorrente do quebrar das ondas, afetando a modificação da estrutura do sedimento e/ou as fontes de alimentos (Bennett 1989).
As praias arenosas constituem a maior parte das áreas costeiras do mundo (Brown & McLachlan 1990), sendo consideradas importantes áreas de crescimento para muitas espécies (McLachlan et al. 1981). Estas áreas formam uma faixa litorânea que se estende desde a linha da costa até o limite externo das células de circulação das correntes geradas pela própria ação das ondas (McLachlan & Erasmus 1983), funcionando como um ecossistema semi-fechado e auto-sustentável, possuindo uma diversidade considerável das comunidades do nécton (Brown & McLachlan 1990). A praia arenosa e a sua zona de arrebentação constituem um ambiente fisicamente controlado, onde a energia das ondas é a força motriz da maioria dos processos físicos, químicos e biológicos (Bennett 1989). Para se adaptarem à elevada instabilidade e diferentes níveis de exposição, os peixes desenvolvem ao longo de sua história evolutiva formato do corpo visando minimizar os custos de energia para contrapor o efeito das ondas (Wootton 1992). Outro aspecto importante é o efeito sazonal dos pulsos de reprodução de peixes costeiros cujos juvenis recrutam nestas áreas, onde encontram alimento e proteção contra predadores devido à elevada turbidez e baixa profundidade (Lasiak 1981).
De acordo com Romer (1990) e Clark et al. (1996), o aumento do grau de exposição é geralmente acompanhado pela diminuição na abundância e riqueza de peixes e aumento na dominância, embora isto também não tenha sido considerado uma regra geral uma vez que abundância e diversidade nem sempre são maiores nos locais mais abrigados e de menor turbulência (Pihl & Van Der Veer 1992). Fatores como diferenciação nos equipamentos de pesca, metodologia de amostragens e influências ambientais, como abundância de macrófitas, salinidade e turbidez podem interagir e influenciar os resultados de testes sobre o grau de exposição às ondas (Monteiro-Neto & Musick 1994, Clark 1996, Gaelzer & Zalmon 2003).
Em razão das dificuldades enfrentadas para realizar estudos faunísticos nesta faixa de alta turbulência, a ictiofauna desta zona tem recebido bem menos atenção do que as de outros ecossistemas costeiros e, conseqüentemente, pouco se conhece sobre a ecologia de peixes desse ambiente. O presente trabalho visou testar a hipótese nula de que não existe influência do grau de exposição às ondas sobre a abundância e riqueza de espécies de peixes jovens em praias arenosas, em oposição à hipótese alternativa de que praias com menor grau de exposição abrigam maiores abundâncias e riquezas de espécies. Adicionalmente, também se objetivou determinar eventuais variações sazonais na composição e na abundância relativa das espécies.
Material e Métodos
Dez praias foram amostradas na costa do município do Rio de Janeiro, de acordo com o grau de exposição, sendo duas na zona abrigada (B1) no interior da Baía de Guanabara (praias de Botafogo e Flamengo), quatro na zona exposta (B2) da área oceânica (Barra da Tijuca 1, Barra da Tijuca 2, Ipanema e Copacabana) e quatro na zona muito exposta (B3) da área oceânica (Grumari, Prainha, Recreio e São Conrado). Esta classificação seguiu metodologia proposta por McLachlan (1980) e foi medida por meio de uma escala subjetiva para avaliação da intensidade e da altura das ondas, durante o período de um minuto. A intensidade das ondas foi definida de acordo com o número de batimento das mesmas e avaliado por meio da quantidade de ondas que quebram na linha da costa. Foram atribuídos os seguintes escores: (0) praticamente ausente, (1) levemente moderada, (2) moderada, (3) extrema. A altura das ondas foi estimada com base em observações visuais da crista das ondas. Três escores foram atribuídos para a altura das ondas: (1) raramente supera 0,5 m; (2) raramente excede 1 m; (3) nunca menor que 1,5 m. O grau de exposição da praia foi obtido por meio da soma dos escores da intensidade e da altura das ondas.
Foram realizadas quatro amostragens em cada localidade, distribuídas sazonalmente em janeiro (verão), maio (outono), agosto (inverno) e novembro (primavera) de 2004. Em cada localidade, foram aplicadas duas passagens com redes de arrasto (10 x 2 m, malha de 7 mm entre nós), manuseadas de forma perpendicular em relação à linha da costa a partir de 1,5 m de profundidade, por uma extensão de aproximadamente 10 m, dependendo da declividade da praia. A soma dos peixes nos dois arrastos foi considerada uma unidade amostral, definindo, assim as Capturas por Unidade de Esforço (CPUEs). Em cada amostragem também foram mensurados temperatura, oxigênio dissolvido, salinidade e transparência. Para determinar a temperatura e o oxigênio dissolvido, foi utilizado um multisensor Horiba; para a salinidade, um refratômetro óptico Erma Tokio (precisão de 0,5 ppm) e, para a transparência, um disco de Secchi graduado em centímetros.
Os exemplares capturados foram fixados em formalina a 10% e posteriormente conservados em álcool a 70%, sendo identificados segundo Figueiredo & Menezes (1978, 1980, 2000) e Menezes & Figueiredo (1980, 1985). Parte dos peixes capturados foi depositada como material testemunho na coleção ictiológica do Laboratório de Ecologia de Peixes da UFRRJ.
Para avaliar as variações na composição e abundância das assembléias de peixes foram realizadas comparações temporais, utilizando-se as capturas por unidade de esforço (CPUEs), tanto para o número de indivíduos quanto para biomassa total como indicadoras da abundância relativa. Foi utilizada Análise de Variância (ANOVA) sobre os dados transformados [Log10 (x + 1)], onde x foi o valor bruto, para detectar possíveis diferenças significativas nas CPUEs entre as estações do ano e zonas de batimentos. Aplicou-se o teste posteriori de Tukey HSD, quando foram detectadas diferenças significativas (p < 0,05) pela ANOVA.
Resultados
1. Composição da ictiofauna
Foram capturados 6.464 indivíduos, pertencentes 38 espécies distribuídas em 22 famílias (Tabela 1), sendo em sua grande maioria juvenis ou indivíduos de pequeno porte. As famílias Clupeidae, Carangidae e Sciaenidae representaram 79% do número total de indivíduos e 61% da biomassa total de peixes capturados. As famílias Carangidae, Sciaenidae e Gerreidae contribuíram com o maior número de espécies, com quatro espécies cada uma (Tabela 1). Com relação à biomassa, foram capturadas 6.330,91 g de peixes, sendo que seis espécies contribuíram com 80,1% do peso total: Harengula clupeola (35,8%), Orthopristis ruber (13,8%), Mugil liza (9,7%), Trachinotus goodei (8,1%), Trachinotus carolinus (6,6%) e Umbrina coroides (5,9%) (Tabela 2).
Quatro espécies apresentaram maior abundância relativa, tendo cada uma, contribuído com mais de 7,0% do número total capturado: H. clupeola (39,3%), U. coroides (20,5%), T. carolinus (11,8%) e M. liza (7,2%) (Tabela 2). Outras espécies menos abundantes e que contribuíram com mais de 0,5% do número total capturado foram Anchoa lyoleps, Atherinella brasiliensis, Trachinotus goodei, Diplodus argenteus, Sardinella brasiliensis, O. ruber, Pomadasys corvinaeformis, Menticirrhus littoralis e Pomatomus saltator. Quando considerado o conjunto das amostragens, T. carolinus e T. goodei foram as espécies mais freqüentes, ocorrendo em aproximadamente 45% das amostras, seguidas por H. clupeola (27%), U. coroides (20%), M. littoralis e P. saltator, estas duas últimas com 15% de ocorrência (Tabela 2).
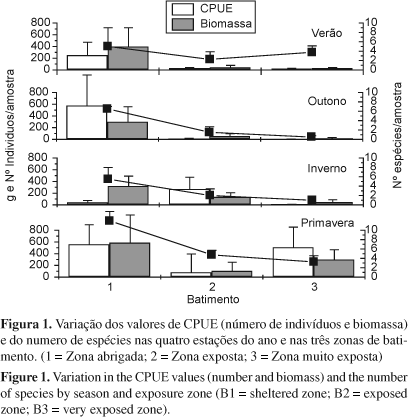
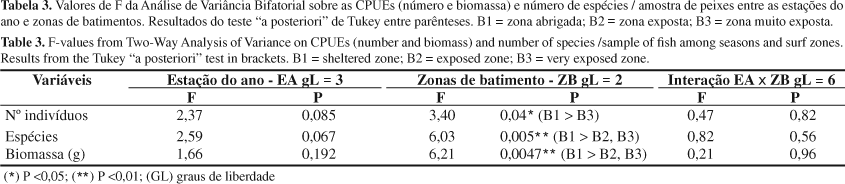
Não houve diferenças significativas nas interações dos fatores estação do ano e zonas de batimento para CPUEs (número de indivíduos e biomassa) e número de espécies (Tabela 3). Em relação às zonas de batimento, foram encontradas diferenças significativas para as CPUEs tanto em número de indivíduos (F = 3,40; p = 0,04), como em biomassa (F = 6,21; p = 0,0047), com as zonas abrigadas (B1) apresentado maiores valores do que as praias com batimento (zonas expostas e muito expostas). O número de espécies por amostra (F = 6,03; p = 0,0047) também foi significativamente maior na zona abrigada. (Figura 1, Tabelas 3 e 4). A riqueza expressa como número total de espécies, também foi maior na zona abrigada (31) e menor na zona muito exposta (13).
Treze espécies contribuíram com mais de 0,5% do total de peixes capturados e distribuíram-se no ambiente conforme o grau de exposição. A maior parte destes peixes utilizou as zonas abrigadas, com destaque para T. carolinus, M. liza, A. lyoleps, S. brasiliensis, O. ruber, P. corvinaeformis e P. saltator (Tabela 4). Por outro lado, T. goodei foi, ao contrário da co-genérica T. carolinus, a espécie que apresentou maior ocorrência na zona muito exposta. Harengula clupeola, A. brasiliensis e D. argenteus não apresentaram um padrão bem definido de distribuição no ambiente.
Do total de 38 espécies identificadas, somente A. brasiliensis, H. clupeola, M. littoralis, P. saltator, T. carolinus, T. goodei e U. coroides ocorreram em todas as estações do ano. As CPUEs, o número de espécies e a biomassa não apresentaram diferenças significativas entre as estações do ano (p > 0,05) (Figura 1, Tabela 3), embora tenham sido detectadas tendências de números de indivíduos relativamente menores no inverno e maiores no outono e primavera (F = 2,37; P = 0,085) (Figura 1). Quando cada zona de batimento foi considerada em separado, diferenças significativas foram apresentadas apenas para o número de espécies na zona muito exposta (B3) onde os valores do verão e primavera foram significativamente maiores do que os do outono. Na primavera foram registradas tendências de maiores biomassas (Figura 1, Tabela 3).
1.1. Variação espaço-temporal das espécies mais abundantes
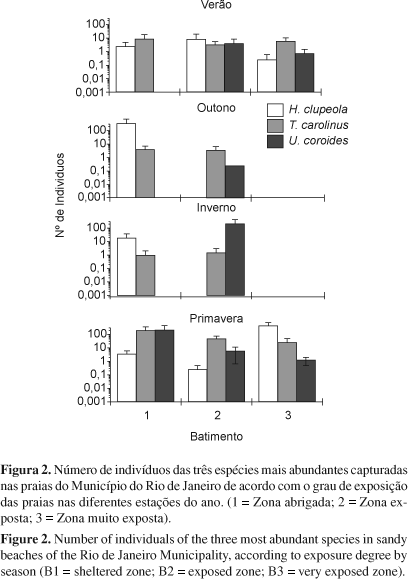
As espécies que contribuíram com mais de 10% do número total de indivíduos capturados (H. clupeola, T. carolinus e U. coroides), não apresentaram diferenças significativas nas abundâncias entre as zonas de batimento. Com relação às estações do ano (Tabela 5), a única exceção foi T. carolinus, cuja abundância variou significativamente, sendo maior na primavera e menor no outono e inverno (F = 6,14; P = 0,01). Em geral, a abundância das espécies dominantes variou entre as estações do ano de acordo com a zona de batimento, com H. clupeola predominando durante o outono na zona abrigada e durante a primavera na zona mais exposta; U. coroides predominou durante o inverno na zona exposta e durante a primavera na zona abrigada, e T. carolinus predominou durante a primavera na zona abrigada (Figura 2).
Discussão
As maiores riquezas, tanto indicadas pelo número de espécies por amostra, como pelo número acumulado de espécies, bem como as maiores CPUEs (número e biomassa) de peixes jovens nas praias do município do Rio de Janeiro ocorreram nas zonas mais protegidas da ação das ondas. Uma situação inversa ocorre nas zonas mais expostas, onde um menor número de espécies e indivíduos usa tais hábitats. Tais observações indicam que o grau de exposição é um fator primário determinante da estruturação das comunidades de peixes jovens, corroborando as observações de Dexter (1990) e Clark (1997) que reportaram a influência do grau de exposição às ondas na composição e estrutura da comunidade íctica. McLachalan (1980) apontou que este fator exerce grande importância no controle das características químicas e físicas na zona de arrebentação, e que tais influências têm implicações nas comunidades bióticas.
O grau de exposição às ondas pode também interferir na eficiência de captura de alimento por parte dos peixes, uma vez que estes têm seu campo visual limitado e devem ajustar continuamente a posição do seu corpo, de maneira a manter o equilíbrio nas áreas mais expostas (Gibson 1994). O grau de exposição às ondas foi o fator que mais influenciou na abundância de espécies, sendo encontrada maior riqueza em locais mais abrigados e de baixa energia (Romer 1990, Giannini & Paiva-Filho 1995, Gaelzer & Zalmon 2003). Não foi confirmada neste trabalho a hipótese de que áreas mais abrigadas apresentam maior representatividade de espécies com hábitos bentônicos demersais enquanto que áreas mais expostas há uma maior contribuição de espécies com hábitos pelágicos, uma vez que na zona abrigada dominaram tanto espécies bentônicas como U. coroides, D. argenteus e O. ruber, bem como espécies nectônicas como M. liza, A. lyoleps e S. brasiliensis.
De acordo com McFarland (1963), a maior riqueza de espécies nas zonas abrigadas de áreas de arrebentação está associada ao fato da maioria das espécies de peixes serem planctófagas. Adicionalmente, Cushing (1975) reportou que existe uma relação entre a disponibilidade de alimento e a riqueza de espécies, com o aumento na quantidade de alimento favorecendo a maior especialização alimentar por parte das espécies e, conseqüentemente, uma maior repartição dos recursos. Portanto áreas mais protegidas tendem a apresentar maior número de espécies, o que foi corroborado no presente trabalho.
Uma elevada riqueza de espécies foi observada nas praias do município do Rio de Janeiro no presente trabalho, com 38 espécies em 6.464 indivíduos amostrados nos 40 arrastos realizados. Esta riqueza é relativamente elevada quando comparada com as 24 espécies registradas em 25.676 indivíduos por Clark (1997), estudando gradiente de exposição às ondas, no sistema baía Saldanha-Lagoa Langebaan, um local na costa oeste da África do Sul (33° S 18° L). Embora comparações da riqueza sejam dificultadas pelos diferentes níveis de esforços, a elevada abundância numérica e o menor número de espécies do estudo de Clark (1997) podem ser atribuídos às diferenças latitudinais entre os dois sistemas, com as praias do Rio de Janeiro (latitude 22° N) sendo mais tipicamente tropicais quando comparadas com as da África do Sul (33° S). Pessanha et al. (2003), estudando a distribuição de peixes na praia de Itacuruçá, sudeste do Brasil, com amostras sazonais de 24 horas, obteve um total de 25.338 peixes com 46 espécies representadas por 23 famílias em 96 amostras realizadas com o mesmo tipo de arrasto. A maior riqueza encontrada por Pessanha et al. (2003) quando comparada ao presente trabalho, pode ser atribuída ao maior esforço amostral, bem como ao período amostrado mais amplo (dia / noite).
Verificou-se que indivíduos juvenis são predominantes na comunidade de peixes que compõem a área de estudo, refletindo a importância desta zona como área de recrutamento e criação. Esses indivíduos permanecem neste local por um curto espaço de tempo até atingirem um maior tamanho, e sua ocorrência está associada à disponibilidade de alimento e proteção contra predadores. O curto tempo de residência da maioria dos componentes da ictiofauna e o predomínio de migradores e visitantes ocasionais nas áreas de batimento, foram indicados pelas baixas freqüências de ocorrências da maioria das espécies, uma vez que 27 dos 38 indivíduos registrados apresentaram menos que 5% de ocorrência nas amostras.
As maiores abundâncias de peixes nas zonas de arrebentação ocorreram durante a primavera e as menores no inverno, um padrão semelhante ao registrado por Paiva Filho & Toscano (1987) na zona de arrebentação do Mar Casado-Guarujá e Mar Pequeno-SãoVicente, SP, onde as maiores abundâncias foram encontradas na primavera/verão e as menores no outono/inverno. Por outro lado, Giannini & Paiva-Filho (1995), estudando as comunidades de peixes de praias arenosas do Litoral de São Paulo, constataram que as maiores capturas ocorreram no verão/outono e menores no inverno. No presente estudo, o maior número de espécies e biomassas foram registrados na primavera e o menor no outono/inverno, comparável aos resultados de Godefroid et al. (2004) em uma área no litoral de Atami, Paraná. Estes últimos autores observaram maior número de espécies do final da primavera até metade do outono, e uma assembléia menos rica em espécies no inverno e primavera. O pico de recrutamento de peixes jovens nas praias do Rio de Janeiro ocorre após o inverno, embora a abundância e a riqueza de espécies não tenham variado significativamente entre as estações do ano.
A ocorrência sazonal de peixes jovens nas praias depende tanto de fatores bióticos, ressaltando os ciclos sazonais de reprodução (Vazzoler 1996) bem como de variáveis abióticas, como correntes costeiras e marés que transportam os ovos e larvas dos locais de reprodução para as áreas de recrutamento nas praias arenosas. Na costa do Rio de Janeiro, ventos predominantes de Sudoeste que ocorrem durante a primavera (Barbiére & Kronemberger 1994) facilitam os deslocamentos de ovos e larvas das áreas de reprodução na plataforma continental para as zonas de arrebentação, sendo um dos prováveis fatores de aumento do recrutamento neste período.
Indivíduos jovens pertencem notadamente às famílias Clupeidae, Sciaenidae e Carangidae, especialmente às espécies H. clupeola, U. coroides e T. carolinus, que responderam por 71% da abundância total foram dominantes. Este reduzido número de espécies dominantes é característico de ambientes com elevado dinamismo, conforme foi reportado por Brown & MacLachlan (1990) e por Moyle & Cech (1988). Harengula clupeola não apresentou um padrão definido com relação às zonas de batimento, tendo apresentado pico na zona abrigada no outono e na zona muito exposta na primavera. Isto pode ser devido ao seu hábito planctófagos, portanto não dependente exclusivamente do gradiente de exposição às ondas e, sim relacionado ao movimento das correntes associados à renovação rápida dos recursos planctônicos (Modde & Ross 1983). Umbrina coroides também apresentou ampla distribuição em relação ao nível de batimento, sendo associada à zona abrigada na primavera e à zona exposta no inverno. Trachinotus carolinus, por outro lado, ocorreu com uma maior abundância na zona abrigada durante a primavera embora seja citada como uma espécie típica de zonas expostas (Modde & Ross 1983). Esta espécie é praticamente ausente das praias arenosas no interior da Baía de Sepetiba, embora ocorra em abundância em praias adjacentes a esta baía (Pessanha et al. 2000).
A variabilidade na ocorrência destas espécies pode estar associada à elevada instabilidade da zona de arrebentação dificultando a detecção de tendências. Sugere-se que a abundância destas espécies em zonas abrigadas deve-se ao fato de serem peixes de pequeno porte e necessitarem de um ambiente que lhes propiciem alimento e proteção contra predadores, porém com o crescimento, se afastam para zonas mais profundas (Da Costa & Araújo 2003).
Os elevados valores de erros padrões no cálculo da abundância das espécies dominantes dificultaram o estabelecimento de padrões bem definidos. Embora algumas coletas tenham capturado elevadas abundâncias de espécies, outras apenas apresentaram baixos registros ou ausência de espécies dominantes. Isto pode ser decorrente de variações no período de atividade das espécies, uma vez que as coletas foram realizadas apenas no período diurno. A sucessão dos dias e noites produz uma oscilação da maioria dos fatores ambientais de interesse ecológico (Margalef 1986), que influenciam a abundância relativa de certas espécies, alterando a composição e a riqueza nas assembléias de peixes (Clark et al. 1996). A importância das áreas rasas costeiras no ciclo de vida dos peixes foi demonstrada por Lenanton (1982) que ressaltou a importância de tais áreas para peixes jovens em praias costeiras da Austrália. Em geral, o uso das áreas das zonas de arrebentação por peixes jovens foi constatado no presente trabalho, e a hipótese do menor grau de exposição ser favorável a maior abundância de indivíduos e número de espécies foi confirmada.
Conclusões
O grau de exposição às ondas foi determinante na estrutura da comunidade ictiofaunística da zona de arrebentação nas praias arenosas do Município do Rio de Janeiro, com as zonas abrigadas representando hábitats de maior abundância, biomassa e riqueza de espécies. A sazonalidade foi um fator de menor relevância na estrutura da ictiofauna, provavelmente devido a diferenciações na atividade dos peixes. As espécies mais abundantes (H. clupeola, U. coroides e T. carolinus) utilizam estas praias como área de criação, sem diferenças na abundância entre as zonas de batimento e estações do ano, devido a grande variabilidade nas amostragens; exceção foi feita para T. carolinus, que foi consistentemente mais abundante em zonas mais abrigadas.
Agradecimentos
A André Luiz M. Pessanha, pelo companheirismo e ajuda na identificação de vários grupos de peixes; a Antônio Gomes da Cruz-Filho pela ajuda nas coletas de campo. Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pela concessão da bolsa de Iniciação Cientifica do primeiro autor e ao auxílio financeiro concedido ao Projeto PEISEP (Proc. 474813/03-7).
Recebido em 04/07/06
Versão reformulada recebida em 20/12/06
Publicado em 03/02/07
ISSN 1676-0603
- BARBIÉRE, E.B. & KRONEMBERGER, D.M.P. 1994. Climatologia do litoral Sul-Sudeste do Estado do Rio de Janeiro. Cad. Geoc. 12:57-73.
- BENNETT, B.A. 1989. The fish community of a moderately exposed beach on the southwestern cape coast of South Africa and an assessment of this habitat a nursey for juvenile fish. Est. Coast. Shelf Sci. 28:293-305.
- BROWN, A.C. & McLACHLAN, A. 1990. Ecology of sandy shores. Elsevier, New York.
- CARTER, R.W.G. 1988. Coastal environments: an introduction to the physical, ecological and cultural systems of coastlines. Academic Press, London.
- CLARK, B.M., BENNETT, S.J. & LAMBERTH, S.J. 1996. Factors affecting spatial variability in seine net catches of fish in the surf zone of False Bay, South Africa. Mar. Ecol. Progr. Ser. 131:17-34.
- CLARK, B.M. 1997. Variation in surf-zone fish community structure across a wave-exposure gradient. Est. Coast. Shelf Sci. 44:659-674.
- CUSHING, D.H. 1975. Marine ecology and fisheries. Cambridge University Press, London.
- DA COSTA, M.R. & ARAÚJO, F.G. 2003. Use of a tropical bay in southeastern Brazil by juvenile and subadult Micropogonias furnieri (Perciformes, Sciaenidae). ICES J. Mar. Sci. 60:268-277.
- DEXTER, D.M. 1990. The effect of exposure and seasonality on sandy beach community structure in Portugal. Cienc. Biol. E'Syst. 10:31-50.
- FIGUEIREDO, J.L. & MENEZES, N.A. 1978. Manual de peixes marinhos do sudeste do Brasil. II. Teleostei (1). Museu de Zoologia da Universidade de São Paulo, São Paulo.
- FIGUEIREDO, J.L. & MENEZES, N.A. 1980. Manual de peixes marinhos do sudeste do Brasil. III. Teleostei (2). Museu de Zoologia da Universidade de São Paulo, São Paulo.
- FIGUEIREDO, J.L. & MENEZES, N.A. 2000. Manual de peixes marinhos do sudeste do Brasil. VI. Teleostei (5). Museu de Zoologia da Universidade de São Paulo, São Paulo.
- GAELZER, L.R. & ZALMON, I.R. 2003. The influence of wave exposure gradient on the community structure of the ichthyofauna in the surf-zone of the Southeastern of Rio de Janeiro, Brazil. J. Coast Res. 35:456-462.
- GIANNINI, R. & PAIVA-FILHO, A.M. 1995. Análise comparativa da ictiofauna da zona de arrebentação de praias arenosas do litoral do Estado de São Paulo, Brasil. Bol. Inst. Ocean. 43:141-152.
- GIBSON, R.N. 1994. Impact of habitat quality and quantity on the recruitment of juvenile flatfishes. Netherl. J. Sea Res. 32:191-206.
- GODEFROID, R.S., SPACH, H.L., MACLAREN, G. & SCHWAIZ JR., R. 2004. Mudanças temporais na abundância da fauna de peixes do infralitoral raso de uma praia, sul do Brasil. Iheringia, Sér. Zool. 94:95-104.
- LASIAK, T.A. 1981. Nursey grounds of juvenile teleosts: evidence from the surf-zone of King's Beach, Port Elizabeth. S. Afric. J. Mar. Sci. 77:388-390.
- LENANTON, R.C.J. 1982. Alternative non-estuarine nursey habitats for some commercially and recreationally important fish species of south-western Australia. Austr. J. Mar. Fresh. Res. 33:881-900.
- MARGALEF, R. 1986. Ecologia. Ediciones Omega, Barcelona.
- McFARLAND, W.N. 1963. Seasonal change in the number and biomass of fishes from the surf at Mustang Island, Texas. Publ. Inst. Mar. Sci. Univ. 9:91-112.
- McLACHLAN, A. & ERASMUS, T. 1983. Sandy beaches as ecosystems. Dr. W. Junk Publishers, Amsterdam.
- McLACHLAN, A. 1980. The definition of sandy beaches in relation to exposure: a simple system. South Afric. J. Sci. 76:137-138.
- McLACHLAN, A., COCKCROFT, A.C. & MALAN, D.E. 1984. Benthic faunal response to high-energy gradient. Mar. Ecol. Prog. Ser. 16:51-63.
- McLACHLAN, A., ERASMUS, T., VAN DER HORST, G., ROSSOUW G., LASIAK, T.A. & McGMYNNE, L. 1981. Sand beach energetics: an ecosystem approach towards a high energy interface. Est. Coast. Shelf Sci. 13:11-25.
- MENEZES, N.A. & FIGUEIREDO, J.L. 1980. Manual de peixes marinhos do sudeste do Brasil. IV. Teleostei (3). Museu de Zoologia da Universidade de São Paulo, São Paulo.
- MENEZES, N.A. & FIGUEIREDO, J.L. 1985. Manual de peixes marinhos do sudeste do Brasil. V. Teleostei (4). Museu de Zoologia da Universidade de São Paulo, São Paulo.
- MODDE, T. & ROSS, S.T. 1983. Trophic relationships of fishes occurring within a surf zone habitat in the northern Gulf of Mexico. North. Gulf Sci. 6:109-120.
- MONTEIRO-NETO, C. & MUSICK, J.A. 1994. Effects of beach seine size on the assessment of surf-zone fish communities. Revta. Atlântica. 16:23-29.
- MOYLE, P.B. & CECH, J.J. 1988. Fishes: an introduction of ichthyology. Prentice Hall, New Jersey.
- NELSON, J.S. 1994. Fishes of the world. Jonh Wiley & Sons, New York.
- PAIVA FILHO, A.M. & TOSCANO, A.P. 1987. Estudo comparativo e variação sazonal da ictiofauna na zona entremarés do Mar Casado-Guarujá e Mar Pequeno-São Vicente, SP. Bol. Inst. Ocean. 35:153-165.
- PESSANHA, A.L.M., ARAÚJO, F.G., AZEVEDO, M.C.C. & GOMES, I.D. 2000. Variações temporais e espaciais na composição e estrutura da comunidade de peixes jovens da Baía de Sepetiba, RJ. Revta. Bras. Zool. 17:251-261.
- PESSANHA, A.L.M., ARAÚJO, F.G., AZEVEDO, M.C.C. & GOMES, I.D. 2003. Diel and seasonal changes in the distribution of fish on a southeast Brazil sandy beach. Mar. Biol. 143:1047-1055.
- PIHL, L. & VAN DER VEER, H.W. 1992. Importance of exposure and habitat structure for the population density of 0-group plaice, Pleuronectes platessa L, in coastal nursery areas. Netherl. J. Sea Res. 29:145-152.
- ROMER, G.S. 1990. Surf zone fish community and species response to wave energy gradient. J. Fish Biol. 36:279-287.
- VAZZOLER, A.E.M. 1996. Biologia da reprodução de peixes Teleósteos: teoria e prática. EDUEM, Maringá.
- WOOTTON, R.J. 1992. Fish ecology. Blackie and Son Limited, London.
Datas de Publicação
-
Publicação nesta coleção
21 Ago 2007 -
Data do Fascículo
2007
Histórico
-
Aceito
03 Fev 2007 -
Recebido
04 Jul 2006