Resumos
Lipases, especialmente as de origem microbiana, são largamente utilizadas em processos e na obtenção de produtos para as indústrias química, cosmética, farmacêutica e alimentícia. A produção de enzimas de elevada pureza é importante, principalmente, do ponto de vista do controle dos processos (ausência de interferentes), porém as etapas necessárias à purificação, em geral, provocam perdas na atividade das enzimas e aumentam seu custo final. O objetivo deste trabalho foi propor a melhor metodologia de purificação para a lipase de Rhizopus sp. através do teste de dois diferentes métodos cromatográficos (troca iônica e interação hidrofóbica) e, ainda verificar o melhor planejamento estatístico para caracterização bioquímica da mesma. Foi possível purificar parcialmente a lipase de Rhizopus sp. com o uso de coluna de DEAE Sepharose (troca aniônica) e de FENIL Sepharose (interação hidrofóbica). A primeira, embora mais seletiva para a enzima em questão, parece provocar redução de sua atividade. A presença de maiores concentrações de íons Na+1 na fração purificada por FENIL Sepharose parece contribuir para o aumento de atividade da lipase. Embora os resultados obtidos por análise multivariável para determinação das características bioquímicas da lipase sejam compatíveis com a análise univariável, aquele planejamento não foi considerado indicado no presente caso.
troca iônica; DEAE Sepharose; interação hidrofóbica; Fenil Sepharose; caracterização bioquímica
Lipases, especially of microbial origin, are widely applied in processes and in the production of insumesfor the chemical, cosmetic, pharmaceutical and food industries. To produce highly pure enzyme is important to process control (absence of interferentes). However the necessary stages to the purification, in general, cause losses of activity and increases enzyme final cost. The aim of this work was to consider the best methodology of purification for the Rhizopus sp. lipase through the test of two different chromatographic methods (ion exchange and hydrophobic interaction) and also to verify the best statistical design for the biochemical characterization of the enzyme. It was possible to partially purify the Rhizopus sp lipase applying a DEAE Sepharose (anionic exchange) column and a PHENYL Sepharose (hydrophobic interaction) column. The first, although more selective for the enzyme in study, seems to cause reduction of its activity. The presence of higher concentrations of Sodium ions in the PHENYL Sepharose fraction seems to contribute for an increased activity of the lipase. Although the results obtained through the factorial design for the biochemical characteristics of the lipase were compatible with the single variable analysis, that statistical approach should not be indicated in the present case.
ion exchange; DEAE Sepharose; hydrophobic interaction; Phenyl Sepharose; biochemical characterization
Purificação parcial, por dois diferentes métodos cromatográficos, da lipase produzida por Rhizopus sp.
Partial purification of the lipase from Rhizopus sp by two different chromatographic methods
Maria Gabriela Bello KoblitzI,* * A quem a correspondência deve ser enviada. , Gláucia Maria PastoreII
IFaculdade de Engenharia de Alimentos / DETEC / UEFS. E-mail: mkoblitz@hotmail.com
IIDCA / FEA / UNICAMP. E-mail: glaupast@fea.unicamp.br
RESUMO
Lipases, especialmente as de origem microbiana, são largamente utilizadas em processos e na obtenção de produtos para as indústrias química, cosmética, farmacêutica e alimentícia. A produção de enzimas de elevada pureza é importante, principalmente, do ponto de vista do controle dos processos (ausência de interferentes), porém as etapas necessárias à purificação, em geral, provocam perdas na atividade das enzimas e aumentam seu custo final. O objetivo deste trabalho foi propor a melhor metodologia de purificação para a lipase de Rhizopus sp. através do teste de dois diferentes métodos cromatográficos (troca iônica e interação hidrofóbica) e, ainda verificar o melhor planejamento estatístico para caracterização bioquímica da mesma. Foi possível purificar parcialmente a lipase de Rhizopus sp. com o uso de coluna de DEAE Sepharose (troca aniônica) e de FENIL Sepharose (interação hidrofóbica). A primeira, embora mais seletiva para a enzima em questão, parece provocar redução de sua atividade. A presença de maiores concentrações de íons Na+1 na fração purificada por FENIL Sepharose parece contribuir para o aumento de atividade da lipase. Embora os resultados obtidos por análise multivariável para determinação das características bioquímicas da lipase sejam compatíveis com a análise univariável, aquele planejamento não foi considerado indicado no presente caso.
Palavras-chave: troca iônica; DEAE Sepharose; interação hidrofóbica; Fenil Sepharose; caracterização bioquímica.
SUMMARY
Lipases, especially of microbial origin, are widely applied in processes and in the production of insumesfor the chemical, cosmetic, pharmaceutical and food industries. To produce highly pure enzyme is important to process control (absence of interferentes). However the necessary stages to the purification, in general, cause losses of activity and increases enzyme final cost. The aim of this work was to consider the best methodology of purification for the Rhizopus sp. lipase through the test of two different chromatographic methods (ion exchange and hydrophobic interaction) and also to verify the best statistical design for the biochemical characterization of the enzyme. It was possible to partially purify the Rhizopus sp lipase applying a DEAE Sepharose (anionic exchange) column and a PHENYL Sepharose (hydrophobic interaction) column. The first, although more selective for the enzyme in study, seems to cause reduction of its activity. The presence of higher concentrations of Sodium ions in the PHENYL Sepharose fraction seems to contribute for an increased activity of the lipase. Although the results obtained through the factorial design for the biochemical characteristics of the lipase were compatible with the single variable analysis, that statistical approach should not be indicated in the present case.
Keywords: ion exchange; DEAE Sepharose; hydrophobic interaction; Phenyl Sepharose; biochemical characterization.
1 INTRODUÇÃO
Lipases, triacilglicerol éster hidrolases (EC 3.1.1.3), são enzimas largamente distribuídas na natureza, que catalisam a hidrólise de óleos e gorduras liberando ácidos graxos livres, diacilgliceróis, monoacilgliceróis e glicerol [1]. Estas enzimas, encontradas em tecidos animais, vegetais e em microrganismos, têm papel fundamental no metabolismo de lipídios destes seres vivos: como enzimas digestivas, na deposição e mobilização dos tecidos de reserva energética e no metabolismo intracelular, atuando sobre as membranas celulares [13].
Os aspectos biológicos, fisiológicos e a aplicação industrial de enzimas lipolíticas têm sido bastante estudados e, nos últimos anos, a pesquisa sobre lipases tem sido intensificada devido principalmente a três motivos:
· Por serem enzimas que apresentam uma forma de ação incomum são solúveis em água mas catalisam reações envolvendo substratos lipofílicos a estrutura molecular das lipases, muitas vezes composta por uma "tampa" que protege o sítio ativo predominantemente hidrofóbico da enzima, tem despertado o interesse de muitos grupos de pesquisa [11];
· Lipases apresentam grande relevância médica, principalmente em relação à arteriosclerose e a hiperlipidemia, uma vez que alguns produtos de sua atuação ácidos graxos livres e diacilgliceróis têm papel crucial na regulação e no metabolismo celular [3];
· A descoberta da capacidade das lipases de catalisar reações de síntese e sua surpreendente estabilidade em diversos solventes orgânicos abriu inúmeras possibilidades no campo da síntese química, onde as diferentes seletividades de lipases de várias fontes, aliada às condições suaves de temperatura e pressão em que atuam apresentam uma enorme vantagem em relação aos catalisadores convencionais [12].
Devido a grande variedade de reações que catalisam, as lipases têm inúmeras aplicações nas indústrias de alimentos, cosméticos, química, farmacêutica e em muitas outras. Entre as vantagens que o uso de lipases apresenta sobre os processos químicos convencionais estão [9, 14]:
· alta eficiência em condições de baixas temperaturas e pressão atmosférica;
· reduzida poluição ambiental;
· produtos originados de reações enzimáticas são considerados "naturais" pela legislação da maioria dos países;
· lipases apresentam vários graus de seletividade, ao contrário dos catalisadores convencionais, gerando menos produtos secundários e reduzindo a necessidade de purificação.
Atualmente o maior empecilho ao uso de lipases em processos industriais está relacionado ao alto custo deste catalisador, entretanto os recentes avanços na tecnologia de engenharia genética e de modificação e imobilização de lipases têm grande possibilidade de mudar este quadro num futuro próximo [10].
A purificação de lipases tem, em geral, dois objetivos básicos: (a) obtenção da enzima virtualmente pura, para melhor estudo de suas características bioquímicas e de sua estrutura e (b) obtenção de um produto com maior atividade específica (unidades de atividade/mg de proteína) para aplicação em diversos processos. Entretanto, processos de purificação costumam elevar grandemente o preço do produto final. Normalmente os protocolos de purificação de enzimas microbianas extracelulares são separados em duas etapas: pré-purificação e purificação por métodos cromatográficos [8].
Na purificação de lipases são aplicados principalmente três tipos de colunas cromatográficas: colunas de troca iônica, colunas de interação hidrofóbica e colunas de permeação em gel. Além destas são também utilizadas colunas de bioafinidade e colunas de adsorção inespecífica empacotadas com hidroxiapatita, por exemplo.
Como regra geral a maioria dos protocolos de purificação de lipases segue a seguinte lógica: nos primeiros passos de purificação são utilizadas colunas com grande capacidade de troca e baixo custo. Estão aí incluídas as resinas de troca iônica e de interação hidrofóbica. Estas últimas têm sido aplicadas com excelentes resultados na purificação de lipases e apresentam a vantagem adicional de dispensarem diálise de extratos precipitados pela adição de sais. Nas etapas finais de purificação em geral são aplicadas colunas de filtração em gel que garantem a remoção de agregados e produtos de degradação sofrida pela enzima ao longo do processo de purificação. Entretanto, este tipo de cromatografia fatalmente irá provocar a diluição do produto final, exigindo uma etapa de concentração posterior, como a liofilização.
2 MATERIAL E MÉTODOS
2.1 Material
2.1.1 Produção da enzima
Um mL de suspensão de esporos, obtido de cultura em BDA inclinado após incubação por 72 horas, foi inoculado em frascos erlenmeyer de 500mL contendo 20g de meio de cultura composto por farelo de trigo e água (60:40 p/p). O meio foi mantido a 300C por 120 horas e após este tempo a lipase foi extraída com água destilada, seguida de filtração em gaze.
2.1.2 Purificação da enzima
O caldo de cultura foi adicionado de sulfato de amônio até 70% de saturação. Após 12 horas sob refrigeração o caldo foi centrifugado a 10.000rpm por 10 minutos.
Para cromatografia de troca iônica: o precipitado formado foi dialisado contra água destilada por 48 horas a 40C. O produto assim obtido foi liofilizado e estocado a 100C.
Para cromatografia de interação hidrofóbica: o precipitado formado foi adicionado de tampão (fosfato de sódio pH=7,0, 0,05M) até a completa dissolução, filtrado em membrana de poro 0,45mm e estocado a 10ºC.
2.2 Métodos
2.2.1 Cromatografia de troca iônica
Para esta etapa de purificação, o extrato liofilizado foi dissolvido em tampão (fosfato de sódio pH=7,0, 0,05M) na concentração de 50mg/mL e filtrado em membrana de poro 0,45mm. Para a cromatografia foi utilizada uma coluna manualmente empacotada com DEAE Sepharose "fast flow", de 10mL de volume interno. A injeção consistiu de 1mL da solução de enzima e a eluição foi atingida por gradiente não linear de NaCl, com patamares nas concentrações de 0,1M, 0,2M e 0,3M e concentração final de 1M do sal.
2.2.2 Cromatografia de interação hidrofóbica
Foi utilizada uma coluna manualmente empacotada com fenil Sepharose "fast flow", de 10mL de volume interno. A injeção consistiu de 1mL da solução de enzima e a eluição foi alcançada por gradiente linear Na2SO4 com concentração inicial de 1M do sal.
Em todas as etapas cromatográficas foi utilizado um equipamento de FPLC (fast protein liquid chromatography Amersham Pharmacia)
2.2.3 Análise dos resultados
Todos os produtos obtidos durante a purificação da enzima foram submetidos a ensaios para medida da concentração de proteína pelo Método de Lowry [6] tendo-se albumina de soro bovino como padrão. Durante a eluição cromatográfica, os picos protéicos foram monitorados por absorção a 280nm. A determinação da atividade enzimática de todos os produtos, assim como a localização da enzima de interesse no cromatograma foi feita através da metodologia descrita por LIN, CHIOU & TSAI [5]. Considerou-se 1 (uma) unidade de atividade a quantidade de enzima necessária para liberar 1mM de p-nitro-fenol, por minuto de reação, por mL de amostra. Para verificação da pureza da enzima foram realizados ensaios eletroforéticos de proteína desnaturada (SDS-PAGE) [4].
2.2.4 Determinação da atividade de protease
Realizada segundo OBATA, IWATA & NAMBA [7], usando caseína como substrato.
2.2.5 Caracterização bioquímica
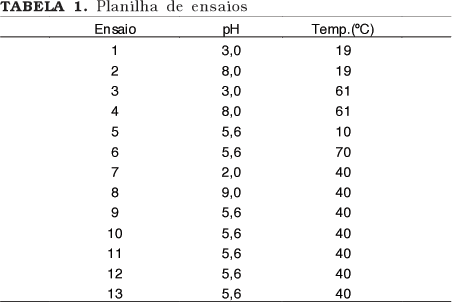
Para verificação do pH e da temperatura ótimos e de estabilidade das frações parcialmente purificadas foi utilizado um planejamento estatístico experimental multivariável baseado na análise de superfície de resposta. Para geração da planilha de ensaios (Tabela 1) e análise dos resultados foi aplicado o Software STATISTICA (versão 5.0).
Foi utilizado um planejamento fatorial completo com cinco pontos centrais. Para determinação da temperatura e do pH ótimos foram feitas medidas de atividade nos parâmetros determinados, com 15 minutos de reação. Para determinação da temperatura e do pH de estabilidade a enzima foi mantida nos parâmetros determinados por 1 hora e foi medida a atividade residual em pH 5,6 e a 50ºC.
Para efeito de comparação, as características bioquímicas da enzima parcialmente purificada por DEAE Sepharose foram também determinadas pelo método univariável utilizando-se temperaturas na faixa entre 30 e 70ºC e valores de pH entre 3,6 e 9,0.
3 RESULTADOS E DISCUSSÃO
3.1 Purificação
A lipase de Rhizopus sp. pôde ser purificada pelas duas colunas propostas, uma vez que foi retida seletivamente pelas mesmas e pôde ser eluída com facilidade pelos gradientes de sal utilizados.
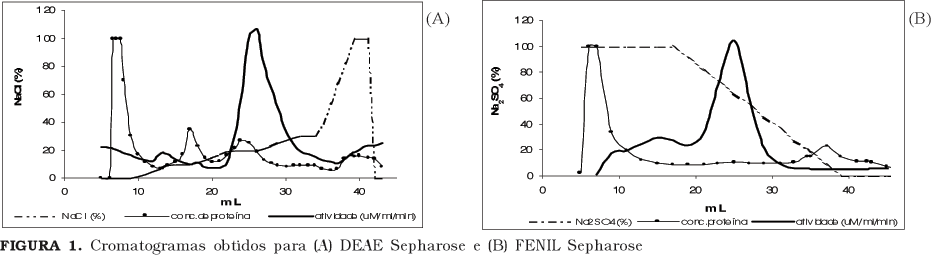
A coluna de FENIL Sepharose apresenta a vantagem de dispensar a etapa de diálise, após a precipitação com sal, o que representa economia de tempo, energia (a diálise deve ser feita em ambiente refrigerado) e aumenta as chances de manutenção da atividade enzimática [8]. Pela observação da Figura 1 esperava-se obter uma fração bastante pura após utilização da coluna de FENIL Sepharose, uma vez que o pico de atividade é muito acentuado e o de proteína é praticamente imperceptível. Entretanto, após ensaio em SDS-PAGE (Figura 2) verifica-se que a suposição acima não se verifica e que a coluna de DEAE Sepharose parece ser mais seletiva para a lipase em questão, como pode ser observado na Figura 2.
Nas Tabelas 2 e 3 verificam-se diferenças entre os valores obtidos para enzima bruta. Isto se deve, provavelmente, à presença de sódio na preparação destinada à purificação por interação hidrofóbica, uma vez que este íon tem a propriedade de ativar a lipase de Rhizopus sp.
De acordo com Figura 3, a purificação por coluna de FENIL Sepharose proporciona uma maior purificação em relação ao uso de troca iônica, o que é devido a maior atividade da fração conseguida por interação hidrofóbica e a menor concentração de proteína presente na mesma. Estes resultados são, de certa forma, contraditórios aos observados na Figura 2. Isto pode ser devido a dois fatores: à redução da atividade da lipase, em conseqüência da perda de sua fração glicosídica, em contato com a coluna de troca aniônica [2] e à ativação sofrida pela enzima quando em meio rico em sódio.
A determinação de atividade de protease na fração lipolítica parcialmente purificada é importante para se estimar a estabilidade da fração ao longo do tempo. É desejável que o método de purificação seja capaz de eliminar as proteases para garantir que não haverá hidrólise da enzima de interesse durante o armazenamento. No presente trabalho, ambas as colunas testadas foram capazes de separar a fração lipolítica da proteásica, não restando na fração coletada qualquer sinal da atividade proteolítica encontrada na enzima bruta.
3.2 Caracterização bioquímica
3.2.1 Análise multivariável
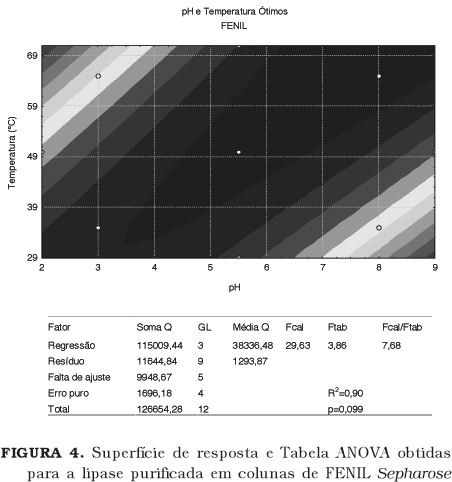
As superfícies em forma de sela foram as que melhor se ajustaram aos resultados obtidos, uma vez que em todos os casos os efeitos quadráticos dos parâmetros testados foram significativos (para a<0,01). Foram também significativos os efeitos lineares para todos exceto para a superfície gerada para pH e temperatura ótimos da enzima parcialmente purificada em coluna de FENIL Sepharose.
3.2.2 Análise univariável
De acordo com as superfícies de resposta para pH e temperatura ótimos (Figura 4) a lipase obtida por purificação em coluna de DEAE Sepharose apresenta maior atividade para os valores de pH entre 4,5 e 7,5 a temperaturas entre 45 e 65ºC. No caso da lipase purificada em coluna de FENIL Sepharose, para temperaturas até 50ºC a atividade é máxima em valores de pH entre 3,5 e 5,5; acima desta temperatura a atividade é maior para valores de pH entre 5,5 e 9,0. Apesar destas diferenças, nos dois casos no centro do máximo de atividade encontra-se o ponto correspondente a pH=5,6 e temperatura de 50ºC. É possível que a maior faixa de ótimo da lipase obtida por FENIL Sepharose se deva a maior atividade observada nesta fração.
Os resultados obtidos através da análise univariável para pH ótimo mostram dois picos distintos de atividade máxima (em 5,5 e 7,5), porém, na temperatura estudada (50ºC) os pontos de pH 6,0 e 6,5 apresentam valores inferiores de atividade. Este fenômeno, que é um indicador da presença de isoenzimas na fração, não pôde ser observado quando a análise multivariável foi aplicada.
A superfície de resposta gerada para estabilidade da enzima obtida por purificação em coluna de DEAE Sepharose (Figura 5) indica que esta lipase mantém 50% ou mais de sua atividade quando submetida a valores de pH entre 5,0 e 8,5 a temperaturas inferiores a 40ºC. No caso da lipase obtida por purificação em coluna de FENIL Sepharose (Figura 6), só foi possível manter 50% de atividade ou mais em valores de pH superiores a 6,0 e a temperaturas inferiores a 35ºC. A diferença apresentada na estabilidade pode ser devida à menor concentração de proteína na fração obtida por interação hidrofóbica.
De acordo com a análise univariável (Figura 7) a enzima parcialmente purificada mantém 50% ou mais de sua atividade após tratamento térmico de 1hora a temperaturas inferiores a 50ºC e após 24 horas a 25ºC, em valores de pH entre 5,0 e 7,0.
A relação entre Fcalculado e Ftabelado indica que embora a regressão obtida seja significativa ela não é preditiva do processo. Os baixos valores obtidos para esta relação podem ser devidos às diferenças encontradas entre os métodos multi e univariável.
4 CONCLUSÕES
Foi possível purificar parcialmente a lipase de Rhizopus sp. com o uso de coluna de DEAE Sepharose (troca aniônica) e de FENIL Sepharose (interação hidrofóbica). A primeira, embora mais seletiva para a enzima em questão, parece provocar redução de sua atividade, provavelmente por perda da fração não protéica da lipase. A enzima assim purificada é mais termoestável que a purificada por interação hidrofóbica. A presença de maiores concentrações de íons Na+1 na fração purificada por FENIL Sepharose parece contribuir para o aumento de atividade da lipase, que apresentou maior faixa de ótimo de atividade.
O uso de planejamento multivariável na determinação das principais características bioquímicas das frações estudadas encobriu a percepção da presença de isoformas da lipase. Embora os resultados sejam compatíveis com a análise univariável esse planejamento não foi o mais indicado no presente caso.
5 REFERÊNCIAS BIBLIOGRÁFICAS
6 AGRADECIMENTOS
Os autores agradecem à Luciana Ferracini, MSc., pela determinação da atividade de protease e à CAPES, pelo financiamento.
Recebido para publicação em 04/07/2003
Aceito para publicação em 30/01/2004 (001163)
- [1] BEISSON, F.; TISS, A.; RIVIÈRE,C.; VERGER, R. Methods for Lipase Detection and Assay: a Critical Review. European Journal Of Lipid Science and Technology v. 34, p. 133-153, 2000.
- [2] BORGSTON, B.; BROCKMAN, H.L.. Lipases Amsterdam: Elsevier, 1984.
- [3] FAROOQUI, A.A.; TAYLOR, W.A.; HORROCS, L.A. Phospholipases, Lysophospholipases and Lipases and Their Envolvment in Various Deseases. Neurochemical Pathology v. 7, n. 2, p. 99-128, 1987.
- [4] LAEMMLI, U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature v. 227, p. 680-685, 1970.
- [5] LIN, S.F.; CHIOU, C.M.; TSAI, C.Y. Effect of Triton X-100 on alkaline lipase production by Pseudomonas pseudoalcaligenes F-111. Biotechnology Letters v. 17, n. 9, p. 959-962,1995.
- [6] LOWRY, O.H.; ROSEBROUGH, N.J.; FARR, A.L.; RANDALL, R.J. Protein measurement with the phenol folin reagent. Journal of Biological Chemistry v. 193, p. 265-275, 1951.
- [7] OBATA, T.; IWATA, H.; NAMBA,Y. Proteolitic enzyme from Oerskovia sp CK lysing viable yeast cell. Agricultural and Biological Chemistry v. 41, n. 12, p. 2387-2394, 1977.
- [8] PALEKAR, A.A.; VASUDEVAN, P.T., YAN, S. Purification of Lipase: a Review. Biocatalysis Biotransformation. v. 18, p. 177-200, 2000.
- [9] POROSKE, L.H. Industrial-Scale Application of Enzymes to the Fats and Oil Industry. Journal of the American Oil Chemists Society v. 61, n. 11, p. 1758-1765, 1984.
- [10] SAXENA, R.K.; SHEORAN, A.; GIRI, B.; DAVIDSON, W.S. Purification Strategies for Microbial Lipases. Journal of Microbiological Methods v. 52, p. 1-18, 2003.
- [11] SCHMIDT, R.D.; VERGER, R. Lipases: Interfacial Enzymes with Attractive Applications. Angewandte Chemie International Edition v. 37, n. 12, p. 1609-1633, 1998.
- [12] SHARMA, R.; CHISTI, Y.; BANERJEE, U.C. Production, Purification, Characterization, and Applications of Lipases. Biotechnology Advances v. 19, n. 8, p. 627-662, 2001.
- [13] VILLENEUVE, P.; MUDERHWA, J.M.; GRAILLE, J.; HAAS, M.M. Customizing Lipases for Biocatalysis: a Survey of Chemical, Physical and Molecular Biological Approches. Journal of Molecular Catalysis B: Enzymatic v. 9, p. 113-148, 2000.
- [14] XU, X. Production of Specific-Structured Triacylglycerols by Lipase-Catalysed Reactions: a Review. European Journal of Lipid Science and Technology v. 34, p. 287-303. 2000.
Datas de Publicação
-
Publicação nesta coleção
06 Ago 2004 -
Data do Fascículo
Jun 2004
Histórico
-
Aceito
30 Jan 2004 -
Recebido
04 Jul 2003