Resumos
O extrato enzimático foi preparado a partir da polpa e casca da maçã de cultivares Fuji e Gala utilizando tampão fosfato de sódio 100mM, pH 5,0 como solução extratora. Dentre as análises determinou-se a concentração de proteína nos extratos enzimáticos concentrados de polpa e casca, sendo que o cultivar Fuji apresentou teores mais elevados em comparação ao cultivar Gala. Os tratamentos térmicos foram realizados nas temperaturas de 60, 65, 70 e 75°C por períodos que variaram de 1 a 10 minutos, sendo observado diminuição da atividade de POD e PPO com o aumento da temperatura e tempo; no entanto a POD não chegou a ser inativada em nenhum dos tratamentos realizados. A PPO foi inativada totalmente após 10 minutos de tratamento a 75°C. A eletroforese mostrou uma composição diferente de isoenzimas aniônicas e catiônicas da peroxidase.
peroxidase; polifenoloxidase; termoestabilidade; maçã; Mallus comunis
The enzymatic extract was prepared using the pulp and the peel of the apples from Fuji and Gala cultivar using sodium phosphate buffer 100 mM, pH 5.0 as the extraction solution. The protein concentration was determined and the Fuji cultivar showed higher amounts of protein than the Gala cultivar. The thermal treatments were carried out in the temperatures of 60, 65, 70 and 75°C for periods that varied from 1 to 10 minutes. A decrease in the activities of POD and PPO with the increase of the temperature and time was observed; however POD was not inactived following any of the treatments used. PPO was totally inativated after 10 minutes of treatment for 75°C. The electrophoresis showed a different pattern for the anionic and cationic peroxidase isoenzymes.
peroxidase; polyphenoloxidase; thermostability; apple; Mallus comunis
EFEITO DO TRATAMENTO TÉRMICO SOBRE A ATIVIDADE DE PEROXIDASE (POD) E POLIFENOLOXIDASE (PPO) EM MAÇÃ (Mallus comunis)1 1 Recebido para publicação em 29/01/00. Aceito para publicação em 10/09/01.
Patrícia VALDERRAMA2 1 Recebido para publicação em 29/01/00. Aceito para publicação em 10/09/01. , Fabiane MARANGONI2 1 Recebido para publicação em 29/01/00. Aceito para publicação em 10/09/01. , Edmar CLEMENTE2 1 Recebido para publicação em 29/01/00. Aceito para publicação em 10/09/01. ,* 1 Recebido para publicação em 29/01/00. Aceito para publicação em 10/09/01.
RESUMO
O extrato enzimático foi preparado a partir da polpa e casca da maçã de cultivares Fuji e Gala utilizando tampão fosfato de sódio 100mM, pH 5,0 como solução extratora. Dentre as análises determinou-se a concentração de proteína nos extratos enzimáticos concentrados de polpa e casca, sendo que o cultivar Fuji apresentou teores mais elevados em comparação ao cultivar Gala. Os tratamentos térmicos foram realizados nas temperaturas de 60, 65, 70 e 75°C por períodos que variaram de 1 a 10 minutos, sendo observado diminuição da atividade de POD e PPO com o aumento da temperatura e tempo; no entanto a POD não chegou a ser inativada em nenhum dos tratamentos realizados. A PPO foi inativada totalmente após 10 minutos de tratamento a 75°C. A eletroforese mostrou uma composição diferente de isoenzimas aniônicas e catiônicas da peroxidase.
Palavras-chave: peroxidase; polifenoloxidase; termoestabilidade; maçã; Mallus comunis.
SUMMARY
EFFECT OF THERMAL TREATMENTS ON PEROXIDASE (POD) AND POLYPHENOLOXIDASE (PPO) ACTIVITIES OF APPLE (Mallus comunis). The enzymatic extract was prepared using the pulp and the peel of the apples from Fuji and Gala cultivar using sodium phosphate buffer 100 mM, pH 5.0 as the extraction solution. The protein concentration was determined and the Fuji cultivar showed higher amounts of protein than the Gala cultivar. The thermal treatments were carried out in the temperatures of 60, 65, 70 and 75°C for periods that varied from 1 to 10 minutes. A decrease in the activities of POD and PPO with the increase of the temperature and time was observed; however POD was not inactived following any of the treatments used. PPO was totally inativated after 10 minutes of treatment for 75°C. The electrophoresis showed a different pattern for the anionic and cationic peroxidase isoenzymes.
Keywords: peroxidase; polyphenoloxidase; thermostability; apple; Mallus comunis.
1 ¾ INTRODUÇÃO
No Brasil, a cultura comercial da macieira tomou impulso na década de 70, principalmente em função do ingresso de novos Estados produtores, como Santa Catarina, Paraná e Rio Grande do Sul. Atualmente o Brasil é o maior produtor mundial do cultivar gala que é bastante procurado na Europa [2, 3, 17]. Com a grande produção de frutos e seus derivados, e a implantação de fábricas de sucos na região, houve a necessidade de se estudar as enzimas peroxidase e polifenoloxidase e seu comportamento com relação ao processo de pasteurização dos sucos, sendo que as mesmas contribuem para off-flavour, alterando com isto o sabor do produto final. A peroxidase (POD) tem um aumento em sua solubilidade durante o período de maturação, conseqüentemente um aumento na atividade desta enzima no pós-climatério. A peroxidase e a polifenoloxidase têm sido consideradas as principais enzimas responsáveis pela deterioração da qualidade em muitos frutos congelados [7, 20]. Estas enzimas podem participar de um grande número de reações oxidativas e de biodegradação, tais como mudança de cor, degradação da clorofila ou auxinas, oxidação de fenóis, oxidação do ácido indol acético, biossíntese da lignina, e muitos destes fatores também podem ser associados com flavour, cor, textura e qualidade nutricional dos alimentos [5, 6, 8, 9, 12, 21]. O controle da atividade da peroxidase e polifenoloxidase é de grande importância para a tecnologia de alimentos, uma vez que estas são responsáveis pelo escurecimento em frutas e vegetais e seus produtos processados [12, 19, 21]. Os extratos preparados de plantas para verificar a atividade enzimática da peroxidase e polifenoloxidase têm mostrado que esta enzima pode ocorrer tanto na forma solúvel como também na forma iônica, ligada à parede celular [11, 13]. Os tratamentos térmicos comercialmente usados no processo de extração de frutas e vegetais, como por exemplo: temperatura elevada por curto tempo (HTST-high temperature short time), são pouco efetivos para uma inativação irreversível principalmente da peroxidase [15, 16]. Na produção de sucos de frutas, muitas vezes se inclui a casca da fruta, e isto contribui geralmente para o aumento da atividade da peroxidase no meio [10]. O objetivo deste trabalho foi estudar o comportamento da atividade enzimática de PPO e POD, quando submetidas a diferentes temperaturas (60, 65, 70 e 75°C) por diferentes períodos de tempo (0, 1, 2, 3, 4, 6, 8 e 10min).
2 ¾ MATERIAIS E MÉTODOS
2.1 ¾ Materiais
As maçãs (Mallus comunis) de cultivares Gala e Fuji, frescas e maduras, foram obtidas em comércio de frutas e verduras local. Todos os reagentes químicos utilizados foram de grau analítico, obtidos da BDH Light Laboratories Ltda.
2.2 ¾ Métodos
2.2.1 ¾ Extração da peroxidase e polifenoloxidase da casca e polpa de maçã
Para preparação do extrato bruto de peroxidase e polifenoloxidase pesaram-se cerca de 100g de casca e/ou 300g de polpa de maçãs, dos cultivares Gala e Fuji, sendo estas homogeneizadas separadamente em liquidificador com 100mL e 300mL, respectivamente, de solução tampão fosfato de sódio (100mM pH 5,0) gelada. Após homogeneização as amostras foram filtradas em tecido de algodão e os filtrados foram centrifugados a 17.000xg por 20 minutos, a 4°C. Para a extração da peroxidase ionicamente ligada, o resíduo da centrifugação foi ressuspenso utilizando 100mL de solução 1M de NaCl em tampão fosfato de sódio 100mM pH 5,0, seguida por centrifugação nas mesmas condições anteriores. Posteriormente, os sobrenadantes foram misturados e os extratos enzimáticos brutos da casca e polpa de maçãs dos cultivares Gala e Fuji foram congelados a ¾ 18°C.
2.2.2 ¾ Obtenção dos extratos enzimáticos concentrados
Os extratos enzimáticos brutos da casca e polpa foram concentrados pela precipitação das proteínas utilizando acetona resfriada a 4°C, na proporção de 2:1 (acetona:extrato).Os precipitados foram ressuspensos em tampão fosfato de sódio 100mM pH 5,0 em volume cinco vezes menor, em relação ao volume inicial do extrato.
2.2.3 ¾ Determinação do teor total de proteína nos extratos enzimáticos
A determinação de proteína nos extratos enzimáticos concentrados foi realizada de acordo com o método descrito por BRADFORD [4].
2.2.4 ¾ Eletroforese
A eletroforese, dos extratos enzimáticos concentrados, para detecção de peroxidase, foi realizada de acordo com o método descrito por ALVIM, CLEMENTE, [1].
Os extratos concentrados foram absorvidos em papel de filtro Whatman número 3 (5x6mm) e inseridos verticalmente em gel de amido a 10%, preparado com solução tampão tris/ácido cítrico e solução tampão ácido bórico/hidróxido de lítio, na proporção de 9:1. Nas cubas foi usada solução tampão ácido bórico/hidróxido de lítio (pH 8,3). Após a migração das proteínas, com 2,5v/cm de gel, durante 16 horas, o gel foi incubado a 37°C, ao abrigo da luz. Para a coloração do gel foram utilizados 50mL de solução tampão fosfato pH 6, 0,10mL de metanol e 2,5mL de o-dianisidina 1% (p/v), deixando-se por um período de 5 minutos, adicionando-se 8mL de solução de peróxido de hidrogênio, ficando então em repouso até a visualização das bandas.
Após a coloração, os géis foram lavados e fixados com solução contendo água destilada, metanol e ácido acético (5:5:1).
2.2.5 ¾ Determinação da atividade enzimática de POD
A atividade enzimática de POD foi determinada pelo método descrito por CLEMENTE [11], utilizando-se um espectrofotômetro UV-VIS (Hitachi U-200) a 460nm. Para a reação misturaram-se 0,2mL do extrato enzimático concentrado com 2,7mL de solução de água oxigenada 0,1% em tampão fosfato de sódio (100mM pH 5,0), e finalmente, 0,1mL de solução de o-dianisidina 1% em etanol. Uma unidade de atividade de POD foi definida como o aumento de uma unidade de absorbância por minuto/g de amostra.
2.2.6 ¾ Determinação da atividade enzimática de PPO
A atividade de PPO foi determinada pelo método descrito por FUJITA et al. [14], utilizando-se um espectrofotômetro UV-VIS (Hitachi U-200). A mistura de 0,5mL do extrato enzimático concentrado, 0,8mL de solução tampão fosfato de sódio 100mM pH 5,0 e 0,05mL de solução de catecol 0,01M foi incubada a 30°C por 30 minutos. Em seguida, adicionou-se 0,8mL de ácido perclórico 2N e a absorbância foi medida a 395nm. Uma unidade de atividade de PPO foi definida como o aumento de uma unidade de absorbância por minuto/g de amostra.
2.2.7 ¾ Tratamento térmico dos extratos concentrados da casca e polpa
Os extratos enzimáticos concentrados da casca e polpa de maçã dos cultivares Gala e Fuji foram submetidos a tratamentos térmicos a 60, 65, 70, 75°C, por períodos de 0, 1, 2, 3, 4, 6, 8, 10 minutos e a atividade residual de POD e PPO foi determinada como descrito anteriormente.
3 ¾ RESULTADOS E DISCUSSÃO
A Tabela 1 ilustra o teor de proteínas, atividade de peroxidase e polifenoloxidase nos extratos enzimáticos concentrados da casca e polpa de maçãs dos cultivares Gala e Fuji. Observou-se que o teor de proteína na polpa da maçã Fuji foi maior do que o encontrado nas demais amostras analisadas. Verificou-se que a maior atividade enzimática de peroxidase está presente na casca, tanto da maçã de cultivar Gala quanto na de cultivar Fuji. Os resultados encontrados mostram-se condizentes com aqueles obtidos por ALVIM, CLEMENTE [1], que relataram ter encontrado em mexerica a maior atividade da enzima peroxidase na casca, tanto para a forma solúvel como para a ionicamente ligada. A maior atividade da polifenoloxidase foi observada no extrato da casca da cultivar Fuji em relação às demais amostras analisadas.
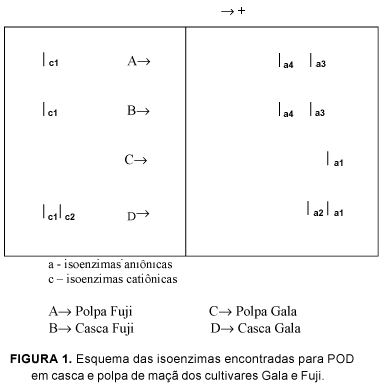
Após a eletroforese para peroxidase dos extratos enzimáticos concentrados da maçã Fuji, observou-se que tanto o extrato da polpa quanto o da casca apresentaram uma isoenzima catiônica (c1) e duas isoenzimas aniônicas (a3, a4). No gel da eletroforese dos extratos concentrados da maçã Gala, detectaram-se uma isoenzima aniônica (a1) da peroxidase na polpa e duas isoenzimas aniônicas da peroxidase (a1, a2) e duas isoenzimas catiônicas da peroxidase (c1, c2) na casca. Os resultados estão ilustrados na Figura 1.
Durante o tratamento térmico dos extratos enzimáticos concentrados, observou-se um decréscimo quase contínuo da atividade de peroxidase e polifenoloxidase em todas as temperaturas, tanto para os extratos da polpa quanto para os extratos da casca de ambos os cultivares citados.
A variação da atividade enzimática de peroxidase para a polpa e casca, em função do tratamento térmico, nas temperaturas de 60, 65, 70 e 75°C, está ilustrada nas Figuras 2, 3, 4 e 5.
O tratamento térmico para a peroxidase mostrou ser um processo não-linear, o que está em concordância com o relatado por McLELLAN, ROBINSON [18] em seu trabalho com peroxidase em repolho. KHAN, ROBINSON [16] também observaram este tipo de comportamento em seu estudo de termoestabilidade de peroxidase em manga.
A peroxidase não foi inativada utilizando-se os tratamentos térmicos testados. Observou-se uma perda máxima de 85% na atividade desta enzima, após 10 minutos de tratamento térmico dos extratos da polpa da maçã Gala e da casca da maçã Fuji a 75°C.
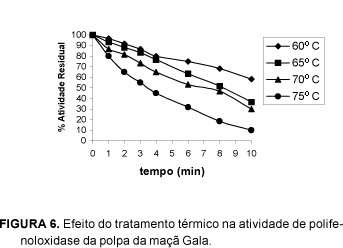
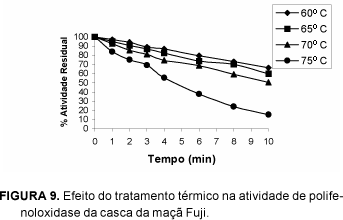
As Figuras 6, 7, 8 e 9 apresentam, respectivamente, o comportamento da atividade de polifenoloxidase após tratamento térmico em temperaturas de 60, 65, 70 e 75°C em função do tempo.
Analisando-se as variações da atividade enzimática de polifenoloxidase, frente ao tratamento térmico, observou-se tratar de um processo não-linear. Verificou-se decréscimo quase contínuo da atividade de polifenoloxidase, podendo esta chegar à total inativação, como no caso da casca da maçã Gala na temperatura de 75°C por 10 minutos.
4 ¾ CONCLUSÕES
Na determinação do teor proteína dos extratos enzimáticos concentrados das maçãs de cultivares Gala e Fuji, concluiu-se que o cultivar Fuji apresenta maior teor de proteína tanto na casca quanto na polpa, quando comparada com o cultivar Gala.
Os resultados da eletroforese indicaram que tanto os extratos da polpa como os da casca da maçã Fuji apresentam uma isoenzima catiônica e duas isoenzimas aniônicas da peroxidase. Já o extrato da polpa da maçã Gala apresenta apenas uma isoenzima catiônica em sua composição, enquanto a casca deste mesmo cultivar apresenta duas isoenzimas catiônicas e duas aniônicas da peroxidase. Para ambos os cultivares foi obtida separação eficiente das isoenzimas aniônicas e catiônicas.
Na determinação da atividade enzimática de PPO e POD pode-se concluir que a casca da maçã de cultivar Fuji apresenta maior atividade tanto de PPO quanto de POD, quando comparado com a polpa do referido cultivar, ou mesmo com a casca ou a polpa do cultivar Gala.
O estudo do tratamento térmico dos extratos concentrados da polpa e casca dos cultivares Gala e Fuji, nas temperaturas de 60°C, 65°C, 70°C e 75°C, durante o período de 0, 1, 2, 3, 4, 6, 8 e 10 minutos, nos permite concluir que a atividade de PPO diminui com o aumento da temperatura e tempo de exposição do extrato enzimático, sendo que a isoenzima foi inativada após 10 minutos de tratamento a 75°C. O tratamento térmico realizado nas mesmas condições não foi eficiente para a inativação da peroxidase. Obteve-se inativação máxima de 85% da atividade de peroxidase, após 10 minutos de tratamento, a 75°C.
5 ¾ REFERÊNCIAS BIBLIOGRÁFICAS
6-¾ AGRADECIMENTOS
Ao CNPq pela concessão da bolsa de Iniciação Científica.
2 Universidade Estadual de Maringá ¾ Departamento de Química. Cep ¾ 87020-900 ¾ Maringá-Paraná. E-mail: eclemente@uem.br.
* A quem a correspondência deve ser enviada.
- [1] ALVIM, K.; CLEMENTE, E. Estudo da termoestabilidade de peroxidases extraídas da polpa e casca de mexerica (Citrus deliciosa). Acta Scientiarum. v. 2, p. 201-205, 1998.
- [2] BENDER, R.J. Manual da cultura da macieira: Colheita e armazenamento. In. EMPASC. Florianópolis/SC, p. 521-550, 1986.
- [3] BERNARD, J.; KREUZ, C.L.; RAASIL, Z.S. Manual da cultura da macieira: Padronização e classificação da maçã. In. EMPASC. Florianópolis/SC, p. 551-562, 1986.
- [4] BRADFORD, M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein ž dye binding. Anal. Biochem. v. 72, p. 248-254, 1976.
- [5] BRUEMMER, J.H.; BONGWOO, R. and BOWEN, E.R. Peroxidase reactions and orange juice quality. J. Food Sci Chicago/USA, v. 41, p. 186-189, 1976.
- [6] BURNETTE, F.S. Peroxidase and its relationship to food flavour and quality: A review. J. Food Sci. v. 42, p. 1-6, 1977.
- [7] CANO, M.P.; ANCOS, B.; LOBO, G. Peroxidase and polyphenoloxidase activities in papaya during postharvest ripening and after freezing/thawing. Journal of Food Science. v. 60, p. 815-820, 1995.
- [8] CARVALHO, V.D.; CHALFOUN, S.M.; CLEMENTE, E. e LEITE, I.P. Relationship between phenolic compouds, peroxidase and polyphenoloxidasse activites and physiological deterioration on cassava. R. Bras. Mand. v.2, p. 89-96, 1985.
- [9] CLEMENTE, E. Heat stability of soluble and ionically bound peroxidase from orange. Unimar. v. 3, p. 401-408, 1995.
- [10] CLEMENTE, E. Isolamento, purificação e termoestabilidade da isoperoxidase do suco de laranja. Ciência e Tecnologia de Alimentos v. 16, p. 1-5, 1996.
- [11] CLEMENTE, E. Purification and thermostability of purified isoperoxidases from Oranges. Phytochemistry. v. 49, p. 29-36, 1998.
- [12] CLEMENTE, E.; PASTORE, G..M. Peroxidase and polyphenoloxidase, the importance for food technology. e Ciênc. Tecnol. Aliment. v. 32, p. 167-171, 1998.
- [13] CLEMENTE, E.; ROBINSON, D.S. The thermostability of purified oranges isoperoxidases. Arq. Biol. Tecnol. v. 38, p. 1109-1118, 1995.
- [14] FUJITA, S.; SAARI, N., MAEGAWA, M.; TETSUKA, T.; HAYASHI, N.; TONO, T. Purification and properties of polyphenol oxidase from cabbage (Brassica oleracea L.). J. Agric. Food Chem. v. 43, p. 1138-1142, 1995.
- [15] KHAN, A.A. & ROBINSON, D.S. Purification of an anionic peroxidase isoenzyme from mango (Mangifera indica L.var.chaunsa). J.Food Sci. v. 46, p. 61-64, 1993.
- [16] KHAN, A.A. & ROBINSON, D.S. The thermostability of purified mango isoperoxidases. Food Chem, Barking/UK, v. 47, p. 53-59, 1993.
- [17] KREUZ, C.L., Situação atual e perspectivas. Toda Fruta. São Caetano do Sul, p. 17-19, 1988.
- [18] MCLELLAN, K.M.; ROBINSON, D.S. Heat stability of peroxidase from orange. Food Chem. v. 13, p. 139-147, 1984.
- [19] PRABHA, T.N.; PATWARDHAN, M.V. Polyphenoloxidase (PPO) and peroxidase (POD) enzyme activities and their isoenzyme patterns in ripening fruits. Acta Alimentaria. v. 15, p. 199-207, 1986
- [20] REED, G. Oxireductases. In "Enzymes in Food Processing"Academic Press, New York, p. 125-165, 1975.
- [21] VAMOS-VIGYAZO, L. Polyphenoloxidase and peroxidase in fruits and vegetables. CRC Crit. Ver. Food Sci. Nutr. Boca Raton/USA, v. 49, p. 127, 1981.
Datas de Publicação
-
Publicação nesta coleção
27 Maio 2002 -
Data do Fascículo
Dez 2001
Histórico
-
Aceito
10 Set 2001 -
Recebido
29 Jan 2000