RESUMO
Aechmea Ruiz & Pav. e Canistropsis (Mez) Leme pertencem à subfamília Bromelioideae, detentora da maior diversidade morfológica em Bromeliaceae. Botões florais de Aechmea distichantha Lem. e Canistropsis billbergioides (Schult. & Schult. f.) Leme foram coletados, fixados e processados conforme técnicas usuais em anatomia vegetal. As espécies compartilham características, tais como presença de cristais de sílica esféricos nas células epidérmicas do perianto; idioblastos contendo ráfides; endotécio com espessamento do tipo anelar e ovário ínfero com placentação axilar. Apêndices petaloides não vascularizados foram observados apenas em flores de A. distichantha, dispostos aos pares em cada pétala. Em ambas as espécies ocorre um nectário septal cuja secreção é rica em proteínas e carboidratos. Tecido obturador placentário está presente, e testes histoquímicos revelaram que a secreção produzida por este tecido contém proteínas e carboidratos, provavelmente, relacionados com o direcionamento do tubo polínico aos óvulos.
Palavras-chave:
apêndices petaloides; nectário septal; obturador
ABSTRACT
Aechmea Ruiz & Pav. and Canistropsis (Mez) Leme belong to the subfamily Bromelioideae, which has the largest morphological diversity in Bromeliaceae. The flower buds of Aechmea distichantha Lem. and Canistropsis billbergioides (Schult. & Schult. f.) Leme were collected, fixed, and processed according to usual techniques in plant anatomy. The species share characteristics such as the presence of spherical crystals of silica in the epidermal cells of perianth; idioblasts with raphids; endothecium with annular thickening; and inferior ovary with axillary placentation. Nonvascular petal appendages were observed only in A. distichantha, arranged in pairs on each petal. Both species present a septal nectary, which nectar is rich in of proteins and carbohydrates. A placental obturator occurs in both species and histochemical tests revealed that the secretion produced by the obturator contains carbohydrates and proteins, probably related to the pollen tube guidance.
Keywords:
obturator; petal appendages; septal nectary
Introdução
Bromeliaceae é uma família de aproximadamente 3.350 espécies, distribuídas em 58 gêneros (Luther 2012Luther, H. 2012. An alphabetical list of bromeliad binomials. 12th ed. The Bromeliad Society International. The Marie Selby Botanical Gardens, Sarasota & Bromeliad Society International.), tradicionalmente, subdividida em três subfamílias: Pitcairnioideae (Meisner) Harms, Tillandsioideae (Dumortier) Harms e Bromelioideae Harms, sendo diferenciadas pela morfologia foliar, posicionamento do ovário, tipo de fruto e semente (Smith & Downs 1974Smith L.B. & Downs R.J. 1974. Pitcairnioideae (Bromeliaceae). Flora Neotropica Monograph 14: 1-662., 1977Smith L.B. & Downs R.J. 1977. Tillandsioideae (Bromeliaceae). Flora Neotropica Monograph 14: 663-1492., 1979Smith L.B. & Downs R.J. 1979. Bromelioideae (Bromeliaceae). Flora Neotropica Monograph 14: 1493-2142.). No entanto, a partir de análises filogenéticas baseadas em dados moleculares, Givnish et al. (2007)Givnish, T.J., Millam, K.C., Berry, P.E. & Sytsma, K.J. 2007. Phylogeny, adaptive radiation, and historical biogeography of Bromeliaceae inferred from ndhF sequence data. Aliso 23: 3-26. reconhecem oito subfamílias monofiléticas (Bromelioideae, Tillandsioideae, Pitcairnioideae, Navioideae, Puyoideae, Brocchinioideae, Hechtioideae e Lindmanioideae), as quais possuem um conjunto de características morfológicas que, às vezes, se sobrepõem, sendo difícil o reconhecimento em campo.
Bromelioideae é detentora da maior diversidade morfológica em Bromeliaceae e compreende mais da metade dos gêneros da família, dentre eles Aechmea Lem. e Canistropsis (Mez) Leme (Benzing 2000Kulkarni, R.A. & Pai, R.M. 1982. The floral anatomy of Puya spathacea Mez. (Bromeliaceae) with special reference to nectaries. Proceedings of Indian Academy of Sciences 91: 472-478.). Aechmea é o maior gênero de Bromeliaceae, compreendendo cerca de 270 espécies (Luther 2012Luther, H. 2012. An alphabetical list of bromeliad binomials. 12th ed. The Bromeliad Society International. The Marie Selby Botanical Gardens, Sarasota & Bromeliad Society International.), sendo 159 endêmicas do Brasil (Forzza et al. 2015Forzza, R.C., Costa, A., Siqueira Filho, J.A., Martinelli, G., Monteiro, R.F., Santos-Silva, F., Saraiva, D.P., Paixão-Souza, B., Louzada, R.B., Versieux, L. 2015. Bromeliaceae. In: Lista de Espécies da Flora do Brasil. Jardim Botânico do Rio de Janeiro. Disponível em http://floradobrasil.jbrj.gov.br/jabot/floradobrasil/FB6335 (acesso em 04-X-2015).
http://floradobrasil.jbrj.gov.br/jabot/f...
). A maioria das espécies é reconhecida pela presença de escapo bem desenvolvido; flores com pétalas livres, as quais apresentam apêndices em sua base; anteras dorsifixas e óvulos caudados (Smith & Downs 1979Smith L.B. & Downs R.J. 1977. Tillandsioideae (Bromeliaceae). Flora Neotropica Monograph 14: 663-1492.). Por outro lado, Canistropsis é um dos menores gêneros da família, com 11 espécies reconhecidas, todas endêmicas da Mata Atlântica brasileira (Forzza et al. 2015Forzza, R.C., Costa, A., Siqueira Filho, J.A., Martinelli, G., Monteiro, R.F., Santos-Silva, F., Saraiva, D.P., Paixão-Souza, B., Louzada, R.B., Versieux, L. 2015. Bromeliaceae. In: Lista de Espécies da Flora do Brasil. Jardim Botânico do Rio de Janeiro. Disponível em http://floradobrasil.jbrj.gov.br/jabot/floradobrasil/FB6335 (acesso em 04-X-2015).
http://floradobrasil.jbrj.gov.br/jabot/f...
). Dentre as características mais marcantes do grupo, destacam-se a inflorescência composta, dividida em fascículos e recobertas por grandes brácteas; corola gamopétala e ausência de apêndices nas pétalas (Smith & Downs 1979Smith L.B. & Downs R.J. 1977. Tillandsioideae (Bromeliaceae). Flora Neotropica Monograph 14: 663-1492.).
Os apêndices petaloides são pouco estudados, apesar de utilizados na circunscrição de muitos gêneros de Bromeliaceae (Benzing 2000Benzing, D.H. 2000. Bromeliaceae: profile of an adaptive radiation. Cambridge University Press, Cambridge.). Dentre os estudos já realizados, destaca-se o trabalho de Brown & Terry (1992)Brown, G.K. & Terry, R.G. 1992. Petal appendages in Bromeliaceae. American Journal of Botany 79: 1051-1071., com espécies das subfamílias Bromelioideae, Pitcairnioideae, Tillandsioideae, Puyoideae e Navioideae. De acordo com os autores, tais apêndices se desenvolvem na porção adaxial das pétalas e são as últimas estruturas a serem formadas na flor. Em todas as subfamílias, os apêndices surgem como duas pequenas proeminências que flanqueiam os filetes antipétalos e não são vascularizados (Brown & Terry 1992Brown, G.K. & Terry, R.G. 1992. Petal appendages in Bromeliaceae. American Journal of Botany 79: 1051-1071.). Nas subfamílias Pitcairnioideae, Puyoideae e Navioideae, seus primórdios se unem logo após a sua iniciação, resultando em apenas um apêndice por pétala.
Segundo hipótese filogenética proposta por Schulte & Zizka (2008)Schulte, K. & Zizka, G. 2008. Multi locus plastid phylogeny of Bromelioideae (Bromeliaceae) and the taxonomic utility of petal appendages and pollen characters. Candollea 63: 209-225., tais estruturas representam uma homoplasia em Bromeliaceae, com múltiplas origens, tendo surgido ao menos três vezes em Bromelioideae. Nesta subfamília, os apêndices são mais complexos, com maior variação morfológica, podendo ser laminares e inteiros a fimbriados (Brown & Terry 1992Brown, G.K. & Terry, R.G. 1992. Petal appendages in Bromeliaceae. American Journal of Botany 79: 1051-1071.). De acordo com Brown & Terry (1992)Brown, G.K. & Terry, R.G. 1992. Petal appendages in Bromeliaceae. American Journal of Botany 79: 1051-1071. e Benzing (2000)Benzing, D.H. 2000. Bromeliaceae: profile of an adaptive radiation. Cambridge University Press, Cambridge., os apêndices estão relacionados à provável função de elevação do néctar em corolas essencialmente tubulares, estabilizando assim a concentração do açúcar e a viscosidade do néctar, retardando a sua evaporação.
Em Bromeliaceae, a presença de nectários septais é uma das características florais mais marcantes. Apesar de serem comuns nas monocotiledôneas em geral, em Poales apenas foram registrados em Bromeliaceae e Rapateaceae. No que diz respeito aos estudos dos nectários septais, poucos são os estudos anatômicos se considerarmos o grande número de espécies reconhecidas na família. Kulkarni & Pai (1982)Kulkarni, R.A. & Pai, R.M. 1982. The floral anatomy of Puya spathacea Mez. (Bromeliaceae) with special reference to nectaries. Proceedings of Indian Academy of Sciences 91: 472-478. descrevem a estrutura dos nectários septais em Puya spathaceae Mez. Outros dois trabalhos que merecem destaque são os de Bernardello (1991)Bernardello, L.M., Galetto, L. & Juliani, H.R. 1991. Floral Nectar, Nectary Structure and Pollinators in Some Argentinean Bromeliaceae. Annals of Botany 67: 401-411., no qual são analisados aspectos relativos à composição do néctar e estrutura dos nectários em Bromeliaceae da Argentina, e o de Sajo et al. (2004)Sajo, M.G., Rudall, P.J. & Prychid, C.J. 2004. Floral anatomy of Bromeliaceae, with particular reference to the evolution of epigyny and septal nectaries in commelinid monocots. Plant Systematics and Evolution 247: 215-231. onde a presença e o tipo de nectário septal (infralocular ou interlocular) são relacionados à evolução da epigenia nas comelinídeas, em especial Bromeliaceae. Apesar de ser uma característica de importância taxonômica e ecológica, ainda há a necessidade de mais estudos em relação à estrutura dos nectários septais no grupo.
Ainda na região do ovário, a presença do tecido obturador é outro caráter que vem sendo registrado em algumas famílias de Poales, como Rapateaceae (Oriani & Scatena 2013Oriani, A. & Scatena, V.L. 2013. The taxonomic value of floral characters in Rapateaceae (Poales-Monocotyledons). Plant Systematics and Evolution 299: 291-303.), Juncaceae (Oriani et al. 2012Oriani, A., Scatena, V.L. 2012. Flora l anatomy of xyrids (Poales): contributions to their reproductive biology, taxonomy and phylogeny. International Journal of Plant Sciences, v. 173, p. 767-779.), Cyperaceae (Goetghebeur 1998Goetghebeur, P. 1998. Cyperaceae. In: K. Kubitzki (ed.). The families and the genera of vascular plants-IV Monocotyledons. SpringerVerlag, Berlin, pp 141-190., Coan et al. 2008Coan, A.I, Alves, M.V., Scatena, V.L. 2008 Comparative study of ovule and fruit development in species of Hyspolytrum and Rhynchospora (Cyperaceae- Poales). Plant Systematic and Evolution. 272: 181-195.) e Bromeliaceae (Sajo et al. 2004Sajo, M.G., Rudall, P.J. & Prychid, C.J. 2004. Floral anatomy of Bromeliaceae, with particular reference to the evolution of epigyny and septal nectaries in commelinid monocots. Plant Systematics and Evolution 247: 215-231., Fagundes & Mariath 2010Fagundes, N.F., Mariath, J.E.A. 2010. Morphoanatomy and ontogeny of fruit in Bromeliaceae species. Acta Botanica Brasilica. 24: 765-779.). Tal tecido pode ter origem na placenta, no funículo, nos tegumentos ou no arilo e, em alguns casos, pode ter origem mista, como por exemplo a partir da placenta e do funículo, recebendo a denominação de tecido obturador placentáriofunicular (Tilton & Horner Jr. 1980Tilton, V.R. & Horner Jr., H.T. 1980. Stigma, style, and obturator of Ornithogalum caudatum (Liliaceae) and their function in the reproductive process. American Journal of Botany 67: 1113-1131., Davis 1966Davis, G.L. 1966. Systematic Embriology of the Angiosperms. New York: John Wiley and Sons., Rao 1959Rao, C.V. 1959. Contributions to the embryology of Palmae. I. Sabalae. Proceedings of the National Institutes of Sciences of India. 25: 143-169.).
Diversos estudos a respeito da composição química da secreção do tecido obturador apontam a pectina como o principal componente (Hudák et al. 1993Hudák J, Walles B, Vennigerholz F. 1993. The transmitting tissue in Brugmansia suaveolens L.: ultrastructure of the stylar transmitting tissue. Annals of Botany 71:177-186., Herrero 2000Herrero, M. 2000. Changes in the Ovary Related to Pollen Tube Guidance. Annals of Botany 85: 79-85.), além de outros polissacarídeos, proteínas e lipídeos (Singh & Walles 1992Singh, S.,Walles, B. 1992. The ovarian transmitting tissue. International Journal of Plant Sciences . 153: 205-211.). Em Bromeliaceae, nos poucos trabalhos que descrevem a ocorrência e estrutura do tecido obturador, não são mencionados dados histoquímicos do exudado que possam ser confrontados com a literatura disponível em outros grupos.
Com o objetivo de aumentar o conhecimento do grupo quanto aos aspectos relativos à ocorrência e estrutura dos apêndices petaloides, dos nectários septais e do tecido obturador, neste estudo são descritos caracteres morfoanatômicos florais de duas espécies Bromeliaceae (Aechmea distichantha Lem. e Canistropsis billbergioides (Schult. & Schult.f.) Leme). Além da descrição morfoanatômica floral, são apresentados dados inéditos relativos à natureza histoquímica do tecido obturador em representantes da família.
Material e métodos
Indivíduos adultos de Aechmea distichantha Lem. e Canistropsis billbergioides (Schult. & Schult.f.) Leme foram coletados no Fitotério do Departamento de Botânica, no Instituto de Biociências da Universidade de São Paulo (USP). Parte do material coletado foi herborizado e depositado no Herbário da Universidade de São Paulo sob os números F.M.C. Oliveira 34 (SPF), F.M.C. Oliveira, 39 (SPF Inflorescências das duas espécies foram fixadas em FAA 50 (Formaldeído, ácido acético e etanol 50 ºGL), como descrito por Johansen (1940)Johansen, D.A. 1940. Plant microtechnique. McGraw-Hill, New York. para a preservação dos compostos hidrofílicos e FNT (Formalina Neutra Tamponada) por 48 horas para a preservação dos compostos lipofílicos (Lillie 1965Lillie, R.D. 1965. Histopathologic technic and pratical histochemistry. 3 ed. McGraw Hill, New York.) e depois estocadas em álcool 70. Botões florais foram desidratados em série etanólica/butanólica e incluídos em parafina (Ruzin 1999Ruzin, S.E. 1999. Plant Microtechnique and Microscopy. Oxford University Press, New York.). Secções transversais e longitudinais seriadas, com espessura entre 8 a 10 µm, foram obtidas em micrótomo rotativo. As secções foram desparafinadas com acetato de butila e coradas com a dupla coloração Azul de Astra 1% em etanol 50% e Safranina 1% em etanol 50% (Kraus & Arduim. 1997Kraus, J.E. & Arduin, M. 1997. Manual básico de métodos em morfologia vegetal. Edur, Seropédica., modificado). As lâminas foram montadas em Bálsamo do Canadá.
Testes histoquímicos foram realizados com Azul de Alcião (Pearse 1985Pearse, A.G.E. 1985. Histochemistry: theoretical and applied. Little, Brown & Company, Boston.), Lugol (Johansen 1940Johansen, D.A. 1940. Plant microtechnique. McGraw-Hill, New York.), Reação de PAS (McManus 1948McManus, J.F.A. 1948. Histological and Histochemical Uses of Periodic Acid. Stain Technology 23: 99-108.), Preto de Amido B (Fisher 1968Fisher, D.B. 1968. Protein Staining of Ribboned Epon Sections for Light Microscopy. Histochemie 16: 92-96.), Preto de Sudão B (Pearse 1985Pearse, A.G.E. 1985. Histochemistry: theoretical and applied. Little, Brown & Company, Boston.) para detecção de pectinas, amido, carboidratos, proteínas e lipídeos, respectivamente.
Para análise em microscopia eletrônica de varredura (MEV), pétalas de botões florais e de flores em antese foram desidratadas em série etanólica. Posteriormente, as amostras foram submetidas ao ponto crítico de CO2, e metalizadas em ouro (Silveira 1989Silveira, M. 1989. O preparo de amostras biológicas para microscopia eletrônica de varredura. In: W. Souza (ed.). Manual sobre Técnicas Básicas em Microscopia Eletrônica de Varredura. Sociedade Brasileira de Microscopia Eletrônica, v. 1, pp. 71-82.).
Resultados
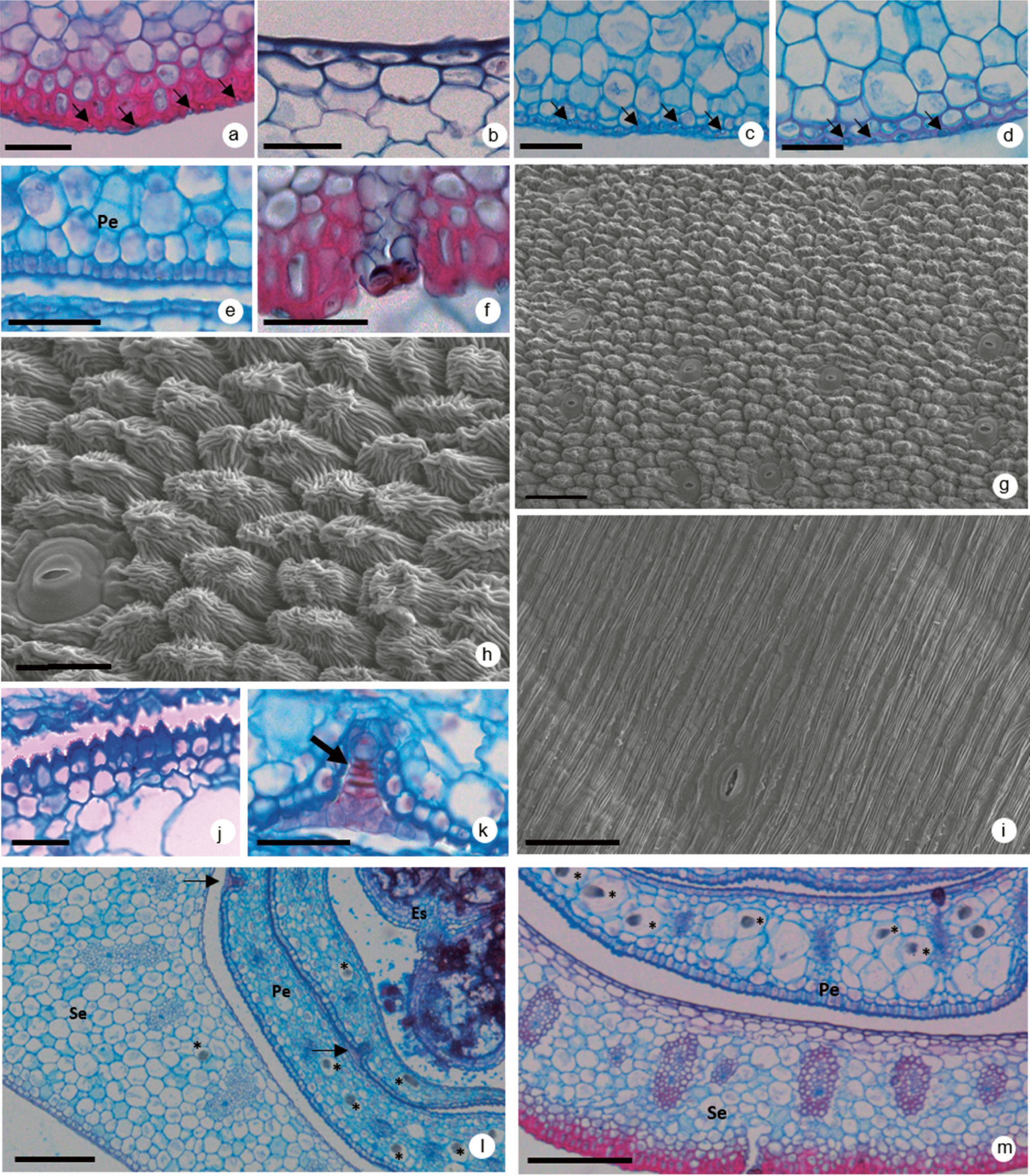
Perianto ˗ A epiderme das sépalas e pétalas, nas duas espécies, é unisseriada (figuras 1a-f), com cristais esféricos de sílica presentes apenas nas células da face abaxial das sépalas (figuras 1a, c, d). Em Aechmea distichantha, células epidérmicas com espessamento de parede em "u" (figura 1a) ocorrem apenas nas sépalas e em toda sua extensão. Já em Canistropsis billbergioides tal espessamento ocorre apenas na região próxima ao ápice das sépalas (figura 1d).
Aspectos morfo-anatômicos do perianto das flores de Aechmea distichantha e Canistropsis billbergioides. a. Secção transversal da sépala de A. distichantha. Detalhe das células epidérmicas na face abaxial, onde as cabeças de seta indicam corpos de sílica. b. Secção transversal da sépala de A. distichantha, mostrando a epiderme na face adaxial. c. Secção transversal da região basal da sépala de C. billbergioides. Detalhe das células epidérmicas na face abaxial, onde as cabeças de seta indicam corpos de sílica. d. Secção transversal da região apical da sépala de C. billbergioides. Detalhe das células epidérmicas na face abaxial, onde as cabeças de seta indicam corpos de sílica. e. Secção transversal da pétala de C. billbergioides, epiderme unisseriada na face abaxial. f. Secção transversal do botão floral de A. distichantha, mostrando epidérmicas lignificadas na face abaxial da sépala. g-i. Microscopia Eletrônica de Varredura (MEV) da pétala de A. distichantha, evidenciando as células de aparência cônica na região apical da pétala (g) e a superfície plana na região basal da pétala (i). Note em h, detalhe da cutícula estriada e o aspecto cônico das células epidérmicas na região apical da pétala. j. Secção transversal da porção apical da pétala de A. distichantha evidenciando as células da epiderme (cônicas). k. Secção transversal da pétala de C. billbergioides, mostrando tricoma peltado (seta). l. Secção transversal do botão floral de C. billbergioides. Note mesofilo homogêneo nas pétalas (Pe) e na sépala (Se). Tricomas peltados absorventes estão apontados por setas. m. Secção transversal do botão floral de A. distichantha. Escalas: a, b, c, d, e, f, j, k = 50 µm, g, i = 60µm, h = 30 µm, l = 100 µm, m = 200 µm, Ap: apêndices petaloides, Es: estame, Pe: pétalas, Se: sépalas. *: idioblastos contendo ráfides
Figure 1
Morphoanatomical aspects of perianth of flowers of Aechmea distichantha and Canistropsis billbergioides. a. Cross section of A. distichantha sepals. Detail of epidermal cells of abaxial surface where the arrows indicate silica bodies. b. Cross section of A. distichantha sepals showing epidermal cells of adaxial surface. c. Cross section of sepal basal portion of C. billbergioides. Detail of epidermal cells of abaxial surface where arrows indicate silica bodies. d. Cross section of sepal apex portion of C. billbergioides. Detail of epidermal cells of abaxial surface where arrows indicate silica bodies. e. Cross section of C. billbergioides petals, unisseriate epidermis of abaxial surface. f. Cross section of A. distichantha flowers showing lignified epidermal cells in sepal abaxial surface. g-i. Scanning electron microscopy (SEM) of A. distichantha petals, in apical portion, showing conical cells (g) and of petal basal region showing plane portion (i). We can note in h the presence of striated cuticle and the conical epidermal cells of apical petal portion. j. Cross section of A. distichantha petal showing epidermis with conical cells. k. Cross section of C. billbergioides petals showing a peltate trichome (arrow). l. Cross section of C. billbergioides flower. Note See homogeneous mesophyll in petals (Pe) and sepals (Se). The arrow show absorbent peltate trichome. m. Cross section of A. distichantha flower. Scales: a, b, c, d, e, f, j, k = 50 µm, g, i = 60 µm, h = 30 µm, l = 100 µm, m = 200µm, *: idioblasts with raphids, Ap: petal appendages, Es: stamen, Pe: petals, Se: sepals.
Em relação às pétalas, as células epidérmicas, em vista frontal, apresentam aspecto cônico (figura 1g-h) na região apical da face abaxial, enquanto que na região basal, a epiderme é plana (figura 1i). Esta condição cônica da epiderme na região apical é resultado da deposição da cutícula estriada (figura 1h). Em ambas espécies foram observados estômatos na face abaxial de sépalas e pétalas (figuras 1f-h). Tricomas ocorrem apenas na face abaxial das pétalas em C. billbergioides, sendo registrados apenas tricomas peltados (figura 1j).
As sépalas e pétalas apresentam mesofilo homogêneo em C. billbergioides (figura 1k). Em A. distichantha as sépalas apresentam 4-5 camadas de células lignificadas próximas a face abaxial da epiderme e nas pétalas, é possível distinguir parênquima aquífero entre os feixes vasculares (figura 1l). Idioblastos contendo ráfides estão presentes apenas nas sépalas de C. billbergioides e nas pétalas de ambas as espécies (figura 2k-l).
a. Secção transversal do botão floral em Aechmea distichantha, mostrando os apêndices petaloides (Ap). b-c. Microscopia Eletrônica de Varredura (MEV) da flor (b) e do botão floral (c) de A. distichantha. Para a elaboração da imagem, foram retirados os estames para a melhor visualização das pétalas. Note em B, ocorre o par de apêndices na base das pétalas. Já no estágio de botão, os apêndices não são observados (c). d. Secção transversal da flor de Canistropsis billbergioides, mostrando o par de calosidades presentes nas pétalas (seta). e-j. Secções transversais do botão floral de C. billbergioides e A. distichantha. e. Visão geral do botão em C. billbergioides. f. Visão geral do botão em A. distichantha. g. Detalhe da pétala em C. billbergioides, evidenciando as calosidades (setas) e o filete (Fi) adnato à pétala (Pe). h. Detalhe do filete achatado em A. distichantha. i. Detalhe da antera em A. distichantha com filete livre. j. Detalhe da antera em C. billbergioides. Escalas: a, i, j = 200 µm, b, c, e, f = 500 µm, d = 300 µm, g, h = 100 µm. * = idioblastos portando ráfides, An: antera, Ap: apêndices petalóides, Es: estigma, Fi: filete, Pe: pétalas, Se: sépalas, St: estames.
Figure 2
a. Cross sections of Aechmea distichantha flower. See the presence of petal appendages in the petal (Ap). b-c. Scanning Electron Microscopy (SEM) of flower (b) and flower bud (c) of A. distichantha. For the picture caption we cut the stamens to better see the petals. Note a pair of petal appendages (Ap) in basal portion of petal. They are not observed in floral bud (c). d. Cross section of Canistropsis billbergioides flower, showing a pair of callosity in the petals (arrow). e-j. Cross section of flower bud of C. billbergioides and A. distichantha. e. General view of C.billbergioides flower bud. f. General view of A. distichantha flower bud. g. Detail of C. billbergioides petal, showing the callosities (arrows) and the adnate filament. h. Detail of the flat filament of A. distichantha. i. Detail of A. distichantha anther with free filament. j. Detail of C. billbergioides anther. Scales: a, i, j = 200 µm, b, c, e, f = 500 µm, d = 300 µm, g, h = 100 µm. *: idioblasts with raphids, An: anther, Ap: petal appendages, Es: stigma, Fi: filament, Pe: petals, Se: sepals, St: stamens.
A vascularização das sépalas é dada por até 18 feixes colaterais em A. distichantha e até 12 feixes em C. billbergioides. Já as pétalas possuem até 9 feixes vasculares em A. distichantha e 12 em C. billbergioides. Apenas em A. distichantha foi observado um par de apêndices petaloides na face adaxial das pétalas (figura 2a), os quais são inteiros com o ápice levemente recortado (figura 2b).
Estes apêndices possuem desenvolvimento tardio, sendo a última estrutura multicelular a se desenvolver nas flores, não estando presentes em botões jovens, como revelou a microscopia eletrônica de varredura (figura 2c). Canistropsis billbergioides, por sua vez, apresenta um par de calosidades longitudinais que flanqueiam os filetes adnatos às pétalas (figura 2d).
Androceu - O androceu é composto por dois ciclos de três estames (figura 2e-f), com os filetes da série epipétala adnatos na base às pétalas e com a porção distal e anteras livres, sendo a segunda série de estames livres (figura 2e-f). Em C. billbergioides, os filetes epipétalos são achatados e os antissépalos são cilíndricos (figura 2e), enquanto que em A. distichantha os filetes são nitidamente achatados (figura 2f). As células epidérmicas do filete apresentam paredes delgadas e o mesofilo é homogêneo, com idioblastos contendo ráfides apenas em A. distichantha (figura 2g-h). As anteras são tetrasporangiadas, sendo, na maturidade, constituídas por uma epiderme unisseriada (figura 2i-j), papilosa e endotécio com duas a três camadas de células e espessamento de parede anelar. Subjacente ao endotécio, encontra-se a camada média e as células do tapete, quase inconspícuas em microscopia ótica.
Gineceu ˗ As duas espécies apresentam ovário ínfero adnato ao hipanto, tricarpelar, sincárpico, e placentação axial (figura 3a, b). A epiderme externa do hipanto é unisseriada, cujas células contêm cristal de sílica (figuras 3c, d). A região do mesofilo em C. billbergioides é homogênea, enquanto que em A. distichantha, as células parenquimáticas mais externas possuem menor tamanho em relação às voltadas para o interior do órgão (figura 3e). Idioblastos contendo ráfides são observados em ambas espécies, sendo mais frequente em A. distichantha.
Secções transversais do gineceu. a-b. Região do ovário de Aechmea distichantha e Canistropsis billbergioides, respectivamente. c-d. Detalhe das células epidérmicas da parede do ovário em C. billbergioides (c) e A. distichantha (d). Cabeças de setas indicam cristais de sílica. e. Aspecto geral da parede do ovário de A. distichantha, mostrando o mesofilo com células menores na região mais externa (seta). f-g. Região da placenta, mostrando óvulos anátropos e tecido obturador em C. billbergioides (f) e A. distichantha (g). h-i. Detalhe do tecido obturador em C. billbergioides (h) e A. distichantha (i), mostrando células com citoplasma intensamente coradas (setas). Note que em A. distichantha, as células do obturador são mais alongadas, quando comparadas às de C. billbergioides. j. Resultado positivo do teste histoquímico para proteínas (Preto de Amido B) na secreção do tecido obturador de A. distichantha. k. Resultado positivo do teste histoquímico para carboidratos (PAS) na secreção do tecido obturador de A. distichantha. l. Região do nectário septal em e A. distichantha. m. Região do estilete em A. distichantha. n-o. Região do estigma em C. billbergioides (n) e A. distichantha (o). Note disposição espiralconduplicado. Escalas: a, b = 500 µm; c, h, i = 50 µm; d = 25 µm; e = 300 µm; f, g, j, k, n, o = 100 µm; l, m = 200 µm. *: idioblastos portando ráfides, Fv: feixe vascular, Ns: nectário septal, Pl: placenta, Ov: ovário, Ou: óvulo.
Figure 3
Gynoecia cross sections. a-b. Ovary portion of Aechmea distichantha and Canistropsis billbergioides, respectively. c-d. Detail of epidermal cells of the ovary wall of C. billbergioides (c) and A. distichantha (d) respectively. Arrows indicate silica bodies. e. general view of A. distichantha ovary wall, showing the mesophyll with smaller cells in the external region (arrow). f-g. Placentae portion, showing anatropous ovules and the obturator tissue of C. billbergioides (f) and A. distichantha. (g). h-i. Detail of obturator tissue in C. billbergioides (h) and A. distichantha (i), with cells with cytoplasm intensely stained in purple (arrow)). Note that A. distichantha obturator cells are more elongated when compared to C. billbergioides cells. j. Positive result of protein histochemical test (Black starch B) in the secretion of obturator tissue secretion of A. distichantha. k. Positive result of carbohydrates histochemical test (PAS) in the secretion of obturator tissue of A. distichantha. l. Detail of septal nectary of A. distichantha. m. Region of the style of A. distichantha. n-o. Detail of the stigma of C. billbergioides (n) and A. distichantha (o). Note the spiral-conduplicate arrangement. Scales: a, b = 500 µm; c, h, i = 50 µm; d = 25 µm; e = 300 µm; f, g, j, k, n, o = 100 µm; l, m = 200 µm *: idioblasts with raphids; arrow indicates obturator tissue, Fv: vascular bundle, Ns: septal nectary, Pl: placentae, Ov: ovary, Ou: ovule.
Os óvulos são anátropos (figura 3g) e a sua vascularização, bem como da placenta, é dada pelos feixes ventrais carpelares. Na região da placenta é observado tecido obturador (figura 3f-i) nas duas espécies. Em secção transversal do ovário, é possível observar que em A. distichantha as células do obturador são mais alongadas (figura 3i) em comparação às de C. billbergioides (figura 3h). As células do tecido obturador, em ambas espécies, apresentam conteúdo celular fortemente corado, indicando sua atividade secretora (figura 3h, i). Testes histoquímicos revelaram que a secreção produzida por este tecido contém proteínas e carboidratos. Em relação à origem do tecido obturador, nas duas espécies estudadas, o tecido tem origem placentária, não estando presente no funículo.
O ovário apresenta ainda um nectário septal interlocular (figura 3a, b, j, k), que ocorre desde o seu terço médio e encerra-se na porção apical do órgão. Em C. billbergioides o nectário ocorre na porção abaixo à placentação, sendo pouco desenvolvido na porção superior. Já em A. distichantha, a atividade secretora das células nectaríferas é mais evidente na porção mediana do ovário, mesma região onde estão inseridos os óvulos. (figura 4). Em ambos os casos, os nectários são vascularizados pelos feixes ventrais dos carpelos (figura 3j, k). Na porção superior do ovário, é possível observar que o feixe carpelar dorsal diverge do feixe estame-sépala acima do nectário septal (figura 4).
Esquema da vascularização floral. a. Canistropsis billbergioides. b. Aechmea distichantha. Fdc: feixe dorsal carpelar, Fvc: feixe ventral carpelar, Fe: feixe dos estames, Fs: feixe da sépala, Fp: feixe da pétala, Fes: feixe estame-sepalar, Ns: nectário septal.
Figure 4
Scheme of floral vascularization. a. Canistropsis billbergioides. b. Aechmea distichantha. Fdc: carpellary dorsal bundle, Fvc: carpellary ventral bundle, Fe: stamen bundle, Fs: sepal bundle, Fp: petal bundle, Fes: stamen-sepal bundle, Ns: septal nectary.
No estilete ocorre o tecido transmissor, caracterizado por uma única camada de células (figura 3l, m). Feixes dorsais dos carpelos estão presentes ao longo de todo o eixo do estilete. Em sua porção mediana-apical, as células epidérmicas são papilosas, sendo mais evidentes na porção apical, próximo ao estigma (figura 3m). O estigma, espiralconduplicado (figura 3n, o), possui epiderme na face abaxial papilosa e adaxial lisa e mesofilo homogêneo, com idioblastos contendo ráfides.
Discussão
A anatomia floral de Aechmea distichantha Lem. e Canistropsis billbergioides (Schult. & Schult.f.) Leme, a partir do material analisado, apresentou pouca variação no que diz respeito aos caracteres já descritos na literatura para Bromeliaceae. No entanto, em alguns casos os caracteres foram descritos apenas em órgãos vegetativos como, por exemplo, a ocorrência de corpos de sílica nas células epidérmicas, uma das características de Bromeliaceae considerada como plesiomórfica da ordem Poales (APG III 2009Angiosperm Phylogeny Group (APG III). 2009. An update of the Angiosperm Phylogeny Group classification for the order and families of flowering plants: APG III. Botanical Journal of the Linnean Society 161: 105-121.). De acordo com Krauss (1949)Krauss, B.H. 1949. Anatomy of the vegetative organs of the pineapple, Ananas comosus (L.) Merr. Botanical Gazette 110: 333-404. e Tomlinson (1969)Tomlinson, P.B. 1969. Comelinales -Zingiberales. In: C.R. Metcalfe (ed.). Anatomy of the monocotyledons: III. Claredon Press, Oxford, pp.193-294., tal caráter é frequentemente relatado nos órgãos vegetativos e, no presente estudo, foram observadas no cálice e no hipanto das duas espécies. Alguns autores como Tomlinson (1969)Tomlinson, P.B. 1969. Comelinales -Zingiberales. In: C.R. Metcalfe (ed.). Anatomy of the monocotyledons: III. Claredon Press, Oxford, pp.193-294. e Prychid et al. (2004)Prychid, C.J., Rudall, P.J. & Gregory, M. 2004. Systematics and Biology of Silica Bodies in Monocotyledons. The Botanical Review 69: 377-440. descrevam que os cristais de sílica são capazes de promover a reflexão da luz, reduzindo assim a transpiração nas folhas. Embora os autores não mencionem tal ocorrência em partes florais, podemos pensar em uma similar adaptação ecofisiológica descrita para folhas, uma vez que sua distribuição se concentra em regiões mais externas da flor, como sépalas e hipanto.
Outro caráter que também é frequentemente observado nos órgãos vegetativos em representantes de Bromeliaceae é a presença de idioblastos contendo ráfides (Krauss 1949Krauss, B.H. 1949. Anatomy of the vegetative organs of the pineapple, Ananas comosus (L.) Merr. Botanical Gazette 110: 333-404., Tomlinson 1969Tomlinson, P.B. 1969. Comelinales -Zingiberales. In: C.R. Metcalfe (ed.). Anatomy of the monocotyledons: III. Claredon Press, Oxford, pp.193-294.). Segundo os autores, esses idioblastos podem estar associados à necessidade de neutralizar a grande quantidade de ácido oxálico produzido nas folhas (Brighina et al. 1984Brighigna, L., Fiordi, A.C., Pallandri, M.R. 1984. Structural characteristics of mesophyll in some Tillandsia species. Phytomorphology 34: 191-200.), além de tornar a planta menos palatável aos herbívoros (Mauseth 1988Mauseth, J.D. 1988. PlantAnatomy. Benjamin/Cummings, Menlo Park.). Em estruturas florais, células contendo ráfides foram relatadas nas anteras de Bromeliaceae (Sajo et al. 2005Sajo, M.G., Furness, C.A., Prychid, C.J. & Rudall, P.J. 2005. Microsporogenesis and anther development in Bromeliaceae. Grana 44: 65-74.) e, no presente estudo, nos verticilos vegetativos (cálice e corola) e reprodutivos (androceu e gineceu).
O aspecto cônico da epiderme das pétalas observado nas duas espécies estudadas, foi registrado em outras espécies como Dahlia sp. (Asteraceae), Cardamine (Brassicaceae), Nerine sarniensis (L.) Herb. (Amaryllidaceae), Geranium procurrens (Geraniaceae), Veronica sp. (Plantaginaceae) e Helianthus annuus L. (Asteraceae) (Koch et al. 2008Koch, K., Bhushan, B., Barthlott, W. 2008. Diversity of Structure, morphology and wetting of plants surfaces. Soft Matter 4: 1943-1963., Whitney et al. 2011Whitney, H.M., Bennet, V., Dorling, M., Sandbach, L., Prince, D., Chittka, L., Glover, B. 2011. Why do so many petals have conical epidermal cells? Annals of Botany 108: 609-616.). Segundo os autores, este caráter pode apresentar algumas implicações ecológicas, como por exemplo melhor aderência do inseto polinizador durante a visita; evitar o acúmulo de resíduos na superfície ("self-cleaning") e, em alguns casos, pode intensificar a coloração da pétala. Embora não tenhamos testado estas hipóteses no presente estudo, é interessante observar que nas duas espécies as flores são tubulares e ao final da antese a superfície abaxial das pétalas fica voltada para cima, o que poderia indicar algum papel na atração dos polinizadores. Em Mayaca selowianna e M. fluviatilis (Mayacaceae, Poales), Oriani & Scatena (2012)Oriani, A., Stützel, T. & Scatena, V.L. 2012. Contributions to the floral anatomy of Juncaceae (Poales-Monocotyledons). Flora 207: 334-340. mencionam que as células papilosas nas pétalas podem estar associadas à atração de polinizadores. Curiosamente, nessas espécies as células papilosas ocorrem apenas na face adaxial, a qual fica voltada para cima ao final da antese e as flores não são tubulares.
Flores de Aechmea distichantha, representante da subfamília Bromelioideae, apresentam apêndices inteiros na base e recortados em seu ápice, como registrado em outras espécies do gênero tais como A. fulgens e A. seideliana (Brown & Terry 1992Brown, G.K. & Terry, R.G. 1992. Petal appendages in Bromeliaceae. American Journal of Botany 79: 1051-1071.). Em flores com pétalas livres, os apêndices podem ocorrer na base da pétala, como em A. distichantha ou, quando em corola gamopétala, ocorrem na porção mediana-distal (Leme 2000Leme, E.M.C. 2000. Nidularium - Bromélias da Mata Atlântica. 1 ed. Sextante, Rio de Janeiro.). Os apêndices petaloides observados em A. distichantha são a última estrutura a ser formada nas flores, corroborando Brown & Terry (1992)Brown, G.K. & Terry, R.G. 1992. Petal appendages in Bromeliaceae. American Journal of Botany 79: 1051-1071. os quais citam que a iniciação de tais apêndices é frequentemente associada à microsporogênese, não estando presente em botões florais mais jovens, como observado no presente estudo.
Ao estudar representantes da subfamília Barbacenioideae (Velloziaceae), Menezes (1973)Menezes, N.L. 1973. Natureza dos apêndices petalóides em Barbacenioideae (Velloziaceae). Boletim de Zoologia e Biologia Marinha 30: 713-755. constatou que os apêndices petaloides possuem vascularização, com feixes colaterais ocupando uma posição invertida em relação aos demais verticilos florais, apresentando xilema situado externamente ao floema. A partir desta observação, Menezes (1973)Menezes, N.L. 1973. Natureza dos apêndices petalóides em Barbacenioideae (Velloziaceae). Boletim de Zoologia e Biologia Marinha 30: 713-755. concluiu que os chamados apêndices petaloides presentes em Barbacenioideae correspondem a uma corona, similar a corona encontrada em Narcisus por Arber (1937)Arber, A. 1937. Studies in flower structure: III. On the 'corona' and androecium in certain Amaryllidaceae. Annals of Botany 1: 293-304.. Apesar da semelhança morfológica dos apêndices de A. distichantha e dos descritos por Menezes (1973)Menezes, N.L. 1973. Natureza dos apêndices petalóides em Barbacenioideae (Velloziaceae). Boletim de Zoologia e Biologia Marinha 30: 713-755. para Velloziaceae, não há vascularização destas estruturas em A. distichantha. Em relação às calosidades encontradas em C. billbergioides algumas semelhanças estruturais com o apêndices foram registradas no presente estudo, como ocorrência na face adaxial das pétalas e ausência de vascularização. No entanto, não é possível estabelecer homologias, sendo necessário novos estudos ontogenéticos e ecológicos.
Em relação ao androceu, as anteras em A. distichantha são tetrasporangiadas, sendo, na maturidade, constituídas por uma epiderme papilosa unisseriada e endotécio com espessamento de parede anelar, características que já foram registradas porSajo et al. (2005)Sajo, M.G., Furness, C.A., Prychid, C.J. & Rudall, P.J. 2005. Microsporogenesis and anther development in Bromeliaceae. Grana 44: 65-74. em representantes de Tillandsia L., Quesnelia Gaudich. e Aechmea Lem. Ainda neste trabalho, as autoras descrevem, ao analisar diversas espécies de Bromeliaceae, que as células do tapete são secretoras em um estágio precoce. As autoras também comentam que as células do tapete tendem a se degenerar precocemente, sendo relacionado com a presença de pólen estéril observada nas mesmas espécies. Entretanto o que se pode observar em A. distichantha e em C. billbergioides é a formação de grãos-de-pólen, aparentemente viáveis, com exina íntegra, sem aparente evidência estrutural de uma condição estéril.
Dentre os caracteres observados no gineceu destacamos, neste estudo, a ocorrência de nectários septais e do tecido obturador. Os nectários são classificados por Fahn (1952Fahn, A. 1952. On the structure of floral nectaries. Botanical Gazette 113: 464-470., 1979)Fahn, A. 1979. Secretory Tissues in Plants. Academic Press, London. em estruturados, quando possuem o tecido nectarífero diferenciado em parênquima e epitélio, ou não estruturados. Segundo o autor, nos nectários estruturados o parênquima é o local onde o néctar é produzido e armazenado, constituído por células epidérmicas de paredes delgadas. Os nectários septais nas espécies estudadas são do tipo estruturado, vascularizados por um grande número de feixes colaterais, constituídos por células xilemáticas e floemáticas.
Segundo Sajo et al. (2004)Sajo, M.G., Rudall, P.J. & Prychid, C.J. 2004. Floral anatomy of Bromeliaceae, with particular reference to the evolution of epigyny and septal nectaries in commelinid monocots. Plant Systematics and Evolution 247: 215-231. as espécies de Bromelioideae possuem nectários interloculares, muito semelhantes aos encontrados em A. distichantha e C. billbergioides. As autoras descrevem que a região secretora do tecido nectarífero encontra-se na porção basal do ovário, fato também observado nas duas espécies estudadas, uma vez que há vacúolos fortemente corados apenas nas células presentes na porção inferior-mediana do ovário. Apesar de serem comuns nas monocotiledôneas, as únicas famílias que apresentam nectários septais em Poales são Bromeliaceae e Rapateaceae, suportando a posição basal destas famílias e considerada uma condição plesiomórfica na ordem (Sajo et al. 2004Sajo, M.G., Rudall, P.J. & Prychid, C.J. 2004. Floral anatomy of Bromeliaceae, with particular reference to the evolution of epigyny and septal nectaries in commelinid monocots. Plant Systematics and Evolution 247: 215-231., Linder & Rudall 2005Linder, H.P. & Rudall, P.J. 2005. Evolutionary history of Poales. Annu. Rev. Ecol. Evo. Syst. 36:107-124., Oriani & Scatena 2013Oriani, A. & Scatena, V.L. 2013. The taxonomic value of floral characters in Rapateaceae (Poales-Monocotyledons). Plant Systematics and Evolution 299: 291-303.), sendo perdida nas demais linhagens de Poales (Linder & Rudall 2005Linder, H.P. & Rudall, P.J. 2005. Evolutionary history of Poales. Annu. Rev. Ecol. Evo. Syst. 36:107-124.). Esta hipótese é corroborada por Givinish et al. (2010)Givnish, T.J., Ames, M., McNeal, J.R., McKain, M.R., Steele, P.R., de Pamphilis, C.W., Graham, S.W., Pires, J.C., Stevenson, D.W., Zomlefer, W.B., Briggs, B.G., Duvall, M.R., Moore, M.J., Heaney, J.M., Soltis, D.E., Soltis, P.S., Thiele, K., Leebens-Mack, J.H. 2010. Assembling the tree of the monocotyledons: plastome sequence phylogeny and evolution of Poales. Annals of Missouri Botanical Garden. 97: 584-616. os quais propõem que a polinização por animais, atraídos pelo néctar produzido nas flores, é condição plesiomórfica em Poales.
A morfologia dos apêndices petalóides e a estrutura dos nectários septais em Bromeliaceae foram descritos por Brown & Terry (1992)Brown, G.K. & Terry, R.G. 1992. Petal appendages in Bromeliaceae. American Journal of Botany 79: 1051-1071. e Sajo et al. (2004)Sajo, M.G., Rudall, P.J. & Prychid, C.J. 2004. Floral anatomy of Bromeliaceae, with particular reference to the evolution of epigyny and septal nectaries in commelinid monocots. Plant Systematics and Evolution 247: 215-231., respectivamente. A partir dos resultados obtidos pelos autores, podemos observar uma tendência de representantes de Bromelioideae apresentarem maior variedade morfológica dos apêndices, e em Tillandsoideae, quando presentes, apresentam morfologia mais simples, geralmente inteiros. Em relação aos nectários, Bromelioideae apresentam nectários interloculares com estrutura mais simples e abertura no assoalho do hipanto e em Tillandsioideae os nectários septais são infraloculares, com estrutura mais complexa, ou seja, presença de labirintos e abertura em fendas na porção basal do ovário. Em relação aos representantes de Pitcairnoideae podemos encontrar espécies que apresentam nectários interloculares e um único apêndice simples por pétala, e outras em que os nectários são infraloculares e não há ocorrência de apêndices petaloides. No caso de A. distichantha, como representante de Bromelioideae, os nectários são interloculares e os apêndices, embora apresente uma base inteira, seu ápice é recortado como observado em outros representantes da subfamília.
Segundo Brown & Terry (1992)Brown, G.K. & Terry, R.G. 1992. Petal appendages in Bromeliaceae. American Journal of Botany 79: 1051-1071. e Benzing (2000)Benzing, D.H. 2000. Bromeliaceae: profile of an adaptive radiation. Cambridge University Press, Cambridge., o néctar é secretado e armazenado na parte inferior do hipanto, em região oposta aos estames antipetalos. Os autores mencionam ainda que os apêndices estão relacionados à provável função de elevação do néctar em corolas essencialmente tubulares, estabilizando assim a concentração do açúcar e a viscosidade do néctar. Em A. distichantha, a morfologia dos apêndices petaloides pode ajudar na função da elevação do néctar em até um quarto da altura da corola (altura máxima dos apêndices em relação às pétalas), a qual embora não seja gamopétala, apresenta uma estrutura tubular.
Em relação ao tecido obturador, este tem sido alvo de estudos, principalmente pela função desempenhada. Este tecido é de suma importância na reprodução, sendo responsável pelo direcionamento químico e/ou mecânico do tubo polínico em direção ao óvulo, bem como pela sua nutrição (Vardar et al. 2012Vardar, F., Ismailoglu, I. & Ünal, M. 2012. Embryological and cytological features of Gagea bohemica (Liliaceae). Turkish Journal of Botany 36: 462-472., Tilton & Horner Jr. 1980Tilton, V.R. & Horner Jr., H.T. 1980. Stigma, style, and obturator of Ornithogalum caudatum (Liliaceae) and their function in the reproductive process. American Journal of Botany 67: 1113-1131., Herrero 2000Herrero, M. 2000. Changes in the Ovary Related to Pollen Tube Guidance. Annals of Botany 85: 79-85.). O direcionamento do tubo polínico pode ocorrer de duas diferentes maneiras: por meio de interações químicas (e neste caso o obturador é secretor) ou de forma mecânica (onde o obturador apresenta-se como tricoma) (Herrero 2000Herrero, M. 2000. Changes in the Ovary Related to Pollen Tube Guidance. Annals of Botany 85: 79-85.). O obturador pode, ainda, variar morfologicamente, apresentando-se de forma empaliçada e glandular, como em A. distichantha e C. billbergioides, ou semelhante à tricomas (Tilton & Horner Jr. 1980Tilton, V.R. & Horner Jr., H.T. 1980. Stigma, style, and obturator of Ornithogalum caudatum (Liliaceae) and their function in the reproductive process. American Journal of Botany 67: 1113-1131., Herrero 2000Herrero, M. 2000. Changes in the Ovary Related to Pollen Tube Guidance. Annals of Botany 85: 79-85.), como em Juncaceae (Oriani et al. 2012Oriani, A., Scatena, V.L. 2012. Flora l anatomy of xyrids (Poales): contributions to their reproductive biology, taxonomy and phylogeny. International Journal of Plant Sciences, v. 173, p. 767-779.) e em Rapateaceae (Oriani & Scatena 2013Oriani, A. & Scatena, V.L. 2013. The taxonomic value of floral characters in Rapateaceae (Poales-Monocotyledons). Plant Systematics and Evolution 299: 291-303.).
Quanto à origem do tecido obturador, alguns trabalhos relatam que o mesmo pode ter origem na placenta, no funículo, nos tegumentos ou no arilo e, em alguns casos, pode ter origem mista (Tilton & Horner Jr. 1980Tilton, V.R. & Horner Jr., H.T. 1980. Stigma, style, and obturator of Ornithogalum caudatum (Liliaceae) and their function in the reproductive process. American Journal of Botany 67: 1113-1131., Davis 1966Davis, G.L. 1966. Systematic Embriology of the Angiosperms. New York: John Wiley and Sons., Rao 1959Rao, C.V. 1959. Contributions to the embryology of Palmae. I. Sabalae. Proceedings of the National Institutes of Sciences of India. 25: 143-169.). Em Bromeliaceae, a ocorrência de tecido obturador é citada por Sajo et al. (2004)Sajo, M.G., Rudall, P.J. & Prychid, C.J. 2004. Floral anatomy of Bromeliaceae, with particular reference to the evolution of epigyny and septal nectaries in commelinid monocots. Plant Systematics and Evolution 247: 215-231. e Fagundes & Mariath (2010)Fagundes, N.F., Mariath, J.E.A. 2010. Morphoanatomy and ontogeny of fruit in Bromeliaceae species. Acta Botanica Brasilica. 24: 765-779. como tendo origem placentária, semelhante ao observado em A. distichantha e C. billbergioides.
Anatomicamente, o tecido obturador em Bromeliaceae é descrito por Fagundes & Mariath (2010)Fagundes, N.F., Mariath, J.E.A. 2010. Morphoanatomy and ontogeny of fruit in Bromeliaceae species. Acta Botanica Brasilica. 24: 765-779. como apresentando uma única série de células secretoras em Bromelioideae e Pitcairnoideae, ou por uma ou duas camadas de células em Tillandsioideae, as quais são mais alongadas quando comparadas às das outras duas subfamílias. Corroborando os dados de Fagundes & Mariath (2010)Fagundes, N.F., Mariath, J.E.A. 2010. Morphoanatomy and ontogeny of fruit in Bromeliaceae species. Acta Botanica Brasilica. 24: 765-779. para Bromelioideae, no presente estudo, descrevemos uma única camada de células secretoras no tecido obturador das duas espécies analisadas.
A natureza química do exudado do tecido obturador tem sido analisada em alguns trabalhos, os quais relatam a pectina como o principal componente (Hudák et al. 1993Hudák J, Walles B, Vennigerholz F. 1993. The transmitting tissue in Brugmansia suaveolens L.: ultrastructure of the stylar transmitting tissue. Annals of Botany 71:177-186.; Herrero 2000Herrero, M. 2000. Changes in the Ovary Related to Pollen Tube Guidance. Annals of Botany 85: 79-85.), além de outros polissacarídeos, proteínas e lipídeos (Singh & Walles 1992Singh, S.,Walles, B. 1992. The ovarian transmitting tissue. International Journal of Plant Sciences . 153: 205-211.). O papel das proteínas no exsudato é principalmente o reconhecimento do tubo polínico e participar de reações de incompatibilidade (Lord & Russel 2002Lord, E.M, Russell, S.D. 2002. The mechanisms of .pollination and fertilization in plants. Annual Review of Cell and Developmental Biology 18: 81-105.), funções que têm lugar, na maior parte das vezes, no estigma e no estilete. No entanto, elas também podem estar envolvidas na nutrição do tubo polínico (Lind et al. 1996Lind,J.L., Bönig, I, Clarke, A.E., Anderson, M.A. 1996. A style-specific 120 kDa glycoprotein enters pollen tubes of Nicotiana alata in vivo. Sexual Plant Reproduction 9: 75-86.) e quimiotropicamente em seu direcionamento (Kim et al. 2003Kim, S., Mollet, J.C., Dong, J., Zhang, K., Park, S.Y., Lord, S.M. 2003. Chemocyanin, a small basic protein from the lily stigma, induces pollen tube chemotropism Proc. Natl Acad. Sci. U S A, 100: 16125-16130.), o que sugere que também tenham grande importância na porção ovariana. A partir das análises histoquímicas realizadas neste estudo, constatamos que o exudado apresenta composição mista, com resultados positivos para carboidratos e proteínas.
Em resumo, os dados apresentados revelam características ainda não registradas em Bromeliaceae, como a presença células papilosas nas pétalas e a natureza química da secreção do tecido obturador. Adicionalmente, sugerimos que seja testada a hipótese de possível relação evolutiva entre a presença dos apêndices petaloides e a estrutura dos nectários septais em Bromeliaceae.
-
1
Parte da Tese de Doutorado da primeira Autora
Agradecimentos
Agradecemos ao CNPq pela concessão da bolsa de doutorado da primeira autora (proc. 140115/2013-7) e de produtividade da ultima autora (Proc. 308070/2012-7). À Dra. Delmira Costa Silva da Universidade Estadual de Santa Cruz pelo auxilio nas análises em Microscopia Eletrônica de Varredura.
Literatura citada
- Angiosperm Phylogeny Group (APG III) 2009. An update of the Angiosperm Phylogeny Group classification for the order and families of flowering plants: APG III. Botanical Journal of the Linnean Society 161: 105-121.
- Arber, A. 1937. Studies in flower structure: III. On the 'corona' and androecium in certain Amaryllidaceae. Annals of Botany 1: 293-304.
- Benzing, D.H. 2000. Bromeliaceae: profile of an adaptive radiation. Cambridge University Press, Cambridge.
- Bernardello, L.M., Galetto, L. & Juliani, H.R. 1991. Floral Nectar, Nectary Structure and Pollinators in Some Argentinean Bromeliaceae. Annals of Botany 67: 401-411.
- Brighigna, L., Fiordi, A.C., Pallandri, M.R. 1984. Structural characteristics of mesophyll in some Tillandsia species. Phytomorphology 34: 191-200.
- Brown, G.K. & Terry, R.G. 1992. Petal appendages in Bromeliaceae. American Journal of Botany 79: 1051-1071.
- Coan, A.I, Alves, M.V., Scatena, V.L. 2008 Comparative study of ovule and fruit development in species of Hyspolytrum and Rhynchospora (Cyperaceae- Poales). Plant Systematic and Evolution. 272: 181-195.
- Davis, G.L. 1966. Systematic Embriology of the Angiosperms. New York: John Wiley and Sons.
- Fagundes, N.F., Mariath, J.E.A. 2010. Morphoanatomy and ontogeny of fruit in Bromeliaceae species. Acta Botanica Brasilica. 24: 765-779.
- Fahn, A. 1952. On the structure of floral nectaries. Botanical Gazette 113: 464-470.
- Fahn, A. 1979. Secretory Tissues in Plants. Academic Press, London.
- Fisher, D.B. 1968. Protein Staining of Ribboned Epon Sections for Light Microscopy. Histochemie 16: 92-96.
- Forzza, R.C., Costa, A., Siqueira Filho, J.A., Martinelli, G., Monteiro, R.F., Santos-Silva, F., Saraiva, D.P., Paixão-Souza, B., Louzada, R.B., Versieux, L. 2015. Bromeliaceae. In: Lista de Espécies da Flora do Brasil. Jardim Botânico do Rio de Janeiro. Disponível em http://floradobrasil.jbrj.gov.br/jabot/floradobrasil/FB6335 (acesso em 04-X-2015).
» http://floradobrasil.jbrj.gov.br/jabot/floradobrasil/FB6335 - Givnish, T.J., Millam, K.C., Berry, P.E. & Sytsma, K.J. 2007. Phylogeny, adaptive radiation, and historical biogeography of Bromeliaceae inferred from ndhF sequence data. Aliso 23: 3-26.
- Givnish, T.J., Ames, M., McNeal, J.R., McKain, M.R., Steele, P.R., de Pamphilis, C.W., Graham, S.W., Pires, J.C., Stevenson, D.W., Zomlefer, W.B., Briggs, B.G., Duvall, M.R., Moore, M.J., Heaney, J.M., Soltis, D.E., Soltis, P.S., Thiele, K., Leebens-Mack, J.H. 2010. Assembling the tree of the monocotyledons: plastome sequence phylogeny and evolution of Poales. Annals of Missouri Botanical Garden. 97: 584-616.
- Goetghebeur, P. 1998. Cyperaceae. In: K. Kubitzki (ed.). The families and the genera of vascular plants-IV Monocotyledons. SpringerVerlag, Berlin, pp 141-190.
- Herrero, M. 2000. Changes in the Ovary Related to Pollen Tube Guidance. Annals of Botany 85: 79-85.
- Hudák J, Walles B, Vennigerholz F. 1993. The transmitting tissue in Brugmansia suaveolens L.: ultrastructure of the stylar transmitting tissue. Annals of Botany 71:177-186.
- Johansen, D.A. 1940. Plant microtechnique. McGraw-Hill, New York.
- Kim, S., Mollet, J.C., Dong, J., Zhang, K., Park, S.Y., Lord, S.M. 2003. Chemocyanin, a small basic protein from the lily stigma, induces pollen tube chemotropism Proc. Natl Acad. Sci. U S A, 100: 16125-16130.
- Koch, K., Bhushan, B., Barthlott, W. 2008. Diversity of Structure, morphology and wetting of plants surfaces. Soft Matter 4: 1943-1963.
- Krauss, B.H. 1949. Anatomy of the vegetative organs of the pineapple, Ananas comosus (L.) Merr. Botanical Gazette 110: 333-404.
- Kraus, J.E. & Arduin, M. 1997. Manual básico de métodos em morfologia vegetal. Edur, Seropédica.
- Kulkarni, R.A. & Pai, R.M. 1982. The floral anatomy of Puya spathacea Mez. (Bromeliaceae) with special reference to nectaries. Proceedings of Indian Academy of Sciences 91: 472-478.
- Leme, E.M.C. 2000. Nidularium - Bromélias da Mata Atlântica. 1 ed. Sextante, Rio de Janeiro.
- Lillie, R.D. 1965. Histopathologic technic and pratical histochemistry. 3 ed. McGraw Hill, New York.
- Lind,J.L., Bönig, I, Clarke, A.E., Anderson, M.A. 1996. A style-specific 120 kDa glycoprotein enters pollen tubes of Nicotiana alata in vivo Sexual Plant Reproduction 9: 75-86.
- Linder, H.P. & Rudall, P.J. 2005. Evolutionary history of Poales. Annu. Rev. Ecol. Evo. Syst. 36:107-124.
- Lord, E.M, Russell, S.D. 2002. The mechanisms of .pollination and fertilization in plants. Annual Review of Cell and Developmental Biology 18: 81-105.
- Luther, H. 2012. An alphabetical list of bromeliad binomials. 12th ed. The Bromeliad Society International. The Marie Selby Botanical Gardens, Sarasota & Bromeliad Society International.
- Mauseth, J.D. 1988. PlantAnatomy. Benjamin/Cummings, Menlo Park.
- McManus, J.F.A. 1948. Histological and Histochemical Uses of Periodic Acid. Stain Technology 23: 99-108.
- Menezes, N.L. 1973. Natureza dos apêndices petalóides em Barbacenioideae (Velloziaceae). Boletim de Zoologia e Biologia Marinha 30: 713-755.
- Oriani, A., Stützel, T. & Scatena, V.L. 2012. Contributions to the floral anatomy of Juncaceae (Poales-Monocotyledons). Flora 207: 334-340.
- Oriani, A., Scatena, V.L. 2012. Flora l anatomy of xyrids (Poales): contributions to their reproductive biology, taxonomy and phylogeny. International Journal of Plant Sciences, v. 173, p. 767-779.
- Oriani, A. & Scatena, V.L. 2013. The taxonomic value of floral characters in Rapateaceae (Poales-Monocotyledons). Plant Systematics and Evolution 299: 291-303.
- Pearse, A.G.E. 1985. Histochemistry: theoretical and applied. Little, Brown & Company, Boston.
- Prychid, C.J., Rudall, P.J. & Gregory, M. 2004. Systematics and Biology of Silica Bodies in Monocotyledons. The Botanical Review 69: 377-440.
- Rao, C.V. 1959. Contributions to the embryology of Palmae. I. Sabalae. Proceedings of the National Institutes of Sciences of India. 25: 143-169.
- Ruzin, S.E. 1999. Plant Microtechnique and Microscopy. Oxford University Press, New York.
- Sajo, M.G., Rudall, P.J. & Prychid, C.J. 2004. Floral anatomy of Bromeliaceae, with particular reference to the evolution of epigyny and septal nectaries in commelinid monocots. Plant Systematics and Evolution 247: 215-231.
- Sajo, M.G., Furness, C.A., Prychid, C.J. & Rudall, P.J. 2005. Microsporogenesis and anther development in Bromeliaceae. Grana 44: 65-74.
- Schulte, K. & Zizka, G. 2008. Multi locus plastid phylogeny of Bromelioideae (Bromeliaceae) and the taxonomic utility of petal appendages and pollen characters. Candollea 63: 209-225.
- Singh, S.,Walles, B. 1992. The ovarian transmitting tissue. International Journal of Plant Sciences . 153: 205-211.
- Silveira, M. 1989. O preparo de amostras biológicas para microscopia eletrônica de varredura. In: W. Souza (ed.). Manual sobre Técnicas Básicas em Microscopia Eletrônica de Varredura. Sociedade Brasileira de Microscopia Eletrônica, v. 1, pp. 71-82.
- Smith L.B. & Downs R.J. 1974. Pitcairnioideae (Bromeliaceae). Flora Neotropica Monograph 14: 1-662.
- Smith L.B. & Downs R.J. 1977. Tillandsioideae (Bromeliaceae). Flora Neotropica Monograph 14: 663-1492.
- Smith L.B. & Downs R.J. 1979. Bromelioideae (Bromeliaceae). Flora Neotropica Monograph 14: 1493-2142.
- Tilton, V.R. & Horner Jr., H.T. 1980. Stigma, style, and obturator of Ornithogalum caudatum (Liliaceae) and their function in the reproductive process. American Journal of Botany 67: 1113-1131.
- Tomlinson, P.B. 1969. Comelinales -Zingiberales. In: C.R. Metcalfe (ed.). Anatomy of the monocotyledons: III. Claredon Press, Oxford, pp.193-294.
- Vardar, F., Ismailoglu, I. & Ünal, M. 2012. Embryological and cytological features of Gagea bohemica (Liliaceae). Turkish Journal of Botany 36: 462-472.
- Whitney, H.M., Bennet, V., Dorling, M., Sandbach, L., Prince, D., Chittka, L., Glover, B. 2011. Why do so many petals have conical epidermal cells? Annals of Botany 108: 609-616.
Datas de Publicação
-
Publicação nesta coleção
Apr-Jun 2016
Histórico
-
Recebido
13 Out 2015 -
Aceito
26 Fev 2016