Resumo
The vocalizations of H. raniceps (Cope, 1826) and their functions are described, including an analysis of the influence of temperature, weight, or SVL (snout-vent length) of males on the acoustic parameters. The vocalizations were recorded in three areas in Fazenda Lagoa Grande, Municipality of Pontalina, State of Goiás, central Brazil. Males began their vocalizations just before sunset, extending them, in some cases, to dawn of the following day. The peak of activities happened between 21h and 23h. The height of calling sites varied plenty, being the position horizontal in about 50% of them. Males defended sites in different areas during consecutive nights. Rain and strong winds interrupted the calling activities. Males emitted three vocalizations: advertisement, territorial and distress calls. The advertisement call has pulsionated structures and it is the most common, being emitted in the presence/absence of females. Significant correlation was found between number of notes and air temperature, notes duration and both male weight and air temperature, calling rate and both male SVL or weight, and frequency and male weight.
Anura; Hylidae; Hyla; vocalization; acoustic parameters
Anura; Hylidae; Hyla; vocalization; acoustic parameters
Vocalizações e interações acústicas em Hyla raniceps (Anura, Hylidae) durante a atividade reprodutiva
Vocalizations and acoustic interactions in Hyla Raniceps (Anura, Hylidae) during the breeding season.
Lorena dall'Ara GuimarãesI; Rogério P. BastosII
IUniversidade Estadual de Goiás, Unidade Universitária Morrinhos, rua 14, nº 625, Jardim América, 75650-000, Morrinhos, Goiás, Brasil. (dallara@icb1.ufg.br)
IIDepartamento de Biologia Geral, Instituto de Ciências Biológicas, Universidade Federal de Goiás, Caixa Postal 131, 74001-970 Goiânia, Goiás, Brasil.
ABSTRACT
The vocalizations of H. raniceps (Cope, 1826) and their functions are described, including an analysis of the influence of temperature, weight, or SVL (snout-vent length) of males on the acoustic parameters. The vocalizations were recorded in three areas in Fazenda Lagoa Grande, Municipality of Pontalina, State of Goiás, central Brazil. Males began their vocalizations just before sunset, extending them, in some cases, to dawn of the following day. The peak of activities happened between 21h and 23h. The height of calling sites varied plenty, being the position horizontal in about 50% of them. Males defended sites in different areas during consecutive nights. Rain and strong winds interrupted the calling activities. Males emitted three vocalizations: advertisement, territorial and distress calls. The advertisement call has pulsionated structures and it is the most common, being emitted in the presence/absence of females. Significant correlation was found between number of notes and air temperature, notes duration and both male weight and air temperature, calling rate and both male SVL or weight, and frequency and male weight.
Keywords: Anura, Hylidae, Hyla, vocalization, acoustic parameters.
INTRODUÇÃO
As vocalizações dos anuros são importantes como mecanismo de isolamento reprodutivo e para a comunicação social (LITTLEJOHN, 1977; WELLS, 1977a), tendo aparecido provavelmente no início da história evolutiva do grupo, pois estão presentes em quase todas as espécies. As vocalizações mais comuns são os cantos de anúncio, que servem primariamente para atrair as fêmeas e secundariamente para mediar interações agressivas entre os machos (RAND, 1985; WELLS, 1988; GERHARDT, 1994; GIVEN, 1999; LEA et al., 2001).
As variações nas características da vocalização de anúncio (freqüência dominante, número de pulsos, duração, taxa de repetição) de várias espécies de Anura estão relacionadas com padrões de preferência das fêmeas (KLUMP & GERHARDT, 1987; GERHARDT, 1991; RYAN & KEDDY-HECTOR, 1992). Vários estudos têm demonstrado que fatores ambientais e sociais influenciam sobre as variáveis do canto (WELLS, 1988; WAGNER, 1992; WILCZYNSKI & RYAN, 1999). Variações na estrutura da vocalização estão relacionadas com características fenotípicas dos indivíduos (LOFTUS-HILLS & LITTLEJOHN, 1971; RAND, 1985; WAGNER, 1989; BASTOS & HADDAD, 1999).
Hyla raniceps (Cope, 1826) pertence ao grupo de H. albopunctata, sendo a espécie do grupo com maior distribuição geográfica, ocorrendo desde o norte da região Neotropical, na Hiléia e nas savanas da Guiana, passando pelo Cerrado, Caatinga, Floresta Atlântica e Pinheirais de Araucária, e chegando ao chaco argentino e chaco paraguaio (FROST, 1985).
Objetiva-se descrever as vocalizações de H. raniceps e o contexto social em que foram emitidas, verificando se há correlação entre os parâmetros acústicos (freqüência dominante, número de pulsos, duração, taxa de repetição, intensidade) e o CRC (comprimento rostro-cloacal) ou peso dos machos, bem como descrever o comportamento dos machos durante as vocalizações.
MATERIAL E MÉTODOS
A área de estudo encontra-se no domínio do bioma Cerrado, que se localiza predominantemente no Planalto Central do Brasil e se constitui na segunda maior formação vegetal brasileira (ALHO & MARTINS, 1995). Este bioma estende-se de 5 a 20º S e de 45 a 60º W, representando 22% do território nacional. As observações acerca da biologia reprodutiva de H. raniceps foram realizadas na Fazenda Lagoa Grande, Município de Pontalina (17º31'23"S, 49º26'49"W; altitude 640 m), sul do Estado de Goiás, Brasil.
O estudo foi realizado entre maio de 1999 e fevereiro de 2002, com intervalos mensais na estação seca (de abril a setembro) e quinzenais na estação chuvosa (de outubro a março), totalizando 40 turnos de observação. Coletas foram realizadas em três áreas, denominadas: área 1, Lagoa JB; área 2, poça da Lagoa Grande; área 3, Retiro. As duas primeiras constituem lagoas permanentes e a última, uma área alagada somente durante as chuvas. Indivíduos coletados estão depositados na Coleção Zoológica da Universidade Federal de Goiás (ZUFG).
Cada turno de observação foi iniciado aproximadamente entre 18h e 19h, pouco antes do pôr-do-sol. Observações das atividades de vocalização e interações acústicas foram realizadas com lanterna manual à pilha, de luz branca, utilizando-se os métodos de animal focal, de todas as ocorrências e de seqüências (LEHNER, 1979; MARTIN & BATESON, 1986). Foram anotadas, para todos os turnos, as seguintes variáveis ambientais: temperatura do ar, umidade relativa, condições meteorológicas (chuva, claridade e fase da lua, presença de trovões e de vento).
Vocalizações dos machos adultos foram registrados em gravador DAT, utilizando-se microfone direcional. Posteriormente, as vocalizações foram digitalizadas, editadas em computador e a análise acústica realizada com os programas Avisoft Sonagraph e Cool Edit Pro. Sonogramas foram confeccionados com estes parâmetros: canto de anúncio (11 kHz, 16 bits, overlap 87,5%, 256 pontos); canto territorial (8 kHz, 16 bits, overlap 87,5%, 256 pontos). Quatro características foram analisadas: duração do canto, número de notas, taxa de repetição e freqüência dominante. Termos relativos ao estudo de bioacústica estão de acordo com DUELLMAN & TRUEB (1986) e GERHARDT (1998). A intensidade sonora das vocalizações foi medida à cerca de 30 cm de distância do indivíduo vocalizante com decibelímetro. A taxa de repetição de canto emitida por machos durante um minuto também foi anotada.
Indivíduos gravados ou quando registradas a taxa de repetição ou intensidade de canto, foram coletados, pesados em balança (precisão de 0,1 g), tiveram seu CRC (comprimento rostro-cloacal) medido com paquímetro de plástico (precisão de 0,1 mm) e foram marcados pela técnica de amputação de artelhos (MARTOF, 1953), sendo soltos na noite seguinte. Para a análise estatística dos dados foi utilizado o índice de correlação de Pearson. O nível de significância considerado foi de p<0,05 (ZAR, 1996).
RESULTADOS
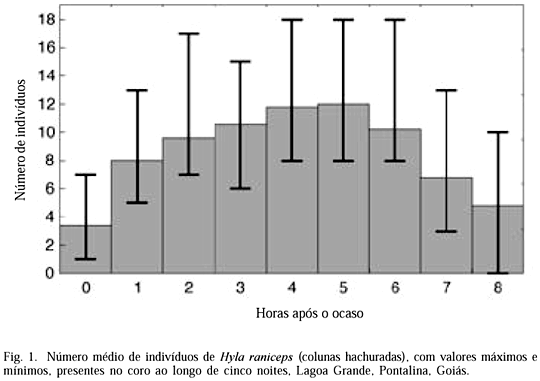
Machos de H. raniceps foram observados vocalizando antes do pôr-do-sol (n=4 turnos) em substratos mais altos e mais distantes das poças, sendo que ao escurecer deslocavam-se em direção aos corpos d'água. Os machos chegavam ao agregado reprodutivo e começavam a vocalizar, em média, cerca de 20 min após o pôr-do-sol (n=7 noites). Houve correlação significativa entre o início das vocalizações e o pôr-do-sol (r=0,74; n=7 noites; p<0,05). Aproximadamente uma hora após o pôr-do-sol os indivíduos movimentam-se freqüentemente, deslocando-se pela água, vegetação ou solo, mudando várias vezes de lugar em busca de um território fixo. As fêmeas foram vistas empoleiradas ou deslocando sobre a água. No começo da estação reprodutiva (após primeiras chuvas de novembro), indivíduos continuavam vocalizando até 13 horas após o ocaso (n=2). O número máximo de indivíduos ocorreu entre 4 e 5 h após o ocaso (n=5 noites; fig. 1).
Os sítios de vocalização variaram de acordo com o ambiente e tipo de vegetação presente. Os machos vocalizam principalmente sobre ramos de vegetação arbustiva ou emergente, mas foram vistos também sobre chão, gravetos e em árvores. A altura média do substrato foi de 39 cm ± 0,29 (n=108). Para 34 machos observados, a posição foi horizontal em 50% dos casos, inclinada em 38,2% e vertical em 11,8%, sendo que em todas as posições vocalizam com os membros posteriores dobrados e anteriores levemente flexionados.
Machos não procuraram ativamente pela fêmea, sendo, portanto territoriais, defendendo seus sítios de vocalização contra invasores através de perseguições, interações acústicas e agressivas (combate físico). Interações agressivas envolvendo fêmeas não foram observadas. O número de interações territoriais com cantos e brigas foi maior na área 3 (n=6), que apresentava sempre maior densidade quando comparada às demais. Machos defenderam sítios de vocalização em áreas distintas nas diferentes noites (territórios flutuantes, sensu WILSON, 1975). Quando os machos estão vocalizando, permanecem com a cabeça erguida e o saco vocal inflado, embora possam mantê-lo inflado sem emitir vocalização. Esta última situação (n=2) sempre ocorreu após interações físicas entre machos.
Quando um macho invadia o território de um outro macho vocalizante, tanto em observações naturais quanto em manipulações experimentais, foram observados dois tipos de comportamentos. No primeiro, o macho residente continuava emitindo o canto de anúncio até perceber a presença do outro macho, depois começava a emitir o canto territorial ou algumas notas isoladas, e na maioria das vezes, após alguns minutos ambos deixavam o território deslocando-se em sentidos opostos, não havendo um vencedor aparente. No segundo caso, após o macho vocalizante perceber a presença do invasor, emitia o canto territorial, em seguida iniciava-se uma perseguição ao invasor. Quando o macho invasor ainda continuava próximo, iniciava-se a interação agonística, onde o macho vocalizante saltava sobre seu dorso, tentando derrubá-lo do galho, golpeando-o com os membros posteriores.
Em condições de chuva forte, acompanhada de ventos e trovões, os indivíduos param de vocalizar, podendo retornar após seu término. Aparentemente, a claridade e a fase da lua não alteraram a atividade de vocalização dos indivíduos de H. raniceps. Ventos fortes prejudicaram a atividade, diminuindo a intensidade de canto ou mesmo interrompendo a vocalização.
A presença de machos satélites foi observada em quatro ocasiões. Neste contexto, foi considerado macho satélite aquele indivíduo que permaneceu por mais de dez minutos sem vocalizar, com o saco vocal desinflado e geralmente em posição mais baixa que o macho vocalizante. A distância entre machos vocalizantes e machos satélites variou de 0,10 a 0,40 m. Em duas ocasiões, após a retirada do macho vocalizante, o satélite começou a emitir o canto de anúncio. Em outra situação, após retirar o macho vocalizante, o satélite deslocou-se em direção a outros machos e passou a emitir o canto de anúncio. Caso o macho satélite se movesse ou começasse a vocalizar, poderia ser perseguido ou mesmo agredido pelo cantor. O tempo que um macho permaneceu como satélite variou de 10 minutos até mais de quatro horas. Nenhum macho satélite foi observado interceptando uma fêmea. Os machos vocalizantes foram em média mais pesados do que os satélites (tab. I).
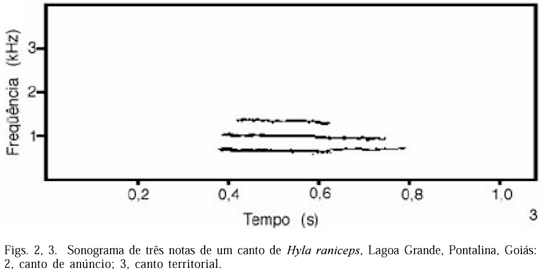
Três tipos de vocalização foram registrados: canto de anúncio, canto territorial e de estresse. O canto de anúncio era emitido tanto na presença quanto na ausência de fêmeas. O canto territorial foi emitido somente em interações com outros machos, sempre intercalado com o canto de anúncio. Alguns indivíduos, quando manuseados para serem medidos e pesados, emitiram um som agudo, denominado canto de estresse.
O canto de anúncio (n=220 cantos, fig. 2) de 44 indivíduos apresentou estrutura pulsionada e foi o mais comum, tendo duração média de 165,68 ms, sendo formado por 4 a 10 pulsos (X=6,13). A duração média dos pulsos foi de 23,78 ms. A freqüência dominante média foi de 900,64 Hz. A taxa de repetição média (número de cantos de anúncio por minuto) foi de 45,85 (n=67 indivíduos) e a intensidade média foi de 85,25 dB (n=51). O canto territorial (fig. 2) foi raro e apresentou estrutura bem diferente do canto de anúncio, tendo duração média de 592,2 ms, sendo formado por apenas uma nota. A freqüência dominante média foi de 735,69 Hz. Foram analisados 25 cantos territoriais de 5 indivíduos. O canto de estresse não foi gravado.
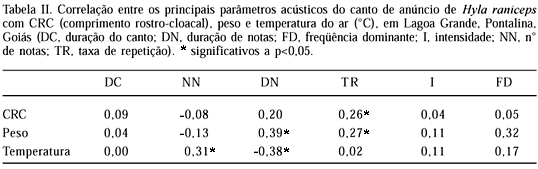
Dos parâmetros acústicos do canto de anúncio foi encontrada correlação significativa entre número de notas e temperatura do ar (r = 0,31; n=39; p<0,05), duração de notas e peso do macho vocalizante (r=0,39; n=29; p<0,05), duração de notas e temperatura do ar (r=-0,38; n=39; p<0,05), taxa de repetição e CRC do macho vocalizante (r=0,26; n=61; p<0,05) e entre a taxa de repetição e peso do macho vocalizante (r=0,27; n=52; p < 0,05) (tab. II).
DISCUSSÃO
Machos de H. raniceps vocalizaram principalmente à noite e na estação chuvosa, indicando que fatores abióticos, tais como umidade, temperatura e intensidade da luz, influenciam a atividade de canto desta espécie. A temperatura e a luminosidade são características que podem influenciar significantemente a atividade de vocalização, além dos fatores endógenos limitantes (CARDOSO & HADDAD, 1992). De acordo com KREBS & DAVIES (1996), a estrutura do hábitat também afeta a transmissão de sinais, modelando os cantos para atingirem a maior distância possível. Durante a atividade de vocalização, machos de H. raniceps freqüentemente mudaram de posição e conseqüentemente a orientação de seu canto, como observado para Dendrobates granuliferus Taylor, 1958 (GOODMAN, 1971), Colostethus stepheni Martins, 1989 e C. marchesianus (Melin, 1941) (JUNCÁ, 1998). Este comportamento pode aumentar a probabilidade de serem ouvidos pelas fêmeas e machos, e com isso aumentar o sucesso de acasalamento, além de advertir seus vizinhos do território ocupado (JUNCÁ, 1998).
Estratégias reprodutivas alternativas são comuns entre anfíbios anuros (WELLS, 1977a; 1977b; FELLERS, 1979; ROBLE, 1985; MORRIS, 1989; WAGNER, 1989; HADDAD & CARDOSO, 1992). De acordo com WELLS (1977b), o comportamento satélite em anuros pode ser empregado tanto para a interceptação de fêmeas atraídas pelo macho cantor, quanto para a espera da vacância do território. Não foi observado nenhum macho satélite de H. raniceps interceptando fêmeas maduras e nem casais já amplectados.
A demonstração de que machos satélites são tolerados suporta a idéia de que o território é mantido, primariamente, por sinais acústicos (MACNALLY, 1979; BENEDIX & NARINS, 1999; ROSSA-FERES et al., 1999). Nas ocasiões em que o macho vocalizante de H. raniceps foi retirado, o satélite passou a emitir o canto de anúncio. Este padrão também foi observado para H. cinerea (Schneider, 1799), H. squirella Bosc, 1800, H. versicolor LeConte, 1825, H. crucifer Wied-Neuwied, 1838, H. regilla (Baird & Girard, 1852) (FELLERS, 1979), H. chrysoscelis Cope, 1880 (Morris, 1989) e H. minuta Peters, 1872 (HADDAD & CARDOSO, 1992). Machos vocalizantes de H. raniceps foram em média maiores e mais pesados do que os satélites, indicando que talvez os últimos possam ser indivíduos mais jovens.
Os sítios de vocalização foram defendidos pelos machos através de interações acústicas e agressivas. Os resultados evidenciaram que combates entre machos por disputa de território existem dentro do sistema de acasalamento de H. raniceps, não sendo observado para as outras espécies do grupo albopunctata. Descrições detalhadas das interações agressivas entre indivíduos de H. raniceps foram registradas por GUIMARÃES et al. (2001).
Várias espécies de hilídeos apresentam dois ou mais tipos de canto, os quais são usados para atrair fêmeas, defender territórios, ou ainda em ocasião de briga ou de estresse (DUELLMAN & TRUEB, 1986). WELLS (1977a) diz que espécies de reprodução prolongada apresentam geralmente vocalizações menos estereotipadas que as de reprodução explosiva. BASTOS & HADDAD (1995) relacionam o rico repertório vocal de H. elegans Wied-Neuwied, 1824 à estação reprodutiva prolongada. Concordando com os autores citados acima, a estação reprodutiva de H. raniceps compreendeu os meses de novembro a fevereiro, sendo portanto a mesma de reprodução prolongada e tendo apresentado um rico repertório vocal com três tipos de canto: de anúncio, territorial e canto de estresse.
O canto de anúncio em H. raniceps apresentou estrutura pulsionada e foi o mais comum, sendo que os parâmetros acústicos analisados foram similares aos descritos na literatura (MÁRQUEZ et al., 1993; GUIMARÃES & LIMA et al., 2001). Diferenças em relação à amplitude dos valores e média, provavelmente são explicadas em função do número de cantos analisados (n=220), ou seja, 5 cantos para cada indivíduo, bem maior neste trabalho que nos citados acima. O canto territorial foi emitido somente durante interações entre machos, e sempre intercalado com canto de anúncio. Uma distinção similar entre cantos de anúncio e cantos territoriais é encontrada em outras espécies de anuros e alguns insetos (WELLS, 1977b).
Em anuros, algumas características das vocalizações são correlacionadas significativamente com alguns aspectos abióticos ou com o peso e CRC do macho, como por exemplo: taxa de repetição do canto e temperatura do ar (BASTOS & HADDAD, 1995), intensidade do canto e CRC (ARAK, 1983; GIVEN, 1988); freqüência e CRC (GIACOMA et al., 1997; HOWARD & YOUNG, 1998). Neste trabalho, foi encontrada uma correlação significativa entre número de notas e temperatura do ar, duração de notas e peso do macho, duração de notas e temperatura do ar, taxa de repetição e CRC do macho vocalizante e entre a taxa de repetição e peso do macho vocalizante. De acordo com alguns autores (Duellman & TRUEB, 1986; CRESPO et al., 1989; SULLIVAN & MALMOS, 1994; GARCIA et al., 2001), há forte influência da temperatura do ar na variação dos parâmetros acústicos em várias espécies de anuros, pois com o aumento da temperatura, aumenta a taxa de canto, com conseqüente aumento da taxa metabólica e gasto de energia (WELLS et al., 1996). Outros autores (GIACOMA et al., 1997; OVASKA & CALDBECK, 1997) não encontraram correlação entre alguns parâmetros acústicos e temperatura.
Para H. raniceps, como encontrado para outras espécies de anuros (GIVEN, 1987), a taxa de repetição, duração de notas e a freqüência dominante estão correlacionadas com o CRC ou peso dos machos, é possível que estes parâmetros desempenhem papel importante nas interações agressivas e na seleção sexual.
Agradecimentos. À C. F. B. Haddad (Universidade Estadual Paulista) e B. B. Santos (Universidade Federal de Goiás) pela leitura e sugestões ao manuscrito; a L. A. dos Santos, R. F. Juliano, H. S. Costa, M. B. Alcantara, M. A. F. Bueno, P. R. F. Filho, S. L. Dutra, E. L. Mesquita e M. V. D. G. Parreira pela ajuda nos trabalhos de campo; ao Sr. Betinho Parreira e Sra. Ismênia pela assistência na Fazenda Lagoa Grande. À CAPES pela bolsa concedida à autora sênior. Ao CNPq pela Bolsa de Produtividade em Pesquisa para o autor júnior e auxílios financeiros (Procs. 400381-97.4 e 520804-99.6). À Fundação de Apoio à Pesquisa (FUNAPE), da Universidade Federal de Goiás, pelos auxílios financeiros (Procs. 69.042 e 69.127).
Recebido em 11.06.2002
aceito em 18.12.2002
- ALHO, C. J. R. & MARTINS, E. S. 1995. De grão em grão, o cerrado perde espaço. In: Cerrado; Impactos do processo de ocupação Brasília, WWF. 66p.
- ARAK, A. 1983. Vocal interactions, call matching, and territoriality in a Sri Lankan treefrog, Philautus leucorhinus (Rhacophoridae). Anim. Behav., London, 31:292-302.
- BASTOS, R. P. & HADDAD, C. F. B. 1995. Vocalizations and acoustic interactions in Hyla elegans (Anura, Hylidae) during the reproductive activity. Naturalia, São Paulo, 20:165-176.
- __. 1999. Atividade reprodutiva de Scinax rizibilis (Anura, Hylidae) na Floresta Atlântica, sudeste do Brasil. Revta bras. Zool., Curitiba, 16(2):409-421.
- BENEDIX, J. H., Jr. & NARINS, P. M. 1999. Competitive calling behavior male treefrogs Eleutherodactylus coqui (Anura: Leptodactylidae). Copeia, Lawrence, 1999:1118-1122.
- CARDOSO, A. J. & HADDAD, C. F. B. 1992. Diversidade e turno de vocalizações de anuros em comunidade neotropical. Acta zool. lilloana, Tucumán, 41:93-105.
- CRESPO, E. G.; OLIVEIRA, M. E. et al. 1989. Mating calls of the Iberian midwife toads Alytes obstetricans boscai and Alytes cisternasii Bioacoustics, Copenhagen, 2:1-9.
- DUELLMAN, W. E. & TRUEB, L. 1986. Biology of amphibians Baltimore, The Johns Hopkins Univ. 670p.
- FELLERS, G. M. 1979. Aggression, territoriality, and mating behaviour in North American treefrogs. Anim. Behav., London, 27:107-119.
- FROST, D. R. 1985. Amphibian species of the world A taxonomic and geographical reference Lawrence, Allen 732p.
- GARCIA, P. C. A.; CARAMASCHI, U. & KWET, A. 2001. O status taxonômico de Hyla cochranae Mertens e recaracterização de Aplastodiscus A. Lutz (Anura, Hylidae). Revta bras. Zool., Curitiba, 18(4):1197-1218.
- GERHARDT, H. C. 1991. Female mate choice in treefrogs: static and dynamic acoustic criteria. Anim. Behav., London, 42:615-635.
- __. 1994. The evolution of vocalizations in frogs and toads. Ann. Rev. Ecol. Syst., Lawrence, 25:293-324.
- __. 1998. Acoustic signals of animals: recording, field measurements, analysis and description. In: HOPP, S. L.; OWREN, M. J. & EVANS, C. S. eds. Animal acoustic communication Berlin, Springer Verlag. p.1-25.
- GIACOMA, C.; ZUGOLARO, C. & BEANI, L. 1997. The advertisement calls of the green toad (Bufo viridis): variability and role in mate choice. Herpetologica, Lawrence, 53(4):454-464.
- GIVEN, M. F. 1987. Vocalizations and acoustic interactions of the carpenter frog, Rana virgatipes Copeia, Lawrence, 1987:467-481.
- __. 1988. Territoriality and aggressive interactions of male carpenter frogs, Rana virgatipes Copeia, Lawrence, 1988:411-421.
- __. 1999. Frequency alteration of the advertisement call in the carpenter frog, Rana virgatipes Herpetologica, Lawrence, 55(3):304-307.
- GOODMAN, D. E. 1971. Territorial behavior in a neotropical frog, Dendrobates granuliferus Copeia, Lawrence, 1971:365-379.
- GUIMARÃES, L. D.; JULIANO, R. F. & BASTOS, R. P. 2001. Hyla raniceps (NCN). Combat. Herpetological review, Lawrence, 32(2):102,103.
- GUIMARÃES, L. D.; LIMA, L. P. et al 2001. Vocalizações de espécies de anuros (Amphibia) no Brasil central. Bolm Mus. nac. Rio de J., Nova Série, Zool., Rio de Janeiro, 474:1-16.
- HADDAD, C. F. B. & CARDOSO, J. 1992. Female choice in Hyla minuta (Amphibia: Anura). Acta zool. lilloana, Tucumán, 41:81-91.
- HOWARD, R. D. & YOUNG, J. R. 1998. Individual variation in male vocal traits and female mating preferences in Bufo americanus Anim. Behav., London, 55:1165-1179.
- JUNCÁ, F. A. 1998. Reproductive biology of Colostethus stepheni and Colostethus marchesianus (Dendrobatidae), with the description of a new anuran mating behavior. Herpetologica, Lawrence, 54(3):377-387.
- KLUMP, G. M. & GERHARDT, H. C. 1987. Use of non-arbitrary acoustic criteria in mate choice by female gray tree frogs. Nature, London, 326:286-288.
- KREBS, J. R. & DAVIES, N. B. 1996. Introdução à ecologia comportamental São Paulo, Atheneu. 420p.
- LEA, J.; DYSON, M. & HALLIDAY, T. 2001. Calling by male midwife toads stimulates females to maintain reproductive condition. Anim. Behav., London, 61:373-377.
- LEHNER, P. N. 1979. Handbook of ethological methods New York, Garland STPm. 403p.
- LITTLEJOHN, M. J. 1977. Long-range acoustic communities in anurans: an integrated and evolutionary approach. In: TAYLOR, D. H.; GUTTMAN, S. I. eds. The reproductive biology of amphibians New York, Phenum. p.263,264.
- LOFTUS-HILLS, J. J. & LITTLEJOHN, M. J. 1971. Mating-call sound intensities of anuran amphibians. J. Acoust. Soc. Am., New York, 49:1327-1329.
- MACNALLY, R. C. 1979. Social organization and interspecific interactions in two sympatric species of Ranidella (Anura). Oecologia, Heidelberg, 42:293-306.
- MÁRQUEZ, R.; RIVA, I., DE LA & BOSCH, J. 1993. Advertisement calls of Bolivian species of Hyla (Amphibia, Anura, Hylidae). Biotropica, London, 25(4):426-443.
- MARTIN, P. & BATESON, P. 1986. Measuring behaviour. An introductory guide Cambridge, Cambridge Univ. 199p.
- MARTOF, B. S. 1953. Territoriality in the green frog, Rana clamitans Ecology, Cambridge, 34:174-195.
- MORRIS, M. R. 1989. Female choice of large males in the treefrog Hyla chrysoscelis: the importance of identifying the scale of choice. Behav. Ecol. Sociobiol., Berkeley, 25:275-281.
- OVASKA, K. E. & CALDBECK, J. 1997. Vocal behaviour of the frog Eleutherodactylus antillensis on the British Virgin Islands. Anim. Behav., London, 54:181-188.
- RAND, A. S. 1985. Tradeoffs in the evolution of frog calls. Anim. Sci., Savoy, 94(6):623-637.
- ROBLE, S. M. 1985. Observations on sattelite males in Hyla chrysoscelis, Hyla picta, and Pseudacris triseriata J. Herpetol., Lawrence, 19(3):432-436.
- ROSSA-FERES, D. C.; MENIN, M. & IZZO, T. J. 1999. Ocorrência sazonal e comportamento territorial em Leptodactylus fuscus (Anura, Leptodactylidae). Iheringia, Sér. Zool., Porto Alegre, (87):93-100.
- RYAN, M. J. & KEDDY-HECTOR, A. 1992. Directional patterns of female mate choice and the role of sensory biases. Am. Nat., Baltimore, 139:4-35.
- SULLIVAN, B. K. & MALMOS, K. B. 1994. Call variation in the Colorado river toad (Bufo alvarius): behavioral and phylogenetic implications. Herpetologica, Lawrence, 50(2):146-156.
- WAGNER, W. E., Jr. 1989. Graded aggressive signals in Blanchard's cricket frog: vocal responses to opponent proximity and size. Anim. Behav., London, 38:1025-1038.
- __. 1992. Deceptive or honest signalling of fighting ability? A test of alternative hypothesis for the function of changes in call dominant frequency by male cricket frogs. Anim. Behav., London, 44:449-462.
- WELLS, K. D. 1977a. The social behaviour of anuran amphibians. Anim. Behav., London, 25:666-693.
- __. 1977b. Territoriality and male mating success in the green frog (Rana clamitans). Ecology, Cambridge, 58:750-762.
- __. 1988. The effects of social interactions on anurans vocal behaviour. In: Fritzsch, B.; Ryan, M. J. et al eds. The evolution of the amphibian auditory system New York, John Wiley. p.433-454.
- WELLS, K. D.; TAIGEN, T. L. & O' BRIEN, J. A. 1996. The effect of temperature on calling energetics of the spring peeper (Pseudacris crucifer). Amphibia-Reptilia, Wien, 17:149-158.
- WILCZYNSKI, W. & RYAN, M. J. 1999. Geographic variation in animal communication systems. In: FOSTER, A. & ENDLER, J. eds. Geographic variation in behavior; perspectives on evolutionary mechanisms Oxford, Oxford University. p.234-241.
- WILSON, E. O. 1975. Sociobiology: the new synthesis Cambridge, Belknap. 366p.
- ZAR, J. H. 1996. Biostatistical analysis 3 ed. New Jersey, Prentice Hall. 662p.
Datas de Publicação
-
Publicação nesta coleção
13 Ago 2003 -
Data do Fascículo
Jun 2003
Histórico
-
Aceito
18 Dez 2002 -
Recebido
11 Jun 2002