Resumos
O conhecimento científico sobre a associação de Thysanoptera com plantas nativas ou cultivadas na região Neotropical é praticamente inexistente. Este trabalho objetivou identificar as espécies de tripes e as plantas por eles visitadas ou utilizadas como hospedeiras em uma unidade de conservação, o Parque Estadual de Itapuã (30°22'S 51°02'W), Viamão, Rio Grande do Sul, Brasil. Entre junho de 1999 e maio de 2001, ramos (n=1.274), flores (n=774) e touceiras de gramíneas (n=596) foram sistematicamente amostradas em 20 pontos em quatro transectos estandardizados. O total de 72 espécies de plantas pertencentes a 26 famílias foram identificadas, 60 das quais foram registradas como hospedeiras. Do total de 9.602 espécimes de tripes, 4.900 (50%) foram registrados em flores, 3.764 (39%) em ramos e 938 (10%) nas touceiras de gramíneas. Para 6.533 dos espécimes (4.480 imaturos e 2.053 adultos), foi possível identificar a planta na qual foram coletados. De uma riqueza total de 61 espécies de tripes, 35 foram registradas em flores, 36 em ramos e 14 em touceiras de gramíneas. As espécies de tripes mais abundantes e as plantas que apresentaram a mais alta diversidade de tripes são comentadas.
Planta hospedeira; tripes; espécies nativas; sul do Brasil
The scientific knowledge about the association of Thysanoptera with native or cultivated plants in the Neotropical region is practically nonentity. This work aimed at identifying the thrips species and the plants visited by them or used as hosts in a Conservation Unit, the "Parque Estadual de Itapuã" (30°22'S 51°02'W), Viamão, Rio Grande do Sul, Southern Brazil. Between June 1999 and May 2001, branches (n=1,274), flowers (n=774) and grass tussocks (n=596) were systematically sampled at 20 points in four standardized transects. A total of 72 plant species belonging to 26 families were identified, 60 of those were registered as host plants. From a total of 9,602 thrips specimens, 4,900 (50%) were registered in flowers, 3,764 (39%) in branches and 938 (10%) in grass tussocks. For 6,533 of the specimens (4,480 immatures and 2,053 adults), it was possible to identify the plant on which they were collected. Of a total richness of 61 species of thrips, 35 were recorded in flowers, 36 in branches and 14 in grass tussocks. The most abundant thrips species and the plant species that showed the higher thrips diversity are commented upon.
Host-plant; thrips; native species; Southern Brazil
Thysanoptera: plantas visitadas e hospedeiras no Parque Estadual de Itapuã, Viamão, RS, Brasil1 1 Contribuição nº 450 do Departamento de Zoologia, Instituto de Biociências, UFRGS.
Thysanoptera: visited and host plants at Parque Estadual de Itapuã, Viamão, RS, Brazil
Silvia M. J. PinentI; Helena P. RomanowskiI; Luiza R. RedaelliI, II; Adriano CavalleriI
IPrograma de Pós-Graduação em Biologia Animal, Instituto de Biociências, Universidade Federal do Rio Grande do Sul, Av. Bento Gonçalves, 9500, Bloco IV, Prédio 43435, 91501-970 Porto Alegre, RS, Brasil. (silviapi@portoweb.com.br)
IIDepartamento de Fitossanidade, Faculdade de Agronomia, Universidade Federal do Rio Grande do Sul, Av. Bento Gonçalves, 7712, 91540-000 Porto Alegre, RS, Brasil
RESUMO
O conhecimento científico sobre a associação de Thysanoptera com plantas nativas ou cultivadas na região Neotropical é praticamente inexistente. Este trabalho objetivou identificar as espécies de tripes e as plantas por eles visitadas ou utilizadas como hospedeiras em uma unidade de conservação, o Parque Estadual de Itapuã (30°22'S 51°02'W), Viamão, Rio Grande do Sul, Brasil. Entre junho de 1999 e maio de 2001, ramos (n=1.274), flores (n=774) e touceiras de gramíneas (n=596) foram sistematicamente amostradas em 20 pontos em quatro transectos estandardizados. O total de 72 espécies de plantas pertencentes a 26 famílias foram identificadas, 60 das quais foram registradas como hospedeiras. Do total de 9.602 espécimes de tripes, 4.900 (50%) foram registrados em flores, 3.764 (39%) em ramos e 938 (10%) nas touceiras de gramíneas. Para 6.533 dos espécimes (4.480 imaturos e 2.053 adultos), foi possível identificar a planta na qual foram coletados. De uma riqueza total de 61 espécies de tripes, 35 foram registradas em flores, 36 em ramos e 14 em touceiras de gramíneas. As espécies de tripes mais abundantes e as plantas que apresentaram a mais alta diversidade de tripes são comentadas.
Palavras-chave: Planta hospedeira, tripes, espécies nativas, sul do Brasil.
ABSTRACT
The scientific knowledge about the association of Thysanoptera with native or cultivated plants in the Neotropical region is practically nonentity. This work aimed at identifying the thrips species and the plants visited by them or used as hosts in a Conservation Unit, the "Parque Estadual de Itapuã" (30°22'S 51°02'W), Viamão, Rio Grande do Sul, Southern Brazil. Between June 1999 and May 2001, branches (n=1,274), flowers (n=774) and grass tussocks (n=596) were systematically sampled at 20 points in four standardized transects. A total of 72 plant species belonging to 26 families were identified, 60 of those were registered as host plants. From a total of 9,602 thrips specimens, 4,900 (50%) were registered in flowers, 3,764 (39%) in branches and 938 (10%) in grass tussocks. For 6,533 of the specimens (4,480 immatures and 2,053 adults), it was possible to identify the plant on which they were collected. Of a total richness of 61 species of thrips, 35 were recorded in flowers, 36 in branches and 14 in grass tussocks. The most abundant thrips species and the plant species that showed the higher thrips diversity are commented upon.
Keywords: Host-plant, thrips, native species, Southern Brazil.
A maioria dos Thysanoptera é fitófaga, sugadora de seiva e geralmente conhecida como habitante das flores (MOUND & KIBBY, 1998). De fato, alguns grupos alimentam-se só de flores, sugando o conteúdo das células ao redor da base das anteras, incluindo grãos de pólen, além de frutos em desenvolvimento. Entretanto, o grupo apresenta também outros hábitos, podendo atuar como polinizadores e predadores. Alguns alimentam-se em plantas aquáticas e, provavelmente, 50% de todas as espécies alimentam-se somente de fungos (MOUND, 2000). Apresentam uma ampla diversidade de padrões de comportamento, incluindo a sociabilidade (CRESPI & MOUND, 1997), a construção domiciliar (MOUND & MORRIS, 2001) e a indução de galhas (MOUND & KRANZ, 1997), além de um único registro de ectoparasitismo no Brasil (IZZO et al. 2002; PINENT et al. 2002a). As espécies de tripes variam quanto ao grau de especificidade de seus hospedeiros; poucas são vistas como estritamente monófagas, sendo que várias são polífagas (MOUND & MARULLO, 1996).
Segundo MONTEIRO (2002), das cerca de 5.500 espécies descritas, 520 são registradas no Brasil até o momento. Este número certamente está subestimado, dado nosso precário conhecimento sobre a tisanopterofauna. Dentre as espécies de tripes relacionadas como pragas, apenas cerca de 1% do total causam prejuízos sérios no país e muitas estão associadas a ervas daninhas (MONTEIRO et al., 1999). Pesquisas que têm enfocado o registro e identificação de espécies de tripes associadas a plantas de crescimento espontâneo, nativas ou cultivadas, são escassas. No Brasil destacam-se os trabalhos de SILVA et al. (1968), que listaram 130 espécies e as respectivas plantas a que estavam associadas, e o de MONTEIRO et al. (1999), que referem 19 espécies encontradas em culturas agrícolas. Assim, persiste uma lacuna em relação ao conhecimento de tripes e suas plantas hospedeiras, especialmente em áreas de preservação ambiental. PINENT et al. (2002b) realizaram um primeiro levantamento da tisanopterofauna em uma unidade de conservação.
Esta pesquisa objetiva identificar as espécies de tripes, suas plantas hospedeiras e plantas visitadas no Parque Estadual de Itapuã, Viamão, RS, Brasil.
MATERIAL E MÉTODOS
A amostragem foi realizada de junho de 1999 a maio de 2001, a intervalos de 30 a 45 dias, no Parque Estadual de Itapuã (30°22'S 51°02'W), Viamão, RS. O Parque Estadual de Itapuã possui área de 5.556,50 ha e dista 57 km do centro de Porto Alegre. Localizado na região ecoclimática da Depressão Central, integra-se à bacia Hidrográfica do Guaíba e à laguna dos Patos. A cobertura vegetal apresenta-se diversificada em função de fatores ambientais determinantes, como a presença da restinga litorânea e morros graníticos. Florestas e campos ocorrem com ampla diversidade de tipos fisionômico-florísticos da vegetação que outrora ocorriam na orla do Guaíba e nos morros graníticos de Porto Alegre e que hoje são raras devido à expansão urbana. Ampla descrição da área pode ser encontrada no Plano de Manejo do Parque (RIO GRANDE DO SUL, 1997).
Quatro trilhas pré-existentes, distintas quanto à fisionomia vegetal e nível de impacto antrópico, foram selecionadas: T1, trilha da praia da Pedreira, estende-se a partir da praia, junto à base do morro da Fortaleza, relativamente pouco impactada (mata ombrófila densa); T2, trilha da praia do Araçá, estende-se da estrada de acesso à praia de Fora em direção à praia do Araçá, íngreme, bastante alterada no passado, hoje em diferentes fases de recuperação (vegetação rupestre, vassourais, mata baixa); T3, trilha da Lagoinha, paralela à praia de Fora, entre dunas e área de banhado, conhecida como "Lagoinha" (campos, vegetação xerofítica e mata de restinga, com presença marcante de figueiras) e T4, trilha do morro da Grota, localizada à meia altura do morro da Grota, formação geológica granítica (vegetação rupestre, vassourais e butiazais).
Nas quatro trilhas, ao longo de 500 m, foram marcados cinco pontos, à direita e à esquerda alternadamente, distantes 100 m um do outro e, em cada um deles, dois sítios - um imediatamente na borda da trilha e outro a 1,5 m perpendicular à trilha. Em cada um dos sítios foram retiradas amostras de três micro-hábitats, flores, ramos e touceiras de gramíneas, selecionados por abrigarem diferentes espécies de Thysanoptera (MOUND & KIBBY, 1998 e Shuji Okajima, comunic. pess.).
Foram coletadas até três flores por sítio, quando presentes. Ramos, com no máximo 20 cm de comprimento, foram obtidos de duas plantas, a priori diferentes, em cada um dos sítios. De cada uma destas plantas, os ramos foram retirados em três estratos eqüidistantes, até uma altura de no máximo 1,80 m, tomada a partir do solo. Touceiras de gramíneas foram coletadas uma por sítio, cortadas rente ao solo com tesoura de poda. Antes do corte, para evitar o escape dos tripes, as partes vegetais eram primeiramente envolvidas com um saco plástico.
Em laboratório, os espécimes foram separados das respectivas unidades amostrais e acondicionados em líquido preservante AGA (10 partes de álcool etílico 60%, uma parte de glicerina e uma parte de ácido acético glacial). Os adultos foram montados em lâminas de microscopia e identificados com base na metodologia proposta por PALMER et al. (1989), MOUND & MARULLO (1996) e MOUND & KIBBY (1998). Os trabalhos de SPEYER & PARR (1941), HEMING (1991) e MORITZ et al. (2001) auxiliaram na identificação dos imaturos. Na impossibilidade de se obter a identificação dos imaturos utilizando-se as chaves acima citadas, muitos deles foram determinados com base em adultos, pelo fato de permanecerem junto a estes.
Segundo a proposta de MOUND & MARULLO (1996), o critério adotado para considerar as plantas como hospedeiras foi o registro concomitante dos diferentes ínstares larvais, pré-pupas e pupas. A visualização ocasional de posturas também foi considerada na determinação do hospedeiro. Nos casos em que apenas adultos foram registrados, as plantas são referidas como visitadas.
Exemplares de plantas foram herborizados, mantidos em exsicata e identificados de acordo com SCHULTZ (1984), BRACK et al. (1998), LORENZI & MOREIRA (1999) e através de consultas ao herbário do Departamento de Botânica da Universidade Federal do Rio Grande do Sul. O sistema de classificação adotado foi o de CRONQUIST (1988).
A origem das espécies de tripes e plantas se nativas e/ou citadas para o Rio Grande do Sul foi determinada com base em MOULTON (1948), HOOD (1952), SILVA et al. (1968), SAKIMURA & O'NEILL (1979), DE SANTIS et al. (1980), MOUND & MARULLO (1996), NAKAHARA (1997), MONTEIRO et al. (1999) e LORENZI & MOREIRA (1999).
Naqueles casos em que não foi possível determinar a espécie a partir das chaves disponíveis, os indivíduos são apresentados por subfamília e/ou gênero e as espécies discriminadas por código numérico para que a diversidade das associações tripes/plantas fosse registrada.
Os exemplares de tripes e as exsicatas estão depositados na coleção do Laboratório de Ecologia de Insetos do Departamento de Zoologia do Instituto de Biociências da Universidade Federal do Rio Grande do Sul.
RESULTADOS E DISCUSSÃO
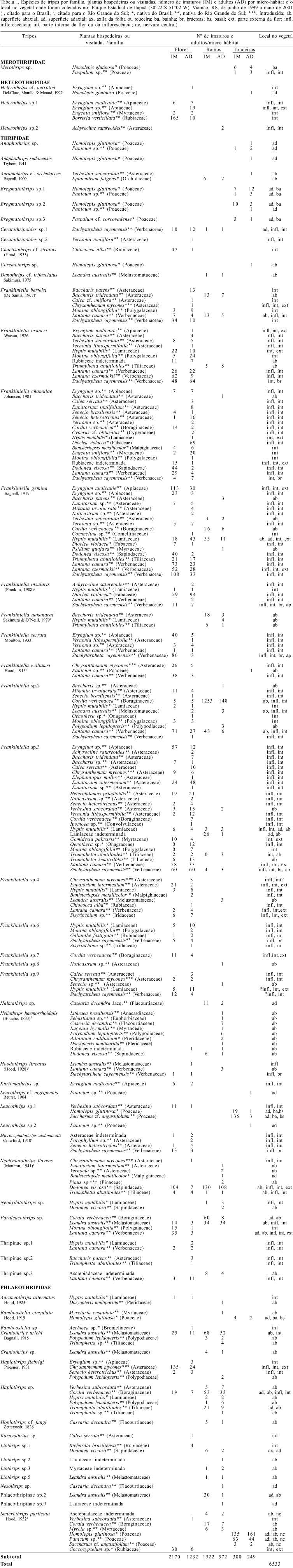
Nas 19 ocasiões de amostragem, 2.644 unidades amostrais foram coletadas (774 flores, 1.274 ramos e 596 touceiras), resultando em 9.602 indivíduos de tripes. Para 6.533 exemplares, 4.480 imaturos e 2.053 adultos, obtidos a partir destas, foi possível identificar a espécie e a da planta onde estavam (tab. I). Foram identificadas 61 espécies de tripes, distribuídas em 26 gêneros, pertencentes a quatro famílias: Merothripidae, Heterothripidae, Thripidae e Phlaeothripidae. PINENT et al. (2003) abordaram 29 espécies de tripes, das quais 27 estão aqui enriquecidas com informações sobre a sua abundância, ínstares e a parte da planta em que foram encontradas.
A maior abundância, constância e riqueza de espécies ocorreu em Thripidae, com 1.590 indivíduos adultos e 3.662 imaturos. Das 40 morfoespécies determinadas nesta família, 17 foram nominadas em nível de espécie e as demais até gênero (20) e subfamília (3). A família Thripidae é diversa, com ampla distribuição mundial e inclui a maioria das espécies-praga. Na maior parte, vivem nas flores ou se alimentam em folhas, mas incluem alguns predadores (MOUND & MARULLO, 1996).
Para Phlaeothripidae, registraram-se 410 indivíduos adultos e 634 imaturos, determinados em 17 morfoespécies, das quais seis foram nominadas. Nesta família há em torno de 3.000 espécies descritas e um grande número por descrever, o que se deve, em parte, à complexidade de padrões entre as espécies (MOUND & MARULLO, 1996).
Em Heterothripidae registraram-se 42 adultos e 173 imaturos de Heterothrips Hood, 1908. Os membros desta família vivem em flores e são encontrados no Novo Mundo (DEL-CLARO et al., 1997).
Da família Merothripidae foram obtidos sete indivíduos adultos e 7 imaturos de Merothrips Hood, 1912. Os representantes desta família medem, no máximo, 1 mm de comprimento, apresentam coloração marrom-pálida ou branco-amarelada e alimentam-se sobre hifas de fungos no folhedo ou em folhas mortas (MOUND & O'NEILL, 1974).
Entre as espécies mais numerosas, Smicrothrips particula Hood, 1952, um fleotripídeo com menos de 1 mm e dotado de grande mobilidade, foi o mais abundante (7,4%, sobre 6.533 indivíduos), com 226 adultos (11,0%, sobre 2.053 adultos) e 258 imaturos (5,8%, sobre 4.480 imaturos), coletados em 18 (95%) das ocasiões de amostragens.
Depois de S. particula, as espécies mais abundantes e freqüentemente coletadas foram do gênero Frankliniella Karny, 1910, totalizando 45,1% dos indivíduos adultos; foi também o gênero encontrado na maior diversidade de plantas. Quatro espécies destacam-se pela abundância: Frankliniella gemina Bagnall, 1919, 559 indivíduos (8,1%) (223 adultos, 10,7%, e 529 imaturos, 11,8%), Frankliniella sp.3, 1.594 indivíduos (16,6%) (206 adultos, 10,0%, e 1.388 imaturos, 31,0%), Frankliniella bruneri Watson, 1926, 342 indivíduos (3,6%) (155 adultos, 7,5%, e 187 imaturos, 4,2%) e Frankliniella chamulae Johansen, 1981, 277 indivíduos (2,9%) (153 adultos, 7,4%, e 124 imaturos, 2,8%). Estas quatro espécies foram obtidas em flores de Asteraceae, Rubiaceae e Lamiaceae. Larvas, pré-pupas e pupas foram encontradas agrupadas junto aos adultos alimentando-se nas partes internas das flores. As posturas, que são endofíticas, puderam ser observadas por transparência nas pétalas e sépalas, quando as plantas, após certo tempo de armazenagem, perderam parte de sua turgidez.
Outra espécie abundante, Neohydatothrips flavens (Moulton, 1941), 366 indivíduos (3,8%) (127 adultos, 6,2%, e 239 imaturos, 5,3%) foi coletada com acentuada freqüência em Dodonaea viscosa Jacq. (Sapindaceae) na superfície abaxial das folhas, quase sempre próxima à nervura central. Adultos e larvas apresentam grande mobilidade, mesmo com a viscosidade característica das folhas da planta. Posturas foram observadas agrupadas, junto e sobre as nervuras das folhas, endofiticamente.
Além das espécies que se destacam pela abundância, outras são apontadas como pragas (tab. I). Frankliniella insularis (Franklin, 1908) é considerada praga de pouca importância em flores de leguminosas, citada por MOUND & MARULLO (1996) para o Brasil; tem sido coletada em abundância nas flores de Malvaviscus sp. (Malvaceae) tanto na Costa Rica como em Piracicaba, São Paulo. Esta espécie foi citada por SILVA et al. (1968) na Bahia, Espírito Santo, Minas Gerais, São Paulo, Santa Catarina e Rio Grande do Sul como "trips da laranjeira", atacando folhas de Persea sp. (Lauraceae), Nicotiana tabacum L. (Solanaceae), Coffea arabica L. (Rubiaceae), Passiflora sp. (Passifloraceae), entre outras. Em Itapuã, foi coletada em cinco diferentes plantas, entre as quais Dioclea violacea Mart. ex Benth. (Fabaceae) e Stachytarpheta cayennensis (Rich.) Vahl (Verbenaceae).
Heliothrips haemorrhoidalis (Bouché, 1833) está citada em GALLO et al. (2002) como praga potencial de Diospyros sp. (Ebenaceae), Citrus sp. (Rutaceae), Syzygium sp. (Myrtaceae) e de outras importantes plantas cultivadas no Rio Grande do Sul e no Brasil. Esta mesma espécie foi citada por MONTEIRO et al. (1999) como praga nativa no Brasil em Macadamia sp. (Proteaceae). Em Itapuã, foi registrada em plantas que costumam ser encontradas próximas a agroecossistemas, destacando-se Casearia decandra Jacq. (Flacourtiaceae), Polypodium lepidopteris (Langsd. & Fisch.) Kunze (Polypodiaceae) e D. viscosa. Estas plantas apresentaram alta diversidade de tripes neste estudo.
As plantas têm representantes em 26 famílias das divisões Pterydophyta, Coniferophyta, Magnoliophyta, classes Pteridopsida, Coniferopsida, Magnoliopsida e Liliopsida. De acordo com o levantamento feito por MONTEIRO (2002), aproximadamente 287 espécies de plantas de 218 gêneros e 84 famílias abrigam tisanópteros em todo o território nacional. Destas, Asteraceae apresenta o maior número de espécies (31) associadas com tripes. Dados aqui apresentados confirmam esse padrão. Em 72 espécies de plantas identificadas associadas com tisanópteros, 22 são asteráceas; nestas foram registradas 24 espécies de tripes, das quais 13 (54,2%) do gênero Frankliniella. Com base na tabela I, pode-se verificar que a assembléia de tripes encontrados em Asteraceae apresenta um padrão de composição e estrutura distinto daqueles encontrados em plantas de outras famílias, sendo estes aspectos ainda pouco compreendidos.
Cordia verbenacea DC. (Boraginaceae), popularmente denominada cordia ou erva-baleeira, é uma planta nativa e abriga seis espécies de tripes, das quais Frankliniella sp. 2 e Haplothrips sp. foram as mais abundantes em seus ramos. Os imaturos são encontrados alimentando-se entre e sob os tricomas das folhas jovens e velhas, dispostas basal e apicalmente nos ramos. A maior abundância dos tripes ocorreu nas folhas, tendo sido raramente coletados nas hastes.
Hyptis mutabilis (Rich.) Briq. (Lamiaceae) é um arbusto cultivado, conhecido como sambaicaitá, distribuído por quase todo território brasileiro. É planta hospedeira de seis espécies de tripes (9,8%, sobre um total de 61) e visitada por outras quatro (6,6%), dentre as quais F. gemina e F. bruneri foram as mais freqüentes e abundantes.
Lantana camara L. (Verbenaceae), o camará ou camaradinha, é um arbusto comum em capoeira e vassoural. Ocorre desde o México até a Argentina, sendo introduzida na Europa, África e Ásia. É hospedeira de sete espécies (11,5%), de Frankliniella e de Paraleucothrips sp. Apenas indivíduos adultos de Hoodothrips lineatus (Hood, 1928) e F. insularis foram coletados. F. insularis é uma das poucas espécies citadas para o Rio Grande do Sul por SILVA et al. (1968) que foi encontrada na amostragem efetuada.
Stachytarpheta cayennensis é um subarbusto perene, nativo do Brasil, cujas flores se abrem durante os meses de primavera-verão. Foram registradas nas inflorescências 10 espécies (16,4%), das quais sete são Frankliniella. Microcephalothrips abdominalis Crawford, 1910 e Ceratothripoides sp. também foram registradas com grande número de imaturos. Nas inflorescências, os imaturos encontram-se mais habitualmente na parte basal e os adultos na apical.
Triumfetta abutiloides A. St. -Hill. (Tiliaceae) é planta herbácea nativa do Brasil, muito comum nas capoeiras e nos campos cerrados. É hospedeira de três espécies (4,9%) do gênero Frankliniella, de N. flavens e ainda visitada por Haplothrips sp. e Frankliniella nakaharai Sakimura & O'Neill, 1979.
Agradecimentos. Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pelo apoio financeiro; ao Departamento de Florestas e Áreas Preservadas da Secretaria Estadual do Meio Ambiente do Rio Grande do Sul, pelo acesso ao Parque Estadual de Itapuã; à Dra. Renata C. Monteiro, por sua inestimável atenção ao nosso trabalho e ao Dr. Laurence A. Mound pela contribuição na confirmação e identificação de espécies de tripes.
Recebido em fevereiro de 2004. Aceito em janeiro de 2005.
- BRACK, P.; SCHÜTZ, R. S. & SOBRAL, M. 1998. Árvores e arbustos na vegetação natural de Porto Alegre, Rio Grande do Sul, Brasil. Iheringia, Série Botânica, (51): 139-166.
- CRESPI, B. J. & MOUND, L. A. 1997. Ecology and evolution of social behaviour among Australian gall thrips and their allies. In: CHOE, J. & CRESPI, B. J. eds. Evolution of Social Behaviour in Insects and Arachnids Cambridge, Cambridge University. p.166-180.
- CRONQUIST, A. 1988. The evolution and classification of flowering plants New York, The New York Botanical Garden. 555p.
- DEL-CLARO, K.; MARULLO, R. & MOUND, L. A. 1997. A new Brazilian species of Heterothrips (Insecta: Thysanoptera) co-existing with ants in the flowers of Peixotoa tomentosa (Malpighiaceae). Journal of Natural History, 31:1307-1312.
- DE SANTIS, L.; GALLEGO DE SUREDA, A. E. & MERLO, E. Z. 1980. Estudio sinoptico de los tisanopteros Argentinos (Insecta). Obra del Centenario del Museo de La Plata, 6:91-166.
- GALLO, D.; NAKANO, O.; NETO, S. S.; CARVALHO, R. P. L.; BATISTA, G. C.; FILHO, E. B.; PARRA, J. R. P.; ZUCCHI, R. A.; ALVES, S. B.; VENDRAMIM, J. D.; MARCHINI, L. C.; LOPES, J. R. S. & OMOTO, C. 2002. Entomologia Agrícola Piracicaba, Fundação de Estudos Agrários. 920 p. (Biblioteca de Ciências Agrárias Luiz de Queiroz, 10).
- HEMING, B. S. 1991. Order Thysanoptera. In: STEHR, F. W. ed. Immature Insects Dubuque, Kendall/Hunt. v.2, p. 1-21.
- HOOD, J. D. 1952. Brazilian Thysanoptera III. Proceedings of the Biological Society of Washington, 65:141-174.
- IZZO, J. T.; PINENT, S. M. J. & MOUND, L. A. 2002. Aulacothrips dictyotus (Heterothripidae), the first Ectoparasitic thrips (Thysanoptera). Florida Entomology, 85:281-283.
- LORENZI, H. & MOREIRA, H. S. 1999. Plantas ornamentais no Brasil: arbustivas, herbáceas e trepadeiras. 2ed. Nova Odessa, Instituto Plantarum. 1088p.
- MONTEIRO, R. C. 2002. The Thysanoptera fauna of Brazil. In: INTERNATIONAL SYMPOSIUM ON THYSANOPTERA, 7th , Reggio Calabria, 2001. Proceedings... CD-ROM, p.325-340.
- MONTEIRO, R. C.; MOUND, L. A. & ZUCCHI, R. A. 1999. Thrips (Thysanoptera) as pests of plants production in Brazil. Revista Brasileira de Entomologia, 43(3/4):163-171.
- MORITZ, G.; MORRIS, D. & MOUND, L. A. 2001. ThripsID: Pest thrips of the world. Collingwood, CSIRO, 1 CD-ROM.
- MOULTON, D. 1948. The genus Frankliniella Karny, with keys for the determination of species (Thysanoptera). Revista de Entomologia, 19:55-114.
- MOUND, L. A. 2000. The aquatic thrips Organothrips indicus Bhatti (Thysanoptera: Thripidae) in Queensland, and a new species, O wrighti, from tropical Australia. Australian Journal of Entomology, 39:10-14.
- MOUND, L. A. & KIBBY, G. 1998. Thysanoptera: an identification guide 2 ed. Wallingford, CAB. 70p.
- MOUND, L. A. & KRANZ, B. 1997. Thysanoptera and plant galls: towards a research programme. In: RAMAN, A. ed. Ecology and evolution of plant-feeding insects in natural and man-made environments New Delhi, Backhuys. p.11-24.
- MOUND, L. A. & MARULLO, R. 1996. The thrips of Central and South America: an introduction (Insecta: Thysanoptera) Florida, Associated Publishers. 487p. (Memoirs on Entomology International 6).
- MOUND, L. A. & MORRIS, D. C. 2001. Domicile constructing phlaeothripine thysanoptera from Acacia phyllodes in Australia: Dunatothrips Moulton and Sartrithrips gen. n., with a key to associated genera. Systematic Entomology, 26:401- 419.
- MOUND, L. A. & O'NEILL, K. 1974. Taxonomy of the Merothripidae, with ecological and phylogenetic considerations (Thysanoptera). Journal of Natural History, 8:481-509.
- NAKAHARA, S. 1997. Annotated list of Frankliniella species of the world (Thysanoptera: Thripidae). Contributions on Entomology International, 2:354-389.
- PALMER, J. M.; MOUND, L. A. & HEAUME, G. J. 1989. Thysanoptera Wallingford, CAB. 74p. (Cie Guides to insects of importance to man, 2).
- PINENT, S. M. J.; MOUND, L. A. & IZZO, T. J. 2002a. Ectoparasitism in thrips and its possible significance for tospovirus evolution. In: INTERNATIONAL SYMPOSIUM ON THYSANOPTERA, 7th, Reggio Calabria, 2001. Proceedings... CD-ROM, p.273-276.
- PINENT, S. M. J.; ROMANOWSKI, H. P.; REDAELLI, L. R. & PINENT, C. E. da C. 2002b. Thysanoptera diversity: survey of the species occurring at Parque Estadual de Itapuã, Viamão, RS, Brazil. In: INTERNATIONAL SYMPOSIUM ON THYSANOPTERA, 7th, Reggio Calabria, 2001. Proceedings... CD-ROM, p.289-292.
- PINENT, S. M. J.; ROMANOWSKI, H. P.; REDAELLI, L. R. & MOUND, L. A. 2003. Thrips species (Thysanoptera) collected at Parque Estadual de Itapuã, Viamão, RS, Brazil. Neotropical Entomology, 32(4):619-623.
- RIO GRANDE DO SUL. 1997. Plano de Manejo Parque Estadual de Itapuã Porto Alegre, Secretaria da Agricultura e Abastecimento, Departamento de Recursos Naturais Renováveis. 158p.
- SAKIMURA, K. & O'NEILL, K. 1979. Frankliniella, redefinition of genus and revision of minuta group species (Thysanoptera: Thripidae) Washington, Department of Agriculture. 49p. (Technical Bulletin, 1572).
- SCHULTZ, A. 1984. Introdução à botânica sistemática. 4.ed. rev. Porto Alegre, Editora da Universidade. 414p.
- SILVA, A. G. A.; GONÇALVES, C. R.; GALVÃO, D. M.; GONÇALVES, A. J. L.; GOMES, J.; SILVA, M. N. & SIMONI, L. 1968. Quarto catálogo de insetos que vivem nas plantas do Brasil Rio de Janeiro, Ministério da Agricultura. v.1, parte II, p. 18-33.
- SPEYER, E. R. & PARR, W. J. 1941. The external structure of some thysanopterous larvae. Transactions of the Royal Entomological Society of London, 91:559-635.
Datas de Publicação
-
Publicação nesta coleção
28 Jul 2005 -
Data do Fascículo
Mar 2005
Histórico
-
Aceito
Jan 2005 -
Recebido
Fev 2004