Resumos
OBJETIVO: Analisar a utilidade da contagem total de linfócitos, contagem global de leucócitos, hemoglobina, estado nutricional, contagem de linfócitos T CD4+ e carga viral como marcadores de progressão da doença e/ou óbito em crianças infectadas pelo HIV. MÉTODOS: Estudo de coorte retrospectiva em população de crianças infectadas pelo HIV, assintomáticas ou com sintomas leves e/ou moderados e virgens de tratamento antirretroviral. Os eventos de interesse foram: progressão para categoria clínica C (de acordo com a classificação dos Centers for Disease Control and Prevention - CDC, de 1994) ou óbito. Valores da contagem global de leucócitos, contagem total de linfócitos, hemoglobina, escore z peso/idade, contagem de linfócitos T CD4+ e carga viral plasmática obtidos à admissão foram considerados na análise do risco de ocorrência dos eventos de interesse. A população foi estratificada em faixas etárias: <12, > 12 e < 36, > 36 e < 60 meses. RESULTADOS: Cento e vinte pacientes, admitidos entre 1997 e 2003, preencheram os critérios para inclusão deste estudo. A mediana global do tempo de acompanhamento foi de 7,4 meses (intervalo interquartil 25-75% = 3,8-21,1). Em análise multivariada, apenas a contagem de linfócitos T CD4+, segundo as categorias da Organização Mundial da Saúde, e o escore z peso/idade ≤ -2 foram preditores do risco de progressão da doença em crianças maiores de 12 meses de idade. Em menores de 12 meses, nenhuma das variáveis analisadas esteve associada ao risco de progressão. CONCLUSÃO: Evidencia-se a importância do estado nutricional na avaliação do risco de progressão da doença em crianças maiores de 12 meses de idade infectadas pelo HIV.
HIV; crianças; peso; marcadores biológicos; linfócitos
OBJECTIVE: To analyze total lymphocyte count, total leukocyte count, hemoglobin levels, nutritional status, CD4+ T-lymphocyte count and viral load as markers of disease progression and/or death in HIV-infected children. METHODS: This retrospective cohort study assessed antiretroviral naïve HIV-infected children who were asymptomatic or had mild and/or moderate symptoms. The events of interest were: progression to clinical category C (according to the classification of the Centers for Disease Control and Prevention - CDC, 1994) or death. Values of total leukocyte count, total lymphocyte count, hemoglobin, weight-for-age z score, CD4+ T-lymphocyte count and plasma viral load obtained at admission were considered in the risk analysis of events of interest. The population was stratified into age groups: < 12, > 12 to < 36, > 36 to < 60 months. RESULTS: One hundred and twenty patients, admitted between 1997 and 2003, met the inclusion criteria for the present study. The total median of follow-up duration was 7.4 months (25-75% interquartile range = 3.8-21.1). In the multivariate analysis, only CD4+ T-lymphocytes count, according to the categories of the World Health Organization, and weight-for-age z score ≤ -2 were predictors of risk for disease progression in children older than 12 months. In children younger than 12 months, none of the variables was associated with risk of progression. CONCLUSION: Nutritional status is an important aspect in the assessment of risk of disease progression in HIV-infected children older than 12 months.
HIV; children; weight; biomarkers; lymphocytes
ARTIGO ORIGINAL
Avaliação dos parâmetros hematológicos, virológicos e antropométricos como marcadores de progressão em crianças infectadas pelo HIV-1
Inácio R. CarvalhoI; Jorge A. PintoII; Claudete A. A. CardosoIII; Talitah M. S. CandianiIV; Fabiana M. KakehasiV
IMestre, Saúde da Criança e do Adolescente, Departamento de Pediatria, Faculdade de Medicina, Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG. Membro, Grupo de HIV/AIDS Materno-Infantil, UFMG, Belo Horizonte, MG. Médico preceptor, Residência em Pediatria, Fundação Hospitalar do Estado de Minas Gerais (FHEMIG), Belo Horizonte, MG
IIDoutor. Professor associado, Departamento de Pediatria, Faculdade de Medicina, UFMG, Belo Horizonte, MG. Coordenador, Grupo de HIV/AIDS Materno-Infantil, UFMG, Belo Horizonte, MG
IIIDoutora, Saúde da Criança e do Adolescente, Departamento de Pediatria, Faculdade de Medicina, UFMG, Belo Horizonte, MG
IVMestre, Saúde da Criança e do Adolescente, Departamento de Pediatria, Faculdade de Medicina, UFMG, Belo Horizonte, MG. Médica infectologista, FHEMIG, UFMG, Belo Horizonte, MG
VDoutora, Saúde da Criança e do Adolescente, Departamento de Pediatria, Faculdade de Medicina, UFMG, Belo Horizonte, MG. Membro, Grupo de HIV/AIDS Materno-Infantil, UFMG, Belo Horizonte, MG
Correspondência Correspondência: Jorge Andrade Pinto Av. Alfredo Balena, 190/161 CEP 30130-100 - Belo Horizonte, MG Tel.: (31) 3409.9822 Fax: (31) 3273.0422 Email: jpinto@medicina.ufmg.br
RESUMO
OBJETIVO: Analisar a utilidade da contagem total de linfócitos, contagem global de leucócitos, hemoglobina, estado nutricional, contagem de linfócitos T CD4+ e carga viral como marcadores de progressão da doença e/ou óbito em crianças infectadas pelo HIV.
MÉTODOS: Estudo de coorte retrospectiva em população de crianças infectadas pelo HIV, assintomáticas ou com sintomas leves e/ou moderados e virgens de tratamento antirretroviral. Os eventos de interesse foram: progressão para categoria clínica C (de acordo com a classificação dos Centers for Disease Control and Prevention CDC, de 1994) ou óbito. Valores da contagem global de leucócitos, contagem total de linfócitos, hemoglobina, escore z peso/idade, contagem de linfócitos T CD4+ e carga viral plasmática obtidos à admissão foram considerados na análise do risco de ocorrência dos eventos de interesse. A população foi estratificada em faixas etárias: <12, > 12 e < 36, > 36 e < 60 meses.
RESULTADOS: Cento e vinte pacientes, admitidos entre 1997 e 2003, preencheram os critérios para inclusão deste estudo. A mediana global do tempo de acompanhamento foi de 7,4 meses (intervalo interquartil 25-75% = 3,8-21,1). Em análise multivariada, apenas a contagem de linfócitos T CD4+, segundo as categorias da Organização Mundial da Saúde, e o escore z peso/idade ≤ -2 foram preditores do risco de progressão da doença em crianças maiores de 12 meses de idade. Em menores de 12 meses, nenhuma das variáveis analisadas esteve associada ao risco de progressão.
CONCLUSÃO: Evidencia-se a importância do estado nutricional na avaliação do risco de progressão da doença em crianças maiores de 12 meses de idade infectadas pelo HIV.
Palavras-chave: HIV, crianças, peso/idade, marcadores biológicos, linfócitos.
Introdução
A utilização da terapia antirretroviral altamente ativa (do inglês highly active antiretroviral therapy) resultou em significativa melhora dos indicadores de mortalidade, morbidade e qualidade de vida de crianças infectadas pelo vírus da imunodeficiência humana tipo 1 (HIV-1)1-3. A decisão quanto ao início da terapia antirretroviral é baseada em parâmetros clínicos e laboratoriais4-7. Os parâmetros laboratoriais, contagem de linfócitos T CD4+ (LT-CD4+) e carga viral plasmática, do HIV requerem tecnologias sofisticadas e de alto custo que não estão facilmente disponíveis em países em desenvolvimento, onde aproximadamente 90% dos indivíduos infectados pelo HIV vivem. Em locais em que não há disponibilidade de exames laboratoriais, a Organização Mundial da Saúde (OMS) recomenda o início de terapia antirretroviral para todas as crianças maiores de 1 ano nos estágios clínicos 3 e 48.
O estabelecimento de marcadores de progressão de baixo custo, derivados de parâmetros facilmente obtidos, como hemograma ou avaliação nutricional, pode ser útil para o acompanhamento de crianças infectadas pelo HIV vivendo em regiões em que o acesso aos métodos laboratoriais mais sofisticados não está disponível e antes que a progressão da infecção seja clinicamente detectável. Com a interiorização da epidemia no Brasil, tal cenário pode ser encontrado em localidades brasileiras distantes dos centros de referência e/ou metropolitanos9.
Meta-análise de estudos na população pediátrica evidenciou que, para semelhantes níveis de carga viral plasmática e LT-CD4+, quanto menor a idade da criança maior o risco de progressão da doença ou óbito7. Portanto, os valores virológicos e imunológicos a serem considerados como critério para início de terapia antirretroviral variam de acordo com as faixas etárias. Análise posterior dessa mesma população avaliou a contagem total de linfócitos (CTL) como marcador de risco de progressão ou morte em 12 meses e analisou a validade dos pontos de corte então vigentes para início de terapia antirretroviral10. Evidenciou-se que a CTL foi um bom preditor do risco de proteção e/ou morte, apesar da fraca correlação com o CD4 (r = 0,08-0,19), e que os pontos de corte inicialmente propostos pela OMS em 2003 não foram adequados para avaliar o risco de progressão da doença. Novos pontos de corte de CTL para quatro diferentes faixas etárias (< 12 meses, 12 a 36 meses, 36 a 60 meses e > de 60 meses de idade) foram então propostos para início de terapia antirretroviral11. Ressalve-se, entretanto, que tais parâmetros foram derivados de estudo em crianças de países desenvolvidos.
O objetivo deste estudo foi analisar a utilidade da CTL, contagem global de leucócitos, hemoglobina, estado nutricional (escores z peso/idade e altura/idade), contagem de LT-CD4+ e carga viral plasmática como marcadores de progressão da doença, definidos como progressão para classe C dos Centers for Disease Control and Prevention CDC, de 1994 e/ou óbito.
Métodos
Trata-se de estudo de coorte retrospectiva conduzido no Centro de Treinamento e Referência em Doenças Infecciosas e Parasitárias Orestes Diniz, em Belo Horizonte (MG). Foram incluídos pacientes com idade inferior a 60 meses, admitidos no serviço no período entre 1 de julho de 1997 e 31 de dezembro de 2003 e com exames de carga viral plasmática, LT-CD4+ e hemograma antes do início da terapia antirretroviral.
Os dados foram obtidos através da revisão dos prontuários médicos e registrados em questionário padronizado, que incluiu dados demográficos e antropométricos, resultados de exames laboratoriais (hemograma, CD4, CD8 e carga viral plasmática) e as avaliações clínicas. As avaliações clínicas e laboratoriais ocorreram a cada 3 ou 4 meses, e as informações coletadas foram revisadas e discutidas por três infectologistas pediátricos antes da digitação no banco de dados. O diagnóstico das doenças foi padronizado segundo critérios clínicos e laboratoriais definidos pelo programa nacional de DST/AIDS12. A classificação clínica e imunológica seguiu os critérios definidos pelo CDC13. Foram utilizados os pontos de corte de CTL e LT-CD4+ de acordo com as definições da OMS11. Para os pontos de corte de carga viral plasmática, foram adotados os valores preconizados pelo grupo Paediatric European Network for Treatment of AIDS14.
A contagem de linfócitos T CD4+ (CD4) foi realizada emcitômetro de fluxo (Facs Count, Becton Dickson®). A quantificação do RNA-HIV plasmático foi feita através da técnica de amplificação baseada em sequência de nucleosídeos (Nucleosid Assay Sequence Based on Amplification NASBA, Nuclisens Organon Teknica®). Hemogramas foram realizados em analisadores hematológicos automatizados (Cell Dyn 3000 e Cell Dyn 3500, Abbott®). Medidas de peso e altura foram obtidas em cada visita pelo médico responsável pelo atendimento. Os pacientes foram pesados em balanças analíticas calibradas semanalmente, e a altura ou comprimento foram aferidos com réguas antropométricas. Os escores z peso/idade e altura/idade foram calculados utilizando o programa de cálculos antropométricos contido no Epi-Info versão 6.415.
Os pacientes foram classificados como progressores ou não-progressores de acordo com a ocorrência do evento de interesse (progressão da doença definida como classificação clínica C dos CDC, de 1994, e/ou óbito) e estratificados por faixas etárias (< 12 meses; > 12 meses e < 36 meses; e > 36 e < 60 meses). Apenas medidas obtidas antes do início da terapia antirretroviral foram analisadas. Para minimizar um possível viés de apresentação, crianças que apresentaram o desfecho (progressão clínica ou óbito) nos primeiros 2 meses a partir da admissão foram excluídas da análise. A análise univariada dos marcadores de progressão foi feita considerando a mediana dos seus valores à admissão. O tempo de progressão e/ou sobrevida dos pacientes, em que houve perda de seguimento, foi censurado na data da última consulta realizada. Os dois grupos foram comparados utilizando o teste do qui-quadrado ou o teste exato de Fisher para as variáveis categóricas e testes não-paramétricos para as variáveis contínuas. A análise multivariada utilizou o método de risco proporcional de Cox, em que a hemoglobina e a contagem global de leucócitos foram consideradas variáveis contínuas, e CTL percentual de LT-CD4+, CV e escore z peso/idade foram consideradas variáveis categóricas. As análises estatísticas foram efetuadas utilizando os pacotes estatísticos SPSS (Statistical Package for the Social Sciences) versão 12.0 e Epi-Info 6.4. Esta pesquisa foi aprovada pelo Comitê de Ética em Pesquisa da Universidade Federal de Minas Gerais (UFMG).
Resultados
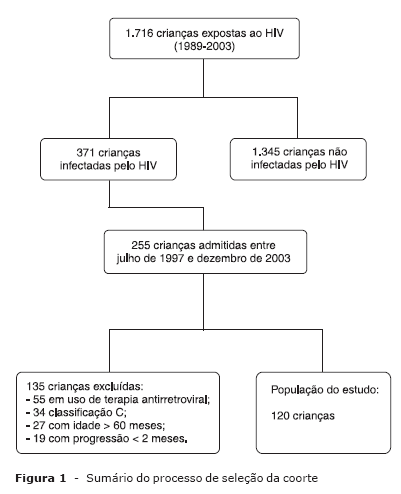
Desde a criação do serviço, em 1989, até 31 de dezembro de 2003 foram atendidas 1.716 crianças expostas ao HIV, e a infecção foi confirmada em 371 delas. Entre julho de 1997 e dezembro de 2003 foram admitidas 255 crianças infectadas. A Figura 1 sumariza o processo de seleção da população para este estudo. Foram excluídas 135 crianças: 55 em uso de terapia antirretroviral à admissão, 34 por apresentarem-se na categoria clínica C (CDC de 1994) à admissão, 27 crianças com mais de 60 meses de idade e 19 por apresentarem progressão clínica nos primeiros 2 meses de seguimento. Portanto, o grupo estudado consistiu de 120 crianças. Não ocorreram óbitos, perda de seguimento nem transferências para outros serviços.
A mediana global do tempo de acompanhamento foi de 7,4 meses, intervalo interquartil 25-75% (IIQ25-75%) = 3,8-21,1. Entre progressores e não-progressores, a mediana de tempo de acompanhamento foi de 5,1 (IIQ25-75% = 3,5-9,9) e 29,5 meses (IIQ25-75% = 9,5-52,0), respectivamente. A faixa etária < 12 meses concentrou o maior número de pacientes (41,7%), sendo que cerca da metade deles era do sexo masculino e a mediana de idade à admissão foi de 18 meses (IIQ25-75% = 4,8-36,2), com quase a totalidade dos pacientes infectados por transmissão vertical. As características demográficas e clínicas à admissão são apresentadas na Tabela 1.
A mediana dos valores dos marcadores CTL, LT-CD4+, hemoglobina, carga viral plasmática e os escores z ≤ -2 de peso/idade e altura/idade foram comparados entre pacientes com e sem progressão da infecção em análise univariada (Tabela 2). Os valores absolutos de LT-CD4+ foram significativamente menores entre os progressores nas faixas etárias inferiores (< 12 e > 12 e < 36 meses). Os valores relativos de LT-CD4+ foram significativamente menores entre os progressores nas faixas etárias > 12 e < 36 meses e > 36 e < 60 meses. Em todas as faixas etárias os progressores apresentaram escores z de peso/idade e altura/idade significativamente menores. A mediana de hemoglobina foi significativamente menor entre os progressores nas faixas etárias > 12 e < 36 meses e > 36 e < 60 meses. A mediana de carga viral plasmática foi significativamente maior apenas entre os progressores da faixa etária de > 36 e < 60 meses. Não houve diferença significativa entre os grupos de progressores e não progressores para os demais marcadores (CTL e contagem global de leucócitos) nas faixas etárias avaliadas.
Para análise dos fatores independentes, realizou-se análise multivariada (Tabela 3) com modelo que incluía as variáveis: hemoglobina, contagem global de leucócitos, escore z peso/idade ≤ -2, linfócitos T CD4+ % e carga viral plasmática. Na faixa etária < 12 meses, nenhum dos parâmetros avaliados mostrou-se útil na diferenciação entre progressores e não-progressores. Entretanto, nas faixas etárias superiores (> 12 e < 36 meses e > 36 e < 60 meses) os valores percentuais de LT-CD4+, categorizados de acordo com a OMS, e o escore z peso/idade ≤ -2 foram bons preditores do risco de progressão.
Discussão
O Brasil tem um programa de atendimento ao paciente portador do HIV considerado como um dos melhores do mundo16. Entretanto, os exames habitualmente utilizados como marcadores da doença, contagem de linfócitos T CD4+ e carga viral plasmática, requerem sofisticação tecnológica e têm custo elevado. Em situações de recursos limitados, seja em áreas remotas do território brasileiro ou em outros países que não contam com infraestrutura laboratorial sofisticada, marcadores obtidos através de um simples hemograma e a avaliação do estado nutricional podem ser ferramentas úteis para a definição da conduta terapêutica em crianças infectadas pelo HIV.
Este estudo tem limitações inerentes ao método retrospectivo. Entretanto, convém ressaltar que os dados clínicos e laboratoriais foram obtidos de prontuários padronizados, o que reduz os vícios de informação. Com o objetivo de minimizar os vícios inerentes ao estudo retrospectivo, todas as fichas clínicas foram revistas e discutidas por três médicos infectologistas pediátricos, utilizando critérios uniformes para as definições das condições clínicas dos pacientes. A perda de seguimento, importante limitação de estudos longitudinais, não ocorreu neste estudo. Foram excluídos pacientes com doença clínica ou imunologicamente estabelecida, pois a inclusão desse grupo não ajudaria na aquisição dos achados para conclusão do estudo. Assim, também não foram incluídos pacientes admitidos no serviço já em uso de terapia antirretroviral, pois o critério de início de tratamento poderia não estar claramente estabelecido ou os exames pré-terapia antirretroviral não disponíveis.
Rotineiramente, as amostras de sangue para realização dos exames de carga viral plasmática, CD4 e hemograma foram colhidas sempre no mesmo horário, entre 7 e 10 horas da manhã, evitando-se as já bem estudadas variações desses exames no decorrer do dia. Porém, tais exames são agendados previamente a cada 3 ou 4 meses e, portanto, algumas vezes as crianças os fazem na vigência ou próximo a doenças agudas bacterianas ou virais. Habitualmente, os pacientes são orientados a realizar as imunizações 1 mês antes ou no mesmo dia dos exames, após a coleta do sangue.
A antropometria permite o diagnóstico de desnutrição em fases iniciais. As medidas de altura e peso dos pacientes foram realizadas pelos médicos responsáveis pelo atendimento com réguas antropométricas e em balanças calibradas semanalmente, reduzindo assim a possibilidade de erro. Além disto, a perda de dados foi mínima, pois só não foram anotados no prontuário o peso de um paciente e a altura de outros cinco.
O estado nutricional, avaliado através do escore z peso/idade, foi um preditor sensível do risco de progressão da doença em crianças maiores de 12 meses. Estudo em Ruanda mostrou média de escore z para peso/idade menor entre crianças infectadas quando comparadas àquelas expostas não infectadas, já no terceiro mês de vida17. Achados semelhantes foram encontrados em estudo brasileiro na era pré-terapia antirretroviral altamente ativa18. Inicialmente, estudo americano evidenciou diminuição de 1 a 0,75 na média do z score para peso/idade em todo o período de seguimento dentre as crianças infectadas pelo HIV, mas sem diferença estatística significativa quando comparada às expostas não infectadas19. Entretanto, elegante estudo prospectivo americano20 evidenciou posteriormente que peso e altura mostraram-se significativamente inferiores entre crianças infectadas pelo HIV, quando comparados aos valores obtidos em crianças não-infectadas de mesmo nível socioeconômico, aos 6 meses de idade. Tal diferença mostrou-se correlacionada com o uso de drogas ilícitas pela mãe durante a gravidez e a outros indícios de doença definidora de AIDS (episódios de pneumonia, contagem de linfócitos T CD4 e uso de terapia antirretroviral), que potencialmente podem interagir com a variável resposta. Infelizmente, o presente estudo não mensurou a influência dos fatores maternos conjuntamente aos parâmetros antropométricos como preditores de progressão para doença como em outros estudos20-22.
Entre os parâmetros derivados do hemograma (contagem global de leucócitos, CTL e hemoglobina), apenas a hemoglobina à admissão foi útil na diferenciação entre progressores e não-progressores em maiores de 12 meses. Na análise multivariada, nenhum desses parâmetros mostrou-se útil na predição do risco de progressão. A correlação da CTL com a progressão da infecção ainda permanece controversa10,23,24. A correlação entre marcadores alternativos e probabilidade de óbito em 12 meses foi avaliada em estudo realizado na população estadunidense, evidenciando CTL e dosagem de albumina como preditores independentes de mortalidade e ausência de associação para outros parâmetros, como hematócrito e contagem global de leucócitos23. Estudo de meta-análise realizado nos EUA e Europa verificou a associação entre os valores de CTL ao início de terapia antirretroviral e comparou seus valores com a contagem de CD410. A CTL mostrou-se bom preditor de risco de progressão ou óbito em maiores de 2 anos de idade, efeito menos expressivo em crianças menores. Entretanto, uma meta-análise derivada de dados longitudinais de nove centros africanos e um brasileiro demonstrou que contagem de LT-CD4+, peso/idade e hemoglobina foram os melhores preditores de risco de progressão, com efeito marginal da CTL24.
Os valores de LT-CD4+ à admissão, categorizados de acordo com a OMS, foram sensíveis na predição do risco de progressão da doença em crianças maiores de 12 meses. Não foram identificados parâmetros sensíveis para predição do risco de progressão em menores de 12 meses de idade. Esse achado encontra suporte nos recentes consensos terapêuticos que, reconhecendo a ausência de marcadores prognósticos sensíveis em lactentes infectados pelo HIV, preconizam início imediato de terapia antirretroviral em menores de 12 meses de idade, independentemente dos valores de LT-CD4+, carga viral plasmática e manifestações clínicas8,25,26.
A carga viral plasmática não se mostrou um bom marcador de progressão na análise univariada, só mostrando diferença significativa na faixa etária mais velha, e na análise multivariada não foi capaz de descriminar progressores e não-progressores em nenhuma das faixas etárias. Tal achado está de acordo com dados da literatura, que relata superposição dos níveis de carga viral plasmática entre os pacientes com progressão rápida da infecção e os progressores clássicos4.
Este estudo enfatiza o valor do estado nutricional na avaliação do risco de progressão da doença em crianças maiores de 12 meses infectadas pelo HIV.
Artigo submetido em 14.10.08, aceito em 26.01.09.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
Como citar este artigo: Carvalho IR, Pinto JA, Cardoso CA, Candiani TM, Kakehasi FM. Evaluation of hematological, virologic and anthropometric parameters as progression markers in HIV-1 infected children. J Pediatr (Rio J). 2009;85(2):149-156.
- 1. Romanelli RM, Pinto J, Melo LJ, Vasconcelos MA, Pereira RM. Effectiveness of dual and triple antiretroviral therapy in the treatment of HIV-infected children. J Pediatr (Rio J). 2006;82:260-5.
- 2. Candiani TM, Pinto J, Cardoso CA, Carvalho IR, Dias AC, Carneiro M, et al. Impact of highly active antiretroviral therapy (HAART) on the incidence of opportunistic infections, hospitalizations and mortality among children and adolescents living with HIV/AIDS in Belo Horizonte, Minas Gerais State, Brazil. Cad Saude Publica. 2007;23 Supl 3:S414-23.
- 3. Gona P, Van Dyke RB, Williams PL, Dankner WN, Chernoff MC, Nachman SA, et al. Incidence of opportunistic and other infections in HIV-infected children in the HAART era. JAMA. 2006;296:292-300.
- 4. Shearer WT, Quinn TC, LaRussa P, Lew JF, Mofenson L, Almy S, et al. Viral load and disease progression in infants infected with human immunodeficiency virus type 1. Women and Infants Transmission Study Group. N Engl J Med. 1997;336:1337-42.
- 5. Mofenson LM, Korelitz J, Meyer WA 3rd, Bethel J, Rich K, Pahwa S, et al. The relationship between serum human immunodeficiency virus type 1 (HIV-1) RNA level, CD4 lymphocyte percent, and long-term mortality risk in HIV-1-infected children. National Institute of Child Health and Human Development Intravenous Immunoglobulin Clinical Trial Study Group. J Infect Dis. 1997;175:1029-38.
- 6. Palumbo PE, Raskino C, Fiscus S, Pahwa S, Fowler MG, Spector AS, et al. Predictive value of quantitative plasma HIV RNA and CD4+ lymphocyte count in HIV-infected infants and children. JAMA. 1998;279:756-61.
- 7. Dunn D. HIV Pediatric Prognostic Markers Collaborative Study Group. Short-term risk of disease progression in HIV-1-infected children receiving no antiretroviral therapy or zidovudine monotherapy: a meta-analysis. Lancet. 2003;362:1605-11.
-
8World Health Organization (WHO). Report of the WHO Technical Reference Group, Paediatric HIV/ART Care Guideline Group Meeting. Geneva, Switzerland, 10-11 April 2008. http://www.who.int/hiv/topics/paediatric/en/ . Acesso: 08/01/09.
-
9Brasil. Ministério da Saúde. Boletim Epidemiológico AIDS - Ano IV nº 1 - julho a dezembro de 2006/janeiro a junho de 2007. Ano IV nº 01 - 27ª a 52ª semanas epidemiológicas - julho a dezembro de 2006 - 01ª a 26ª semanas epidemiológicas - janeiro a junho de 2007. http://www.aids.gov.br/data/documents/storedDocuments/%7BB8EF5DAF-23AE-4891-AD36-1903553A3174%7D/%7B721527B6-FE7A-40DF-91C4-098BE8C704E0%7D/Boletim2007_internet090108.pdf . Acesso: 07/01/09.
- 10. HIV Pediatric Prognostic Markers Collaborative Study Group. Use of total lymphocyte count for informing when to start antiretroviral therapy in HIV-infected children: a meta- analysis of longitudinal data. Lancet. 2005;366:1868-74.
-
11World Health Organization (WHO). Antiretroviral Therapy for HIV infection in infants and children in resource-limited settings: towards universal access: recommendations for a public health approach. Geneva: WHO; 2006. http://www.who.int/hiv/pub/guidelines/paediatric020907.pdf . Acesso: 15/12/07.
- 12. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Programa Nacional de DST e AIDS. Critérios de definição de casos de AIDS em adultos e crianças. Brasília: Ministério da Saúde; 2003. http://www.aids.gov.br/data/documents/storedDocuments/%7BB8EF5DAF-23AE-4891-AD36-1903553A3174%7D/%7B2A9F7D1C-093E-4A04-8380-84ED432964A5%7D/criterios.pdf . Acesso: 15/12/07.
- 13. Centers for Disease Control and Prevention - CDC. 1994 revised classification system for Human Immunodeficiency Virus infection in children less than 13 years of age. MMWR Recomm Rep. 1994;43(RR-12):1-10
- 14. Sharland M, Blanche S, Castelli G, Ramos J, Gibb DM; PENTA Steering Committee. PENTA guidelines for use of antiretroviral therapy, 2004. HIV Med. 2004;5 Suppl 2:61-86.
- 15. Dean AG, Dean JA, Burton AH, Dicker RC. Epi Info: a general-purpose microcomputer program for public health information systems. Am J Prev Med. 1991; 7:178-82.
- 16. Lepage P, Msellati P, Hitimana DG, Bazubagira A, Van Goethem C, Simonon A, et al. Growth of human immunodeficiency type 1-infected and uninfected children: a prospective cohort study in Kigali, Rwanda, 1988 to 1993. Pediatr Infect Dis J. 1996;15:479-85.
-
17World Health Organization (WHO). Joint United Nations Programme on HIV/AIDS (UNAIDS). Epidemiological fact sheet on HIV and Aids. Core data on epidemiology and response – Brazil. 2008 Update. http://www.who.int/globalatlas/predefinedReports/EFS2008/full/EFS2008_BR.pdf . Acesso: 07/01/09.
- 18. Pinto JA. Marcadores prognósticos e diagnóstico precoce em uma coorte de crianças infectadas verticalmente pelo vírus da imunodeficiência humana tipo 1 (HIV-1) [tese]. Belo Horizonte, MG: Universidade Federal de Minas Gerais; 1999.
- 19. Pollack H, Glasberg H, Lee E, Nirenberg A, David R, Krasinski K, et al. Impaired early growth of infants perinatally infected with human immunodeficiency virus: correlation with viral load. J Pediatr. 1997;130:915-22.
- 20. Miller TL, Easley KA, Zhang W, Orav EJ, Bier DM, Luder E, et al. Maternal and infant factors associated with failure to thrive in children with vertically transmitted human immunodeficiency virus-1 infection: the prospective, P2C2 human immunodeficiency virus multicenter study. Pediatrics. 2001;108:1287-96.
- 21. Chearskul S, Chotpitayasunondh T, Simonds RJ, Wanprapar N, Waranawat N, Punpanich W, et al. Survival, disease manifestations, and early predictors of disease progression among children with perinatal human immunodeficiency virus infection in Thailand. Pediatrics. 2002;110:e25.
- 22. Newell ML, Borja MC, Peckham C; European Collaborative Study. Height, weight, and growth in children born to mothers with HIV-1 infection in Europe. Pediatrics. 2003;111:e52-60.
- 23. Mofenson LM, Harris DR, Moye J, Bethel J, Korelitz J, Read JS, et al. Alternatives to HIV-1 RNA concentration and CD4+ to predict mortality in HIV-1-infected children in resource-poor settings. Lancet. 2003;362:1625-7.
- 24. Cross Continents Collaboration for Kids (3Cs4kids) Analysis and Writing Committee. Markers for predicting mortality in untreated HIV-infected children in resource-limited settings: a meta-analysis. AIDS. 2008;22:97-105.
-
25USPHS Guidelines for the use of antiretroviral agents in pediatric HIV infection. July 29, 2008. http://aidsinfo.nih.gov/contentfiles/PediatricGuidelines.pdf . Acesso: 19/01/09.
-
26PENTA guidelines for the use of antiretroviral therapy in HIV paediatric infection – 2008 draft revision. http://www.pentatrials.org/guide08.pdf . Acesso: 19/01/09.
Correspondência:
Datas de Publicação
-
Publicação nesta coleção
13 Abr 2009 -
Data do Fascículo
Abr 2009
Histórico
-
Aceito
26 Jan 2009 -
Recebido
14 Out 2008