Resumos
O valor clínico dos marcadores tumorais séricos em câncer de pulmão é incerto. Objetivos: Avaliar a associação da concentração sérica de marcadores tumorais com a extensão da neoplasia e seu valor prognóstico. Casuística e método: Entre fevereiro de 1995 e setembro de 1997 foram estudados 103 pacientes, no Departamento de Cirurgia Torácica do Hospital do Câncer. Antes do tratamento os pacientes foram submetidos à coleta de sangue para dosagem da concentração do CEA, CYFRA21.1, CA15.3, CA19.9, CA72.4 e NSE. Resultados: O CYFRA21.1 foi o marcador mais freqüentemente elevado (55%). Os pacientes com neoplasia avançada tiveram concentração sérica média do CEA (90,82 ± 329,08ng/ml), CYFRA21.1 (20,34 ± 58,42ng/ml) e CA15.3 (56,54 ± 86,81U/ml) significativamente superior às observadas nos tumores localizados, respectivamente, 10,24 ± 35,96ng/ml, 12,67 ± 25,23ng/ml e 22,22 ± 15,86U/ml. Mesmo considerando todos os marcadores deste estudo, apenas os pacientes com CEA elevado tiveram chance 5,6 vezes maior de ser portadores de neoplasia avançada, quando comparados com aqueles com CEA normal. A sobrevida foi influenciada pelo performance status (p = 0,001), extensão anatômica (p = 0,006), concentração aumentada do CEA (p = 0,043), mais que dois marcadores aumentados (p < 0,001) e tipo de tratamento (p < 0,001). O valor prognóstico da extensão da neoplasia atingiu o limite da significância (p = 0,052); entretanto, a presença de mais do que dois marcadores aumentados e a modalidade terapêutica tiveram valor prognóstico independente (respectivamente, p = 0,035 e p = 0,005). Conclusões: Nenhum dos marcadores tumorais séricos avaliados apresenta utilidade clínica no manejo dos pacientes com CNPCP.
marcadores biológicos de tumores; estadiamento de neoplasias; carcinoma pulmonar de células não-pequenas; prognóstico
The usefulness of serum tumor markers in lung cancer is not well defined. Objective: The aim of this study is to examine the correlation between serum tumor markers and tumor extension and its prognostic value. Patients and method: From February 1995 to September 1997, 103 patients with non-small cell lung carcinoma were evaluated at the Department of Thoracic Surgery. Serum levels of CEA, CYFRA21.1, CA15.3, CA19.9, CA72.4, and NSE were determined before treatment. Results: The serum level of CYFRA21.1 was the most frequent elevated tumor marker (55%). Patients with advanced tumor had higher mean serum level of CEA (90.8 ng/ml), CYFRA21.1 (20.3 ng/ml) and CA15.3 (56.5%) than those with localized carcinoma, respectively 10.2 ng/ml, 12.6 ng/ml and 22.2 ng/ml. Considering all serum tumor markers evaluated in this study, only patients with elevated CEA had greater chance (5.6) of presenting with advanced non-small lung carcinoma than patients with normal CEA. Overall survival was influenced by performance status (p = 0.001), tumor extension (p = 0.006), elevated serum level of CEA (p = 0.043), more than two elevated serum tumor markers (p < 0.001), and type of treatment (p < 0.001). The prognostic value of anatomical tumor extension reached the limit of significance (p = 0.052); however, two or more elevated serum tumor markers and type of treatment had independent prognostic value (respectively, p = 0.035 and p = 0.005). Conclusion: None of these serum tumor markers had clinical value in the management of NSCLC patients.
biological tumor markers; neoplasm staging; non-small cell lung carcinoma; prognosis
ARTIGO ORIGINAL
Aplicação clínica dos marcadores tumorais séricos em carcinoma não-pequenas células do pulmão* * Trabalho realizado Departamento de Cirurgia Torácica do Hospital do Câncer A.C. Camargo ¾ Fundação Antonio Prudente, São Paulo ¾ SP.
JEFFERSON LUIZ GROSS1 * Trabalho realizado Departamento de Cirurgia Torácica do Hospital do Câncer A.C. Camargo ¾ Fundação Antonio Prudente, São Paulo ¾ SP. , RIAD NAIM YOUNES2 * Trabalho realizado Departamento de Cirurgia Torácica do Hospital do Câncer A.C. Camargo ¾ Fundação Antonio Prudente, São Paulo ¾ SP. , JOSÉ ALEXANDRE MARZAGÃO BARBUTO3 * Trabalho realizado Departamento de Cirurgia Torácica do Hospital do Câncer A.C. Camargo ¾ Fundação Antonio Prudente, São Paulo ¾ SP. , FABIO JOSÉ HADDAD1 * Trabalho realizado Departamento de Cirurgia Torácica do Hospital do Câncer A.C. Camargo ¾ Fundação Antonio Prudente, São Paulo ¾ SP. , DANIEL DEHENZELIN1 * Trabalho realizado Departamento de Cirurgia Torácica do Hospital do Câncer A.C. Camargo ¾ Fundação Antonio Prudente, São Paulo ¾ SP.
O valor clínico dos marcadores tumorais séricos em câncer de pulmão é incerto. Objetivos: Avaliar a associação da concentração sérica de marcadores tumorais com a extensão da neoplasia e seu valor prognóstico. Casuística e método: Entre fevereiro de 1995 e setembro de 1997 foram estudados 103 pacientes, no Departamento de Cirurgia Torácica do Hospital do Câncer. Antes do tratamento os pacientes foram submetidos à coleta de sangue para dosagem da concentração do CEA, CYFRA21.1, CA15.3, CA19.9, CA72.4 e NSE. Resultados: O CYFRA21.1 foi o marcador mais freqüentemente elevado (55%). Os pacientes com neoplasia avançada tiveram concentração sérica média do CEA (90,82 ± 329,08ng/ml), CYFRA21.1 (20,34 ± 58,42ng/ml) e CA15.3 (56,54 ± 86,81U/ml) significativamente superior às observadas nos tumores localizados, respectivamente, 10,24 ± 35,96ng/ml, 12,67 ± 25,23ng/ml e 22,22 ± 15,86U/ml. Mesmo considerando todos os marcadores deste estudo, apenas os pacientes com CEA elevado tiveram chance 5,6 vezes maior de ser portadores de neoplasia avançada, quando comparados com aqueles com CEA normal. A sobrevida foi influenciada pelo performance status (p = 0,001), extensão anatômica (p = 0,006), concentração aumentada do CEA (p = 0,043), mais que dois marcadores aumentados (p < 0,001) e tipo de tratamento (p < 0,001). O valor prognóstico da extensão da neoplasia atingiu o limite da significância (p = 0,052); entretanto, a presença de mais do que dois marcadores aumentados e a modalidade terapêutica tiveram valor prognóstico independente (respectivamente, p = 0,035 e p = 0,005). Conclusões: Nenhum dos marcadores tumorais séricos avaliados apresenta utilidade clínica no manejo dos pacientes com CNPCP.
Clinical application of serum tumor markers in patients with non-small cell lung carcinoma
The usefulness of serum tumor markers in lung cancer is not well defined. Objective: The aim of this study is to examine the correlation between serum tumor markers and tumor extension and its prognostic value. Patients and method: From February 1995 to September 1997, 103 patients with non-small cell lung carcinoma were evaluated at the Department of Thoracic Surgery. Serum levels of CEA, CYFRA21.1, CA15.3, CA19.9, CA72.4, and NSE were determined before treatment. Results: The serum level of CYFRA21.1 was the most frequent elevated tumor marker (55%). Patients with advanced tumor had higher mean serum level of CEA (90.8 ng/ml), CYFRA21.1 (20.3 ng/ml) and CA15.3 (56.5%) than those with localized carcinoma, respectively 10.2 ng/ml, 12.6 ng/ml and 22.2 ng/ml. Considering all serum tumor markers evaluated in this study, only patients with elevated CEA had greater chance (5.6) of presenting with advanced non-small lung carcinoma than patients with normal CEA. Overall survival was influenced by performance status (p = 0.001), tumor extension (p = 0.006), elevated serum level of CEA (p = 0.043), more than two elevated serum tumor markers (p < 0.001), and type of treatment (p < 0.001). The prognostic value of anatomical tumor extension reached the limit of significance (p = 0.052); however, two or more elevated serum tumor markers and type of treatment had independent prognostic value (respectively, p = 0.035 and p = 0.005). Conclusion: None of these serum tumor markers had clinical value in the management of NSCLC patients.
Descritores ¾ marcadores biológicos de tumores, estadiamento de neoplasias, carcinoma pulmonar de células não-pequenas, prognóstico
Key words ¾ biological tumor markers, neoplasm staging, non-small cell lung carcinoma, prognosis
CEA ¾ Antígeno carcinoembrionário
CYFRA21.1 ¾ Fragmento de citoqueratina 19
NSE ¾ Enolase neurônio específica
CNPCP ¾ Carcinoma não pequenas células do pulmão
INTRODUÇÃO
O carcinoma não-pequenas células do pulmão (CNPCP) representa um desafio para os oncologistas, pois, mesmo no estádio clínico precoce, a sobrevida em cinco anos varia de 60% a 80%(1,2). Os principais fatores determinantes do prognóstico em CNPCP são o índice de performance status, o estadiamento clínico e a perda de peso(3). A terapêutica adjuvante para estes pacientes ainda não mostrou benefícios claros(4,5).
O valor clínico dos marcadores tumorais séricos em CNPCP ainda não está bem definido(6). Os principais marcadores estudados nestes pacientes são antígeno carcinoembrionário (CEA), fragmento de citoqueratina 19 (CYFRA21.1), antígeno polipeptídico tecidual (TPA), antígeno do carcinoma de células escamosas (SCC-Ag), enolase neurônio específica (NSE), e cromogranina A (Chr A)(7). O valor destes marcadores na determinação do estadiamento e do prognóstico é controverso. A concentração sérica do CEA não parece ter valor prognóstico independente nos pacientes com CNPCP(8-10). Estudos mais recentes sugerem que o CYFRA21.1 seja determinante do prognóstico, principalmente nos carcinomas espinocelulares(10-13). A NSE também tem sido estudada em pacientes com CNPCP e o seu valor prognóstico é controverso(10,14,15). A concentração sérica de outros marcadores, como o CA15.3, CA19.9 e o CA72.4 ainda foi muito pouco estudada em pacientes com CNPCP.
Os objetivos do presente estudo são: 1) avaliar a associação entre a concentração sérica dos marcadores tumorais (CYFRA21.1, CEA, CA19.9, CA15.3, CA72.4, NSE) com a extensão anatômica do CNPCP; 2) avaliar o valor prognóstico dos marcadores tumorais séricos neste grupo de pacientes.
CASUÍSTICA E MÉTODO
Casuística: Entre fevereiro de 1995 e setembro de 1997, foram estudados 103 pacientes admitidos no Departamento de Cirurgia Torácica do Hospital do Câncer A.C. Camargo. Foram excluídos os pacientes que receberam tratamento oncológico prévio e aqueles com segunda neoplasia sincrônica ou metacrônica. As características clínicas dos pacientes estudados estão demonstradas na Tabela 1.
Todos os pacientes foram submetidos a exame físico, tomografia computadorizada (TC) do tórax, abdome superior e crânio, mapeamento ósseo e broncoscopia(16). Os pacientes foram estadiados segundo o modelo proposto por Mountain em 1997(1), sendo definido o estadiamento clínico para todos os pacientes. O estadiamento patológico foi determinado apenas para os doentes submetidos à cirurgia. Conforme o estadiamento, os pacientes foram classificados em: CNPCP localizado (estádios IA até IIIA), 29 pacientes (28,2%), e CNPCP avançado (estádios IIIB e IV), 74 pacientes (71,8%).
Antes de iniciar qualquer tratamento foi determinada a concentração sérica dos seguintes marcadores tumorais: CYFRA21.1, CEA, CA19.9, CA15.3, CA72.4 e NSE.
Os resultados da dosagem sérica dos marcadores tumorais não influenciou na decisão terapêutica. Conforme o tratamento empregado, os pacientes foram divididos em três grupos: 40 pacientes (38,3%) receberam tratamento loco-regional (cirurgia e/ou radioterapia); 38 pacientes (36,7%) foram submetidos a tratamento sistêmico (quimioterapia) e 25 pacientes (24,3%) foram tratados apenas paliativamente.
O tempo mediano de seguimento foi de 8,5 meses, variando de 0,3 até 40,6 meses.
Método: Logo após a admissão, todos os pacientes foram submetidos à coleta de sangue periférico no laboratório de Patologia Clínica do Hospital do Câncer e, conforme os valores de referência do kit de dosagem (Byk-Sangtek, Bromme ¾ Sweden), foram considerados como limite superior do normal os seguintes valores: 3,3ng/ml para o CYFRA21.1; 5ng/ml para o CEA; 37U/ml para o CA19.9; 30U/ml para o CA15.3; 4U/ml para o CA72.4 e 12,5mg/ml para a NSE.
Devido à não disponibilidade constante dos kits para dosagem, a concentração sérica de todos os marcadores não pode ser determinada em todos os pacientes. A NSE foi dosada em 98 pacientes, o CYFRA21.1 e o CEA em 99 pacientes, o CA15.3 e o CA72.4 em 100 pacientes, e o CA19.9 em 102 pacientes.
De acordo com a concentração sérica de cada um dos marcadores tumorais, os pacientes foram classificados em dois grupos: marcador normal ou marcador aumentado. Conforme o número de marcadores elevados, os pacientes também foram divididos em dois grupos: até dois marcadores elevados e acima de dois marcadores aumentados.
Análise estatística: Os valores médios das concentrações séricas dos marcadores conforme a extensão do CNPCP foram comparados através do teste U de Mann-Whitney(17). Os valores medianos foram comparados entre os grupos avançado e localizado através do teste da mediana.
Foi realizada avaliação de fatores de risco para CNPCP avançado conforme a concentração sérica dos marcadores tumorais, através de modelos de regressão logística.
A sobrevida atuarial foi calculada através do método de Kaplan-Meier (1958)(18). As curvas de sobrevida foram comparadas pelo teste de log rank(19). A análise dos fatores prognósticos foi feita através do modelo de riscos proporcionais de Cox (1972)(20).
As diferenças foram consideradas significativas quando p < 0,05.
A análise estatística foi feita com auxílio do programa estatístico computadorizado SPSS para Windows (versão 7.0)(21).
RESULTADOS
A distribuição dos pacientes conforme a concentração sérica dos marcadores está demonstrada na Tabela 2.
Analisando os pacientes conforme a extensão da neoplasia observou-se que a concentração sérica do CYFRA21.1, do CEA e do CA15.3 foi significativamente maior nos pacientes com CNPCP avançado (Tabela 3).
A concentração sérica inicial de cada um dos marcadores foi utilizada para calcular o risco do paciente ser portador de CNPCP avançado. Verificou-se que os pacientes com CEA aumentado tiveram risco seis vezes maior de ter CNPCP avançado. Mesmo considerando a concentração sérica de todos os marcadores tumorais, o CEA foi o único que determinou risco significativamente maior de tumor avançado (Tabela 4): os pacientes com concentração do CEA aumentada tiveram 5,6 vezes mais chance de ser portadores de CNPCP avançado.
A sobrevida global estimada em 40 meses foi de 8,4%, com mediana de 9,97 meses, conforme demonstrado na Figura 1.
A análise univariada das características clínicas pré-tratamento determinantes da sobrevida evidenciou que os pacientes com baixo índice de performance status e aqueles com CNPCP avançado tiveram pior sobrevida (Tabela 5).
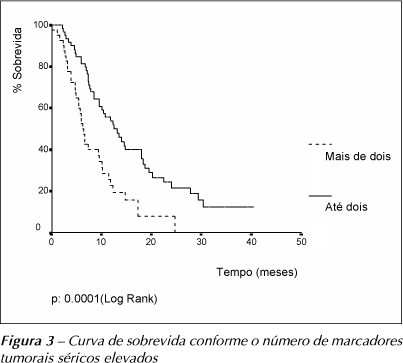
Na Tabela 6 está representada a análise univariada do valor prognóstico dos marcadores tumorais séricos. Entre os marcadores tumorais, de forma isolada, o CEA elevado foi o único associado a pior sobrevida. Os doentes que apresentavam mais do que dois marcadores elevados tiveram sobrevida significativamente menor que os pacientes que tinham até dois marcadores séricos aumentados.
O tipo de tratamento empregado influenciou na determinação da sobrevida: os pacientes que receberam apenas tratamento paliativo tiveram pior sobrevida mediana (4,73 meses) que aqueles que receberam tratamento sistêmico (10,07 meses) ou loco-regional (12,50 meses), com p < 0,001.
As curvas de sobrevida conforme a concentração sérica do CEA e segundo o número de marcadores aumentados estão representadas nas Figuras 2 e 3.
Na análise multivariada dos fatores prognósticos, observou-se que apenas o número de marcadores aumentados e o tipo de tratamento tiveram valor prognóstico independente (Tabela 7). Os pacientes com mais do que dois marcadores aumentados tiveram risco de morrer 2,8 vezes maior que os com até dois marcadores aumentados. Em relação ao tipo de tratamento, os pacientes submetidos apenas a tratamento paliativo tiveram risco de morrer 3,38 vezes maior que os submetidos a tratamento sistêmico.
DISCUSSÃO
A aplicação clínica dos marcadores tumorais séricos em pacientes com CNPCP ainda não está definida, apesar de algumas de suas potenciais utilidades já terem sido pesquisadas(22).
Os marcadores tumorais séricos podem auxiliar no manejo clínico dos pacientes com câncer de pulmão quando fornecem informações relativas ao diagnóstico, estadiamento, resposta terapêutica, detecção de recidiva e prognóstico. Nenhum marcador isoladamente é capaz de fornecer todas estas informações. Por este motivo, também estudamos o valor da associação de vários marcadores tumorais séricos, analisando a sua capacidade de detectar os pacientes com neoplasia avançada e de estimar o prognóstico dos doentes com CNPCP.
O CEA, o CYFRA21.1 e a NSE são os marcadores séricos mais avaliados nos pacientes com carcinoma broncogênico(7). No presente estudo, além destes marcadores, também foram incluídos o CA19.9, CA15.3 e o CA72.4, sobre os quais se têm poucas informações.
Certos marcadores podem estar associados a neoplasias de determinado sítio anatômico, mas não existe um marcador tumoral específico para CNPCP(22). Mais recentemente o CYFRA21.1 foi descrito como um marcador que se eleva principalmente em pacientes com carcinoma pulmonar(23), embora possa estar aumentado também em outras doenças(24). Em nosso estudo o CYFRA21.1 foi o marcador que mais se elevou (53,5%), semelhante ao descrito por outros autores (40% a 66%)(10,25-27). O CEA se eleva, principalmente nos carcinomas colorretal e pancreático(28); entretanto, é descrito como elevado em 40% até 80% dos pacientes com CNPCP(7). A NSE eleva-se mais comumente nas neoplasias da linhagem neuroendócrina; no câncer de pulmão, está mais freqüentemente aumentada nos pacientes com carcinoma de pequenas células(29). Entretanto, seu aumento tem sido observado em 10% a 40% dos pacientes com CNPCP(7,10,30), sugerindo que as células do CNPCP podem ter diferenciação neuroendócrina(31). O CA72.4 está aumentado mais freqüentemente nos tumores malignos do trato digestivo(32). O aumento do CA15.3 é mais observado em pacientes com câncer de mama(33) e sua concentração sérica foi muito pouco estudada em pacientes com CNPCP. O CA19.9 foi descrito em poucas séries de pacientes com CNPCP(10,28), em que estava elevado em cerca de 15% dos casos, semelhante ao observado em nossa casuística (14,7%), na qual foi o marcador que menos comumente se elevou.
A definição da modalidade de tratamento a ser empregada nos pacientes com CNPCP fundamenta-se no seu estadiamento. Desta forma, a pesquisa da associação dos marcadores tumorais séricos com a extensão anatômica do CNPCP tem por objetivo identificar marcadores que traduzam a extensão da neoplasia e assim possam ser utilizados no processo de escolha da melhor terapêutica. O CYFRA21.1, o CEA e o CA15.3 foram os marcadores que se correlacionaram com a extensão do CNPCP. A concentração sérica do CYFRA21.1 vem sendo descrita como significativamente elevada nos pacientes com CNPCP avançado(11,12,25,34,35). Em 1995, Seregni et al.(36) observaram que a concentração sérica do CYFRA21.1 estava aumentada em 81,5% dos pacientes com CNPCP avançado (EC IIIB e IV), e em 56% dos doentes com CNPCP localizado (EC I até IIIA). Com base nestes resultados propuseram que a concentração sérica do CYFRA21.1 pudesse classificar os pacientes em potencialmente operáveis e inoperáveis. Resultados semelhantes foram observados por Bréchot et al. (1997)(10); entretanto, os autores observaram que a concentração sérica do CYFRA21.1 não foi capaz de identificar todos os pacientes cirurgicamente ressecáveis. Em relação ao CEA os resultados são mais controversos, sendo relatado seu aumento nos pacientes com CNPCP avançado(37,38), enquanto outros estudos não observaram esta mesma associação(10,36,39). O CA15.3 foi pouco estudado em CNPCP; neste sentido, o presente estudo é pioneiro em observar a associação do CA15.3 com a extensão anatômica do carcinoma broncogênico, sugerindo que este marcador possa ser útil para ajudar na determinação do estadiamento do CNPCP. Outros autores também demonstraram que as concentrações séricas do CA72.4 e da NSE não se correlacionam com o estadiamento do CNPCP(10,29).
Embora tenha sido verificado que a concentração sérica do CYFRA21.1, do CEA e da CA15.3 estavam aumentadas nos pacientes com CNPCP avançado, não se podem selecionar os pacientes como potencialmente operáveis ou como inoperáveis com base neste critério, porque mesmo com estes marcadores normais alguns pacientes apresentavam doença avançada, assim como a sua concentração pode estar elevada em pacientes potencialmente operáveis. Desta maneira, o aumento da concentração sérica destes marcadores pode ser útil para identificar os pacientes com maior risco de CNPCP avançado e que podem requerer investigação mais cuidadosa na pesquisa de metástases, mas não devem ser considerados na decisão terapêutica.
A sobrevida em cinco anos para os pacientes com CNPCP permanece em 13% ao longo das últimas décadas(1). A baixa sobrevida estimada na presente casuística (8,4% em 40 meses) deve-se ao grande número de pacientes tratados apenas paliativamente (24,3%). O CYFRA21.1 vem sendo apontado como fator prognóstico independente em alguns estudos(10-12), porém Niklinski et al. (1995)(13) observaram que este marcador não teve valor prognóstico superior ao do estadiamento clínico. Em relação ao CEA os principais estudos relatam seu valor prognóstico apenas em análise univariada dos fatores prognósticos(8,10). A influência dos demais marcadores no prognóstico dos pacientes com CNPCP foi pouco estudada até ao momento. Em nossa casuística apenas o CEA teve valor prognóstico na análise univariada; entretanto, quando considerados na análise multivariada, nenhum marcador isolado teve valor prognóstico independente. A presença de mais do que dois marcadores elevados esteve correlacionada com pior sobrevida, independente do tipo de tratamento empregado, sugerindo que o aumento da concentração de vários marcadores traduz comportamento mais agressivo do CNPCP.
CONCLUSÕES
O CYFRA21.1 foi o marcador que se elevou com maior freqüência. Os pacientes com nível sérico aumentado do CEA têm maior risco de apresentar CNPCP avançado, sugerindo que nestes pacientes a pesquisa de metástases seja realizada de maneira mais intensiva. Isoladamente, nenhum marcador sérico foi capaz de estimar o prognóstico, porém a presença de mais do que dois marcadores aumentados teve valor prognóstico independente. O papel real da determinação da concentração sérica dos marcadores tumorais em CNPCP avaliados no presente estudo parece ser marginal; portanto, não são recomendados em nenhuma situação no manejo clínico dos pacientes com CNPCP.
1. Médico assistente do Departamento de Cirurgia Torácica do Hospital do Câncer A.C. Camargo.
2. Chefe do Departamento de Cirurgia Torácica do Hospital do Câncer A.C. Camargo; Professor Livre-Docente da Universidade Paulista e da Faculdade de Medicina da Universidade de São Paulo.
3. Professor Doutor do Departamento de Imunologia do Instituto de Ciências Biológicas da Universidade de São Paulo.
Endereço para correspondência ¾ Jefferson Luiz Gross, Rua Professor Antônio Prudente, 211 ¾ 01509-010 ¾ São Paulo, SP. Tel.: (11) 3272-5120; fax: (11) 3272-5088; E-mail: jefgross@uol.com.br
Recebido para publicação em 13/3/00. Aprovado, após revisão, em 3/5/00.
- 1. Mountain CF. Revisions in the international system for staging lung cancer. Chest 1997;111:1710-1717.
- 2. Naruke T, Tsuchiya R, Kondo H, Asamura H, Nakayama H. Implications of staging lung cancer. Chest 1997;112:S242-S248.
- 3. Langer CJ, Rosvold E. Prognostic factors for patients with non-small cell lung cancer. Curr Probl Cancer 1996;4:272-278.
- 4. Feld R. Chemotherapy as adjuvant therapy in completely resected non-small cell lung cancer: have we made progress? J Clin Oncol 1996; 14:1045-1047.
- 5. Johnson DH. Adjuvant therapy for non-small cell lung cancer. Chest 1994;106:S313-S317.
- 6. Splinter TAW. Serum tumor markers and management of non-small cell lung cancer. Lung Cancer 1995;13:177-179.
- 7. Ferrigno D, Buccheri G. Clinical applications of serum markers for lung cancer. Respir Med 1995;89:587-597.
- 8. Ferrigno D, Buccheri GF. A comprehensive evaluation of serum ferritin levels in lung cancer patients. Lung Cancer 1992;8:85-94.
- 9. Buccheri GF, Ferrigno D, Vola F. Carcinoembryonic antigen (CEA), tissue polypeptide antigen (TPA) and other prognostic indicators in the squamous cell carcinoma of the lung. Lung Cancer 1993;10:21-33.
- 10. Bréchot JM, Chevret S, Nataf J, Le Gail C, Frétaut J, Rochemaure J, Chastang C. Diagnostic and prognostic value of CYFRA21.1 compared with other tumor markers in patients with non-small cell lung cancer; a prospective study of 116 patients. Eur J Cancer 1997;33: 385-391.
- 11. Pujol JL, Grenier J, Parrat E, Lehmann M, Lafontaine T, Quantin X, Michel FB. Cytokeratins as serum tumor markers in lung cancer: a comparison of CYFRA21.1 and TPS. Am J Respir Crit Care Med 1996;154:725-733.
- 12. Takey Y, Minato K, Tsuchiya S, Takise A, Nakano H, Ezawa K. CYFRA21.1: an indicator of survival and therapeutic effect in lung cancer. Oncology 1997;54:43-47.
- 13. Niklinski J, Furman M, Chyczewski E, Chyczewski L, Rogowaki F, Laudanski J. Diagnostic and prognostic value of the new tumor marker CYFRA21.1 in patients with squamous cell lung cancer. Eur Respir J 1995;8:291-294.
- 14. Graziano SL, Mazid R, Newman N, Tatun A, Oler A, Mortimer JA, Gullo JJ, Difino SM, Scalco AJ. The use of neuroendocrine immunoperoxidase markers to predict chemotherapy response in patients with non-small cell lung cancer. J Clin Oncol 1989;7:1398-1406.
- 15. Zandwijk N, Jassen E, Johannes MG, Mooi WJ, Tinteren H. Serum neuron-specific enolase and lactate dehydrogenase as a predictor of response to chemotherapy and survival in non-small cell lung cancer. Semin Oncol 1992:19(Suppl 2):37-43.
- 16. Younes RN, Chojniak R, Lima ENP. Papel da tomografia computadorizada de tórax e de abdome superior no estadiamento de pacientes com câncer de pulmão: avaliação prospectiva. Acta Oncol Bras 1995; 15:57.
- 17. Dawson-Saunders B, Trapp RG. Basic and clinical biostatistics. Norwalk, Appleton & Lange, 1994;117-126.
- 18. Kaplan EL, Meier P. Non parametric estimation from incomplete observations. J Am Stat Assoc 1958;53:457-481.
- 19. Peto R, Pike MC. Design and analysis of randomized clinical trials requiring prolonged observation of each patient: II: analysis and examples. Br J Cancer 1977;35:1-39.
- 20. Cox DR. Regression models and life tables (with discussion). J R Stat Soc Ser B 34:187-220.
- 21. SPSS for Windows. Version 7.0. Chicago, IL: SPSS, 1995.
- 22. Strauss GM, Skarin AT. Use of tumor markers in lung cancer. Hematol Oncol Clin North Am 1994;8:507-532.
- 23. Broers JLV, Ramaekers FCS, Rot MK, Oostendorp T, Huysmans A, Van Muijen GN, Wagenaar SS, Vooljs GP. Cytokeratins in different types of human lung cancer as monitored by chain-specific monoclonal antibodies. Cancer Res 1988;48:3221-3229.
- 24. Narita T, Funahashi H, Satoh Y, Imai T, Tagaki H. Fragment of cytokeratin subunit 19 (CYFRA21.1) in the sera of breast cancer patients. Jpn J Cancer Chemother 1993;20:2075-2077.
- 25. Stieber P, Hasholzner U, Bodemmüller H, Nagel D, Sunder-Plasmann L, Dienemann H, Meier W, Fateh-Moghadam A. CYFRA21.1 a new marker in lung cancer. Cancer 1993;7:707-713.
- 26. Pujol JL, Grenier J, Daures JP, Daver A, Pujol H, Michel FB. Serum fragment of cytokeratin subunit 19 measured by CYFRA21.1: immunoradiometric assay as a marker of lung cancer. Cancer Res 1993; 53:61-66.
- 27. Ebert W, Dienemann H, Fateh-Moghadam A, Scheulen M, Konietzko N, Schleich, Bombardieri E. Cytokeratin 19 fragment CYFRA21.1 compared with carcynoembrionic antigen and neuron-specific enolase in lung cancer: results of an international multicentre study. Eur J Clin Chem Clin Biochem 1994;32:189-199.
- 28. Ritts RE, Villano BC, Go VLW, Heberman RB, Klug TL, Zuraski VR. Initial clinical evaluation of an imunoradiometric assay for CA19.9 using the NCI bank serum. Int J Cancer 1984;33:339-345.
- 29. Burghuber OC, Worokfka B, Schunthaner G, Vetter N, Neumann M, Dudczak R, Kuzmits R. Serum neuron-specific enolase is a useful tumor marker for small cell lung cancer. Cancer 1990;65:1386-1390.
- 30. Gazdar AF, Carney DN, Becker KL, Deftos LJ, Liang V, Go W, Marangos PJ, Moody TW, Wolsen AR, Zweig, MH. Expression of peptide and other markers in lung cancer cell lines. Recent Results Cancer Res 1985;99:167-174.
- 31. Baylin SB, Mendelsohn G. Ectopic (inappropriate) hormone production by tumors: mechanisms involved and the biological and clinical implications. Endocr Rev 1980;1:45-77.
- 32. Hepner G, Domschke A, Domschke B. Comparison of CA72.4 with CA19.9 and CEA in the sero diagnosis of gastrintestinal malignancies. Scand J Gastroenterol 1986;24:745-750.
- 33. Colomer R, Ruibal A, Salvador L. Circulating tumor markers levels in advanced breast carcinoma correlated with the extent of metastatic disease. Cancer 1989;64:1674-1681.
- 34. Wieskopf B, Demangeat C, Purohit A, Stenger R, Gries P, Kreisman H, Quoix E. CYFRA21.1 as a biological marker of non-small cell lung cancer, evaluation of sensitivity, specificity, and prognostic role. Chest 1995;108:163-169.
- 35. Niklinski J, Furman M, Burzykowski T, Chyczewski L, Laudanski J, Chczewski E, Rapellino M. Preoperative CYFRA21.1 level as a prognostic indicator in resected primary squamous cell lung cancer. Br J Cancer 1996;74:956-960.
- 36. Seregni E, Botti A, Bogni E, Bombardieri E. Tumour marker evaluation in patients with lung cancer. Scand J Clin Lab Invest 1995;55 (Suppl 221):67-71.
- 37. Rasmuson T, Bjork GR, Dambe L, Holm SE, Jacobson L, Jepsson A, Stingbrand T, Westamn G. Tumour marker in bronchogenic carcinoma. Acta Radiol Oncol 1983;22:209-214.
- 38. Hansen M. Serum tumour marker in lung cancer. Scand J Clin Lab Invest 1991;(Suppl 206):93-101.
- 39. Vincent RG, Chu TM, Fargen TB, Ostrander M. Carcinoembryonic antigen in 228 patients with carcinoma of the lung. Cancer 1975; 36: 2069-2076.
Datas de Publicação
-
Publicação nesta coleção
20 Ago 2003 -
Data do Fascículo
Ago 2000
Histórico
-
Aceito
03 Maio 2000 -
Recebido
13 Mar 2000