Resumos
A pesquisa teve o objetivo de avaliar a ultra-estrutura dos ovaríolos de Tropidacris collaris (Stoll), submetido aos fotoperíodos de 10L:14E, 12L:12E e 14L:10E. Foram utilizadas 60 ninfas (30 machos e 30 fêmeas) no último estágio de desenvolvimento, sendo colocados 10 casais em cada tratamento. Trinta dias após atingirem o estágio adulto, as fêmeas foram sedadas com éter etílico e dissecadas sob estereomicroscópio. Os ovaríolos foram fixados em Karnovsky (glutaraldeido 2,5%, paraformaldeído 4% e tampão cacodilato de sódio 0,1 M) e analisados em microscopia eletrônica de transmissão e varredura. Os resultados mostraram não haver influência dos fotoperíodos sobre a ultra-estrutura dos ovaríolos, onde estes apresentaram-se revestidos por uma bainha espessa constituída por um material homogêneo e filamentoso. Na região do filamento terminal observaram-se células com núcleos volumosos, algumas com citoplasma escasso, além de estruturas filamentosas assumindo característica de tecido conjuntivo. No germário, as células germinativas são maiores, com núcleos volumosos, escassos citoplasma e membrana celular com interdigitações. As células foliculares são menores com núcleo pequeno, apresentando ainda projeções citoplasmáticas. No vitelário as células foliculares sofrem modificações na sua morfologia, variando de cúbica a achatada.
Gafanhoto; aparelho reprodutor feminino; ovário; morfologia
The research evaluated the ultrastructure of the ovarioles of Tropidacris collaris (Stoll), submitted to photoperiods 10L:14D, 12L:12D and 14L:10D. Sixty nymphs (30 males and 30 females) in the last stage of development were paired in ten couples in each treatment. Thirty days after adult emergence, the females were immobilized with ethylic ether and dissected under stereomicroscope. The ovarioles were transferred to Karnovsky fixative (2.5% glutaraldehyde, 4% paraformaldehyde and 0.1 M sodium cacodylate buffer) and analyzed in transmission and scanning electron microscopes. The different photoperiods had no effect on the ovarioles' ultrastructure. Each ovariole is covered by a thick sheath constituted by a homogeneous and filamentous material. In the terminal filament, there are cells with large nuclei, some with scarce cytoplasm and projections cytoplasmatic, besides filamentous structures assuming characteristic of conjunctive tissue. In the germarium, the germ cells are big with large nuclei, scarce cytoplasm and plasma membrane containing interdigitations. The follicular cells are small with a small nucleus, yet presenting cytoplasmatic projections. In the vitellarium the follicular cells suffer modifications in their morphology varying from cubic to flat.
Grasshopper; female reproductive system; ovary; morphology
SYSTEMATICS, MORPHOLOGY AND PHYSIOLOGY
Ultra-estrutura dos ovaríolos de Tropidacris collaris (Stoll) (Orthoptera: Romaleidae) submetido a três fotoperíodos
Ultrastructure of the ovarioles of Tropidacris collaris (Stoll) (Orthoptera: Romaleidae) submitted to three photoperiods
Fabiana D. SantosI; Antônio F.S.L. VeigaII; Fabio A.B. SantosIII; Jorge B. TorresIV; Álvaro A.C. TeixeiraI; Valéria Wanderley-TeixeiraI
IDepto. Morfologia e Fisiologia Animal, Área de Histologia, valeria@ufrpe.br
IIDepto. Biologia, Área de Zoologia
IIICentro de Pesquisas Aggeu Magalhães CPqAM/Fiocruz, Av. Professor Moraes Rego, s/n Cidade Universitária 50.670-420, Recife, PE
IVDepto. Agronomia, Programa de Pós-Graduação em Entomologia Agrícola Univ. Federal Rural de Pernambuco 52171-900, Recife, PE
RESUMO
A pesquisa teve o objetivo de avaliar a ultra-estrutura dos ovaríolos de Tropidacris collaris (Stoll), submetido aos fotoperíodos de 10L:14E, 12L:12E e 14L:10E. Foram utilizadas 60 ninfas (30 machos e 30 fêmeas) no último estágio de desenvolvimento, sendo colocados 10 casais em cada tratamento. Trinta dias após atingirem o estágio adulto, as fêmeas foram sedadas com éter etílico e dissecadas sob estereomicroscópio. Os ovaríolos foram fixados em Karnovsky (glutaraldeido 2,5%, paraformaldeído 4% e tampão cacodilato de sódio 0,1 M) e analisados em microscopia eletrônica de transmissão e varredura. Os resultados mostraram não haver influência dos fotoperíodos sobre a ultra-estrutura dos ovaríolos, onde estes apresentaram-se revestidos por uma bainha espessa constituída por um material homogêneo e filamentoso. Na região do filamento terminal observaram-se células com núcleos volumosos, algumas com citoplasma escasso, além de estruturas filamentosas assumindo característica de tecido conjuntivo. No germário, as células germinativas são maiores, com núcleos volumosos, escassos citoplasma e membrana celular com interdigitações. As células foliculares são menores com núcleo pequeno, apresentando ainda projeções citoplasmáticas. No vitelário as células foliculares sofrem modificações na sua morfologia, variando de cúbica a achatada.
Palavras-chave: Gafanhoto, aparelho reprodutor feminino, ovário, morfologia
ABSTRACT
The research evaluated the ultrastructure of the ovarioles of Tropidacris collaris (Stoll), submitted to photoperiods 10L:14D, 12L:12D and 14L:10D. Sixty nymphs (30 males and 30 females) in the last stage of development were paired in ten couples in each treatment. Thirty days after adult emergence, the females were immobilized with ethylic ether and dissected under stereomicroscope. The ovarioles were transferred to Karnovsky fixative (2.5% glutaraldehyde, 4% paraformaldehyde and 0.1 M sodium cacodylate buffer) and analyzed in transmission and scanning electron microscopes. The different photoperiods had no effect on the ovarioles' ultrastructure. Each ovariole is covered by a thick sheath constituted by a homogeneous and filamentous material. In the terminal filament, there are cells with large nuclei, some with scarce cytoplasm and projections cytoplasmatic, besides filamentous structures assuming characteristic of conjunctive tissue. In the germarium, the germ cells are big with large nuclei, scarce cytoplasm and plasma membrane containing interdigitations. The follicular cells are small with a small nucleus, yet presenting cytoplasmatic projections. In the vitellarium the follicular cells suffer modifications in their morphology varying from cubic to flat.
Key words: Grasshopper, female reproductive system, ovary, morphology
No Brasil, a presença e o aumento da população dos gafanhotos estão ligadas certamente ao desmatamento e aos novos tipos de manejos de culturas agroflorestais implantadas no cerrado e outras regiões (Lecoq 1991). Dentre as espécies de gafanhotos, Tropidacris collaris (Stoll) chama atenção pelo seu grande tamanho, com comprimento variando de 50 mm a 70 mm para o macho e 85 mm a 105 mm para a fêmea. Trata-se de uma espécie de importância econômica, principalmente porque causa danos à mangueira, coqueiro, abacateiro, bananeira, mandioca, algodoeiro, limoeiro, videira, seringueira e às vezes à cana-de-açúcar e arroz (Santos 1982, Duranton et al. 1987, Chagas et al. 1995).
Nas fêmeas adultas dos gafanhotos, os ovários ocupam grande parte do abdome, estendendo-se sobre o canal alimentar (Uvarov 1966, Chapman 1998). Na maioria dos insetos cada ovário é formado por um grupo de unidades cilíndricas, chamadas de ovaríolos, que convergem para o oviduto lateral (Snodgrass 1993). Cada ovaríolo é constituído pelas seguintes regiões: filamento terminal, germário, vitelário e um pedúnculo do ovaríolo ou pedicelo (Chapman 1998, Gullan & Cronston 2000, Gallo et al. 2002).
Estudos morfológicos e histológicos do aparelho reprodutor feminino têm sido relatados por vários autores, como importante instrumento para relações filogenéticas entre as espécies de insetos (Kubrakiewicz et al. 1998, Simiczyjew et al. 1998, Szklarzewicz 1998). Silva & Caetano (1991) relatam ainda que o aparelho reprodutor feminino de Orthoptera, em particular de Acrididae, tem sido discutido em termos comparativos por muitos autores, encontrando-se acentuadas variações morfológicas.
Os insetos são influenciados por vários fatores ecológicos, entre eles o fotoperíodo, levando-os a mudanças comportamentais e caracterizando os diferentes padrões relativos às suas atividades (Beck 1980). Assim, segundo Figueira et al. (2000) e Fonseca et al. (2001) a temperatura, a umidade relativa do ar e o fotoperíodo podem afetar o potencial reprodutivo e o desenvolvimento dos insetos, atuando positiva ou negativamente sobre o número de indivíduos de uma população. Várias pesquisas mostram ainda que o fotoperíodo induz ou interrompe a diapausa, torna o dia mais curto ou mais longo, afeta o desenvolvimento, a reprodução, o tamanho do ovário e a biologia de inúmeros grupos taxonômicos de insetos (Trudel et al. 2002, Velarde et al. 2002, Macedo et al. 2003). De acordo com Lenteren (1989) também a ovogênese nos insetos é controlada por fatores externos como o fotoperíodo, o que se dá através do sistema neuroendócrino, onde as condições de dias curtos levam à inativação dos corpora allata, resultando em baixos teores do hormônio juvenil e preparação para diapausa.
Tanaka & Sadoyama (1997), estudando a influência de três fotoperíodos (14L, 12L e 10L) sobre a oviposição de Nomadacris succincta L. (Orthoptera: Acrididae), verificaram que as fêmeas iniciaram a oviposição mais cedo quando submetidas ao fotoperíodo mais longo.
Assim, devido à falta de informações sobre o efeito do fotoperíodo na ovogênese de T. collaris, objetivou-se neste trabalho descrever a ultra-estrutura dos ovaríolos desse Orthoptera submetidos aos fotoperíodos 10L/14E, 12L/12E e 14L/10E, visando conhecer melhor a sua fisiologia reprodutiva para criação em laboratório.
Material e Métodos
Insetos adultos foram coletados no Município de Pombos, Agreste de Pernambuco e levados para o Laboratório de Entomologia do Departamento de Biologia da Universidade Federal Rural de Pernambuco, sendo incorporados à criação estoque. Os insetos foram mantidos em gaiolas teladas, contendo recipiente para postura e alimentados com folhas de mangueira (Mangifera indica L.), trocadas a cada dois dias.
Para realização do experimento foram utilizadas 60 ninfas (30 machos e 30 fêmeas) no último estágio de desenvolvimento, sendo colocados 10 casais em gaiolas separadas e submetidos aos seguintes tratamentos, de acordo com a metodologia de Tanaka & Sadoyama (1997): tratamento I: 10h com luz/14h sem luz; tratamento II: 12h com luz/12h sem luz; tratamento III: 14h com luz/10h sem luz.
A temperatura e umidade foram registradas por meio de termômetro de bulbo seco e bulbo úmido (higrômetro). Foram feitas três aferições diárias onde as médias obtidas para a temperatura e umidade relativa foram de 30 ± 2ºC e 72 ± 10%, respectivamente.
Os fotoperíodos foram obtidos por meio de uma modificação da técnica preconizada por Amorim & Adis (1995). Para isso, foi utilizada uma caixa de madeira, bem dimensionada (180 x 60 x 120) cm e ventilada, dividida em três compartimentos, cada um contendo lâmpadas (Phillips, modelo luz do dia, 40W) que forneceram cerca de 400 Lux na região ocupada pelos insetos. Dentro da caixa foram colocadas as gaiolas teladas com os insetos, onde foram submetidos aos respectivos tratamentos. O controle da luminosidade foi realizado por meio de um timer. A limpeza das gaiolas e a troca da alimentação dos insetos foram realizadas sempre que necessário no período de luz.
Trinta dias após atingirem o estágio adulto, as fêmeas foram anestesiadas com éter etílico e dissecadas sob estereomicroscópio (QUIMIS - modelo 1069). Os ovaríolos foram fixados em Karnovsky (glutaraldeído 2,5%, paraformaldeído 4% e tampão cacodilato de sódio 0,1 M) e levados ao Laboratório de Imunopatologia Keizo Asami (LIKA) da Universidade Federal de Pernambuco para processamento e análise em microscopia eletrônica de varredura (MEV) e transmissão (MET).
Para as observações no MEV, os ovaríolos foram lavados três vezes em tampão e pós-fixados em tetróxido de ósmio (OsO4) a 1% em tampão fosfato 0,1M pH 7,2 por 30 min, em ausência de luz a temperatura ambiente. Em seguida procedeu-se à lavagem e à desidratação em séries crescentes de etanol por 10 min cada. Os ovaríolos foram submetidos à secagem pelo método do Ponto Crítico usando CO2 líquido, metalizados com ouro coloidal durante 1 min e levados para análise em microscópio JEOL-5600LV. Os ovaríolos destinados às observações no MET foram pós-fixados por 1h em tetróxido de ósmio (OsO4) a 1%, em tampão cacodilato de sódio 0,2 M, pH 7.2, e em seguida, lavados três vezes por 10 min em tampão. Posteriormente foram desidratados em séries crescentes de acetona, 10 min cada etapa, a temperatura ambiente. A infiltração foi realizada em resina Epon e acetona em estufa a 70°C por 48h para polimerização. Os blocos foram colocados no dessecador por 24h. Os cortes ultrafinos foram obtidos em ultramicrótomo Reichert Ultracut, contrastados com acetato de uranila e citrato de chumbo e analisados em microscópio Zeiss EM 109.
Resultados
A análise da ultra-estrutura dos ovaríolos de T. collaris submetidos aos fotoperíodos de 10L, 12L e 14L indicou que os mesmos não apresentaram alterações estruturais. Os ovaríolos estão diferenciados em um curto filamento terminal, germário, vitelário e pedicelo que liga o ovaríolo ao oviduto lateral. Cada ovaríolo está revestido por uma bainha espessa constituída por um material homogêneo e filamentoso (Fig. 1).
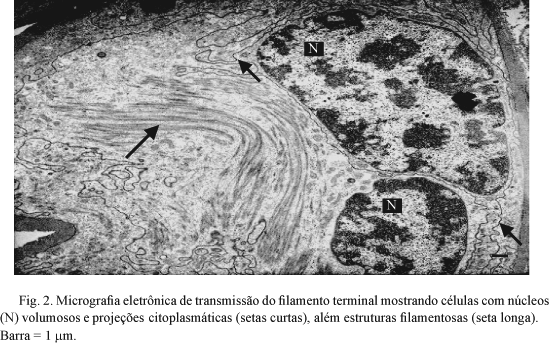
Na região do filamento terminal observam-se células com núcleos volumosos, algumas com citoplasma escasso e projeções citoplasmáticas, além de estruturas filamentosas assumindo característica de tecido conjuntivo (Fig. 2).
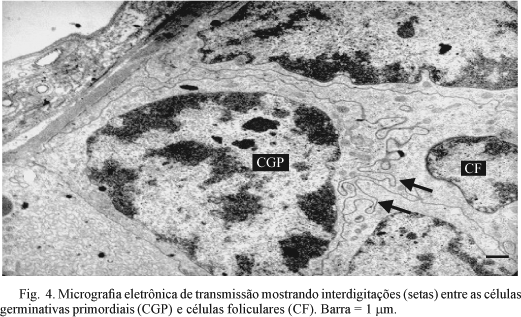
No germário é possível observar as células germinativas primordiais ou ovogônias bem unidas, não sendo evidente a presença de matriz extracelular entre elas. Essas células estão em diversos estágios de desenvolvimento associadas às células foliculares. As células germinativas primordiais são maiores com núcleos volumosos e escasso citoplasma. Sua membrana plasmática apresenta várias interdigitações na região de contato com as células foliculares. As células foliculares são menores com núcleo pequeno, apresentando ainda projeções citoplasmáticas que permite um maior contato com as células germinativas primordiais (Figs. 3 e 4).
O vitelário consiste em arranjos lineares de folículos ovarianos (ovócitos circundados por células foliculares) em vários estágios de desenvolvimento. Os folículos menos desenvolvidos encontram-se na região apical (distal) do vitelário, enquanto que os mais desenvolvidos localizam-se na base do ovaríolo. Durante a vitelogênese o volume do ovócito aumenta consideravelmente e no seu citoplasma evidenciam-se várias vesículas esféricas de vitelo e lipídio. As células foliculares apresentam morfologia variando de cúbicas a achatadas, dependendo do estágio de desenvolvimento do folículo (Figs. 5A, B e 6A , B ).
Discussão
Os ovaríolos de T. collaris apresentaram as mesmas características descritas para ovaríolos panoísticos (Rosciszewska 2001, Simiczyjew & Margas 2001, Simiczyjew 2002). No entanto, várias pesquisas têm demonstrado a interferência do fotoperíodo sobre o desenvolvimento e aspectos reprodutivos dos insetos, onde este pode atuar como fator de controle (ecofator) no número de estádios ninfais de gafanhotos em ecossistemas tropicais, mesmo sendo situados perto do equador, devido a mudanças sazonais de insolação e/ou intensidade de luz durante o ano (Amorim & Adis 1995).
Analisando o efeito do fotoperíodo sobre a reprodução em insetos, Tanaka et al. (1993), Tanaka & Sodoyama (1997) e Ekesi et al.(1999) observaram que gafanhotos Megalurothrips sjostedti (Tryborn), Nomadacris succincta L. e Locusta migratória L. quando submetidos a fotoperíodo curto apresentaram redução na produção de ovos e realizaram posturas tardias contendo ovos inférteis, além de reduzir o período de oviposição. Luker et al. (2002), analisando a resposta reprodutiva em populações de gafanhotos Romalea microptera Beavois (Orthoptera: Romaleidae), verificaram que fotoperíodos curto (11,5L/12,5E) e longo (13,75L/10,25E) não interferiram no período de oviposição, número de ovos e média de massa seca de ovos. Porém, esses autores observaram ainda que a associação do curto fotoperíodo com redução da alimentação produziu alterações nos parâmetros estudados.
Assim, a não interferência dos fotoperíodos estudados, sobre a ovogênese em T. collaris pode estar relacionada à habilidade dessa espécie de ajustar o seu potencial reprodutivo às variações fotoperiódicas.
Agradecimentos
Ao Laboratório de Imunopatologia Keiso Asami- LIKA UFPE pela obtenção das eletromicrografias e à CAPES pela concessão de bolsa ao primeiro autor, possibilitando a realização deste trabalho.
Received 08/V/06. Accepted 04/X/06.
- Amorim, M.A. & J. Adis. 1995. Desenvolvimento ninfal do gafanhoto neotropical semi-aquático Stenacris fissicauda fissicauda (Bruner, 1908) (Orthoptera: Acrididae) em condições controladas. Acta Amazônica 25: 73-92.
- Beck, S.D. 1980. Insect photoperidism. Second edition, New York, Academic Press, 387p.
- Chagas, M.C.M., M.A.B. Moreira & M.F.P. Barreto. 1995. Biological aspects of Schistocerca pallens, Stiphra robusta and Tropidacris collaris grasshoppers species at Rio Grande do Norte state, Brazil. In: International symposium on tropical fruits, Vitória, 37p.
- Chapman, R.F. 1998: The Insects: Structure and function, 4th ed. Cambridge, Cambridge University Press, 788p.
- Duranton, J.F., M. Launois, H.L. Luong, & M. Lecoq. 1987. Guia prático de luta contra os gafanhotos devastadores no Brasil. Roma, Fao-Cirad-Prifas, 343p.
- Ekesi, S., N.K. Maniania & I. Onu. 1999. Effects of temperature and photoperiod on development and oviposition of the legume Bower thrips, Megalurothrips sjostedti. Entomol. Exp. Appl. 93: 149-155.
- Figueira, F.K., C.F. Carvallho & B. Souza. 2000. Biologia e exigências térmicas de Chrysoperla externa (Hanger, 1861) (Neuropteraa: Chrysopidae) alimentada com ovos de Alabama argillacea (Hübner, 1818) (Lepidopetra: Noctuidae). Ciênc. Agrotec. 24: 319-326.
- Fonseca, A.R., C.F. Carvalho & B. Souza. 2001. Resposta funcional de Chrysoperla externa (Hanger) (Neuropteraa: Chrysopidae) alimentada com Schizuphis graminum (Rondani, 1852) (Hemiptera: Aphididae) em diferentes temperaturas. Ciênc. Agrotec. 25: 251-263.
- Gallo, D., O. Nakano, S.S. Neto, R.P.L. Carvalho, G.C. de Baptista, E.B. Filho, J.R.P. Parra, R.A. Zcchi, S.B. Alves, J.V. Vendramim, L.C. Marchini, J.R.S. Lopes & C. Omoto. 2002. Entomologia agrícola. Piracicaba, Biblioteca de Ciências Agrárias Luiz de Queirós, 920p.
- Gullan, P.J.P. & P.S. Cronston. 2000. The insects: An outline of entomology. 2nd. ed., Oxford, Blackwel Science, 470p.
- Kubrakiewicz, J., I. Jedrzejowska & S.M. Bilinsk. 1998. Neuropteroidea: Different ovary structure in related groups. Folia Histoch. Cytobiol. 36: 179-187.
- Lecoq, M. 1991. Gafanhotos do Brasil: Natureza do problema e bibliografia. Brasília, EMBRAPA, 157p.
- Lenteren, J.C. Van. 1989. Fundamental knowledge about insect reproduction: Essential to develop sustainable pest management. Invert. Reprod. Develop. 367: 1-15.
- Luker, L.A., J.D. Hatle & S.A. Juliano. 2002. Reproductive responses to photoperiod by a south Florida population of the grasshopper Romalea microptera (Orthoptera: Romaleidae). Environ. Entomol. 31: 702-707.
- Macedo, L.P.M., B. Souza, C.F. Carvalho & C.C. Escole. 2003. Influência do fotoperíodo no desenvolvimento e na reprodução de Chrysoperla externa (Hangel) (Neuroptera: Chrysopidae). Neotrop. Entomol. 32: 91-96.
- Rosciszewska, E. 2001. Structure of the ovaries in larvae and mature females of euholognathan stoneflies (Plecoptera). Acta Zoologica. 82: 307-314.
- Santos, E. 1982. Os insetos, vidas e costumes. Belo Horizonte, Itatiaia, 197p.
- Silva, E.C.A. & F.H. Caetano. 1991. Anatomia e histologia do aparelho reprodutor feminino de Abracris flavolineata (Acrididae-Ommatolampinae-Abracrini). B. Indústr. Anim. 48: 23-29.
- Simiczyjew, B., A. Ogorzalek & P. Stys. 1998. Heteropteran ovaries: Variations on the theme. Folia Histochem. Cytobiol. 36: 147-156.
- Simiczyjew, B. & W. Margas 2001. Ovary structure in the bat flea Ischnopsyllus spp. (Siphonaptera: Ischnopsyllidae). Phylogenetic implications. Zool. Pol. 46: 5-14.
- Simiczyjew, B. 2002. Structure of the ovary in Nannochorista neotropica Navás (Insecta: Mecoptera: Nannochoristidae) with remarks on mecopteran phylogeny. Acta Zool. 83: 6166.
- Snodgrass, R.E. 1993. Principles of insect morphology. 2. ed. London, Cornell University Press, 667p.
- Szklarzewicz, T. 1998. The ovaries of scale insects (Hemiptera, Coccinea). Morphology and phylogenetic conclusions. Folia Histoch Cytobiol. 36: 157-165.
- Tanaka, S., T. Hakomori & E. Hasegawa. 1993. Effects of day length and hopper density on reproductive traits in a Japanese population of the migratory locust, Locusta migratoria L. J. Insect Physiol. 39: 571-580.
- Tanaka, S. & Y. Sadoyama. 1997. Photoperiodic termination of diapause in field-collected adults of the Bombay locust, Nomadacris succincta (Orthoptera: Acrididae) in southern Japan. Bull. Entomol. Res. 87: 533-539.
- Trudel, R., R. Lavallée, É. Bauce & C. Guertin. 2002. The effect of cold temperature exposure and long-day photoperiod on the termination of the reproductive diapause of newly emerged female Pissodes strobe (Coleoptera: Curculionidae). Agric. For. Entomol. 4: 301-308.
- Uvarov, S.B. 1966. Grasshoppers and locusts. London, Cambridge University Press, 481p.
- Velarde, R.A.M., R. N.Wiedenmann & D.J. Voegtlin. 2002. Influence of photoperiod on the overwintering induction of Galerucella calmariensis L. BioControl. 47: 587-601.
Datas de Publicação
-
Publicação nesta coleção
09 Ago 2007 -
Data do Fascículo
Jun 2007
Histórico
-
Recebido
08 Maio 2006 -
Aceito
04 Out 2006