Resumo:
A liberação da placenta após o parto envolve a perda da adesão materno-fetal e ocorre somente após a maturação completa do placentoma, que está relacionada com a diminuição da celularidade dos tecidos fetal e materno. A apoptose é requerida tanto para a maturação quanto para a liberação normal da placenta após o parto. O objetivo do presente estudo foi avaliar a ocorrência de apoptose em amostras de placenta de vacas em diferentes fases de gestação. Amostras de placentomas de 15 vacas saudáveis com 4 (n=5), 6 (n=5) e 9 (n=5) meses de gestação foram colhidas e processadas rotineiramente para a histologia, imunoistoquímica e histoquímica. As lâminas obtidas foram coradas em HE, Picrosirius Red e submetidas à análise imunoistoquímica das proteínas Caspase 3, Caspase 8, Bax e Bid. O aumento no número de vasos não necessariamente se associou ao aumento do calibre destes durante a evolução da gestação. Os resultados de histomorfometria revelaram aumento da marcação para Bax e Caspases 3 e 8 em células trofoblásticas binucleadas no final da gestação, enquanto o Bid se manteve sem alteração significativa. A histomorfometria das células trofoblásticas mononucleadas revelou expressão alta para Bax no início de gestação, com diminuição aos 6 meses de gestação e aumento das imunomarcações para Caspases 3 e 8, e Bid com o avanço gestacional. Os colágenos tipo I e III não aumentaram do terço médio ao final da gestação, o que é importante para a diminuição da adesão materno-fetal. Esses resultados confirmam que as Caspases 3 e 8, e o Bax estão envolvidos nos mecanismos de ativação da apoptose pela via intrínseca mitocondrial e/ou extrínseca ao longo da gestação em células trofoblásticas binucleadas, e que nas células trofoblásticas mononucleadas o Bax deixa de ser importante, enquanto o Bid e as Caspases 3 e 8 se tornam os mais significativos.
Termos de Indexação:
Placenta; maturação placentária; apoptose; imunoistoquímica; Caspase 3; Caspase 8; Bid; Bax; bovinos
Abstract:
Placental release after birth involves loss of maternal-fetal adhesion and occurs only after complete maturation of the placentoma related to the decrease in cellularity of fetal and maternal tissues. Apoptosis is required for both the normal maturation and release of the placenta after birth. The aim of this study was to evaluate the occurrence of apoptosis in samples of the placenta of cows in different stages of gestation. Samples of 15 healthy cow placentomas at 4 (n=5), 6 (n=5) and 9 (n=5) months of gestation were harvested and processed for routine histology, immunohistochemistry and histochemistry. The slides were stained with HE, PicroSirius Red and subjected to immunohistochemical analysis of proteins Caspase 3, Caspase 8, Bax and Bid. Increase in number of vessels was not associated with increase in vascular area during progression of gestation. The results of histomorphometry revealed increased labeling for Bax and Caspases 3 and 8 in trophoblastic binucleated cells in late pregnancy, where the Bid remained without significant change. Histomorphometry analyzing the mononuclear trophoblast cells showed a high expression for Bax in early pregnancy, but decreased at 6 months of gestation. Immunolabeling revealed increased Caspases 3/8 and Bid with advancing of gestation. Further evaluation of type I and III collagen showed a decrease of both types of collagens at the end of gestation, what is very important for the reduction of maternal-fetal adhesion. These results confirm that Caspases 3 and 8 and Bax are involved in the mechanisms of activation of apoptosis through mitochondrial intrinsic and/or extrinsic pathway during pregnancy in trophoblastic binucleated cells. In mononuclear trophoblast cells Bax looses importance in the apoptosis process, awhile Bid and caspases 3 and 8 become the most significant.
Index Terms:
Placental maturation; apoptosis; immunohistochemistry; Caspase 3; Caspase 8; Bid; Bax; cattle
Introdução
A placenta bovina é classificada como cotiledonária, pela presença de regiões específicas de trocas, os chamados placentomas, compostos pela carúncula materna e pelo cotilédone fetal. O crescimento e desenvolvimento normal dos placentomas são essenciais para o desenvolvimento e crescimento fetais (Laven & Peters 2001Laven R.A. & Peters A.R. 2001. Gros morphometry of the bovine placentome during gestation. Reprod. Domest. Anim. 36:289-296.). A liberação da placenta após o parto envolve a perda da adesão materno-fetal e ocorre somente após a maturação completa do placentoma que está relacionada com a diminuição da população celular dos tecidos fetal e materno (Malard et al. 1996Malard P.F., Barreto Filho J.B., Santos R.L. & Marques Junior A.P. 1996. Proporção volumétrica dos componentes estruturais da placenta de vacas zebu ao longo da gestação. Arq. Bras. Med. Vet. Zootec. 48:553-558.). Estudos mostram que a apoptose está envolvida tanto na maturação quanto para a liberação normal da placenta após o parto (Nunes et al. 2001Nunes J.E.S., Vasconcelos A.C., Martins E., Martins V.M.V.& Marques Jr A.P. 2001. Maturação e liberação placentária em bovinos e a sua relação com apoptose. Rev. Bras. Reprod. Anim. 25:513-525., Martins et al. 2004Martins V.M.V., Marques Junior A.P., Vasconcelos A.C., Martins E., Santos, R.L. & Lima F.P.C. 2004. Maturação e expulsão placentária em vacas das raças Holandesa e Nelore. Arq. Bras. Med. Vet. Zootec. 56:157-167.). No momento do parto, a apoptose nas células do placentoma é mais intensa e pode estar associada à mudanças hormonais (Martins et al. 2004Martins V.M.V., Marques Junior A.P., Vasconcelos A.C., Martins E., Santos, R.L. & Lima F.P.C. 2004. Maturação e expulsão placentária em vacas das raças Holandesa e Nelore. Arq. Bras. Med. Vet. Zootec. 56:157-167.).
A apoptose é um tipo de morte celular programada ativada por genes que codificam endonucleases e proteases para a morte da célula (Saraste & Pulkki 2000Saraste A. & Pulkki K. 2000. Morphologic and biochemical hallmarks of apoptosis. Cardiovasc. Res. 45:528-37.). Existem duas vias distintas que podem estar ativas. Na via extrínseca a apoptose é iniciada via receptores de morte, ativando a pró-caspase-8 ou -10 (Hengartner 2000Hengartner M.O. 2000. The biochemistry of apoptosis. Nature 407:770-776.). Na via intrínseca ou mitocondrial, ativada com as alterações de permeabilidade de membrana mitocondrial ocorre a liberação do citocromo c para o citosol, que se liga a dATP, Apaf-1 e pró-caspase-9, formando o complexo apoptossomo. A caspase-9 (iniciadora) cliva as caspases efetoras subsequentes (-2, -3, -6, -7, -8, -9 e -10) (Anazetti et al. 2003Anazetti M.C., Melo P.S., Durán N. & Haun M. 2003. Comparative cytotoxicity of Dimethylamide-Crotonin in the promyelocytic leukemia cell line (HL60) and human peripheral blood mononuclear cells. Toxicol. 188:261-274.). A via mitocondrial é ativada em resposta a danos no DNA, que ativam membros pró-apoptóticos da família Bcl-2 (Bax, Bid). Membros pró- e anti apoptóticos da família Bcl-2 regulam a liberação de citocromo c a partir da membrana mitocondrial interna. Os membros anti-apoptóticos da família Bcl-2 inibem a apoptose impedindo a formação de poros na membrana mitocondrial e o extravasamento do citocromo c para o citosol (Gottlieb 2000Gottlieb R.A. 2000. Role of mitochondria in apoptosis. Crit. Rev. Eukaryot Gen Expr. 10:231-239.). Caspases subsequentes são ativadas, culminando na clivagem de substratos específicos e na apoptose (Anuradha et al. 2001Anuradha C.D., Kanno S. & Hirano S. 2001. Oxidative damage to mitochondrial is a preliminary step to caspase-3 activation in fluoride-induced apoptosis in HL60 cells. Free Rad. Biol. Med. 31:367-373.).
A remodelação dos componentes do estroma materno e a manutenção do formato dos placentomas envolve a participação de macrófagos. Esse processo ocorre durante toda a gestação, diminuindo a fixação do tecido fetal no materno ao final para liberação das membranas fetais após o parto (Miyoshi & Sawamukai 2004Miyoshi M. & Sawamukai Y. 2004. Specific localization of macrophages in pregnant bovine caruncles. Reprod. Domest. Anim. 39:125-128.).
Diversos fatores ou componentes do placentoma são importantes na maturação placentária em bovinos. Nesse estudo visa-se a ampliação de conhecimentos sobre as mudanças estruturais na placenta no seu desenvolvimento e maturação, considerando as consequências econômicas de sua retenção. Nesse contexto, a análise imunoistoquímica associada a morfometria deverá permitir o detalhamento numérico das células imunomarcadas no placentoma bovino em diferentes momentos da gestação.
Este trabalho objetivou avaliar quantitativamente o número e área de vasos nos componentes materno e fetal da placenta, e a proporção de colágeno tipo I e III em diferentes idades gestacionais. Avaliou-se também a imunoexpressão das Caspases 3 e 8, do Bax e do Bid em células trofoblásticas binucleadas e demais células do placentoma, correlacionando estes dados com a idade gestacional.
Material e Métodos
Delineamento experimental. Foram utilizadas 15 placentas de vacas mestiças adultas provenientes do Frigorífico Alvorada, situado no município de Igarapé, MG. Essas amostras foram divididas em três grupos (n=5): o Grupo I foi formado por placentomas obtidos de vacas com 4 meses de gestação; enquanto os Grupos II e III por placentomas de vacas com 6 e 9 meses de gestação, respectivamente. A estimativa da idade gestacional foi calculada pelo comprimento craniocaudal (CRL) do feto (Noakes 1990Noakes D.E. 1990. Fertilidade e obstetrícia em bovinos. Varela, São Paulo. 25p.).
Análise histopatológica e morfométrica. As amostras foram fixadas em formol tamponado pH 7.4 por 24 horas e processadas para inclusão em parafina. Secções de 5μm foram realizadas para análise histológica, imunoistoquímica e histoquímica. As lâminas foram coradas em HE (Hematoxilina e Eosina) para determinação do número e área de vasos, em Picrosirius Red para análise dos colágenos tipo I e III e submetidas à reação de imunoistoquímica das proteínas Bid, Bax e Caspases 3 e 8. Os fragmentos foram analisados em microscópio ótico para contagem e localização das células ou estruturas marcadas. Para tanto, as imagens foram capturadas câmera digital (JVC TK-1270/JCB) acoplada a microscópio ótico (Olympus BX43) e posteriormente analisadas com programa de análise de imagens Media Cybernetics Image Pro-Plus versão 4.5.0.29 para Windows®.
A análise das fibras colágenas tipo I e tipo III dos placentomas foi realizada a partir da observação das lâminas coradas com Picrosírius Red. Foram capturados 3 campos/lâmina por animal, em objetiva planocromática de 10x com luz polarizada. A quantificação dos colágenos tipo I e tipo III foi através da área de colágeno (unidade, μM2).
A quantificação do número e área de vasos foi realizada a partir da observação das lâminas coradas com HE. Foram capturados 8 campos/lâmina para cada animal, em objetiva planocromática em 10x.
Análise imuno-histoquímica. Seções histológicas de placentomas foram desparafinizadas, hidratadas e incubadas por 30 minutos em peróxido de hidrogênio a 3% para bloqueio das peroxidases endógenas. Após a lavagem por cinco minutos com tampão fosfato (PBS), as lâminas foram submetidas à recuperação antigênica conforme padronizado para cada anticorpo. Para as Caspases 3 e 8 utilizou-se a solução de Proteinase K (Proteinase K, Dako Corp., Carpinteria, CA) por 5 minutos e para Bid e Bax a solução de Ácido cítrico 10mM pH 6.0 em banho úmido por 30 minutos a 96°C. O bloqueio das ligações inespecíficas endógenas foi feio com leite desnatado 5% (Molico® - Indústria Brasileira). Os cortes foram incubados câmara úmida "overnight" com os anticorpos primários nas diluições de 1:200 para Caspases 3 e 8, de 1:50 para anti Bax e de 1:100 para anti Bid. Os anticorpos foram diluídos em PBS. Utilizaram-se os anticorpos: anti-Caspase 3 clone JHM62 (Mouse Monoclonal CPP32, Novacastra TM), anti-Caspase 8 clone 11B6 (Mouse Monoclonal CASP-8, Novacastra TM), anti-Bax (Polyclonal Rabbit Anti-Human Bax, Dako®, Dinamarca), e anti-Bid (Rabbit Polyclonal anti-Bid, Chemicon, CA, EUA). Posteriormente as laminas foram incubadas com o anticorpo secundário biotinalado (DAKO LSAB 2 kit, DAKO Corp., Carpinteria, CA) em temperatura ambiente por 1 hora. Em seguida incubou-se com a solução streptavidina-biotina (DAKO Corp., Carpinteria, CA) permanecendo por 30 minutos em câmara úmida à temperatura ambiente. Utilizou-se o cromógeno diaminobenzidina (DAB, Dako Corp., Carpinteria, CA) e todas as seções foram contracoradas com Hematoxilina de Harris.
As imagens dos campos contendo as imunomarcações foram capturadas com objetiva planacromática de 40x. A imunomarcação para cada antígeno alvo foi quantificada morfometricamente obtendo-se um índice de marcação representando a proporção das células marcadas sobre as células totais (Ex: IBax= somatório das células imunomarcadas com o anticorpo anti Bax/somatório das células totais x 100).
As imunomarcações foram quantificadas em um número mínimo representativo de campos definido pela avaliação da evolução dos erros padrões de acordo com o aumento da amostragem (Moro et al. 2004Moro L., Vasconcelos A.C., Santos F.G.A., Alves C.M., Nunes J.E.S. & Sampaio I.B.M. 2004. Determination of the minimal representative number of microscopic fields to quantify apoptosis in canine lymph nodes. Arq. Bras. Med. Vet. Zootec. 56:408-410.). Brevemente, determinou-se o Índice de marcação a partir da contagem de células no número máximo obtido de campos tomados numa lamina. Desses, formaram-se subamostras crescentes de campos (5, 10, 15...., etc) sorteados com reposição. Essas subamostras foram caracterizadas por suas médias e respectivos erros padrões. Plotou-se um gráfico da evolução dos erros padrões com o aumento do número de campos. Quando o erro padrão não diminuía acompanhando o aumento do número de campos se obtinha o número mínimo representativo de campos para cada parâmetro a ser analisado imunoistoquimicamente. Ficou assim estabelecido 25 campos/lâmina para Bax e 30 campos/lâmina para Bid, Caspases 3 e 8.
Para a análise estatística os parâmetros morfométricos obtidos dos diversos campos histológicos foram submetidos ao teste de Kolmogorf-Smirnoff (KS) para verificação de distribuição normal (Gaussiana). Quando os dados tinham distribuição Gaussiana, procedeu-se à Análise de Variância e à múltipla comparação de Newman Keuls (SNK). As médias e respectivos erros de cada tratamento foram plotadas em gráfico. Em caso de distribuição dos dados não se encaixar no teste de normalidade, optou-se pelo teste não paramétrico de Kruskall-Wallis acrescido do teste de múltiplas comparações de Dunn, utilizando-se o programa GraphPad Prism versão 5.1.
Resultados
Achados de número e área de vasos
O número de vasos placentários foi similar entre placentas com 9 e 6 meses de gestação (5,525±0,4282 e 5,150±0,3273, respectivamente), e maior que em placentas com 4 meses de gestação (4,031±0,5635, com p<0,05) (Fig.1A). Assim houve aumento significativo do número de vasos em placentas de 4 para 6 meses de gestação, porém não de 6 para 9 meses. Inversamente a área média dos vasos diminuiu em placentas de 4 para 6 meses de gestação, porém não de 6 para 9 meses ( Fig.1B ).
(A)Análise morfométrica do número de vasos em placenta de vaca com 4, 6 e 9 meses de gestação. O número de vasos aumentou de 4 (4,031±0,5635) para 6 meses (5,150±0,3273), mas não de 6 para 9 meses de gestação (5,525±0,4282) com p<0,05. (B) Análise morfométrica da área média dos vasos em placentas bovinas com 4, 6 e 9 meses de gestação. A área de vasos foi maior no grupo com 4 meses de gestação (3,88±0,25), diminuindo aos 6 (3,08±0,22) e mantendo-se similar aos 9 meses de gestação (2,71±0,18), com p<0,001.
Avaliação histoquímica de colágeno
Os colágenos do tipo I e III aumentaram dos 4 aos 6 meses de gestação. Dos 6 aos 9 meses houve discreta queda, não significativa ( Fig.2 e 3 ).
Placenta de vaca. (A) Representa o grupo com 4 meses de gestação, com menor concentração de colágeno tipo I e III. (B) Representa o grupo com 6 meses de gestação, com maior concentração de colágeno tipo I, caracterizado por birrefringência e coloração vermelha, e maior concentração de colágeno tipo III, caracterizado pela reduzida birrefringência e coloração verde. (C) Representa o grupo com 9 meses de gestação, com redução do colágeno tipo I e III. Picrosirius Red, microscopia óptica sob luz polorizada, 10x.
Médias e erros padrões das áreas de colágenos tipo I e III nos grupos com 4, 6 e 9 meses de gestação, obtidos com a coloração de Picrosirius Red sob luz polarizada. (A) A quantidade de colágeno I aumentou de 4 (0,3064±0,1715) aos 6 (1,778±0,4569), mas não de 6 para 9 (1,328±0,4281) meses de gestação (p<0,05). (B) A área de colágeno III aumentou de 4 (0,2596±0,4705)para 6 (0,9195±0,1219) meses de gestação, mas não de 6 para 9 (0,6266±0,9706) (p<0,05).
Avaliação imuno-histoquímica
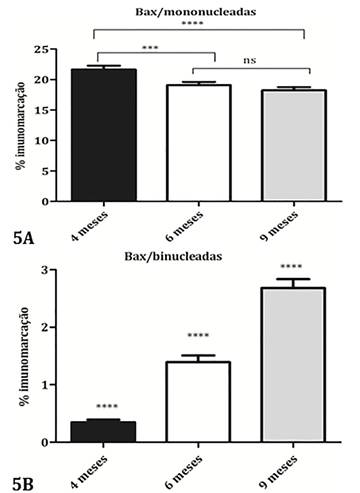
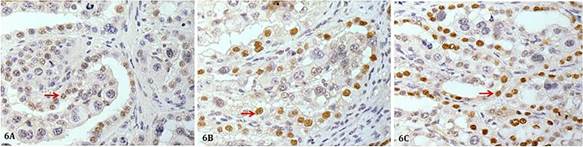
A reação imuno-histoquímica com o anticorpo policlonal para a proteína Bax ocorreu como grumos castanhos no citoplasma das células trofoblásticas no tecido materno e com maior intensidade no tecido fetal. ( Fig.4 ). O percentual de imunomarcação para Bax nas células trofoblásticas mononucleadas foi maior nas placentas com 4 meses (21,64%) diminuindo no Grupo com 6 meses de gestação (19,08%), que ficou semelhante às placentas com 9 meses de gestação (18,25%) (p<0,0002) ( Fig.5A ). Já nas células trofoblásticas binucleadas a marcação para Bax aumentou progressivamente ao longo da gestação estando menor aos 4 meses (0,3458%), e maior aos 9 meses (2,68%) (p<0,0001) ( Fig.5B ).
Placenta bovina mostrando marcação imunoistoquímica para Bax. Áreas acastanhadas no citoplasma definem as marcações imunoreativas. (A) Placenta com 4 meses de gestação. (B) Placenta com 6 meses de gestação. (C) Placenta com 9 meses de gestação. Complexo streptavidina-peroxidase, 40x. (*) região materna; (VF) vilo fetal; (setas pretas) células binucleadas; (setas vermelhas) células mononucleadas.
(A) Distribuição do índice de marcação para Bax nas células trofoblásticas mononucleadas nos grupos com 4, 6 e 9 meses de gestação. A imunomarcação diminuiu do grupo com 4 (21,64±0,6373) para 6 (19,08±0,5306), mas não de 6 para 9 meses de gestação (18,25±0,4911), com p<0,0002. (B) Distribuição do índice de marcação para Bax nas células trofoblásticas binucleadas imunomarcadas nos grupos com 4, 6 e 9 meses de gestação. A marcação aumentou do grupo com 4 meses (0,3458±0,04585) para o de 6 (1,391±0,1173) e para 9 meses de gestação (2,680±0,1568), com p<0,0001.
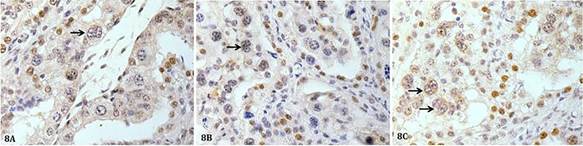
Houve ampla marcação imunoistoquímica para a proteína Bid em células trofoblásticas mononucleadas nas amostras com 9 (60,75%) e 4 meses de gestação (51,46%) e menor marcação nas amostras com 6 meses de gestação (49,52%) ( Fig.6 e 7A ) (p<0,0001.). Nas células trofoblásticas binucleadas a imunomarcação para Bid aos 4, 6 e 9 meses de gestação foi respectivamente, 3,234%, 2,874% e 3,020%, sem apresentar diferença estatística entre os grupos ( Fig.7B e 8 ).
Placenta de vaca mostrando marcação imunoistoquímica para Bid em células trofoblásticas mononucleadas. Áreas acastanhadas no citoplasma e núcleo definem marcações imunorreativas (seta vermelha: célula mononucleada e epitélio materno. (A) Placenta com 4 meses de gestação. (B) Placenta com 6 meses de gestação. (C) Placenta com 9 meses de gestação. Complexo streptavidina-peroxidase, 40x.
(A) Distribuição do índice de marcação para Bid nas células trofoblásticas mononucleadas imunomarcadas nos grupos com 4, 6 e 9 meses de gestação. A imunomarcação aumentou do grupo com 4 meses (51,46±1,166) para o com 9 meses de gestação (60,75±1,058), mas não para o com 6 meses de gestação (49,52±1,325), com p<0,0001. (B) Distribuição do índice de marcação para Bid nas células trofoblásticas binucleadas imunomarcadas nos grupos com 4 (3,234± 0,2257), 6 (2,874± 0,1763) e 9 (3,020± 0,1960) meses de gestação. Não houve diferenças estatísticas significativas entre os grupos.
Placenta de vaca mostrando marcação imunoistoquímica para Bid em células trofoblásticas binucleadas. Áreas acastanhadas no citoplasma e núcleo definem marcações imunorreativas (seta preta: célula binucleada). (A) Placenta com 4 meses de gestação. (B) Placenta com 6 meses de gestação. (C) Placenta com 9 meses de gestação. Complexo streptavidina-peroxidase, 40x.
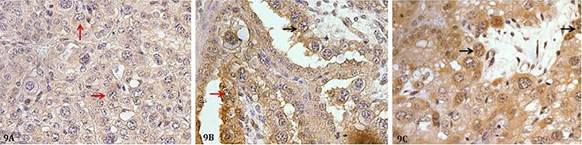
A marcação imunoistoquímica para Caspase 3 ( Fig.9 ) em células trofoblásticas mononucleadas foi menor nas amostras do grupo com 4 meses de gestação (12,27%) e aumentou progressivamente aos 6 e aos 9 meses de gestação (14,98% e 26,43%) respectivamente ( Fig.10A ) (p<0,0001). Nas células trofoblásticas binucleadas foi menos intensa, mas seguiu o mesmo padrão, sendo menor no grupo com 4 meses (0,1674%) e aumentando progressivamente aos 6 e aos 9 meses de gestação (0,4380% e 0,9389% respectivamente) ( Fig.10B ) (p<0,0001).
Placenta de vaca mostrando marcação imunoistoquímica para Caspase 3. Áreas acastanhadas no citoplasma definem marcações imunorreativas (seta vermelha - células mononucleadas; setas pretas: células binucleadas). (A) Placenta com 4 meses de gestação. (B) Placenta com 6 meses de gestação. (C) Placenta com 9 meses de gestação. Complexo streptavidina-peroxidase, 40x.
(A) Distribuição do índice de marcação para Caspase 3 nas células trofoblásticas mononucleadas nos grupos com 4, 6 e 9 meses de gestação. A imunomarcação aumentou progressivamente do 4º mês (12,27±0,5723) para o 6º mês (14,98±0,4880) e para o 9º mês de gestação (26,43±1,097) com p<0,0001. (B) Distribuição do índice de marcação para Caspase 3 nas células trofoblásticas binucleadas nos grupos com 4, 6 e 9 meses de gestação. A marcação aumentou do grupo com 4 meses (0,1674±0,02652) para o de 6 (0,4380±0,04086) e para 9 meses de gestação (0,9389±0,07386), com p<0,0001.
A reação imunoistoquímica para a Caspase 8 ( Fig.11 ) mostrou expressão progressiva aumentando de 4 (12,16%) a 6 (18,41%) e a 9 meses de gestação (23,19%) em células trofoblásticas mononucleadas (p<0,0001) ( Fig.12A ). Já nas células trofoblásticas binucleadas só houve diferença entre os extremos, sendo maiores com 9 (1,820%) e menores com 4 meses de gestação (0,8304%) (p<0,0001) ( Fig.12B ).
Placenta de vaca mostrando marcação imunoistoquímica para Caspase 8. Áreas acastanhadas no citoplasma e núcleo definem marcações imunorreativas (seta preta: célula binucleada e seta vermelha: células mononucleadas e epitélio materno). (A) Placenta com 4 meses de gestação. (B) Placenta com 6 meses de gestação. (C) Placenta com 9 meses de gestação. Complexo streptavidina-peroxidase, 40x.
(A) Distribuição do índice de marcação para Caspase 8 nas células trofoblásticas mononucleadas nos grupos com 4, 6 e 9 meses de gestação. A marcação aumentou do grupo com 4 meses (12,16±1,127) para o de 6 (18,41±1,406) e para 9 meses de gestação (23,19±1,556), com p<0,0001. (B) Distribuição do índice de marcação para Caspase 8 nas células trofoblásticas binucleadas nos grupos com 4, 6 e 9 meses de gestação. A marcação aumentou do grupo com 4 meses de gestação (0,8304±0,1518) aos 9 meses de gestação (1,820±0,2603), mas não houve diferença entre o grupo com 6 meses de gestação (1,054±0,2139) e os demais (p<0,01).
Discussão
Neste trabalho avaliou-se as mudanças estruturais na placenta no seu desenvolvimento e maturação. Analisou-se histomorfometricamente o número e área de vasos nos componentes materno e fetal da placenta, e a proporção de colágeno tipo I e III em diferentes idades gestacionais. Além disto quantificou-se a imunoexpressão das Caspases 3 e 8, do Bax e do Bid em células trofoblásticas binucleadas e demais células do placentoma, correlacionando estes dados com a idade gestacional.
Houve aumento significativo do número de vasos em placentas de 4 para 6 meses de gestação, porém não de 6 para 9 meses. Inversamente a área média dos vasos diminuiu em placentas de 4 para 6 meses de gestação, porém não de 6 para 9 meses. Assim o aumento no numero de vasos não necessariamente se associou ao aumento do calibre destes durante a evolução da gestação. Aos 6 meses de gestação, os vasos placentários estavam aumentando de numero e diminuindo de tamanho, indicando maior angiogênese e criação de anastomoses. Não houve aumento da área e número dos vasos no terço final da gestação, o que concorda em parte com os achados de Grunert (1984)Grunert E. 1984. Placental separation/retention in the bovine. 10th Int. Congr. Anim. Reprod. A.I., Illinois, USA, Plennary and Symposia Papers, IV(XI):17-24. como sendo resultado da hialinização das paredes dos vasos sanguíneos, proliferação de tecido conjuntivo da sub-íntima e adventícia, bem como pela obliteração do lúmen dos mesmos.
O número de vasos placentários aumenta com o avanço da gestação. No inicio da gestação poucos capilares são encontrados no mesênquima, existindo uma evolução na vascularização com o progresso da gestação, conforme relatado por Pinto et al. (2008)Pinto L.M., Ambrósio C.E., Teixeira D.G., Araújo K.P.C., Kfoury Júnior J.R., Morini Junior J.C., Rici R.E.G., Ferreira G.J.B.C., Martins D.S. & Miglino M.A. 2008. Comportamento das células trofoblásticas gigantes na placenta de vacas Nelore (Bos indicus Linnaeus, 1758). Revta Bras. Reprod. Anim. 32(2): 110-121.. A maioria dos trabalhos em placentas em estágios iniciais de gestação e no terço médio evidenciam maior vasculogênese, com a formação de uma rede vascular anostomosada (Cheung et al. 1995Cheung C.Y., Madhu S., Ebaugh M.J. & Brace R.A. 1995. Vascular endothelial growth factor gene expression in ovine placenta and fetal membranes. Am. J. Obstetr. Gynecol. 173(3):753-759.), proporcional às necessidades do desenvolvimento fetal (Reynolds & Redmer 2001Reynolds L.P. & Redmer D.A. 2001. Angiogenesis in the placenta. Biol. Reprod. 64:1033-1040.). Em todos os tipos de placenta existe um crescimento considerável de vasos sanguíneos, garantindo uma potencialização nas trocas entre os organismos materno e fetal (Charnock-Jones et al. 2001Charnock-Jones D.S., Clark D.E., Licence D., Day K., Wooding F.B.P. & Smith K. 2001. Distribution of vascular endothelial growth factor (VEGF) and its binding sites at the maternal-fetal interface during gestation in pigs. Reproduction 122:753-760.). A não expansão da vascularização placentária no terço inicial tem sido associada à mortalidade embrionária precoce (Hill et al. 2000Hill J.R., Burghardt R.C., Jones K., Long C.R., Looney C.R., Shin T., Spencer T.E., Thompson J.A., Winger Q.A. & Westhusin M.E. 2000. Evidence for placental abnormality as the major cause of mortality in first trimester somatic cell cloned bovine fetuses. Biol. Reprod. 63:1787-1794., Charnock-Jones & Burton 2000Charnock-Jones D.S. & Burton G.J. 2000. Placental vascular morphogenesis. Bailliere Clin. Obstetr. Gynecol. 14:953-968.).
Os colágenos do tipo I e III aumentaram dos 4 aos 6 meses de gestação indicando uma colagenização progressiva das carúnculas até o terço medio da gestação. Dos 6 aos 9 meses houve discreta queda, não significativa. Estes resultados indicam que na placenta bovina em período final de gestação não ocorre mais aumento dos colágenos I e III, apesar do crescimento fetal e da preparação para o parto. Esta esclerose funcional da placenta materna é mais evidente nas zonas marginais da carúncula, especialmente na periferia das criptas (Grunert 1984Grunert E. 1984. Placental separation/retention in the bovine. 10th Int. Congr. Anim. Reprod. A.I., Illinois, USA, Plennary and Symposia Papers, IV(XI):17-24.). Segundo Melendez et al. (2006)Melendez P., Gonzalez G., Benzaquen M., Risco C. & Archbald L. 2006. The effect of a monensin controlled-release capsule on the incidence of retained fetal membranes, milk yield and reproductive responses in Holstein cows. Theriogenol. 66:234-241. no útero normal, há aumento das colagenases e outras proteases, resultando numa quebra massiva de colágeno no final da gestação, e essa degradação é essencial à maturação e consequente separação dos placentomas. A falha da colagenólise dos cotilédones é proposta por muitos autores como sendo fundamental na Retenção Placentária (RP). Se o sistema de ancoragem não é enzimaticamente degradado, as membranas fetais ficam retidas. Vacas com RP apresentam uma colagenólise diminuída (Gross et al. 1985Gross T.S., Williams W.F. & Manspeacker J.E. 1985. In vitro placental prostaglandin synthesis in the late pregnant and peripartum cow. Biol. Reprod. 32:154., Melendez et al. 2006Melendez P., Gonzalez G., Benzaquen M., Risco C. & Archbald L. 2006. The effect of a monensin controlled-release capsule on the incidence of retained fetal membranes, milk yield and reproductive responses in Holstein cows. Theriogenol. 66:234-241.), ou ainda um sistema anti-colagenase mais ativo (Eiler & Hopkins 1993Eiler H. & Hopkins F.M. 1993. Successful treatment of retained placenta with umbilical cord injections of collagenase in cows. J. Am.Vet. Med. Assoc. 203:436-443.), sendo incapazes de degradar o colagénio tipo III, que diminui significativamente em vacas normais no final da gestação (Sharpe et al. 1990Sharpe K.L., Eiler H. & Hopkins F.M. 1990. Changes in the proportion of type I and type III collagen in the developing and retained bovine placentome. Biol. Reprod. 43:229-235.).
Na avaliação das moléculas envolvidas na maturação placentária associadas com a idade gestacional, a primeira molécula aqui estudada foi o Bax. A reação imunoistoquímica com o anticorpo policlonal para a proteína Bax mostrou percentual de imunomarcação nas células trofoblásticas mononucleadas maior que nas binucleadas, e seguiu um padrão diferente, sendo maior nas placentas com 4 meses e diminuindo aos 6 meses de gestação nas mononucleadas enquanto nas binucleadas era menor aos 4 meses e aumentava progressivamente aos 6 e 9 meses de gestação.
O aumento da expressão de Bax em células binucleadas trofoblásticas em nosso estudo e a subsequente ativação da caspase ativa a apoptose (Sgarbosa et al. 2006Sgarbosa F., Barbisan L.F., Brasil M.A., Costa E., Calderon I.M., Gonçalves C.R., Bevilacqua E. & Rudge M.V. 2006. Changes in apoptosis and Bcl-2 expression in human hyperglycemic, term placental trophoblast. Diabetes Res. Clin. Pract. 73:143-149.) nessas células. Williams et al. (1987Williams W.F., Margolis M.J., Manspeaker J., Douglass L.W. & Davidson J.F. 1987. Peripartum changes in the bovine palcenta related to fetal membrane retention. Theriogenology 28:213-223.) relataram a diminuição progressiva de células trofoblásticas gigantes na vaca ao longo da gestação. O número de células binucleadas diminui somente nas últimas semanas da gestação (Wooding et al. 1993Wooding F.B.P., Hobbs T., Morgan G., Heap R.B. & Flint A.P. 1993. Cellular dynamics of growth in sheep and goat synepitheliochorial placentomes: an autoradiographic study. J. Reprod. Fertil. 98:275-283.). Quando o número das células binucleadas não diminui no final da gestação aumenta-se as chances de retenção placentária (Santos et al. 1996Santos R.L., Marques Jr A.P. & Barreto Filho J.B. 1996. Proporção volumétrica dos componentes estruturais do placentônio de vacas leiteiras com liberação normal e retenção de placenta. Arq. Bras. Med. Vet. Zootec. 48(3):317-24.).
As proteinas da família Bcl-2 são reguladoras da apoptose na placenta, entre eles o Bax pro-apoptótico e Bcl-2 anti-apoptótico (Antonsson et al. 1997Antonsson B., Conti F., Ciavatta A., Montessuit S., Lewis S. & Martinou I. 1997. Inhibition of Bax channel-forming activity by Bcl-2. Science 277:370-372., Fleischer & Rebollo 2004Fleischer A. & Rebollo A. 2004. Induction of p53-independent apoptosis by the BH3-only protein ITM2Bs. FEBS Lett. 34: 313.). O excesso de Bax formará complexos com Bcl-2 inibindo sua função protetora, enquanto a formação de homodímeros de Bax forma poros na membrana da mitocôndria para a liberação do citocromo-c (Liu et al. 2003Liu Z., Sun Q.H., Ying Y., Liu J.M. & Peng J.P. 2003. Effect of IFN on caspase-3, Bcl-2 and Bax expression, and apoptosis in rabbit placenta. Cytokine 7:201-209.). Para Ushizawa et al. (2006Ushizawa K., Takahashi T., Kaneyama K., Hosoe M. & Hashizume K. 2006. Cloning of the bovine antiapoptotic regulator, BCL2-related protein A1, and its expression in trophoblastic binucleate cells of bovine placenta. Biol. Reprod. 74:344-351.) o pico da expressão de Bax pelas células binucleadas ocorre no meio da gestação, descordando das várias evidencias de maior apoptose no final da gestação e dos resultados encontrados nesse trabalho, em que a maior expressão de Bax ocorreu aos 9 meses da gestação.
O índice de imunomarcação da proteína Bid foi maior nas células trofoblásticas mononucleadas de placentas com 9 meses e menor com 4 e 6 meses de gestação. Nas células trofoblásticas binucleadas a imunomarcação para Bid não apresentou diferença estatística entre os grupos. A imunomarcação para-Bid foi intensa no epitélio materno em todos os períodos gestacionais avaliados nesse estudo. Proteínas como Bax e Bid são pró-apoptóticas e ativam caspases efetoras (Patel & Gores 1998Patel T. & Gores G.J. 1998. Apoptosis in liver transplantation: a mechanism contributing to immune modulation, preservation injury, neoplasia, and viral disease. Liver Transpl. Surg. 4:42-50.). A maturação placentária é mediada pela apoptose das células das criptas do epitélio materno e ocorre durante toda a gestação na renovação normal (Boos et al. 2003Boos A., Janssen V. & Mülling C. 2003. Proliferation and apoptosis in bovine placentomes during pregnancy and around induced and spontaneous parturition as well as in cows retaining the fetal membranes. Reprodroduction 126:469-480.), aumentando no terço final. Straszewski-Chavez et al. (2005)Straszewski-Chavez S.L., Abrahams V.M. & Mor G. 2005. The role of apoptosis in the regulation of trophoblast survival and differentiation during pregnancy. Endocr. Rev. 26:877-897. avaliaram placentas humanas e demonstraram maior apoptose nos sítios de invasão do trofoblasto no epitélio materno, sugerindo que este processo facilite a invasão do trofoblasto e a remodelação dos vilos endometriais.
A imunomarcação para Caspase 3 em células trofoblásticas mono e binucleadas foi menor aos 4 meses de gestação e aumentou progressivamente aos 6 e aos 9 meses de gestação, sendo menos intensa nas células trofoblásticas binucleadas. Estes resultados indicam que, na fase final da gestação ocorre aumento da apoptose nas células trofoblásticas mono e binucleadas, concordando com o relatado por Martins et al. (2004)Martins V.M.V., Marques Junior A.P., Vasconcelos A.C., Martins E., Santos, R.L. & Lima F.P.C. 2004. Maturação e expulsão placentária em vacas das raças Holandesa e Nelore. Arq. Bras. Med. Vet. Zootec. 56:157-167. e Nunes et al. (2001Nunes J.E.S., Vasconcelos A.C., Martins E., Martins V.M.V.& Marques Jr A.P. 2001. Maturação e liberação placentária em bovinos e a sua relação com apoptose. Rev. Bras. Reprod. Anim. 25:513-525.). A apoptose ocorre na placenta em toda a gestação, mas com maior frequência no período final (Straszewski-Chavez et al. 2004Straszewski-Chavez S.L., Abrahams V.M., Funai E.F. & Mor G. 2004. X-linked inhibitor of apoptosis (XIAP) confers human trophoblast cell resistance to Fas-mediated apoptosis. Mol. Hum. Reprod. 10:33-41.). Benetone (2005)Benetone M.Z. 2005. Apoptose e proliferação na placenta de búfalas. Dissertação de Mestrado em Medicina Veterinária, Departamento de Cirurgia, Universidade de São Paulo, São Paulo, SP. 186p. demonstrou maior marcação para caspase 3 e apoptose nas placentas de 9 a 10 meses de gestação comparados com placentas de 2 a 5 meses de gestação. Relacionou a redução da proliferação com o aumento da apoptose com a maturação da placenta e consequente liberação dos anexos fetais após o parto. Liu et al. (2003)Liu Z., Sun Q.H., Ying Y., Liu J.M. & Peng J.P. 2003. Effect of IFN on caspase-3, Bcl-2 and Bax expression, and apoptosis in rabbit placenta. Cytokine 7:201-209. relataram aumento da marcação para caspase-3 no sincicio e citotrofoblasto ao decorrer da gestação. Padrões crescentes de apoptose na placenta humana durante a gestação também foi observada e relacionada à constante renovação e remodelação tecidual como um processo natural por Straszewski-Chavez et al. (2005)Straszewski-Chavez S.L., Abrahams V.M. & Mor G. 2005. The role of apoptosis in the regulation of trophoblast survival and differentiation during pregnancy. Endocr. Rev. 26:877-897..
A caspase-3 ativada cliva proteínas vitais, como as enzimas reparadoras do DNA e as proteínas do citoesqueleto. Isto explica a morfologia característica das células apoptóticas como condensação nuclear, bolhas na membrana e retração celular. A deoxyribonuclease ativada pela caspase cliva o DNA inespecificamente em fragmentos de aproximadamente 200 pares de bases matando as células (Straszewski-Chavez et al. 2005Straszewski-Chavez S.L., Abrahams V.M. & Mor G. 2005. The role of apoptosis in the regulation of trophoblast survival and differentiation during pregnancy. Endocr. Rev. 26:877-897.). O aumento do índice apoptótico em placentomas com o avanço da idade gestacional em vacas foi comprovado morfologicamente com a reação de Tunel por Meça et al. (2011)Meça K.K.O.L., Puerto H.L.D., Rodrigues L.V., Rachid M.A., Pereira N.B., Cândido M.G.L. & Vasconcelos A.C. 2011. Apoptose na maturação placentária de vacas em diferentes estágios de gestação: evidenciação imuno-histoquímica e bioquímica. Pesq. Vet. Bras. 31:718-722..
A Caspase 8 aumentou progressivamente ao longo da gestação nas células trofoblásticas mononucleadas. Já nas células trofoblásticas binucleadas só houve diferença entre o terço inicial e o final da gestação, estando os valores obtidos para 6 meses similares aos com 4 e 9 meses de gestação. O aumento da expressão de caspase 8 ao final da gestação em células trofoblásticas mononucleadas e binucleadas é também relatado por Donovan & Cotter (2004)Donovan M. & Cotter T.G. 2004. Control of mitochondrial integrity by Bcl-2 family members and caspase-independent cell death. Biochem. Biophys. Acta 1644:133-147., e reflete a ativação da via extrínseca da apoptose. Meça et al. (2010)Meça K.K.O.L., Martins A.S., Del Puerto H.L. & Vasconcelos A.C. 2010. Apoptose e expressão de Bcl-2 e das caspases 3 e 8 em placenta bovina, em diferentes estágios de gestação. Arq. Bras. Med. Vet. Zootec. 62(2):258-264. estudaram placentas bovinas em idades gestacionais de 4, 6 e 9 meses de gestação e observaram a imunoexpressão de caspase 8 nos três períodos analisados.
A ativação de caspase 8 é consequencia da ligação de moléculas sinalizadoras com receptores da morte na membrana citoplasmática. A Caspase 8 cliva e ativa as caspases efetoras 3 e 7. Estas caspases efetoras são capazes de clivar uma série de substratos, iniciando a apoptose (Hengartner 2000Hengartner M.O. 2000. The biochemistry of apoptosis. Nature 407:770-776.). Além disso, a ativação da caspase 8 pode levar a uma integração da via extrínseca com a via intrínseca da apoptose através da clivagem da proteína Bid (Wei et al. 2000Wei M.C., Zong W.X., Cheng E.H.Y., Lindsen T., Panoutsakopoulou V., Ross A.J., Roth K.A., MacGregor G.R., Thompson C.B. & Korsmeyer S.J. 2001. Proapoptotic Bax and Bak: a requisite gateway to mitochondrial dysfunction. Science 292:727-730.). A proteína Bid truncada (tBid) é capaz de induzir a liberação do citocromo c da mitocôndria e ativar a caspase 9 causando a morte celular (Petros et al. 2004Petros A.M., Olejniczak E.T. & Fesik S.W. 2004. Structural biology of the Bcl-2 family of proteins. Biochem. Biophys. Acta 1644:83-94., Bras et al. 2005Bras M., Queenan B. & Susin S.A. 2005. Programmed cell death via mitochondria: different modes of dying. Biochem. 70(2):231-239., Kutuk & Basaga 2006Kutuk O. & Basaga H. 2006. Bcl-2 protein family: Implications in vascular apoptosis and atherosclerosis. Apoptosis 11:1661-1675.).
Os resultados da imunoistoquímica, tomados em conjunto, parecem sugerir diferenças na ativação da apoptose para os componentes materno-fetais da placenta bovina, durante a sua maturação. Moléculas comuns às duas vias, como as Caspases 3, são expressas de maneira ascendente e progressivas ao longo da gestação tanto para o componente materno quanto fetal. Merece destaque, no entanto, o fato de nas células trofoblásticas mononucleadas o Bax deixar de ser importante e diminuir ao longo da gestação, enquanto o Bid e as Caspases 3 e 8 se tornam os mais significativos, aumentando progressivamente.
Conclusões
Bax e Caspases 3 e 8 aumentam de expressão em células trofoblásticas binucleadas no final da gestação, enquanto o Bid se manteve sem alteração significativa.
Nas células trofoblásticas mononucleadas Bax aumenta no início de gestação, e diminui aos 6 meses de gestação com o aumento das Caspases 3 e 8 e Bid com o avanço gestacional.
Os colágenos tipo I e III e a vascularização não aumentam ao final da gestação, diminuindo a adesão dos componentes materno-fetais.
Esses resultados confirmam que as Caspase 3 e 8 e o Bax estão envolvidos nos mecanismos de ativação da apoptose pela vias intrínseca mitocondrial e/ou extrínseca ao longo da gestação em células trofoblásticas binucleadas, e que nas células trofoblásticas mononucleadas o Bax deixa de ser importante, enquanto o Bid e as Caspases 3 e 8 se tornam os mais significativos.
Agradecimentos
Esta pesquisa foi financiada pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pela concessão de bolsa de mestrado e pela FAPEMIG, a quem agradecemos pelo apoio financeiro.
Referências
- Anazetti M.C., Melo P.S., Durán N. & Haun M. 2003. Comparative cytotoxicity of Dimethylamide-Crotonin in the promyelocytic leukemia cell line (HL60) and human peripheral blood mononuclear cells. Toxicol. 188:261-274.
- Antonsson B., Conti F., Ciavatta A., Montessuit S., Lewis S. & Martinou I. 1997. Inhibition of Bax channel-forming activity by Bcl-2. Science 277:370-372.
- Anuradha C.D., Kanno S. & Hirano S. 2001. Oxidative damage to mitochondrial is a preliminary step to caspase-3 activation in fluoride-induced apoptosis in HL60 cells. Free Rad. Biol. Med. 31:367-373.
- Benetone M.Z. 2005. Apoptose e proliferação na placenta de búfalas. Dissertação de Mestrado em Medicina Veterinária, Departamento de Cirurgia, Universidade de São Paulo, São Paulo, SP. 186p.
- Boos A., Janssen V. & Mülling C. 2003. Proliferation and apoptosis in bovine placentomes during pregnancy and around induced and spontaneous parturition as well as in cows retaining the fetal membranes. Reprodroduction 126:469-480.
- Bras M., Queenan B. & Susin S.A. 2005. Programmed cell death via mitochondria: different modes of dying. Biochem. 70(2):231-239.
- Charnock-Jones D.S. & Burton G.J. 2000. Placental vascular morphogenesis. Bailliere Clin. Obstetr. Gynecol. 14:953-968.
- Charnock-Jones D.S., Clark D.E., Licence D., Day K., Wooding F.B.P. & Smith K. 2001. Distribution of vascular endothelial growth factor (VEGF) and its binding sites at the maternal-fetal interface during gestation in pigs. Reproduction 122:753-760.
- Cheung C.Y., Madhu S., Ebaugh M.J. & Brace R.A. 1995. Vascular endothelial growth factor gene expression in ovine placenta and fetal membranes. Am. J. Obstetr. Gynecol. 173(3):753-759.
- Donovan M. & Cotter T.G. 2004. Control of mitochondrial integrity by Bcl-2 family members and caspase-independent cell death. Biochem. Biophys. Acta 1644:133-147.
- Eiler H. & Hopkins F.M. 1993. Successful treatment of retained placenta with umbilical cord injections of collagenase in cows. J. Am.Vet. Med. Assoc. 203:436-443.
- Fleischer A. & Rebollo A. 2004. Induction of p53-independent apoptosis by the BH3-only protein ITM2Bs. FEBS Lett. 34: 313.
- Gottlieb R.A. 2000. Role of mitochondria in apoptosis. Crit. Rev. Eukaryot Gen Expr. 10:231-239.
- Gross T.S., Williams W.F. & Manspeacker J.E. 1985. In vitro placental prostaglandin synthesis in the late pregnant and peripartum cow. Biol. Reprod. 32:154.
- Grunert E. 1984. Placental separation/retention in the bovine. 10th Int. Congr. Anim. Reprod. A.I., Illinois, USA, Plennary and Symposia Papers, IV(XI):17-24.
- Hengartner M.O. 2000. The biochemistry of apoptosis. Nature 407:770-776.
- Hill J.R., Burghardt R.C., Jones K., Long C.R., Looney C.R., Shin T., Spencer T.E., Thompson J.A., Winger Q.A. & Westhusin M.E. 2000. Evidence for placental abnormality as the major cause of mortality in first trimester somatic cell cloned bovine fetuses. Biol. Reprod. 63:1787-1794.
- Kutuk O. & Basaga H. 2006. Bcl-2 protein family: Implications in vascular apoptosis and atherosclerosis. Apoptosis 11:1661-1675.
- Laven R.A. & Peters A.R. 2001. Gros morphometry of the bovine placentome during gestation. Reprod. Domest. Anim. 36:289-296.
- Liu Z., Sun Q.H., Ying Y., Liu J.M. & Peng J.P. 2003. Effect of IFN on caspase-3, Bcl-2 and Bax expression, and apoptosis in rabbit placenta. Cytokine 7:201-209.
- Malard P.F., Barreto Filho J.B., Santos R.L. & Marques Junior A.P. 1996. Proporção volumétrica dos componentes estruturais da placenta de vacas zebu ao longo da gestação. Arq. Bras. Med. Vet. Zootec. 48:553-558.
- Martins V.M.V., Marques Junior A.P., Vasconcelos A.C., Martins E., Santos, R.L. & Lima F.P.C. 2004. Maturação e expulsão placentária em vacas das raças Holandesa e Nelore. Arq. Bras. Med. Vet. Zootec. 56:157-167.
- Meça K.K.O.L., Martins A.S., Del Puerto H.L. & Vasconcelos A.C. 2010. Apoptose e expressão de Bcl-2 e das caspases 3 e 8 em placenta bovina, em diferentes estágios de gestação. Arq. Bras. Med. Vet. Zootec. 62(2):258-264.
- Meça K.K.O.L., Puerto H.L.D., Rodrigues L.V., Rachid M.A., Pereira N.B., Cândido M.G.L. & Vasconcelos A.C. 2011. Apoptose na maturação placentária de vacas em diferentes estágios de gestação: evidenciação imuno-histoquímica e bioquímica. Pesq. Vet. Bras. 31:718-722.
- Melendez P., Gonzalez G., Benzaquen M., Risco C. & Archbald L. 2006. The effect of a monensin controlled-release capsule on the incidence of retained fetal membranes, milk yield and reproductive responses in Holstein cows. Theriogenol. 66:234-241.
- Miyoshi M. & Sawamukai Y. 2004. Specific localization of macrophages in pregnant bovine caruncles. Reprod. Domest. Anim. 39:125-128.
- Moro L., Vasconcelos A.C., Santos F.G.A., Alves C.M., Nunes J.E.S. & Sampaio I.B.M. 2004. Determination of the minimal representative number of microscopic fields to quantify apoptosis in canine lymph nodes. Arq. Bras. Med. Vet. Zootec. 56:408-410.
- Noakes D.E. 1990. Fertilidade e obstetrícia em bovinos. Varela, São Paulo. 25p.
- Nunes J.E.S., Vasconcelos A.C., Martins E., Martins V.M.V.& Marques Jr A.P. 2001. Maturação e liberação placentária em bovinos e a sua relação com apoptose. Rev. Bras. Reprod. Anim. 25:513-525.
- Patel T. & Gores G.J. 1998. Apoptosis in liver transplantation: a mechanism contributing to immune modulation, preservation injury, neoplasia, and viral disease. Liver Transpl. Surg. 4:42-50.
- Petros A.M., Olejniczak E.T. & Fesik S.W. 2004. Structural biology of the Bcl-2 family of proteins. Biochem. Biophys. Acta 1644:83-94.
- Pinto L.M., Ambrósio C.E., Teixeira D.G., Araújo K.P.C., Kfoury Júnior J.R., Morini Junior J.C., Rici R.E.G., Ferreira G.J.B.C., Martins D.S. & Miglino M.A. 2008. Comportamento das células trofoblásticas gigantes na placenta de vacas Nelore (Bos indicus Linnaeus, 1758). Revta Bras. Reprod. Anim. 32(2): 110-121.
- Reynolds L.P. & Redmer D.A. 2001. Angiogenesis in the placenta. Biol. Reprod. 64:1033-1040.
- Santos R.L., Marques Jr A.P. & Barreto Filho J.B. 1996. Proporção volumétrica dos componentes estruturais do placentônio de vacas leiteiras com liberação normal e retenção de placenta. Arq. Bras. Med. Vet. Zootec. 48(3):317-24.
- Saraste A. & Pulkki K. 2000. Morphologic and biochemical hallmarks of apoptosis. Cardiovasc. Res. 45:528-37.
- Sgarbosa F., Barbisan L.F., Brasil M.A., Costa E., Calderon I.M., Gonçalves C.R., Bevilacqua E. & Rudge M.V. 2006. Changes in apoptosis and Bcl-2 expression in human hyperglycemic, term placental trophoblast. Diabetes Res. Clin. Pract. 73:143-149.
- Sharpe K.L., Eiler H. & Hopkins F.M. 1990. Changes in the proportion of type I and type III collagen in the developing and retained bovine placentome. Biol. Reprod. 43:229-235.
- Straszewski-Chavez S.L., Abrahams V.M. & Mor G. 2005. The role of apoptosis in the regulation of trophoblast survival and differentiation during pregnancy. Endocr. Rev. 26:877-897.
- Straszewski-Chavez S.L., Abrahams V.M., Funai E.F. & Mor G. 2004. X-linked inhibitor of apoptosis (XIAP) confers human trophoblast cell resistance to Fas-mediated apoptosis. Mol. Hum. Reprod. 10:33-41.
- Ushizawa K., Takahashi T., Kaneyama K., Hosoe M. & Hashizume K. 2006. Cloning of the bovine antiapoptotic regulator, BCL2-related protein A1, and its expression in trophoblastic binucleate cells of bovine placenta. Biol. Reprod. 74:344-351.
- Wei M.C., Zong W.X., Cheng E.H.Y., Lindsen T., Panoutsakopoulou V., Ross A.J., Roth K.A., MacGregor G.R., Thompson C.B. & Korsmeyer S.J. 2001. Proapoptotic Bax and Bak: a requisite gateway to mitochondrial dysfunction. Science 292:727-730.
- Williams W.F., Margolis M.J., Manspeaker J., Douglass L.W. & Davidson J.F. 1987. Peripartum changes in the bovine palcenta related to fetal membrane retention. Theriogenology 28:213-223.
- Wooding F.B.P., Hobbs T., Morgan G., Heap R.B. & Flint A.P. 1993. Cellular dynamics of growth in sheep and goat synepitheliochorial placentomes: an autoradiographic study. J. Reprod. Fertil. 98:275-283.
Datas de Publicação
-
Publicação nesta coleção
Mar 2016
Histórico
-
Recebido
06 Mar 2015 -
Aceito
15 Jan 2016