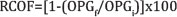Resumos
Para investigar o potencial anti-helmíntico do extrato hidroalcóolico da raiz de Tarenaya spinosa, como alternativa no controle do nematóide gastrintestinal Haemonchus contortus de ovinos, foram realizados testes in vitro com Artemia salina, em seguida, sobre coproculturas contendo ovos do helminto, avaliando a ação ovicida e larvicida do extrato. Após os testes preliminares, foi realizado o teste in vivo em 20 ovinos machos os quais foram divididos em quatro tratamentos Grupo 1: ivermectina 1%; Grupo 2: sem tratamento; Grupo 3: extrato hidroalcóolico de T. spinosa 150μg/mL; Grupo 4: extrato hidroalcóolico de T. spinosa 300μg/mL, amostras de fezes e de sangue foram coletadas para exames parasitológicos e hematológicos. No teste in vitro, a toxicidade frente a A. salina foi de 150μg/mL, obteve-se eficiência de 81,53% sobre ovos e larvas do H. contortus. No teste in vivo, a avaliação da eficácia dos tratamentos foi realizada pelo teste de redução na contagem de ovos fecais (RCOF), os grupos tratados com Ivermectina e T. spinosa a 150μg/mL e 300μg/mL obtiveram os melhores resultados, reduzindo o OPG após 28 dias em 40,6, 41 e 40,2% respectivamente, revelando assim seu potencial fitoterápico para fins de controle de nematódeos gastrintestinais em ovinos.
Tarenaya spinosa; Haemonchus contortus; ação ovicida e larvicida
To investigate the anthelmintic potential of hydroalcoholic extract of the root of Tarenaya spinosa, as an alternative in the control of gastrointestinal nematode Haemonchus contortus in sheep, in vitro tests were performed with Artemia salina then on stool cultures containing helminth eggs, assessing ovicidal and larvicidal action of the extract. After preliminary tests, the in vivo test was performed in 20 male sheep were divided into four treatments: Group 1 Ivermectin 1 %, Group 2: untreated; Group 3: hydroalcoholic extract of T. spinosa 150μg/mL; Group 4: hydroalcoholic extract T. spinosa 300μg/mL, stool samples and blood were collected for parasitological and haematological tests. In in vitro tests, toxicity against A. salina was 150μg/mL, there was obtained 81.53% efficiency against eggs and larvae of H. contortus. In vivo test, evaluating the effectiveness of treatments was performed by reduction test in faecal egg count (RCOF), the groups treated with Ivermectin and T. spinosa the 150μg/mL and 300μg/mL obtained the best results, reducing OPG after 28 days in 40.6, 41 and 42.6% respectively, thus revealing its herbal potential for control of gastrointestinal nematodes in sheep.
Tarenaya spinosa; Haemonchus contortus; ovicidal and/or larvicidal action
ANIMAIS DE PRODUÇÃO
Ação anti-helmíntica do extrato hidroalcóolico da raiz da Tarenaya spinosa (Jacq.) Raf. no controle de Haemonchus contortus em ovinos
Anthelmintic action of the hydroalcoholic extract of the root of Tarenaya spinosa (Jacq.) Raf. for Haemonchus contortus control in sheep
Fabio D. AndradeI; Ana Raquel C. RibeiroI, * * Autor para correspondência: a.raquel.ribeiro@hotmail.com ; Maria C. MedeirosI; Saul S. FonsecaII; Ana Célia R. AthaydeI; Adriano F. FerreiraII; Onaldo G. RodriguesI; Wilson W. SilvaI
IPrograma de Pós-Graduação em Zootecnia, Universidade Federal de Campina Grande (UFCG), Rodovia Patos-Teixeira Km Zero, Jatobá, Patos, PB 58700-970, Brasil. E-mails: medvetfabio@hotmail.com, ducamedeiros@hotmail.com, wouflan@hotmail.com, athayde@cstr@hotmail.com, onlado@cstr.ufcg.edu.br
IILaboratório de Patologia Clínica, Hospital Veterinário, UFCG, Rodovia Patos-Teixeira Km Zero, Jatobá, Patos, PB 58700-970. E-mail: saul_123ssf@hotmail.com, adriano@cstr.ufcg.edu.br
RESUMO
Para investigar o potencial anti-helmíntico do extrato hidroalcóolico da raiz de Tarenaya spinosa, como alternativa no controle do nematóide gastrintestinal Haemonchus contortus de ovinos, foram realizados testes in vitro com Artemia salina, em seguida, sobre coproculturas contendo ovos do helminto, avaliando a ação ovicida e larvicida do extrato. Após os testes preliminares, foi realizado o teste in vivo em 20 ovinos machos os quais foram divididos em quatro tratamentos Grupo 1: ivermectina 1%; Grupo 2: sem tratamento; Grupo 3: extrato hidroalcóolico de T. spinosa 150μg/mL; Grupo 4: extrato hidroalcóolico de T. spinosa 300μg/mL, amostras de fezes e de sangue foram coletadas para exames parasitológicos e hematológicos. No teste in vitro, a toxicidade frente a A. salina foi de 150μg/mL, obteve-se eficiência de 81,53% sobre ovos e larvas do H. contortus. No teste in vivo, a avaliação da eficácia dos tratamentos foi realizada pelo teste de redução na contagem de ovos fecais (RCOF), os grupos tratados com Ivermectina e T. spinosa a 150μg/mL e 300μg/mL obtiveram os melhores resultados, reduzindo o OPG após 28 dias em 40,6, 41 e 40,2% respectivamente, revelando assim seu potencial fitoterápico para fins de controle de nematódeos gastrintestinais em ovinos.
Termos de indexação:Tarenaya spinosa, Haemonchus contortus, ação ovicida e larvicida.
ABSTRACT
To investigate the anthelmintic potential of hydroalcoholic extract of the root of Tarenaya spinosa, as an alternative in the control of gastrointestinal nematode Haemonchus contortus in sheep, in vitro tests were performed with Artemia salina then on stool cultures containing helminth eggs, assessing ovicidal and larvicidal action of the extract. After preliminary tests, the in vivo test was performed in 20 male sheep were divided into four treatments: Group 1 Ivermectin 1 %, Group 2: untreated; Group 3: hydroalcoholic extract of T. spinosa 150μg/mL; Group 4: hydroalcoholic extract T. spinosa 300μg/mL, stool samples and blood were collected for parasitological and haematological tests. In in vitro tests, toxicity against A. salina was 150μg/mL, there was obtained 81.53% efficiency against eggs and larvae of H. contortus. In vivo test, evaluating the effectiveness of treatments was performed by reduction test in faecal egg count (RCOF), the groups treated with Ivermectin and T. spinosa the 150μg/mL and 300μg/mL obtained the best results, reducing OPG after 28 days in 40.6, 41 and 42.6% respectively, thus revealing its herbal potential for control of gastrointestinal nematodes in sheep.
Index terms: Tarenaya spinosa, Haemonchus contortus, ovicidal and/or larvicidal action.
INTRODUÇÃO
A ovinocultura é uma importante fonte de renda no Brasil, pela sua alta produção de leite e de carne, com um rebanho aproximado de 17,3 milhões de animais (IBGE 2012). No entanto, a produção é limitada principalmente por práticas de manejo inadequadas no tocante à higiene sanitária, em especial, más condições de higiene que favorecem o aumento na população de parasitos gastrintestinais, dentre eles, Haemonchus contortus que é considerado o parasito de maior importância epidemiológica pela sua alta prolificidade e resistência a anti-helmínticos (Idris et al. 2012).
Tradicionalmente, o controle dos parasitos gastrintestinais em ovinos no Brasil é realizado por anti-helmínticos sintéticos e seu uso indiscriminado, tem induzido à seleção de linhagens de parasitos resistentes, além de gerar resíduos contaminantes ao meio ambiente e aumentar custos na produção (Sutherland et al. 2008, Zaros et al. 2014).
Vários estudos têm apontado para novas alternativas de controle parasitário. Uma delas, de baixo custo e não poluente, é o uso de fitoterápicos (Eguale et al. 2007), que surge como uma opção devido ao largo uso de plantas na medicina popular, já que o Brasil apresenta a maior diversidade genética vegetal do mundo (Santos et al. 2013)
Dentre várias espécies com potencial anti-helmíntico, destaca-se o mussambê (Tarenaya spinosa), planta objeto desse estudo, muito utilizada empiricamente no combate a diversos tipos de enfermidades (Mcneil et al. 2010). É uma espécie herbácea da família Capparaceae que possui porte arbustivo, chegando à altura de 1 a 1,8 metros e está associada a áreas úmidas de ampla distribuição no Brasil (Lima et al. 2013), citada em outras trabalhos com o nome de Cleome spinosa (Moreira 2011).
Como triagem inicial de extratos vegetais, o teste de toxicidade sobre o microcrustáceo marinho Artemia salina tem sido bastante utilizado (Albuquerque et al. 2014), por ser de baixo custo, fácil execução, não requerer maiores cuidados com assepsia (Reis et al. 2013). Os resultados desse teste relacionam-se a testes de biológicos específicos, como o anti-helmíntico (Silva et al. 2014).
Objetivou-se com o presente trabalho investigar o potencial anti-helmíntico do extrato hidroalcóolico da raiz da T. spinosa, como alternativa no controle do nematódeo gastrintestinal Haemonchus contortus de ovinos.
MATERIAL E MÉTODOS
Coleta do material botânico. Amostras das raízes de Tarenaya spinosa foram coletadas em março de 2013, no município de Patos, localizado no Centro-Oeste do Estado da Paraíba/Brasil, na intersecção das coordenadas geográficas de 6° 56' 13" Latitude S e 37° 23' 14" de Longitude W. A exsicata foi depositada no Herbário do Centro de Saúde e Tecnologia Rural (CSTR) da Universidade Federal de Campina Grande (UFCG) sob o protocolo de número 4021. Os procedimentos de coleta e herborização basearam-se nas metodologias de Cartaxo et al. (2010).
Obtenção do extrato hidroalcoólico. Raízes de T. spinosa foram trituradas e acondicionadas em recipientes de vidro, submetidas à extração por solvente orgânico utilizando etanol absoluto (100%) dissolvido em água destilada, para se obter 70% de concentração. Após 96h de percolação, foram realizadas filtrações simples onde os extratos orgânicos ficaram mantidos à temperatura ambiente (30±2°C) para evaporação total do solvente, segundo metodologia proposta por Pereira et al. (2009).
Teste in vitro. A ação tóxica do extrato hidroalcóolico de T. spinosa sobre Artemia salina e o efeito ovicida e larvicida de Haemonchus contortus foram testados in vitro.
A determinação da toxicidade da raiz do extrato de T. spinosa, foi realizada de acordo com a metodologia descrita por Araújo et al. (2010). O extrato bruto foi diluído em solução de dimetil sulfóxido (DMSO) a 1%, nas concentrações 100, 500 e 1000µg/mL. Utilizaram-se três grupos controle: GC1 (Grupo Controle 1: DMSO a 1%); GC2 (Grupo Controle 2: Solução salina isotônica); GC3 (Grupo controle 3: NaClO a 1%).
A seguir, os valores obtidos com as médias dos náuplios mortos foram submetidos à análise estatística, estimando-se a concentração letal para matar 50% (CL50) das larvas através da análise de Probits, pelo método matemático Trimmed Spearman-Karber (Hamilton et al. 1977) com 95% de intervalo de confiança.
Para testar a ação ovicida e larvicida do extrato, foram feitas coproculturas utilizando a metodologia adaptada de Roberts & O'Sullivan (1950) com fezes contendo apenas ovos do nematóide H. contortus. A contagem média de ovos por grama de fezes (OPG) das amostras utilizadas no experimento foi de 6500.
As coproculturas foram confeccionadas em triplicata, em seguida, adicionados 2,5mL do extrato hidroalcoólico bruto diluído em água destilada na concentração da CL50 obtida a partir do teste sobre A. salina. Para o grupo controle, foi utilizada água destilada segundo metodologia proposta por Chagas & Vieira (2007). As amostras ficaram em repouso por sete dias, em temperatura ambiente e, em seguida, as larvas de terceiro estágio (L3) foram identificadas e contadas em microscópio óptico para determinação da eficácia do tratamento (ET), de acordo com a fórmula descrita por Camurça-Vasconcelos et al. (2007):
Onde:
L3 inicial corresponde à estimativa do número de larvas em cada coprocultura;
L3 do grupo tratado corresponde à quantidade de larvas recuperadas após oito dias de incubação com os diferentes tratamentos.
Teste in vivo. O efeito do extrato hidroalcóolico de T. spinosa sobre H. contortus foi testado in vivo, em ovinos no semiárido paraibano. Para tanto, foram selecionados 20 animais sem padrão de raça definida (SRD), machos, com idade entre 6 e 12 meses e peso médio de 15 kg/PV.
Os animais passaram por um período de adaptação, onde foram mantidos em baias individuais (1,5m2), com piso ripado suspenso, distribuídas em um galpão medindo 15,0 x 8,0m com cobertura em telha de amianto, onde permaneceram durante toda a fase experimental. A alimentação consistia de capim Brachiaria sp. e milho misturado com sabugo e folhas (rolão) e recebiam água ad libitum. Todos os animais foram tratados durante três dias consecutivos com levamisol (10mg/kg PV) sendo que, no último dia também receberam albendazol (10mg/kg PV).
Sete dias após a vermifugação, foi realizada a contagem do OPG para certificar que os animais estavam desparasitados, o que foi verificado com uma contagem de OPG negativa.
Certificados de que os animais estavam isentos de parasitos gastrointestinais, procedeu-se uma monoinfecção através da ingestão oral de aproximadamente 3.000 larvas (L3) do nematódeo Haemonchus contortus, durante três dias consecutivos. Sendo confirmada a presença dos ovos dos parasitos numa nova coleta de fezes realizada 21 dias após a monoinfecção, esta coleta foi considerada a do dia 0 (zero). A seguir, os animais foram divididos aleatoriamente em quatro grupos de cinco animais, sendo cada grupo submetido a tratamentos distintos com cinco repetições, conforme descrito abaixo:
Grupo 1 (G1); Controle positivo, cujos animais receberam Ivermectina 1%, na dose única de 200µg/kgPV por via subcutânea;
Grupo 2 (G2): Controle negativo, cujos animais não receberam nenhum vermífugo sintético ou natural;
Grupo 3 (G3): Animais receberam semanalmente, durante cinco semanas, 10mL do extrato bruto da raiz de T. spinosa, dissolvido em água, na concentração de 150µg/mL, por via oral;
Grupo 4 (G4): Animais receberam semanalmente, durante cinco semanas, 10mL do extrato bruto da raiz de T. spinosa, dissolvido em água, na concentração de 300µg/mL, por via oral.
Iniciados os tratamentos, foram realizadas coletas de fezes nos dias 7, 14, 21 e 28, com o objetivo de avaliar a ação dos tratamentos durante todo o ciclo interno de Haemonchus contortus.
Para determinação da eficiência dos tratamentos, foi utilizado o teste de Redução da Contagem de Ovos Fecais (RCOF) segundo Coles et al. (1992), pela seguinte fórmula:
Onde:
OPGf = média do número de ovos por grama de fezes no final do tratamento;
OPGi = média do número de ovos por grama de fezes no início do tratamento.
Também foram realizadas coletas de sangue nos dias 0, 14 e 28 com o intuito de verificar a ação dos tratamentos sobre o comportamento do volume globular (VG). A coleta de sangue foi realizada diretamente através de punção da veia jugular, sendo a amostra depositada em tubos contendo o anticoagulante ácido Etileno Diamino Tetra-Acético a 10% (EDTA), nas primeiras horas da manhã.
Após a coleta, os tubos foram enviados ao Laboratório de Patologia Clinica Veterinária do Hospital Veterinário da Universidade Federal de Campina Grande para a determinação do Volume Globular (VG) através da técnica do micro hematócrito (Coles, 1984).
Analise estatística. Os valores da contagem de OPG após a transformação logarítmica em log (x+1), os percentuais de RCOF e os valores do VG foram submetidos à análise de variância (ANOVA) de uma via e teste de Tukey a 5% de probabilidade. As análises foram realizadas utilizando o software BIOESTAT 5.0 (Ayres et al. 2007).
RESULTADOS E DISCUSSÃO
Na avaliação in vitro da evolução da toxicidade do extrato hidroalcoólico de Tarenaya spinosa em Artemia salina, constatou-se que a concentração de 150μg/mL foi capaz de causar mortalidade de 50% dos náuplios, conforme demonstrado no Quadro 1, evidenciando que o extrato da raiz é moderadamente tóxico, pois sua CL50 está compreendida entre 80µg/ml e 250µg/ml, conforme classificação de Meyer et al. (1982) e Vinatea (1994).
Albarello et al. (2013) estudando extratos metanólicos das folhas de Tarenaya spinosa em bioensaio com A. salina, não observaram toxicidade nos extratos, nas concentrações testadas: 0,1, 0,5, 1,0, 1,5, 2,0, 2,5, e 3,0mg/ml. Rocha (2012) realizou estudos de toxicidade com Cleome rosea Vahl ex DC., também da família Capparaceae, nos quais não foi verificada toxicidade do extrato a 3,0 mg/L de concentração. Estes resultados poderiam ser atribuídos as partes da planta testada, às diferenças entre as espécies e ao fato de terem sido coletadas em locais diferentes (fatores ambientais).
Quanto ao efeito do extrato sobre Haemonchus contortus, o percentual de eclodibilidade foi de 18,46%; isto demonstra a capacidade da planta em inibir o desenvolvimento dos ovos. Quando se analisa a sua eficiência, observa-se que o percentual foi de 81,53% (Quadro 2). Segundo Powers et al. (1982), um anti-helmíntico é considerado satisfatório quando sua eficiência está entre 80 a 90%. Na literatura consultada não há relatos do efeito anti-helmíntico de T. spinosa, porém vários trabalhos são observados sobre as ações farmacológicas dessa espécie, comprovando efeitos antinociceptivo, antiinflamatório, antimicrobiano (Santos 2005, Mcneil et al. 2010, Liporacci & Simão 2013). Avaliando o potencial anti-helmíntico Chandak et al. (2010) realizaram teste in vitro comprovando o potencial anti-helmíntico do extrato alcoólico das folhas da Cleome viscosa Linn. (Capparidaceae) contra o nematódeo Ascardia galli na concentração mais elevada de 150mg/mL, planta esta pertencente à mesma família da T. spinosa.
Vários estudos apontam fitoterápicos com atividades antihelminticas sobre H. contortus. Ferreira (2013), avaliando os efeitos in vitro do extrato aquoso da Annona muricata sobre ovos, larvas infectantes e formas adultas de H. contortus mostrou 84,91% e 89,08% de eficácia em testes de eclodibilidade de ovos e teste de motilidade larval, respectivamente, resultados semelhantes aos do presente estudo; já Kamaraj et al. (2010) encontraram resultados superiores, avaliando a atividade dos extratos hidroalcoólicos das folhas e sementes de Melia azedarach L. (Meliaceae), onde as folhas inibiram 100% da eclosão dos ovos e 100% de desenvolvimento de larvas na concentração de 12,5mg/ml, concentração muito elevada comparada com o teste realizado neste experimento, onde a concentração foi de 150μg/mL, com eficiência sobre ovos e larvas de 81,53%.
Na avaliação do teste in vivo, o percentual de redução da contagem de OPG foi constatado em todos os grupos tratados. Os grupos de animais que receberam o extrato da T. spinosa nas dosagens de 10mL nas concentrações de 150µg/ml e 300µg/ml, tiveram redução estatisticamente significativa (p<0,05%), quando comparadas ao controle negativo, obtendo percentuais de redução de 41 e 40,2% respectivamente (Quadro 3). Os grupos tratados com o fitoterápico foram estatisticamente iguais ao tratamento com Ivermectina 1%, que apresentou percentual de redução de 40,6%. Quando se comparam os dois grupos que receberam o extrato, não se observou diferença significativa, onde o G4 recebeu uma dosagem duas vezes maior, e o seu resultado não atingiu o esperado na redução do OPG, confirmando que a super dosagem não é caminho correto para controle de nematoides gastrintestinais (Molento 2004). O aumento da biodisponibilidade de fármacos esta correlacionado com a solubilização de substâncias pouco solúveis bem como com a diminuição da dose administrada, garantindo além de vantagens econômicas, a diminuição de efeitos adversos (Kawakami et al. 2002). Apesar dos resultados estarem abaixo dos padrões recomendados pela WAAVP (World Association for the Advancement of Veterinary Parasitology), ressalta-se que muitos anti-helmínticos químicos não reduzem os níveis de infecção parasitária, devido à resistência desenvolvida por populações de parasitas (Coles et al. 1992).
Na avaliação do VG nos grupos tratados, o modelo estatístico não detectou diferenças significativas (P>0,05) na variável, o qual permaneceu dentro dos parâmetros de normalidade para a espécie ovina (Quadro 4), segundo os valores descritos por Kramer (2006). Eguale et al (2007) avaliando o extrato hidroalcóolico de Hedera helix contra o H. contortus, demonstraram que o extrato contribuiu para a manutenção do hematócrito dos animais avaliados, ao contrário do grupo controle sem tratamento, comprovando atividade in vivo contra o parasito, havendo redução significativa da contagem de ovos nas fezes no 7º dia após tratamento.
Os tratamentos realizados com a Ivermectina 1% e T. spinosa mantiveram os percentuais do VG dentro da normalidade. Mesmo parasitados, os cordeiros não apresentaram anemia e ao exame clinico os animais apresentavam mucosas normocoradas, sugerindo que a dose de larvas infectantes provocou uma infecção subclínica e os tratamentos também não influenciaram na queda ou elevação do VG. Beriajaya (2006) afirma que o efeito patogênico de H. contortus resulta da incapacidade do hospedeiro de compensar a perda de sangue, se a perda exceder a capacidade hematopoiética, a anemia progressiva leva o animal rapidamente à morte.
CONCLUSÕES
Os testes in vitro sobre Artemia salina e Haemonchus contortus foram fundamentais na determinação da dosagem para administração nos ovinos, a fim de detectar a aplicabilidade desses extratos no controle de parasitos internos de ovinos.
Mais estudos in vivo, em diferentes desafios epidemiológicos devem ser realizados para detectar a aplicabilidade do extrato, demonstrando seu potencial fitoterápico para fins de controle da população de nematódeos gastrintestinais a nível economicamente sustentável, visto que produtos químicos com eficácia aproximada de 100% promovem rápida seleção de parasitos resistentes.
Agradecimentos - Às amigas, Ana Raquel e Maria do Carmo pela valiosa ajuda neste trabalho e ao co-orientador Prof. Dr. Wilson Wouflan Silva assim como a orientadora Profª. Drª. Ana Célia Rodrigues Athayde. À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), pela concessão de bolsa de mestrado, e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
Recebido em 1 de julho de 2014
Aceito para publicação em 9 de agosto de 2014
- Albarello N., Simões-Gurgel C., Castro T.C., Gayer C.R.M., Coelho M.G.P., Moura R.S. & Mansur E. 2013. Anti-inflammatory and antinociceptive activity of fieldgrowth plants and tissue culture of Cleome spinosa (Jacq.) in mice. J. Med. Plants Res. 7(16):1043-1049.
- Albuquerque L.P., Pontual E.V., Santana G.M.S., Silva L.R.S., Aguiar J.S., Coelho L.C.B.B., Rêgo M.J.B.M., Pitta M.G.R., Silva T.G., Melo A.M.M.A., Napoleão T.H. & Paiva P.M.G. 2014. Toxic effects of Microgramma vacciniifolia rhizome lectin on Artemia salina, human cells, and the schistosomiasis vector Biomphalaria glabrata Acta Trop. 138:23-27.
- Araújo M.G.F., Cunha W.R. & Veneziani R.C.S. 2010. Estudo fitoquímico preliminar e bioensaio toxicológico frente a larvas de Artemia salina Leach. de extrato obtido de frutos de Solanum lycocarpum A.St.-Hill. (Solanaceae). Revta Ciênc. Farm. Básica Apl. 31:205-209.
- Ayres M.A.J., Ayres M.D.L. & Santos A.A. 2007. BIOESTAT: aplicações estatísticas nas áreas das ciências bio-médicas. Ong. Mamiraua, Belém, PA.
- Beriajaya C.D.B. 2006. Haemonchus contortus and Trichostrongylus colubriformis in pen-trials with Javanese thin tail sheep and Kacang cross Etawah goats. Vet. Parasitol. 135(3/4):315-323.
- Camurça-Vasconcelos A.L.F., Bevilaqua C.M.L., Morais S.M., Maciel M.V., Costa C.T.C., Macedo I.T.F., Oliveira L.M.B., Braga R.R., Silva R.A. & Vieira L.S. 2007. Anthelmintic activity of Croton zehntneri and Lippia sidoides essential oils. Vet. Parasitol. 148:288-294.
- Cartaxo S.L., Souza M.M.A. & Albuquerque U.P. 2010. Medicinal plants with bioprospecting potential used in semi-arid Northeastern Brazil. J. Ethnopharmacol. 131:326-342.
- Chagas A.S. & Vieira L.S. 2007. Ação da Azadirachta indica (Neem) em nematódeos gastrintestinais de caprinos. Braz. J. Vet. Res. Anim. Sci. 44(1):49-55.
- Chandak R.R., Bhairat N.K., Devdhe S.J. & Majmudar H.F. 2010. In vitro evaluation of anthelmintic potential of leaves of Cleome viscosa Linn. Int. J. Pharmaceut. Sci. Rev. Res. 5(3), Art.13.
- Coles E.H. 1984. Patologia Clinica Veterinária. Manole, São Paulo.
- Coles G.C., Bauer C., Borgsteede F.H.M., Geerts S., Klei T.R., Taylor M.A. & Waller P.J. 1992. World Association for the Advancement of Veterinary Parasitology (WAAVP) methods for the detection of anthelmintic resistance in nematodes of veterinary importance. Vet. Parasitol. 44:35-44.
- Eguale T., Tilahun G., Debella A., Feleke A. & Makonnen E. 2007. In vitro and in vivo anthelmintic activity of crude extracts of Coriandrum sativum against Haemonchus contortus J. Ethnopharmacol. 110(3):428-433.
- Ferreira L.E., Castro P.M., Chagas A.C., França S.C. & Beleboni R.O. 2013. In vitro anthelmintic activity of aqueous leaf extract of Annona muricata L. (Annonaceae) against Haemonchus contortus from sheep. Exp. Parasitol.134(3):327-32.
- Hamilton M.A., Russo R.C. & Thurston R.V. 1977. Trimmed Sperman-Karber: method for estimating median lethal concentrations in toxicity biossays. Environ. Sci. Technol. 11:714-719.
- IBGE 2012. Instituto Brasileiro de Geografia e Estatística. Disponível em <http://www.sidra.ibge.gov.br> Acessado em 10 jan. 2014.
- Idris A., Moors E., Sohnrey B. & Gauly M. 2012. Gastrointestinal nematode infections in German sheep. Parasitol. Res. 110:1453-1459.
- Kamaraj C., Rahuman A.A., Bagavan A., Mohamed M.J., Elango G., Rajakumar G., Zahir A.A., Santhoshkumar T. & Marimuthu S. 2010. Ovicidal and larvicidal activity of crude extracts of Melia azedarach against Haemonchus contortus (Strongylidae). Parasitol. Res. 106:1071-1077.
- Kawakami K., Yoshikawa T., Moroto Y., Kanaoka E., Takahashi K., Nishihara Y. & Masuda K. 2002. Microemulsion formulation for enhaced absorption of poorly soluble drugs. I. Prescription design. J. Controlled Release 81(1/2):65-74.
- Kramer J.W. 2000. Normal hematology of cattle, sheep and goats, p.1075-1084. In: Feldman B.F., Zink J.G. & Jain N.C. (Eds), Schalm's Veterinary Hematology. 5th ed. Williams and Wilkins, Philadelphia. 1176p.
- Liporacci H.S.N. & Simão D.G. 2013. Levantamento etnobotânico de plantas medicinais nos quintais do Bairro Novo Horizonte, Ituiutaba, MG. Revta Bras. Plant. Med. 15(4):529-540.
- Machado-Filho H.O. & Melo J.I.M. 2013. Aquatic angiosperms in the Environmental Protection Area (EPA) of Cariri, Paraíba state, Brazil. Rodriguesia 64(4):667-683.
- McNeil M.J., Porter R.B., Williams L.A. & Rainford L. 2010. Chemical composition and antimicrobial activity of the essential oils from Cleome spinosa Nat. Prod. Commun. 5(8):1301-1306.
- Meyer B.N., Ferrigni N.R., Putnam J.E., Jacobsen L.B., Nichols D.E., & McLaughlin J.L. 1982. Brine Shrimp: a convenient general bioassay for activ plant constituints. J. Med. Plants Res. 45(5):31-34.
- Molento M.B. 2004. Resistência de helmintos em ovinos e caprinos. Revta Bras. Parasitol. Vet. 13:82-87.
- Moreira H.J.C. & Bragança H.B.N. 2011. Manual de identificação de plantas infestantes: hortifruti. FMC Agricultural Products, São Paulo. 1017p.
- Pereira E.C., Lucetti D.L., Barbosa-Filho J.M., Brito E.M., Monteiro V.S., Patrocínio M.C.A., Moura R.R., Leal L.K.A.M., Macedo D.S., Sousa F.C.F., Viana G.S.B. & Vasconcelos S.M.M. 2009. Coumarin effects on amino acid levels in mice prefrontal cortex and hippocampus. Neurosci. Lett. 454(2):139-142.
- Powers K.G., Wood I.B., Eckert J., Gibson T. & Smith H.J. 1982. World Association for the Advancement of Veterinary Parasitology (WAAVP.) guidelines for evaluating the efficacy of anthelmintics in ruminants (bovine and ovine). Vet. Parasitol. 10(4):265-284.
- Reis J.M., Costa W.F., Minguzzi S. & Silva R.C.L. 2013. Avaliação da composição química e da toxicidade do óleo essencial de folhas e frutos de Jatropha gossypifolia L. Semina, Tech. Exp. 34(2):185-192.
- Roberts F.H.S. & O'Sullivan J.P. 1950. Methods for egg counts and larval cultures for strongyles infesting the gastrointestinal tract of cattle. Aust. J. Agric. Res. 1(1):99-102.
- Rocha A.S. 2012. Produção de carotenóides em culturas in vitro de Cleome rosea Vahl ex DC (Capparaceae) e avaliação de sua toxidade e potencial antioxidante. Dissertação de Mestrado em Biologia Vegetal, Instituto de Biologia Roberto Alcântara Gomes, Universidade do Estado do Rio de Janeiro, Rio de Janeiro, RJ. 94p.
- Santos A.C.B., Silva M.A.P., Santos M.A.F. & Leite T.R. 2013. Levantamento etnobotânico, químico e farmacológico de espécies de Apocynaceae Juss. ocorrentes no Brasil. Revta Bras. Plant. Med. 15(3):442-458.
- Santos D.A. & Menezes J.E.S.A. 2005. Estudo das atividades citotóxica e antimicrobiana de Cleoma spinosa espécie nativa do município de Itapipoca. Anais 57ª Reunião Anual da SBPC, Fortaleza, CE. Disponível em <http://www.sbpcnet.org.br/livro/58ra> Acesso em 3 jul. 2014. (Resumo)
- Silva J.C.C., Teodoro J.A.R., Afonso R.J.C.F., Aquino S.F. & Augusti R. 2014. Photolysis and photocatalysis of ibuprofen in aqueous medium: characterization of by-products via liquid chromatography coupled to high-resolution mass spectrometry and assessment of their toxicities against Artemia Salina J. Mass Spectrom. 49(2):145-153.
- Sutherland I.A., Damsteegt A., Miller C.M. & Leathwick D.M. 2008. Multiple species of nematodes resistant to ivermectin and a benzimidazole-levamisole combination on a sheep farm in New Zealand. N.Z. Vet. J. 56(2):67-70.
- Vinatea J.E. 1994. Artemia um ser vivo excepcional. Panorama da Aqüicultura 4(25):8-9.
- Zaros L.G., Neves M.R.M., Benvenuti C.L., Navarro A.M.C., Sider L.H., Coutinho L.L. & Vieira L.S. 2014. Response of resistant and susceptible Brazilian Somalis crossbreed sheep naturally infected by Haemonchus contortus Parasitol. Res. 113(3):1155-1161.
Datas de Publicação
-
Publicação nesta coleção
09 Dez 2014 -
Data do Fascículo
Out 2014
Histórico
-
Recebido
01 Jul 2014 -
Aceito
09 Ago 2014