Resumen
The thermal decomposition reaction of pinacolone diperoxide (DPP; 0.02 mol kg-1) in 2-methoxyethanol solution studied in the temperature range of 110.0-150.0 °C, follows a first-order kinetic law up to at least 50% DPP conversion. The organic products observed were pinacolone, methane and tert-butane. A stepwise mechanism of decomposition was proposed where the first step is the homolytic unimolecular rupture of the O-O bond. The activation enthalpy and activation entropy for DPP in 2-methoxyethanol were calculated (deltaH# = 43.8 ± 1.0 kcal mol-1 and deltaS# = 31.9 ± 2.6 cal mol-1K-1) and compared with those obtained in other solvents to evaluate the solvent effect.
cyclic peroxide; kinetic; solvent effect
cyclic peroxide; kinetic; solvent effect
Artigo
DESCOMPOSICION TERMICA DEL DIPEROXIDO DE PINACOLONA (3,6-DITERBUTIL-3,6-DIMETIL-1,2,4,5-TETRAOXACICLOHEXANO) EN SOLUCIÓN DE 2-METOXIETANOL
Gladys N. Eyler*, Adriana I. Cañizo e Rosa K. Nesprias
Facultad de Ingeniería, Universidad Nacional del Centro de la Provincia de Buenos Aires, Av. Del Valle 5737, (B7400JWI) Olavarría, Buenos Aires - Argentina
* e-mail: neyler@fio.unicen.edu.ar
Recebido em 5/1/01; aceito em 14/11/01
THERMAL DECOMPOSITION OF PINACOLONE DIPEROXIDE (3,6-ditertbutyl-3,6-dimethyl-1,2,4,5-tetraoxacyclohexane) IN 2-METHOXYETHANOL SOLUTION. The thermal decomposition reaction of pinacolone diperoxide (DPP; 0.02 mol kg-1) in 2-methoxyethanol solution studied in the temperature range of 110.0-150.0 °C, follows a first-order kinetic law up to at least 50% DPP conversion. The organic products observed were pinacolone, methane and tert-butane. A stepwise mechanism of decomposition was proposed where the first step is the homolytic unimolecular rupture of the O-O bond. The activation enthalpy and activation entropy for DPP in 2-methoxyethanol were calculated (DH# = 43.8 ± 1.0 kcal mol-1 and DS# = 31.9 ± 2.6 cal mol-1K-1) and compared with those obtained in other solvents to evaluate the solvent effect.
Keywords: cyclic peroxide; kinetic; solvent effect.
INTRODUCCION
Los peróxidos orgánicos son compuestos que tienen gran importancia en numerosas reacciones de combustión e importantes aplicaciones industriales tales como iniciadores de polimerización, agentes de entrecruzamiento, blanqueadores, desinfectantes, etc.
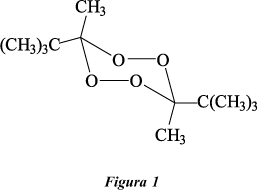
Los estudios cinéticos y mecanísticos correspondientes a la termólisis en solución de peróxidos orgánicos cíclicos y todas las comparaciones entre ellos que de allí surgen, han sido el objetivo inicial de este grupo de investigación. Sin embargo, en los últimos años ha resultado de gran interés la aplicación de este tipo de compuestos como iniciadores polifuncionales en los procesos de polimerización radicálica de estireno. Si bien el diperóxido de pinacolona (3,6-diterbutil-3,6-dimetil-1,2,4,5-tetraoxaciclohexano, DPP; Figura 1) fue utilizado hace varias décadas como iniciador en la obtención de poliestireno1, actualmente, a través de la introducción de algunas modificaciones en las condiciones de trabajo, se ha logrado su utilización a temperaturas relativamente altas y con mayores conversiones del monómero (ca. 99 %)2. Por lo tanto, el estudio del comportamiento de estos peróxidos en solución es complementario de los estudios relacionados con su aplicación en procesos industriales.
Las técnicas de polimerización que se están desarrollando contemplan el agregado del peróxido cíclico polifuncional en estado sólido2 o en solución3, dando en cada caso diferentes resultados. De todos los peróxidos orgánicos cíclicos estudiados hasta el momento, el DPP y el triperóxido cíclico de dietilcetona (TPDEC) son los que han manifestado el mejor comportamiento como iniciadores polifuncionales. Sin embargo, el efecto de solvente que presentan algunos peróxidos orgánicos en su descomposición térmica no siempre se transmite en el mismo sentido en relación a su función como iniciador cuando se lo agrega en solución, como se ha evidenciado para el TPDEC3.
De acuerdo a los resultados obtenidos en estudios anteriores la constante de velocidad correspondiente a la descomposición térmica de DPP no es sensiblemente afectada cuando la reacción se lleva a cabo en benceno4, acetonitrilo5, ácido acético5, n-octano5 o tolueno6. Por ello, resulta de interés encontrar algún solvente donde se aumente la velocidad de la reacción de descomposición del DPP. En estudios anteriores con otros compuestos peroxídicos se ha determinado quecuando se utiliza como solvente 2-propanol7,8, ácido acético5,9 y 2-metoxietanol10,11 la descomposición de los peróxidos se acelera. El objetivo de este trabajo es comprobar si la termólisis del DPP en solventes de la familia de los alcoholes presenta algún comportamiento similar al observado para otros peróxidos cíclicos derivados de cetonas. En este trabajo se presentan los parámetros cinéticos y de activación del DPP en 2-metoxietanol, y se establecen comparaciones y correlaciones con los datos correspondientes obtenidos previamente para la misma reacción en otros solventes. Los resultados obtenidos serán utilizados para continuar con los estudios relacionados con el empleo de DPP como iniciador bifuncional en la polimerización de estireno.
PARTE EXPERIMENTAL
Síntesis del diperóxido de pinacolona
El diperóxido de pinacolona se prepara utilizando una modificación de la técnica descripta por McCullough12 para la obtención de diperóxidos cíclicos derivados de cetonas lográndose una mejora en el rendimiento de casi un 100 por ciento.
En un erlenmeyer enfriado a -15 ºC se colocan 14 g de ácido sulfúrico 70 % (vol), sobre los cuales se agregan 6 mL de pinacolona (0,048 moles), manteniendo el sistema en agitación constante. A esta mezcla, que se torna amarillenta, se le adicionan gota a gota desde una ampolla de decantación y en el transcurso de una hora y media 5,7 mL de peróxido de hidrógeno al 30 % (0,056 moles). El precipitado blanco obtenido se filtra y se lava con agua destilada hasta eliminar el exceso de ácido, finalmente se lava con un pequeño volumen (2 mL) de acetona y se coloca en el desecador (3,23 g, 67% de rendimiento).
El producto crudo se purifica por recristalización (dos veces) con metanol (p.f: 122-124 ºC, lit.12 124ºC). Las bandas de absorción obtenidas por espectroscopía FTIR (KBr) son: 1)- 2988,183 (s) cm-12)-2970,215 (s) cm-13)- 2927,200 (m) cm-1 4)- 2878,032 (m) cm-1 5)- 1485,423 (m) cm-16)- 1459,500 (s) cm-1 7)- 1390,500 (s) cm-18)- 1124,637 (vs) cm-1 9)- 1175,305 (s) cm-110)- 1024,600 (m) cm-1 11)- 939,249 (m) cm-1 12)- 902,817 (s) cm-1 13)- 815,200 (m) cm-114)- 611,853 (m) cm-1 15)- 546,953 (m) cm-1. Estos valores coinciden con los informados en la literatura12.
Solventes utilizados
El 2-metoxietanol (libre de peróxidos) utilizado como solvente y el n-octano (patrón interno) fueron purificados según técnicas apropiadas13 y controlada su pureza por CG.
Determinaciones cinéticas
Tubos Pyrex cerrados en un extremo (8 cm de largo x 2 mm diám. int.) fueron cargados con ca. 0,5 mL de la solución de DPP en el solvente adecuado, algunos sellados en presencia de oxígeno con la llama de un soplete y otros convenientemente degasificados en la línea de vacío (-196ºC) y cerrados de igual forma.
Estas ampollas fueron sumergidas en un baño de aceite de silicona termostatizado (± 0,1ºC) a la temperatura elegida, extrayéndose las mismas a tiempos convenientemente determinados y deteniendo la descomposición del DPP a 0 ºC, en un baño de hielo y agua.
Las determinaciones cuantitativas del DPP remanente en las soluciones pirolizadas, la cuantificación de la pinacolona y la determinación cualitativa de otros productos formados (metano, terbutano), se realizaron por CG utilizando el método de patrón interno (n-octano). Se empleó un cromatógrafo de gases marca Konik, modelo KNK 2000, equipado con detector FID, columna rellena tipo SE30 (metil silicona Gum-Rubber) y se utilizó nitrógeno como gas portador.
Los análisis se realizaron a temperatura programada manteniendo inicialmente la columna a 60 ºC durante 12 min, luego se incrementó la temperatura a razón de 10 ºC por minuto hasta alcanzar una temperatura final de 160 ºC. La temperatura del inyector se fijó en 125 ºC.
Los valores de kexp de primer orden fueron calculados por el método de los mínimos cuadrados como la pendiente de la recta determinada cuando se representa ln [DPP] en función del tiempo.
Utilizando la ecuación de Arrhenius se analizó el efecto de la temperatura sobre la kexp y se calculó la energía de activación y el factor preexponencial correspondiente. Los parámetros de activación (DH# y DS#) se calcularon utilizando la representación de Eyring.
RESULTADOS Y DISCUSION
La descomposición del DPP se ha estudiado en solución de 2-metoxietanol, en el ámbito de temperaturas de 110,0 ¾ 150,0 ºC y a concentraciones iniciales de 0,02 mol kg-1. La termólisis del DPP en 2-metoxietanol, cumple con una ley cinética de primer orden hasta conversiones del peróxido de ca. 50 por ciento. Si bien a concentraciones bajas del DPP los efectos de reacciones secundarias de descomposición inducida por radicales libres originados en el medio de reacción, pueden considerarse mínimos o despreciables, se realizaron algunas experiencias en presencia de oxígeno. Los resultados obtenidos indican que prácticamente no existen diferencias en los valores de las constantes de velocidad (Tabla 1) cuando el oxígeno está presente o cuando fue eliminado del medio, lo que indicaría que los radicales libres generados no inducen la descomposición del DPP.
A los efectos de corroborar que las constantes de velocidad calculadas no incluyen una contribución de reacciones inducidas por especies radicalarias derivadas del peróxido, se investigó el efecto de la concentración de DPP sobre el valor de la kexp a 140 ºC (Tabla 1). A causa de la baja solubilidad del DPP en 2-metoxietanol,la concentración más elevada que se preparó fue ca. 0,2 mol kg-1, observándose que no existe efecto de la concentración sobre la velocidad de reacción.
El efecto de la temperatura sobre los valores de kexp (Tabla 1), puede representarse por la ecuación de Arrhenius (ec. 1), donde los errores mostrados corresponden a los desvíos estándar obtenidos por el tratamiento de los datos cinéticos con el método de los mínimos cuadrados14,15 y la energía de activación está expresada en cal mol-1.
La linealidad de la ecuación de Arrhenius (r = 0,990) en un intervalo de temperaturas relativamente amplio (40 ºC), sugiere que los parámetros de activación calculados (energía de activación y factor preexponencial, ec. 1), para la reacción del DPP en 2-metoxietanol corresponden a un proceso simple representado por la ruptura homolítica16,17 del enlace O-O , (ec. 2):
El birradical intermediario (ec. 2), puede experimentar posteriores reacciones que involucren rupturas de enlaces C-O, justificando la aparición de pinacolona con un rendimiento del 60 % (1,2 mol pinacolona/mol DPP descompuesto), o rupturas C-C dando lugar a radicales terbutilo y metilo, que luego reaccionan con el solvente extrayendo hidrógeno para formar metano (ec. 3) y terbutano (ec. 4):
Los radicales R. que derivan del solvente vuelven a reaccionar con él dando una serie de compuestos de elevado peso molecular entre los cuales se pueden mencionar el 2,5,8,11,14- pentaoxapentadecano y el 2,5,8,11,14,17-hexaoxaoctadecano, detectados por CG/EM.
La termólisis de algunos tetraoxaciclohexanos sustituídos indica que el rendimiento de la correspondiente cetona y de los otros productos de reacción depende fuertemente del tipo de sustrato18 y de la naturaleza del solvente de reacción19.
El efecto del solvente sobre la kexp puede analizarse a través de la representación del logaritmo natural de la constante de velocidad para la descomposición del DPP en distintos solventes en función de algún parámetro empírico de polaridad de los mismos. En la Figura 2 se presenta la correlación existente entre el logaritmo natural de las constantes de velocidad y el parámetro empírico de polaridad del solvente ET(30) determinado por Dimroth y Reichardt20-22 para una importante cantidad de solventes y mezclas de solventes. Este parámetro se basa en la energía de transición, medida en kcal mol-1, asociada a la banda de absorción solvatocrómica de mayor longitud de onda del colorante betaína piridinio N-fenóxido (colorante nº 30 en el trabajo original de dichos autores20) o de algún otro derivado de la betaína. Este parámetro es una medida de las interacciones entre soluto/solvente en la región cibotáctica y no tiene equivalencia directa con otras propiedades macroscópicas del solvente como la constante dieléctrica o el momento dipolar. Al respecto, puede observarse que a medida que aumenta la polaridad del solvente, determinada a través del parámetro ET(30), también aumenta la velocidad de descomposición del peróxido, sin embargo esta correlación no es lineal. Este hecho nos permite sugerir que las interacciones específicas soluto/solvente son condicionantes de la reactividad del DPP en solución. Se ha demostrado en la bibliografía5,7-9 que para diferentes peróxidos cíclicos estas interacciones corresponden a enlace puente de hidrógeno entre el solvente prótico y el enlace O-O.
Por otro lado, si se analizan los parámetros de activación, puede observarse que los correspondientes a las determinaciones cinéticas en 2-metoxietanol (Tabla 2) son muy superiores a aquellos observados en los otros solventes. El elevado valor hallado para la entropía de activación en 2-metoxietanol es comparable al informado9 para la descomposición térmica de una trioxazina sustituída en ácido acético.
En general, en una serie de reacciones23 que involucre cambios en el solvente o moderados cambios en la estructura de los compuestos considerados, la entalpía y la entropía varían, pero no en forma independiente. En este caso, se observa la existencia de una compensación entre los parámetros de activación ya que se mantiene la constancia en los valores de la energía libre de activación en los diferentes solventes. Sin embargo, cabe aclarar que cuando en una serie de reacciones se estudian efectos de solvente sobre la velocidad de reacción, no resulta suficiente a fin de establecer conclusiones considerar únicamente el cambio en la energía libre de activación correspondiente, ya que la misma está determinada por las contribuciones de los términos entálpico y entrópico. A veces la correlación entre ambos parámetros se aproxima a una relación lineal característica para esa serie de reacciones en particular24. Existen en la literatura4-6,8,9,25 antecedentes que muestran este efecto para otros peróxidos cíclicos.
La existencia de una compensación lineal entre los parámetros de activación para la descomposición térmica del DPP en distintos solventes (Tabla 2) de acuerdo con el criterio de Leffler24, también conocida como "efecto de compensación", puede representarse a través de la ecuación (5), que muestra una relación aproximadamente lineal (r = 0,976), siendo 426 K (153 ºC) el valor de la "temperatura isocinética" (b), o sea la temperatura a la cual en todos los solventes la reacción de descomposición térmica de DPP transcurriría a la misma velocidad.
Dado que los estudios cinéticos del DPP en cada solvente se han realizado en un intervalo de temperaturas de al menos 30 ºC y que los errores en los parámetros de activación (Tabla 2) son despreciables frente a las diferencias observadas entre los mismos (DDH# @ 14 kcal mol-1 y DDS# @ 33,4 cal mol-1 K-1), podría considerarse que la correlación de acuerdo al criterio de Leffler12 es válida. Sin embargo al analizar la reactividad del DPP en varios solventes a distintas temperaturas, el peróxido muestra comportamientos diferentes, por ejemplo a 140 ºC (Tabla 2) la reacción es más rápida en solventes próticos, como 2-propanol o 2-metoxietanol, que en solventes no próticos.
Estas observaciones concuerdan con el hecho de que la relación isocinética ha sido muy criticada26-28 cuando se utiliza como único tratamiento para analizar la existencia de efecto de solvente o de sustituyentes sobre una reacción dada y su validez debe ser consistente con el tratamiento propuesto posteriormente por Exner26. Así la representación del logaritmo natural de la constante de velocidad en cada solvente en función de 1/T (Figura 3) debe ser lineal de acuerdo con la ecuación de Arrhenius y dichas líneas deben interceptarse en un punto que se conoce como la inversa de la "temperatura isocinética" (b-1). La aplicación de un método estadístico27,28 permitiría obtener la función Su (suma residual de cuadrados) cuyo mínimo corresponde a b-1. Para este caso en particular, se observa que no existe dicho punto de intersección ya que las rectas se cortan de a pares en todo el rango de temperaturas experimentales, por lo cual no es posible aplicar el tratamiento estadístico para determinar el valor de b. Además, de acuerdo al tratamiento de Leffler, la temperatura isocinética cae dentro del rango de temperaturas experimentales, por lo cual no resulta sorprendente encontrar inversión en el comportamiento cinético de los diferentes sistemas estudiados a las distintas temperaturas consideradas. Sin embargo, es evidente que la reacción de descomposición térmica del DPP es afectada por solventes de diferentes características fisicoquímicas (Tabla 2). Por ello, se postula que en la serie de reacciones consideradas, donde el mecanismo de reacción es común y corresponde a la ruptura homolítica unimolecular del enlace O-O, se ponen de manifiesto diferentes mecanismos de interacción soluto /solvente, a los cuales pueden atribuirse los cambios en los valores de los parámetros de activación.
CONCLUSIONES
1 - La termólisis del DPP en 2-metoxietanol sigue una cinética de primer orden hasta al menos una vida media.
2 - Las condiciones de trabajo elegidas permiten descartar reacciones secundarias inducidas por radicales libres derivados del peróxido por lo cual los valores de kexp informados corresponden a la ruptura homolítica del enlace peroxídico.
3 - El efecto observado en la reactividad del DPP a diferentes temperaturas y en diferentes solventes es de gran utilidad al momento de utilizar estos sistemas para la obtención de polímeros derivados de estireno.
REFERENCIAS
1. Walter, H. A.; US pat. 2591645 1952. (C A 1953, 47, 601).
2. Cerna, J. R.; Morales, G.; Eyler, G. N.; Cañizo, A. I; J. Appl. Polym. Sci. 2002, 83, 1.
3. Cerna, J. R.; Morales, G.; Cañizo, A. I.; Eyler, G. N.; J. Org. Chem. 2001, submetido.
4. Cafferata, L. F. R.; Eyler, G. N.; Cañizo, A. I.; Svartman, E. L.; Borkowski, E. J.; J. Org. Chem. 1990, 55, 1058.
5. Cafferata, L. F. R.; Eyler, G. N.; Svartman, E. L.; Cañizo, A. I. ; Alvarez, E. E.; J. Org. Chem. 1991, 56, 411.
6. Eyler, G.N.; Cañizo, A.I.; trabalho no publicado.
7. Cañizo, A. I.; Cafferata, L. F. R.; An. Asoc. Quim. Argent. 1992, 80, 345.
8. Eyler, G. N.; Cañizo, A. I.; Alvarez, E. E.; Cafferata, L. F. R.; An. Asoc. Quim. Argent. 1994, 82, 175; Eyler, G. N.; Tesis de Maestría; UNER, Argentina, 1996.
9. Cafferata, L. F. R.; Nojima M.; Yamakoshi H.; Int. J. Chem. Kim. 1996, 28, 21; Eyler, G. N.; Cañizo, A. I.; Alvarez, E. E.; Revista Copaqui 1995, 15, 953.
10. Leiva, L.; Gómez Vara, E.; trabalho no publicado.
11. Eyler, G. N.; trabalho no publicado.
12. McCullough, K. J.; Morgan, A. R.; Nonhebel, D. C.; Pauson, P. L.; White, G. J.; J. Chem. Res., Synop. 1980, 34, M 0601.
13. Perrin, D. D.; Armarego, W. L. F.; Purification of Laboratory Chemicals, Pergamon Press, 3° ed., 1988, p 218.
14. Schaleger, L. L.; Long, F. A.; Adv. Phys. Org. Chem. 1963, 1, 1.
15. Huyberechts, S.; Halleux, A.; Kruys, P.; P. Bull, Soc. Chim. Belg. 1955, 64, 203.
16. Cafferata, L.F.R.; Eyler, G.N.; Mirífico, M.V.; J. Org. Chem. 1984, 49, 2107.
17. Castro, E. A.; Villar, H.O.; Stradella, O. G.; J. Mol. Struct. Theochem. 1986, 7, 135.
18. McCullough, K. J.; Morgan, A. R.; Nonhebel, D. C.; Pauson, P. L.; J. Chem. Res., Synop. 1981, 35, M 0629. Ibid 36, M 0651.
19. Sanderson, J. R.; Story, P. R.; J. Org. Chem. 1974, 39, 3463.
20. Dimroth, K.; Reichardt, C.; Siepmann, T.; Bohlmann, F.; Liebigs Ann. Chem. 1963, 661, 1.
21. Dimroth, K.; Reichardt, C.; Siepmann, T.; Bohlmann, F.; Liebigs Ann. Chem. 1969, 93, 727.
22. Reichardt, C. En Solvents and Solvent Effects in Organic Chemistry, 2º ed. (Suiza), Cambridge; New York, NY: VCH, 1988, cap. 7, p. 359.
23. Bunnett, J. F. En Investigation of Rates and Mechanisms of Reaction, Parte I, vol VI de Techniques of Chemistry, Weissberger, A. ed., Wiley: NY, 1974, Cap. VIII, p 367.
24. Leffler, J. E.; J. Org. Chem. 1955, 20, 1202.
25. Eyler, G. N.; Cañizo, A. I.; Mateo, C. M.; Alvarez, E. E.; Cafferata, L. F. R.; J. Org. Chem. 1999, 64, 8457.
26. Exner, O.; Collect. Czech. Chem. Commun. 1972, 37, 1425.
27. Linert, W.; Jameson, R. F.; Chem. Soc. Rev. 1989, 18, 477.
28. Petersen, R. C.; J. Org. Chem. 1964, 29, 3133.
- 1. Walter, H. A.; US pat. 2591645 1952 (C A 1953, 47, 601).
- 2. Cerna, J. R.; Morales, G.; Eyler, G. N.; Cañizo, A. I; J. Appl. Polym. Sci. 2002, 83, 1.
- 3. Cerna, J. R.; Morales, G.; Cañizo, A. I.; Eyler, G. N.; J. Org. Chem. 2001, submetido.
- 4. Cafferata, L. F. R.; Eyler, G. N.; Cañizo, A. I.; Svartman, E. L.; Borkowski, E. J.; J. Org. Chem 1990, 55, 1058.
- 5. Cafferata, L. F. R.; Eyler, G. N.; Svartman, E. L.; Cañizo, A. I. ; Alvarez, E. E.; J. Org. Chem 1991, 56, 411.
- 6. Eyler, G.N.; Cañizo, A.I.; trabalho no publicado.
- 7. Cañizo, A. I.; Cafferata, L. F. R.; An. Asoc. Quim. Argent. 1992, 80, 345.
- 8. Eyler, G. N.; Cañizo, A. I.; Alvarez, E. E.; Cafferata, L. F. R.; An. Asoc. Quim. Argent 1994, 82, 175;
- Eyler, G. N.; Tesis de Maestría; UNER, Argentina, 1996.
- 9. Cafferata, L. F. R.; Nojima M.; Yamakoshi H.; Int. J. Chem. Kim. 1996, 28, 21;
- Eyler, G. N.; Cañizo, A. I.; Alvarez, E. E.; Revista Copaqui 1995, 15, 953.
- 10. Leiva, L.; Gómez Vara, E.; trabalho no publicado.
- 11. Eyler, G. N.; trabalho no publicado.
- 12. McCullough, K. J.; Morgan, A. R.; Nonhebel, D. C.; Pauson, P. L.; White, G. J.; J. Chem. Res., Synop 1980, 34, M 0601.
- 13. Perrin, D. D.; Armarego, W. L. F.; Purification of Laboratory Chemicals, Pergamon Press, 3° ed., 1988, p 218.
- 14. Schaleger, L. L.; Long, F. A.; Adv. Phys. Org. Chem. 1963, 1, 1.
- 15. Huyberechts, S.; Halleux, A.; Kruys, P.; P. Bull, Soc. Chim. Belg 1955, 64, 203.
- 16. Cafferata, L.F.R.; Eyler, G.N.; Mirífico, M.V.; J. Org. Chem 1984, 49, 2107.
- 17. Castro, E. A.; Villar, H.O.; Stradella, O. G.; J. Mol. Struct. Theochem. 1986, 7, 135.
- 18. McCullough, K. J.; Morgan, A. R.; Nonhebel, D. C.; Pauson, P. L.; J. Chem. Res., Synop. 1981, 35, M 0629. Ibid 36, M 0651.
- 19. Sanderson, J. R.; Story, P. R.; J. Org. Chem. 1974, 39, 3463.
- 20. Dimroth, K.; Reichardt, C.; Siepmann, T.; Bohlmann, F.; Liebigs Ann. Chem. 1963, 661, 1.
- 21. Dimroth, K.; Reichardt, C.; Siepmann, T.; Bohlmann, F.; Liebigs Ann. Chem. 1969, 93, 727.
- 22. Reichardt, C. En Solvents and Solvent Effects in Organic Chemistry, 2º ed. (Suiza), Cambridge; New York, NY: VCH, 1988, cap. 7, p. 359.
- 23. Bunnett, J. F. En Investigation of Rates and Mechanisms of Reaction, Parte I, vol VI de Techniques of Chemistry, Weissberger, A. ed., Wiley: NY, 1974, Cap. VIII, p 367.
- 24. Leffler, J. E.; J. Org. Chem 1955, 20, 1202.
- 25. Eyler, G. N.; Cañizo, A. I.; Mateo, C. M.; Alvarez, E. E.; Cafferata, L. F. R.; J. Org. Chem. 1999, 64, 8457.
- 26. Exner, O.; Collect. Czech. Chem. Commun 1972, 37, 1425.
- 27. Linert, W.; Jameson, R. F.; Chem. Soc. Rev. 1989, 18, 477.
- 28. Petersen, R. C.; J. Org. Chem. 1964, 29, 3133.
Fechas de Publicación
-
Publicación en esta colección
07 Ago 2002 -
Fecha del número
Mayo 2002
Histórico
-
Recibido
05 Ene 2001 -
Acepto
14 Nov 2001