Resumo
In this work the effects of time and temperature of thermal treatments under reducing atmosphere (H2) on PtRu/C catalysts for the hydrogen oxidation reaction (HOR) in the presence of CO on a proton exchange membrane fuel cell (PEMFC) single cells have been studied. It can be seen that the increase of the treatment temperature leads to an increasing sintering of the catalyst particles with reduction of the active area, although the catalyst treated at 550 ºC presents more CO tolerance for the HOR.
electrocatalysis; thermal treatment; CO tolerance
electrocatalysis; thermal treatment; CO tolerance
ARTIGO
Estudo do efeito de tratamentos térmicos em catalisadores de PtRu/C frente à reação de oxidação de hidrogênio na presença de CO
Study of the effect of thermal treatments of PtRu/C catalysts on the hydrogen oxidation reaction in the presence of CO
Pietro Papa Lopes; Edson Antonio Ticianelli* * e-mail: edsont@iqsc.usp.br
Departamento de Físico Química, Instituto de Química de São Carlos, Universidade de São Paulo, CP 780, 13560-970 São Carlos - SP, Brasil
ABSTRACT
In this work the effects of time and temperature of thermal treatments under reducing atmosphere (H2) on PtRu/C catalysts for the hydrogen oxidation reaction (HOR) in the presence of CO on a proton exchange membrane fuel cell (PEMFC) single cells have been studied. It can be seen that the increase of the treatment temperature leads to an increasing sintering of the catalyst particles with reduction of the active area, although the catalyst treated at 550 ºC presents more CO tolerance for the HOR.
Keywords: electrocatalysis; thermal treatment; CO tolerance.
INTRODUÇÃO
As células a combustível são sistemas que convertem a energia química de um combustível (H2, Met-OH, Et-OH etc.) e um oxidante (O2) em energia elétrica e calor1-3. Dentre os diversos tipos de células existentes, aquelas que contêm uma membrana de troca protônica como eletrólito (PEMFC) apresentam grande destaque devido à geração de altas densidades de potência em baixas temperaturas (< 130 ºC) e à possibilidade de aplicações móveis e portáteis.
Porém, a utilização de hidrogênio proveniente de reforma compromete o desempenho da célula devido à presença de traços de CO o qual, via adsorção sobre a superfície catalítica (Pt dispersa em carbono, Pt/C), acaba por bloquear os sítios necessários à reação de oxidação de hidrogênio (ROH)4,5. Para resolver este problema, tem sido proposta na literatura a utilização de ligas bimetálicas de Pt, na qual a presença do segundo metal leva ao aumento da tolerância ao CO por meio de dois processos principais6-10: o mecanismo bifuncional e o efeito eletrônico. O mecanismo bifuncional atua na reação de oxidação do CO adsorvido devido à formação de espécies oxi-hidróxi em potenciais menores que aqueles necessários para Pt, sendo fundamental a presença de tais espécies para a eliminação do CO como CO28,11. Assim, o mecanismo bifuncional é essencialmente relacionado ao mecanismo de oxidação do CO. O efeito eletrônico relaciona-se ao deslocamento da energia da banda 5d da Pt, o que pode levar ao enfraquecimento da adsorção do CO na superfície10,12. No entanto, apesar de ser notável a presença de ambos os fatores no aumento da tolerância ao CO, ainda permanece a dúvida quanto ao processo mais efetivo.
Dessa forma, muitos autores afirmam que tratamentos térmicos nos catalisadores em determinadas atmosferas ajudam a promover a segregação do átomo que possui maior afinidade pela atmosfera empregada8,11-14, sendo que este tipo de estudo sobre os parâmetros de tempo e temperatura carece de estudo sistemático. Assim, neste trabalho foi estudada a influência dos parâmetros de tempo e temperatura em catalisadores de PtRu/C, submetidos a vários tratamentos térmicos, sobre sua performance como ânodos de células a combustível PEMFC alimentadas com hidrogênio contaminado com CO. Para avaliação destes catalisadores foram realizados experimentos de difração de raios-X (DRX), voltametria cíclica e voltametria de "stripping" de CO, além de serem obtidas curvas de polarização em estado estacionário em células PEMFC unitárias.
PARTE EXPERIMENTAL
No estudo dos parâmetros de tratamento térmico em atmosfera redutora (H2) foi utilizado o catalisador de 30% (em massa) PtRu/C (E-Tek, EUA) com composição atômica Pt:Ru de 50:50 e 30% Pt/C (E-Tek, EUA) para comparação com materiais tratados termicamente. Os tratamentos térmicos foram efetuados em um forno tubular, sendo os materiais colocados em barcas de porcelana. O gás hidrogênio foi passado pelo tubo contendo as amostras durante todo o procedimento. Os materiais foram tratados a 250, 550 e 850 ºC durante 30, 60 e 180 min, com rampa de aquecimento de 10 ºC min-1 e sendo a passagem de gás encerrada a temperaturas abaixo de 50 ºC.
Os materiais tratados foram caracterizados fisicamente via difração de raios-X (DRX) utilizando um difratômetro URD-6 Carl Zeiss-Jena com velocidade de varredura constante a 2º min-1 no intervalo de 20 a 100 em 2q graus. A radiação incidente corresponde a Ka-Cu com comprimento de onda de 1,5406 Å. Na determinação do tamanho médio das partículas e do parâmetro de rede "a", foram utilizadas equações já mostradas na literatura15, sendo utilizado o plano (220) da estrutura cúbica de face centrada (cfc) da platina.
Os diferentes eletrocatalisadores tratados foram utilizados para preparar os eletrodos de difusão de gás (EDGs), empregados como ânodos na célula PEMFC unitária, como descrito previamente1,16. Os EDGs (área geométrica de 4,6 cm2) consistiram de uma camada difusora, a qual foi feita a partir da deposição de uma suspensão contendo pó de carbono (Vulcan XC-72R, Cabot) e 15% de PTFE (Teflon TE-306A, Du Pont) sobre um tecido de carbono (PWB-3, Stackpole), e de uma camada catalisadora que foi preparada a partir da deposição do material catalítico em uma das faces da camada difusora1,16. Em todos os casos os ânodos continham 0,4 mg cm-2 de metal (30% Metal/C) e 40% (m/m) de Nafion® e os cátodos 0,4 mg cm-2 de Pt (20% Pt/C) e 35,5% de Nafion® na camada catalisadora. Os conjuntos membrana-eletrodos (MEA, "membrane and electrode assembly") foram preparados por prensagem a quente na temperatura de 125 ºC e 1000 kgf cm-2 durante 2 min. Em todos os casos foram utilizadas membranas de Nafion® 115 (Du Pont) previamente tratadas1,16 como eletrólito.
O sistema membrana-eletrodos foi acondicionado entre placas de grafite que permitem o contato elétrico e a distribuição uniforme do fluxo dos gases que alimentam a célula. O conjunto todo foi acondicionado entre placas terminais de alumínio, sendo que através destas ocorrem a coleta da eletricidade e o controle de aquecimento da célula unitária1,16. Todos os experimentos de polarização foram conduzidos de forma galvanostática com a temperatura da célula a 85 ºC, temperatura do oxigênio umidificado a 90 ºC e pressurizado a 1,7 atm e hidrogênio puro ou contaminado com 100 ppm de CO umidificado a 100 ºC e pressurizado a 2 atm. Antes da obtenção das curvas de polarização esperou-se 2 h para que o sistema alimentado com H2 puro entrasse em estado estacionário a um potencial da célula constante a 0,7 V. Quando o combustível foi trocado para H2 contaminado com CO, o potencial da célula foi alterado para 0,8 V.
As condições para a realização dos experimentos de voltametria cíclica e voltametria de "stripping" de CO estão discutidas na literatura7. Estas experiências foram realizadas a 20 mV s-1 à temperatura ambiente, apenas nos ânodos (eletrodo de trabalho) após a injeção constante de nitrogênio para desoxigenação do sistema. Ao cátodo baseado em Pt/C, que atuou como eletrodo de referência (Pt, H2/H+ ERH) e como contra-eletrodo, foi injetado H2 puro. Após a realização das voltametrias cíclicas, passou-se durante 30 min CO puro no eletrodo de trabalho (ânodo da célula), sendo o seu potencial fixado em 0,1 V vs. ERH. Depois foi borbulhado N2 durante 30 min para eliminar traços de CO não adsorvidos no catalisador. Foi realizada uma voltametria a 10 mV s-1 logo em seguida para se obter o perfil da oxidação do CO adsorvido. Estes experimentos foram realizados em um potenciostato-galvanostato (Solarton 1285).
RESULTADOS E DISCUSSÃO
Efeito da temperatura de tratamento
Na Figura 1 estão mostrados os difratogramas dos catalisadores tratados por 1 h nas temperaturas indicadas e do catalisador sem tratamento térmico. Pode ser observado que existe um estreitamento nos picos dos difratogramas dos catalisadores tratados sob maior temperatura, o que é indicativo de um aumento no tamanho das partículas. Na Tabela 1 estão os valores dos tamanhos médios das partículas, parâmetro de rede (a) e distância média dos átomos de Pt-Pt e Pt-Ru (r), calculados conforme descrito anteriormente. A área superficial dos catalisadores foi obtida a partir dos valores do tamanho das partículas, conforme metodologia apresentada na literatura14.
Dois efeitos decorrentes do aumento da temperatura de tratamento térmico são claramente observados nos resultados da Tabela 1: o aumento do tamanho médio dos cristalitos e a diminuição do parâmetro de rede. O aumento do tamanho médio das partículas deve ser devido ao aumento da energia térmica das partículas do catalisador, que faz com que haja a coalescência entre partículas menores de tamanhos variados. Desta forma, partículas menores separadas se unem para formar partículas maiores, termodinamicamente mais estáveis, causando uma diminuição da área específica do catalisador. A diminuição do parâmetro de rede e da distância interatômica Pt-Pt(Ru) reflete o aumento do grau de liga (fortalecimento da ligação Pt-Ru na liga metálica), também causado pelo aumento da energia térmica das partículas.
Na Figura 2 estão apresentadas as voltametrias cíclicas dos ânodos contendo os catalisadores tratados sob diversas temperaturas. Em primeiro lugar deve-se observar que o perfil voltamétrico apresenta as características típicas do catalisador de PtRu/C em todos os casos14. Nota-se também que existe uma diminuição das cargas capacitivas e das correntes relativas ao processo de dessorção de hidrogênio (pico anódico localizado entre 0,1 e 0,3 V vs. ERH) com o aumento da temperatura de tratamento.
O efeito da diminuição da carga capacitiva deve se referir ao aumento do tamanho de partícula, que causa uma diminuição na área total do catalisador. Devido ao fato de que os tratamentos térmicos são realizados em atmosfera redutora, outro fator que deve contribuir para a diminuição da carga capacitiva é a possível redução de espécies oxigenadas de rutênio eventualmente presentes na superfície. Estas espécies são amplamente empregadas na fabricação de capacitores de alta capacitância17, fato que dá suporte a esta proposição.
Na forma em que foram apresentados, os resultados da Figura 2 não permitem uma análise clara do fenômeno de segregação de Pt na superfície das partículas como alguns autores alegam na literatura8,11-14. Sendo assim, foi construída a Figura 3, que mostra as voltametrias apresentadas na Figura 2 com as correntes normalizadas pela corrente capacitiva obtida no potencial de 0,36 V vs. ERH.
Pode-se observar que para todos os tratamentos realizados houve um aumento relativo das correntes associadas à formação das espécies óxi/hidróxidos de Ru acima de 0,4 V vs. ERH. Isto confirma que durante o tratamento térmico houve um processo de redução de óxidos de Ru não ativos, o que acarretou no aumento da quantidade de sítios ativos. Além da ativação de sítios de Ru, é possível notar uma pequena diferença no perfil da região de hidrogênio (entre 0,1 a 0,35 V vs. ERH). No catalisador tratado a 850 ºC houve um achatamento do pico inicial de dessorção de hidrogênio, tornando a região com caráter retangular, mais semelhante aos catalisadores de Pt/C. Este resultado pode estar relacionado a um aumento na quantidade de átomos de Pt na superfície do material quando tratado a 850 ºC. No entanto, altas temperaturas de tratamento facilitam a coalescência das partículas, o que diminui drasticamente a área ativa do catalisador. Portanto, apesar de eventualmente haver o enriquecimento superficial de Pt a altas temperaturas, a perda de área torna-se fator limitante para a utilização deste tratamento para sistemas práticos.
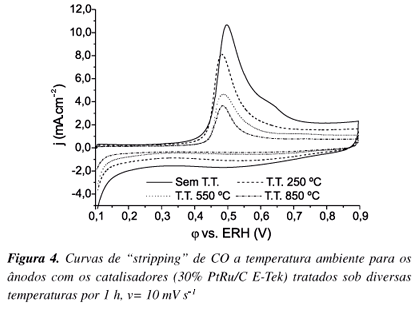
As curvas de "stripping" de CO dos catalisadores estudados estão apresentadas na Figura 4. Pode-se observar um ligeiro deslocamento dos potenciais de oxidação do CO para valores menores e um decréscimo das correntes envolvidas, para os catalisadores tratados a 550 e 850 ºC. Isto provavelmente é devido à menor área ativa destes materiais, que propicia menor número de sítios ativos para a adsorção e a oxidação do CO.
Os resultados da Figura 4 mostram que ainda que possa ter ocorrido uma pequena segregação de Pt na superfície (Figura 3), os átomos superficiais de Ru são suficientes para que qualquer CO adsorvido exclusivamente sobre Pt seja oxidado em potencial inferior ao usualmente encontrado6. Este é o princípio do mecanismo bifuncional, mostrado abaixo, onde as espécies óxi-hidróxi são formadas sobre os átomos de Ru em potenciais inferiores ao da Pt:
Um fato importante observado por meio destes resultados é a ausência total de picos de oxidação do CO adsorvido sobre Pt, que para Pt/C aparece ao redor de 0,7 V vs. ERH6, fato que tem sido explicado pela ocorrência do mecanismo Langmuir/Hinshelwood18 (reação R3), verificando-se que o CO adsorvido sobre Pt é removido com o auxílio de átomos de Ru vizinhos.
Os resultados das curvas de polarização das células montadas com os ânodos contendo os catalisadores tratados termicamente estão apresentados na Figura 5. Nota-se que a curva de polarização da célula na presença de H2/O2 apresenta o perfil típico observado em trabalhos prévios1,7,8,11,16. Observa-se também que a introdução de H2/CO (100 ppm) no lugar de H2 puro leva a um acentuado decréscimo no desempenho do sistema. No entanto, pode-se observar que existe um aumento na tolerância ao CO nos catalisadores tratados a 250 e 550 ºC frente ao não tratado. Este ganho de atividade deve ser atribuído à eliminação de possíveis impurezas presentes antes do tratamento, conforme já discutido anteriormente. A resposta inferior do catalisador tratado a 850 ºC é mais provavelmente devida à perda de área causada pelo aumento do tamanho de partícula, como apresentado na Tabela 1.
Pode também ser observado que existe um ganho de atividade dos catalisadores tratados a 550 ºC frente à dos materiais tratados em outras temperaturas. Neste caso, além da limpeza superficial de outras espécies, deve também ocorrer a redução de espécies oxidadas de rutênio, o que possibilita um aumento de atividade via mecanismo bifuncional, já mencionado anteriormente.
Finalmente deve-se observar que para todos os catalisadores, as curvas obtidas com o ânodo sendo alimentado com H2/CO, em densidades de correntes superiores a 1,5 A cm-2 demonstraram fenômenos de oscilação do potencial devido à presença de processos de oxidação e adsorção do CO na superfície catalítica, sendo este fenômeno já amplamente discutido na literatura19,20.
Efeito do tempo de tratamento
De forma a compreender o efeito causado pela variação do tempo de tratamento, foram realizados novos tratamentos nas mesmas temperaturas anteriores, mas por tempos mais prolongados, exceto à temperatura de 850 ºC que forneceu resultados restritos em relação ao tamanho das partículas. Na Tabela 2 encontram-se os resultados dos tamanhos de partícula, parâmetros de rede e distância interatômica Pt-Pt(Ru). Houve alguma variação no tamanho das partículas apenas com o tratamento a 550 ºC durante 3 h em comparação com o material tratado na mesma temperatura por 30 min ou 1 h. Para os tratamentos realizados a 250 ºC, o tamanho das partículas permaneceu invariável. Também se observa que as distâncias interatômicas não sofreram alteração em função do tempo, nas duas temperaturas consideradas.
Nas Figuras 6 e 7 estão apresentados os voltamogramas cíclicos para os catalisadores tratados a 250 e 550 ºC, respectivamente, durante os diversos tempos. Estes resultados mostram que um aumento no tempo de tratamento térmico, tanto a 250 como a 550 ºC, não leva a mudança apreciável no comportamento dos materiais, tanto qualitativa como quantitativamente. As pequenas diferenças observadas devem ser devidas ao aumento do tamanho médio das partículas entre os catalisadores tratados em particular a 550 ºC, como observado na Tabela 2. Para ambas temperaturas, não foi observado nenhum indício de segregação superficial de Pt quando o tempo de tratamento foi elevado de 1 para 3 h.
Nas Figuras 8 e 9 estão apresentados os resultados de "stripping" de CO para os catalisadores tratados a 250 e 550 ºC, respectivamente, durante os diversos tempos. Na Figura 8 é notável a diminuição dos potenciais de início da oxidação do CO dos catalisadores tratados durante 1 e 3 h em relação ao tratado por 30 min. Possivelmente este fato está relacionado à limpeza superficial de óxidos de Ru inativos, sendo 30 min pouco tempo para que ocorra todo o processo. Pela Figura 9 nota-se pouca diferença nos perfis da oxidação do CO, para os materiais tratados a 550 ºC.
As curvas de polarização para as células unitárias com ânodos contendo os catalisadores submetidos aos diferentes tempos de tratamento térmico estão mostradas nas Figuras 10 e 11. Na Figura 10 é possível notar que não houve alteração significativa no desempenho dos materiais submetidos aos diversos tempos de tratamento a 250 ºC, tanto na ausência como na presença de CO. Apenas uma ligeira melhora de desempenho para o catalisador tratado durante 3 h pode ser observada na faixa entre 0,5 e 1,5 A cm-2. Já para os catalisadores tratados a 550 ºC sob os diversos tempos de tratamento, cujos resultados são mostrados na Figura 11, nota-se uma queda de desempenho do catalisador tratado durante 3 h em relação àquele tratado por 1 h. Isto deve ser devido à diminuição da área ativa provocada pelo aumento do tamanho das partículas, como mostrado na Tabela 2.
Como observação final deve ser notado que, apesar de não haver efeitos significativos no desempenho dos materiais submetidos aos tratamentos térmicos sob diferentes tempos de tratamento, os catalisadores tratados a 550 ºC por 30 min ou 1 h apresentaram melhores desempenhos frente à ROH na presença de CO, sendo que a queda do potencial da célula na presença de CO não chega a 100 mV a 1 A cm-2. Este é considerado um ótimo resultado, comparável aos obtidos por Santiago et. al.11 quando catalisadores de PtRu/C foram tratados com vapor d'água à temperatura de 100 ºC por 24 h.
CONCLUSÕES
Neste trabalho estudaram-se os parâmetros envolvidos em processos de tratamento térmico, de maneira a avaliar os efeitos da temperatura e do tempo de tratamento térmico sobre a performance de catalisadores PtRu/C frente à ROH na presença de CO. Tais parâmetros são fundamentais para um controle dos tamanhos das partículas, processos difusionais em estado sólido e a limpeza superficial que podem ser proporcionadas pela presença de atmosfera redutora.
Os resultados de DRX mostram que houve um aumento no tamanho das partículas e uma diminuição no parâmetro de rede dos materiais com o aumento da temperatura de tratamento, indicando um aumento no grau de liga do material PtRu, porém com conseqüente diminuição da área ativa dos catalisadores devido à coalescência de partículas menores. Os perfis voltamétricos mostram que houve uma limpeza superficial de óxidos de Ru inativos para o mecanismo bifuncional, o que permite que o material seja mais tolerante ao CO. Também foi observada uma pequena segregação de Pt na superfície catalítica no material tratado a 850 ºC.
O tratamento realizado a 550 ºC durante 30 min foi suficiente para promover um ganho de desempenho da célula, sendo o sobrepotencial causado pela presença de CO a 1 A cm-2 próximo a 100 mV, comparável ao valor relatado na literatura para o catalisador de PtRu/C tratado com vapor d'água a 100 ºC por 24 h.
AGRADECIMENTOS
À FAPESP pelo suporte financeiro.
Recebido em 30/8/06; aceito em 18/1/07; publicado na web em 30/7/07
- 1. Ticianelli; E. A.; Gonzalez; E. R. Em Handbook of Fuel Cell Technology; Vielstich, W.; Lamm, A.; Gasteiger, H. A., eds.; Wiley: New York, 2003, vol. 2, cap. 33.
- 2. dos Santos, L.; Colmati, F.; Gonzalez, E. R.; J. Power Sources 2006, 159, 869.
- 3. Oliveira Neto, A.; Giz, M. J.; Perez, J.; Ticianelli, E. A.; Gonzalez, E. R.; J. Electrochem. Soc. 2002, 149, A272.
- 4. Camara, G. A.; Ticianelli, E. A.; Mukerjee, S.; Lee, S. J.; McBreen, J.; J. Electrochem. Soc. 2002, 149, A748.
- 5. Igarashi, H.; Fujino, T.; Watanabe, M.; J. Electroanal. Chem. 1995, 391, 119.
- 6. Lin, W. F.; Iwasita, T.; Vielstich, W.; J. Phys. Chem. B 1999, 103, 3250.
- 7. Santiago, E. I.; Camara, G. A.; Ticianelli, E. A.; Electrochim. Acta 2003, 48, 3527.
- 8. Santiago, E. I.; Ticianelli, E. A.; Int. J. Hydrogen Energy 2005, 30, 159.
- 9. Watanabe, M.; Motoo, S.; Electroanal. Chem. Interf. Electrochem. 1975, 60, 267.
- 10. Christoffersen, E.; Liu, P.; Ruban, A.; Skriver, H. L.; Norskov, J. K.; J. Catal. 2001, 199, 123.
- 11. Santiago, E. I.; Paganin, V. A.; do Carmo, M.; Gonzalez, E. R.; Ticianelli, E. A.; J. Electroanal. Chem. 2005, 575, 53.
- 12. Camara, G. A.; Giz, M. J.; Paganin, V. A.; Ticianelli, E. A.; J. Electroanal. Chem. 2002, 537, 21.
- 13. McNicol, B. D.; Short, R. T.; J. Electroanal. Chem. 1977, 81, 249.
- 14. Castro Luna, A. M.; Camara, G. A.; Paganin, V. A.; Ticianelli, E. A.; Electrochem. Commun. 2000, 2, 222.
- 15. Salgado, J. R. C.; Gonzalez, E. R.; Eclética Química 2003, 28, 2.
- 16. Paganin, V. A.; Ticianelli, E. A.; Gonzalez, E. R.; J. Appl. Electrochem. 1996, 26, 297.
- 17. Jang, J. H.; Kato, A.; Machida, K.; Naoi, K.; J. Electrochem. Soc. 2006, 153, A321.
- 18. Kotobuki, M.; Watanabe, A.; Uchida, H.; Yamashita, H.; Watanabe, M.; J. Catal. 2005, 236, 262.
- 19. Vielstich, W.; Paganin, V. A.; Lima, F. H. B.; Ticianelli, E. A.; J. Electrochem. Soc. 2001, 148, A502.
- 20. Zhang, J.; Fehribach, J. D.; Datta, R.; J. Electrochem. Soc. 2004, 151, A689.
Datas de Publicação
-
Publicação nesta coleção
28 Set 2007 -
Data do Fascículo
Out 2007
Histórico
-
Recebido
30 Ago 2006 -
Aceito
18 Jan 2007