Resumo
A new kind of material, denominated MCM-71, was synthesized and characterized by several complementary techniques: X Ray Diffractometry, textural analysis by nitrogen adsorption, Scanning electronic microscopy and infrared spectroscopy. MCM-71 zeolite was successfully synthesized by hydrothermal synthesis in the presence of triethanolamine. Mordenite phase as impurity was not detected, otherwise quartz was observed. The MCM-71 sample obtained presented a BET surface area of 20 m²/g in the as synthesized form and of 85 m²/g in protonic form. By SEM was observed crystals with rectangular shape with average size of 2 x 0,2 x 0,05 µm and this crystals were agglomerated in spherical particles with average diameter between 14 and 24 µm.
MCM-71; zeolites; synthesis
MCM-71; zeolites; synthesis
ARTIGO
Estudo da síntese da zeólita MCM-71
Study of MCM-71 zeolite synthesis
Caroline Luvison; Marcelo L. Mignoni; Sibele B. C. Pergher* * e-mail: pergher@uri.com.br
Departamento de Química, Universidade Regional Integrada do Alto Uruguai e das Missões, Campus Erechim, Av. Sete de Setembro, 1621, 99700-000 Erechim - RS, Brasil
ABSTRACT
A new kind of material, denominated MCM-71, was synthesized and characterized by several complementary techniques: X Ray Diffractometry, textural analysis by nitrogen adsorption, Scanning electronic microscopy and infrared spectroscopy. MCM-71 zeolite was successfully synthesized by hydrothermal synthesis in the presence of triethanolamine. Mordenite phase as impurity was not detected, otherwise quartz was observed. The MCM-71 sample obtained presented a BET surface area of 20 m2/g in the as synthesized form and of 85 m2/g in protonic form. By SEM was observed crystals with rectangular shape with average size of 2 x 0,2 x 0,05 µm and this crystals were agglomerated in spherical particles with average diameter between 14 and 24 µm.
Keywords: MCM-71; zeolites; synthesis.
INTRODUÇÃO
Zeólitas são compostos microporosos que apresentam um papel importante em vários áreas tecnológicas, principalmente como catalisadores.1,2 As razões de seu êxito em catálise são sua alta área superficial, capacidade de adsorção, seus centros ácidos, tamanhos de seus canais e cavidades e sua seletividade de forma. Estas características fazem com que as zeólitas sejam materiais interessantes para serem utilizados também como trocadores iônicos, peneiras moleculares e adsorventes. Neste sentido é interessante sempre buscar novos materiais zeolíticos ainda pouco estudados.
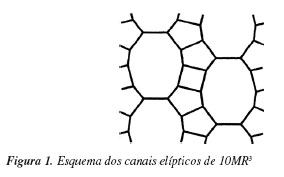
A síntese da zeólita MCM-71 foi descrita recentemente.3,4 Esse novo material possui um sistema de canais tridimensionais retos, de abertura elíptica, formados por 10 MR (0,65 x 0,43 nm) que são intersectados por outro sistema de canais senozoidais definidos por abertura de 8 MR (0,47 x 0,36 nm), Figura 1.
Este material foi sintetizado com uma relação Si/Al ∼8, que faz que seja um catalisador interessante para reações ácido-base. Zeólitas de poros médios têm sido empregadas em reações que requerem seletividade de forma, tais como adição de amina no metanol para produzir monometilamina pela inibição da formação de di- e trimetilamine; em reações de isomerização de n-alcanos de frações leves de nafta para aumento da octanagem e, em reações de reforma catalítica do diesel pela remoção seletiva de parafinas de cadeias lineares para aumentar o índice de viscosidade do produto.5
O objetivo deste trabalho foi estudar a síntese e caracterização da zeólita MCM-71.
PARTE EXPERIMENTAL
Síntese da MCM-71
A síntese da zeólita MCM-71 foi realizada seguindo o procedimento descrito na patente (US Pat. 6,645,462 e WO 03/097531)3,4 empregando os seguintes reagentes: sílica coloidal (30%), Al(OH)3, KOH, trietanolamina (R) e H2O. O gel formado, possuindo a composição molar Si/Al2 = 21 ; H2O/Si = 30; OH/Si = 0,375; K+/Si = 0,375; R/Si = 0,20, foi transferido para autoclaves de aço inoxidável com cobertura interna de Teflon e mantido a 160 ºC por 15 dias e 180 ºC por mais 5 dias. Após este período, o material foi separado por centrifugação e lavado até que a água de lavagem tivesse um pH inferior a 9,0.
A forma protonada do material, H+-MCM71, foi preparada por troca catiônica com uma solução 0,1 mol/L de NH4NO3 a 80 ºC por 3 h. A razão zeólita/solução empregada foi de 1 g de zeólita/100 g de solução. Os materiais preparados foram calcinados a 500 ºC por 3 h (taxa de aquecimento 3 ºC/min).
Caracterização dos materiais
Os materiais preparados foram caracterizados por diversas técnicas complementares: difração de Raios X, análise textural por adsorção de nitrogênio, microscopia eletrônica de varredura e espectroscopia no infravermelho.
As análises de difração de raios X foram realizadas num difraktometer modelo D5000 (Siemens) utilizando filtro de Ni e radiação Cu-kα (λ=1,54 Å).
A caracterização textural dos materiais foi realizada utilizando um autosorb-1 da Quantachrome (Nova-2200e). Antes da análise, cerca de 100 mg de amostra foram tratadas a vácuo, a uma temperatura de 300 ºC por 3 h. As medidas foram realizadas na temperatura do N2 líquido.
As análises de microscopia eletrônica de varredura foram realizadas em um microscópio MEV SSZ 550 Shimadzu e as amostras foram previamente recobertas com um filme de ouro.
A análise de espectrocopia no infravermelho foi realizada em um espectrofotômetro FTIR Shimadzu, modelo 8300. O espectro foi obtido com 32 varreduras e com 4 cm-1 de resolução. Para a análise, a amostra foi preparada na forma de pastilhas de aproximadamente 2 mm de espessura e 5 mm de diâmetro. Uma diluição de cerca de 10% de amostra foi realizada com KBr.
RESULTADOS E DISCUSSÃO
As análises de difração de raios X mostraram que em 15 dias o material obtido era amorfo e que em 20 dias o material já apresentava cristalinidade e um difratograma típico da MCM-71.3,4 A Tabela 1 apresenta a comparação do material sintetizado com o da literatura.3,4 Observa-se boa concordância entre os sinais. Não se observa a fase mordenita (2θ = 6,5; 8,6; 9,7; 13,4; 13,8; 19,6; 22,2; 25,6; 26,2; 27,6) como impureza que, segundo a literatura, pode estar presente.3 Entretanto, nota-se a presença de quartzo (2θ ~ 27º).
As isotermas de adsorção/dessorção de N2 das amostras recém-sintetizada e da amostra que sofreu troca iônica com H+ estão representadas na Figura 3. No caso da MCM-71 recém-sintetizada, que possui íons K+ como compensadores de carga, obteve-se baixa adsorção de N2 indicando uma baixa acessibilidade desta molécula à superfície interna da estrutura zeolítica. Este fato ocorre também com outras estruturas zeolíticas, como por exemplo, a zeólita A, que na forma recém-sintetizada (Na+-A) não possui acessibilidade às moléculas de N2. Entretanto, quando a zeólita A é trocada com íons Ca+2 a estrutura fica acessível às moléculas de N2.5,6 Em virtude disso, realizou-se na MCM-71 uma troca catiônica com íons NH4+ e através de posterior calcinação a 500 ºC obtive-se o material H+-MCM-71. Este material apresentou um aumento na quantidade de nitrogênio adsorvida ao ser comparado com a MCM-71 recém-sintetizada. Isso ocorre porque a acessibilidade à estrutura interna aumenta com a diminuição do tamanho do cátion compensador de carga.
Através dos dados de adsorção calcularam-se a área superficial específica e os volumes de poros (Tabela 2). Observa-se um aumento na área superficial específica de 20 a 85 m2/g, devido ao aumento da microporosidade ao realizar-se a troca iônica com H+. Ernst et al.7 obtiveram valores de 380 m2/g para H+-MCM-71. O baixo valor obtido para área superficial provavelmente se deve ao fato de a troca iônica com H+ não ter sido total. Não descartamos a possibilidade do material conter trietanolamina nos poros, que não tenha sido eliminada de forma definitiva. Também devemos levar em consideração a contribuição do quartzo.
As micrografias de MEV (Figura 4) apresentaram a morfologia do material MCM-71, onde se observam cristais retangulares aglomerados formando esferas. Os aglomerados possuem diâmetro de 14 a 24 µm. Os cristais possuem um tamanho médio de 2 x 0,2 x 0,05 µm. Este tamanho é muito inferior ao encontrado por Ernst et al.,7 de 12 x 8 x 4 µm.
A Figura 5 apresenta o espectro de refletância difusa na região do infravermelho. A banda a 3600 cm-1 pode ser atribuída à combinação de vibrações simétricas e antissimétricas do OH da molécula de água ou pode ser devido a vibrações de moléculas de água localizadas em duas posições diferentes na cavidade da zeólita.8 A banda a 1630 cm-1 observada refere-se à interação do OH com o oxigênio da estrutura zeolítica. Entre 300 a 1500 cm-1 observam-se vibrações referentes à estrutura zeolítica. Segundo a correlação FKS6 podem-se classificar as vibrações estruturais e obter informações sobre modificações estruturais. Entretanto, como na literatura não foi apresentado o espectro de infravermelho da MCM-71, fica difícil obter informações da estrutura e observar possíveis modificações. Por trabalhos anteriores em outras estruturas zeolíticas,6 sabe-se que vibrações assimétricas ocorrem entre 950 e 1250 cm-1 e vibrações simétricas entre 650 e 950 cm-1. No material MCM-71 sintetizado, observamos a 1030 cm-1 uma vibração assimétrica referente à vibração TO4 insensível à estrutura e uma outra vibração assimétrica a 1175 cm-1 referente à vibração de ligação de tetraedros TO4 sensíveis à estrutura. Entre 300 e 650 cm-1 observam-se bandas referentes à vibração da estrutura, que no caso da MCM-71 fica difícil de classificar por ser um material novo. Outras estruturas associam estas vibrações a anéis duplos de 6 membros, a aberturas de poros, etc.6
CONCLUSÕES
A zeólita MCM-71 foi sintetizada com sucesso através da síntese hidrotérmica na presença de trietanolamina. Não foi detectada a fase mordenita como impureza, entretanto observa-se quartzo. A zeólita MCM-71 apresentou uma maior acessibilidade quando na forma protônica, sendo possivelmente adequada para o emprego em catálise.
AGRADECIMENTOS
À URI - Campus Erechim e ao CNPq pelo auxílio financeiro e ao Laboratório de Difração de raios-X - UFRGS pelas análises de DRX.
Recebido em 21/11/07; aceito em 24/7/08; publicado na web em 15/12/08
- 1. Braga, A. A. C.; Morgon, N. H.; Quim. Nova 2007, 30, 178.
- 2. Luna, F. J.; Ulf, S.; Quim. Nova 2001, 24, 885.
- 3. Dhingra, S.; US Pat. 6,645,462 2003
- 4. Dhingra, S.; Sherer, E. F.; WO 03/097531 2003
- 5. Rigo, R. T.; Luvison, C.; Pergher, S.; Resumos da 30Ş Reunião Anual da Sociedade Brasileira de Química,Águas de Lindóia, Brasil, 2007.
- 6. Giannetto, G.; Montes, A.; Rodríguez, G.; Zeolitas: Características, propiedades y aplicaciones industriales, EdiT: Caracas, 2000.
- 7. Ernst, S.; Hartmann, M.; Tontisirin, S.; Böhlmann, W.; Stud. Surf. Sci. Catal. 2005, 158, 1287.
- 8. Hunger, J.; Beta, I. A.; Bolhlig, H.; Ling, C.; Jobic, H.; Hunger, B.; J. Phys. Chem. B 2006, 110, 342.
Datas de Publicação
-
Publicação nesta coleção
26 Fev 2009 -
Data do Fascículo
2009
Histórico
-
Revisado
24 Jul 2008 -
Recebido
21 Nov 2007