Resumos
A família Apiaceae (Umbelliferae), também denominada de pioneira das praias, é capaz de habitar locais de alto teor de salinidade, além de suportar a ação dos ventos e das ondas. O presente trabalho teve como objetivo o estudo da anatomia foliar e radicular e analisar constituintes químicos das folhas e do sistema radicular, caracterizando grupos químicos biologicamente ativos presentes nesses órgãos que permitam aplicações farmacológicas. O material foi coletado na região de Proteção Ambiental Iguape, Cananéia, Peruíbe. As folhas são dorsiventrais, com epiderme unisseriada, bordo regular, parênquima paliçádico com duas a três camadas e parênquima lacunoso com oito e nove camadas de células. É anfiestomática, apresentando grandes câmaras subestomáticas com maior incidência de estômatos na epiderme abaxial. O feixe vascular é colateral apresentando células de esclerênquima em forma de meia lua ao redor do xilema e do floema. O pecíolo apresenta contorno irregular, está envolvido por colênquima em toda sua extensão e apresenta grande quantidade de canais secretores entre os feixes vasculares. O rizoma apresenta contorno irregular com variação de 10 a 15 camadas de células de parênquima constituindo o córtex. O cilindro central é constituído por feixes colaterais delimitados pela endoderme. O periciclo é sinuoso e envolve totalmente os feixes vasculares. Sob a epiderme há uma faixa contínua de colênquima. A medula é constituída de células de parênquima de parede fina. H. umbellata apresentou triterpenos, saponinas, flavonóides, compostos poliacetilênicos e leucoceramidas. Folhas e rizomas apresentaram constituintes químicos semelhantes, com diferenças apenas na intensidade dos picos, o que denota diferença quantitativa entre as substâncias presentes. O rendimento do extrato do rizoma é menor que o rendimento das folhas.
Hydrocotyle umbellata; Apiaceae; anatomia vegetal; constituintes químicos; restinga
The Apiaceae family (Umbelliferae), also called pioneer of beaches, is capable to inhabit areas of high salinity levels. It supports the action of the winds as well as the waves. The objectives of the present work are the study of the foliar and root anatomy and its chemical constituents, in order to find biological active agents that allow pharmacological applications. The plants were collected in an environmental protected region (Área de Proteção Ambiental de Iguape, Cananéia, Peruíbe, SP). The leaves are dorsiventral, with one cellular layer epidermis, palisade parenchyma having two or three layers and lacunary parenchyma presenting eight or nine layers of cells. The leaves are amphistomatical, presenting great substomatal chambers with bigger incidence of stomata in abaxial epidermis. The vascular bundles are collateral, presenting half moon sclerenchyma form around the xylem and the phloem. Petiole shows irregular contour, involved by collenchyma in all extension and presents great amount of secretory ducts between vascular bundles. Rhizome presents irregular contour with ten to fifteen layers of cortical parenchyma cells. The central cylinder has collateral bundles delimited by the endodermis. Pericycle is sinuate and totally involves vascular bundles. Under the epidermis there is a continuous band of collenchyma. The medulla has thin wall parenchyma cells. H. umbellata presented triterpenoids, saponins, flavonoids, poliacetylenes compounds and leucoceramides. Leaves and rhizomes presented similar chemical components, with slightly differences on spectral peaks. The yield of rhizome extract was smaller than the leaves extract.
Hydrocotyle umbellata; Apiaceae; plant anatomy; chemical constituents; restinga
ARTIGO
Caracterização anatômica e química da folha e do sistema radicular de Hydrocotyle umbellata (Apiaceae)
Anatomical and chemical characterization of the leaf and root system of Hydrocotyle umbellata (Apiaceae)
Maria Bernadete Gonçalves MartinsI,** E-mail: bernadete@csv.unesp.br, Tel. +55-013-35699404, Fax +55-13-35699446; Ana Paula MarconiI; Alberto J. CavalheiroII; Selma D. RodriguesI
IUniversidade Estadual Paulista, Campus do Litoral Paulista - Unidade São Vicente, Praça Infante Dom Henrique s/n- Parque Bitaru, 11330-900 São Vicente-SP, Brasil
IIUniversidade Estadual Paulista, Instituto de Química, Departamento de Química Orgânica, Campus de Araraquara, Rua Francisco Degni, s/n, Bairro Quitandinha, 14800-900, Araraquara-SP, Brasil
RESUMO
A família Apiaceae (Umbelliferae), também denominada de pioneira das praias, é capaz de habitar locais de alto teor de salinidade, além de suportar a ação dos ventos e das ondas. O presente trabalho teve como objetivo o estudo da anatomia foliar e radicular e analisar constituintes químicos das folhas e do sistema radicular, caracterizando grupos químicos biologicamente ativos presentes nesses órgãos que permitam aplicações farmacológicas. O material foi coletado na região de Proteção Ambiental Iguape, Cananéia, Peruíbe. As folhas são dorsiventrais, com epiderme unisseriada, bordo regular, parênquima paliçádico com duas a três camadas e parênquima lacunoso com oito e nove camadas de células. É anfiestomática, apresentando grandes câmaras subestomáticas com maior incidência de estômatos na epiderme abaxial. O feixe vascular é colateral apresentando células de esclerênquima em forma de meia lua ao redor do xilema e do floema. O pecíolo apresenta contorno irregular, está envolvido por colênquima em toda sua extensão e apresenta grande quantidade de canais secretores entre os feixes vasculares. O rizoma apresenta contorno irregular com variação de 10 a 15 camadas de células de parênquima constituindo o córtex. O cilindro central é constituído por feixes colaterais delimitados pela endoderme. O periciclo é sinuoso e envolve totalmente os feixes vasculares. Sob a epiderme há uma faixa contínua de colênquima. A medula é constituída de células de parênquima de parede fina. H. umbellata apresentou triterpenos, saponinas, flavonóides, compostos poliacetilênicos e leucoceramidas. Folhas e rizomas apresentaram constituintes químicos semelhantes, com diferenças apenas na intensidade dos picos, o que denota diferença quantitativa entre as substâncias presentes. O rendimento do extrato do rizoma é menor que o rendimento das folhas.
Unitermos: Hydrocotyle umbellata, Apiaceae, anatomia vegetal, constituintes químicos, restinga.
ABSTRACT
The Apiaceae family (Umbelliferae), also called pioneer of beaches, is capable to inhabit areas of high salinity levels. It supports the action of the winds as well as the waves. The objectives of the present work are the study of the foliar and root anatomy and its chemical constituents, in order to find biological active agents that allow pharmacological applications. The plants were collected in an environmental protected region (Área de Proteção Ambiental de Iguape, Cananéia, Peruíbe, SP). The leaves are dorsiventral, with one cellular layer epidermis, palisade parenchyma having two or three layers and lacunary parenchyma presenting eight or nine layers of cells. The leaves are amphistomatical, presenting great substomatal chambers with bigger incidence of stomata in abaxial epidermis. The vascular bundles are collateral, presenting half moon sclerenchyma form around the xylem and the phloem. Petiole shows irregular contour, involved by collenchyma in all extension and presents great amount of secretory ducts between vascular bundles. Rhizome presents irregular contour with ten to fifteen layers of cortical parenchyma cells. The central cylinder has collateral bundles delimited by the endodermis. Pericycle is sinuate and totally involves vascular bundles. Under the epidermis there is a continuous band of collenchyma. The medulla has thin wall parenchyma cells. H. umbellata presented triterpenoids, saponins, flavonoids, poliacetylenes compounds and leucoceramides. Leaves and rhizomes presented similar chemical components, with slightly differences on spectral peaks. The yield of rhizome extract was smaller than the leaves extract.
Keywords:Hydrocotyle umbellata, Apiaceae, plant anatomy, chemical constituents, restinga.
INTRODUÇÃO
As Florestas de Restinga são caracterizadas por se distribuírem ao longo dos cordões litorâneos, formados por sedimentos marinhos de origem Quaternária em toda a planície costeira (Silva et al., 1994). A localização das florestas sobre ou nas depressões de tais cordões define diferentes tipos florestais, influenciados, principalmente, pela profundidade do lençol freático e, conseqüentemente, pela possibilidade de inundação (Britez et al., 1997).
Dentre as formações vegetais existentes nas restingas estão as comunidades florestais, que podem ou não sofrer inundações durante o ano (Araújo & Henriques, 1984; Silva, 1998); apresentam fisionomia, estrutura e composição florística diferenciadas, e recebem variadas denominações como mata seca, mata de Myrtaceae (Araújo & Henriques, 1984; Pereira, 1990; Bastos, 1996), mata arenosa (Waechter, 1985), floresta arenícola costeira (Trindade, 1991), floresta arenosa litorânea (Fabris, 1995) ou simplesmente mata ou floresta de restinga (Silva et al., 1994; Sugyiama & Mantovani, 1994; César & Monteiro, 1995; Lobão & Kurtz, 2000).
As dunas são locais onde a sobrevivência das espécies vegetais depende da existência de determinadas estruturas morfológicas, anatômicas e de mecanismos fisiológicos que permitam o seu desenvolvimento nessas condições adversas. Além disso, o solo é bastante pobre em nutrientes e muito permeável, já que é arenoso. O vento intenso também é um fator adicional de estresse para as plantas (Souza & Capellari, 2004).
A família Apiaceae é conhecida por apresentar alguns óleos essenciais (Dethier, 1941) na folha como limoneno e linalol (Hadaruga et al., 2005); monoterpenos e cumarinas (Ribeiro & Kaplan, 2002; Razavi et al., 2008). As cumarinas estão presentes em diferentes partes das plantas tanto nas raízes como nas flores e frutos e podem estar distribuídas em diferentes famílias de Angiospermas como Apiaceae, Rutaceae, Asteraceae nas quais são encontradas com ampla ocorrência (Ribeiro & Kaplan, 2002; Taleb-Contini et al., 2006).
Hydrocotyle umbellata, é uma espécie da família Apiaceae (Umbelliferae), característica de restinga, conhecida também como "acaricaba", "acariroba", "acariçoba", "barbarosa", "para-sol" e "erva-do-capitão" (Lorenzi, 2000). Apresenta como características: planta perene, herbácea, prostrada, acaule, rizomatosa, aquática, de solo pantanoso, arenoso ou restinga litorânea, encontrada em todo o território brasileiro, nativa do continente Americano. Propaga-se por sementes e através de rizomas. Apresenta flores discretas de cor verde amarelada, dispostas em panículas de umbelas no ápice, de longa haste floral que as dispõe acima da folhagem (Lorenzi, 2002; Coulter & Rose, 1887; Mathias, 1936).
Hydrocotyle umbellata é considerada uma planta daninha, que apresenta potencial medicinal na folha, no pecíolo e no rizoma, sendo que as folhas são também consideradas tóxicas (Lorenzi, 2002; Brandão et al., 2006; Brandão et al., 2008).
Adams et al. (1989), extraíram flavonóides das partes aéreas de Hydrocotyle umbellata, dentre eles quercetina.
A planta toda é empregada na medicina caseira. O suco das folhas e do pecíolo é usado na remoção de sardas e manchas na pele. O suco do rizoma é de uso interno e é considerado: anticatártico, anti-hidrópico, anti-reumático, anti-sifilítico, aperiente, desubstruente do fígado e do intestino, diurético, emético e tônico (Lorenzi, 2002; Martins et al., 1998; Balbach, 1983 e Alzugaray & Alzugaray, 1983).
A análise do óleo essencial desta planta revelou a presença de isotiocianatos, como um dos componentes principais (Lorenzi, 2002).
Os isotiocianatos voláteis são separados por cromatografia gasosa e são obtidos do material vegetal triturado por destilação com vapor d'água ou por hidrólise ácida e enzimática dos glucosinolatos (Harboner, 1984). O isotiocianato de benzila apresenta atividade antibacteriana para gram-positivas e gram-negativas (Wagner, 1993). Os isotiocianatos são capazes de induzir a atividade de enzimas das fases de biotransformação, influenciando processos de carcinogênese química, atividade mutagênica e capacidade destes mutagênicos se ligarem ao DNA (Verhoeven et al., 1997).
MATERIAL E MÉTODOS
O material foi coletado, na região de Proteção Ambiental Iguape, Cananéia, Peruíbe (IBAMA/APA/CIP), em março de 2006, sob registro no herbário ESALQ-USP 99268. Vários procedimentos foram realizados para se estudar a anatomia e os constituintes químicos de Hydrocotyle umbellata, tais como:
Diafanização foliar
Os estudos do sistema vascular de folhas adultas foram executados usando-se não somente métodos anatômicos e citológicos, mas também técnicas de clarificação e coloração. O material foi colocado em NaOH 5%, trocando a solução até que a folha ficasse amarela, após lavagem em água, foi colocado em hipoclorito de sódio 20% por aproximadamente 20 minutos. Utilizou-se o corante azul de toluidina aquoso (O'Brien et al., 1964). O material foi desidratado em série alcoólica (etílica), passando-se pelo xilol e finalizou-se com a montagem das lâminas permanentes (Felipe & Alencastro, 1966).
Estudos de microscopia óptica
Foram utilizadas folhas adultas, provenientes do estrato mediano, para estudar a histologia foliar. O preparo do material para microscopia óptica utilizou processos usuais em microtomia, que incluem: fixação em FAA 70% por 24 horas, desidratação em série alcoólica (etílica), infiltração em resina GMA (glicolmetacrilato), emblocamento, seccionamento, coloração e montagem de lâminas permanentes. As peças incluídas em resina foram seccionadas em micrótomo rotativo, obtendo-se secções transversais da lâmina foliar nas regiões do bordo, mediana e da nervura principal com 5 µm. Foi utilizado corante azul de toluidina 1% com borato de sódio 1% em 100 ml de água destilada (Gerrits, 1964).
Microscopia eletrônica de varredura
O material foi fixado em uma solução de Karnovsky modificada, composta por paraformoldeído 4%, glutaraldeído 0,5%, em tampão cacodilato de sódio, pH 7,2, 0,1 M e água destilada por uma noite no vácuo. Em seguida foram feitas três lavagens com cacodilato 0,05 M, com duração de 10 minutos cada uma, pós-fixação com tetróxido de ósmio (OsO4) por uma hora. O material foi desidratado com acetona, seguindo a série de concentrações 30%, 50%, 70%, 90% e 100%. O material foi levado à secagem até o ponto crítico e fixado a um suporte através de um adesivo condutor e em seguida metalizado (Danilatos, 1998). A análise foi realizada no Microscópio Eletrônico de Varredura, localizado no NAP/MEPA, ESALQ-USP, Piracicaba (SP).
Preparação do extrato bruto foliar para as análises químicas
As folhas foram prensadas e desidratadas em estufa a 40 ºC, por três dias de secagem. Em seguida foram moídas e reservadas até a análise dos constituintes químicos.
Metodologia para a análise química dos compostos
Preparação da amostra: A cerca de 100 mg de material vegetal seco e moído, pesado em balança analítica foi adicionado 2 mL de metanol (J. T. Baker, grau HPLC). A extração foi realizada por sonicação, por cerca de 20 minutos, em banho de ultra-som da Elma Transsonic 700. Em seguida a amostra foi centrifugada em centrífuga de bancada Celm Combatea, a 500 g por 10 minutos para sedimentação do resíduo sólido. Uma alíquota de 1 mL do sobrenadante foi filtrada em membrana 0,22 µm, sendo o filtrado acondicionado em frasco de vidro, prσprios para amostrador automático.
Análise cromatográfica
As amostras devidamente preparadas foram analisadas em CLAE-DAD (Cromatografia Líquida de Alta Eficiência Varian ProStar configurado com sistema de bombeamento mod. 230, amostrador automático mod.410 e detetor UV/VIS com arranjo de diodos mod 330), utilizando coluna Phenomenex Luna C18 250 x 4,6 mm, 5 µm, volume de injeção de 20 µL, utilizando como fase móvel acetonitrila (ACN) e água c/ 0,1% de ácido acético (Água). As condições de eluição estão indicadas na Tabela 1. Os espectros no UV foram adquiridos na faixa de 200 a 400 nm, sendo os comprimentos de onda para registro dos cromatogramas escolhidos após análise dos cromatogramas utilizando o software AURORA v. 5.52, da Varian. Os espectros no UV foram obtidos através do software PolyView 2000 5.5, também da Varian.
RESULTADOS E DISCUSSÃO
Anatomia foliar e radicular
As folhas de Hydrocotyle umbellata são simples, peltadas, espessas, brilhantes, glabras, apresentando nervuras radiadas, com traqueídeos evidentes entre as nervuras, bordo crenado-lobado e pecíolo longo. A planta é herbácea, perene, acaule, com rizomas enterrados na areia (Figura 1 A - D).
Segundo, Lorenzi (2002); Coulter & Rose (1887) e Mathias (1936), Hydrocotyle umbellata apresenta como características: planta perene, herbácea, prostrada, acaule, rizomatosa, aquática, de solo pantanoso, arenoso ou restinga litorânea, encontrada em todo o território brasileiro. Com folhas simples, coriáceas, peltadas, longo-pedunculadas de 30 a 90 cm de comprimento e 05 a 08 cm de diâmetro, glabras em ambas as faces, brilhantes, nativa do continente Americano. Propaga-se por sementes e através de rizomas. Apresenta flores discretas de cor verde amarelada, dispostas em panículas de umbelas no ápice, de longa haste floral que as dispõe acima da folhagem.
Planta rasteira (herbácea), com grandes folhas palmadas, grossas, com 15 a 20 nervuras radiadas. Suas flores são brancas, pequenas e numerosas, dispostas em umbelas irregulares sobre pedúnculos compridos. Os frutos são pequeninos, com duas sementes dentro, com formato de cápsula achatada. As folhas são muito venenosas e a raiz possui aroma e sabor idênticos aos da salsa (Alzugaray & Alzugaray, 1983).
Hydrocotyle umbellata é uma planta daninha, aquática ou de solos pantanosos com ocorrência em todo o país. Ocorre também em solos secos, areia de restingas nas praias da costa Atlântica, onde é mais freqüente. Infesta gramados, jardins e áreas desocupadas. É considerada tóxica e medicinal (Lorenzi, 2000). Foloni & Pitelli (2005), aplicaram herbicida ecotoxicológico (carfentrazone ethyl) em Hydrocotyle umbellata não obtendo resultados satisfatórios no controle desta planta daninha.
Suas folhas são dorsiventrais, com epiderme unisseriada apresentando contorno irregular. O parênquima paliçádico apresenta duas a três camadas e o parênquima lacunoso com oito a nove camadas de células (Figura 2 A - B). As folhas são anfiestomáticas, apresentando grandes câmaras subestomáticas com maior incidência de estômatos na epiderme abaxial (Figura 2 A - B), fato que expressa restrição a perda de água nesse ecossistema devido a escassez de nutrientes e a vários fatores que influem negativamente no balanço hídrico dessas plantas, como a baixa capacidade de retenção de água do solo, forte ação dos ventos marinhos, elevadas salinidades e insolação. Sousa et al. (2005), estudaram as características anatômicas das folhas de Foeniculum vulgare var. vulgare Mill. (Apiaceae) e observaram a epiderme pluriestratificada, sendo constituída por duas camadas de células retangulares, o que difere do resultado encontrado para H. umbellata. Em relação ao parênquima paliçádico ambas apresentaram 2 a 3 camadas de células.
Segundo Theobald (1967), folhas jovens de Uldinia ceratocarpa (Umbelliferae), não apresentam câmaras subestomáticas como em Hydrocotyle umbellata; porém, tanto Uldinia como Hydrocotyle apresentam ductos secretores próximos aos feixes vasculares tanto nas folhas, como no pecíolo, confirmando o resultado observado (Figura 2, B, D, E).
Sousa et al. (2005), em folhas de Foeniculum vulgare var. vulgare Mill. (Apiaceae), observaram ductos secretores de óleos dispersos nas proximidades dos tecidos vasculares e ductos maiores na região entre o floema e nos feixes de fibras esclerenquimáticas.
Liu et al. (2007a) observaram a dispersão de cristais e a presença de ductos na região da nervura; em frutos de três taxa da subfamília Saniculoideae (Apiaceae), com rigorosa comparação entre eles, observaram que há valor taxonômico segundo essa disposição.
O feixe vascular de Hydrocotyle umbellata é do tipo colateral apresentando células de esclerênquima em forma de meia lua ao redor do xilema e do floema (Figura 2C). O pecíolo apresenta contorno irregular sendo envolvido por colênquima em toda a sua extensão e apresentam maior quantidade de ductos secretores próximos aos feixes vasculares do que as folhas (Figura 2 D - E). Segundo Sousa et al. (2005), os ductos secretores também ocorrem em maior número no pecíolo foliar de Foeniculum vulgare.
Conforme, Carmello et al. (1995), os ductos secretores de Lithraea molleoides, estão restritos ao floema no caule. De acordo com Judd et al. (1999), os ductos secretores de óleo são utilizados para caracterizar a família Apiaceae e consequentemente, indicar apomorfias com a família Pittosporaceae.
Liu et al. (2007b), realizando a revisão do gênero Marlothiella (Apiaceae), observaram várias características típicas da subfamília Apioideae com características da subfamília Saniculoideae, tais como largos ductos na nervura, tricomas unicelulares estrelados (não observados em nenhum outro gênero da família), e feixes vasculares ventrais desenvolvidos ou ausentes.
Theobald (1967) observou que plantas jovens de Uldinia ceratocarpa (Umbelliferae), também apresentavam células epidérmicas com contorno irregular e com estômatos em ambas as superfícies foliares, como apresentado em Hydrocotyle umbellata; porém, o arranjo dos estômatos de Uldinia são do tipo anomocítico, comum da família Apiaceae (Metcalf & Chalk, 1950). Em Hydrocotyle umbellata foi observado estômatos predominantemente paracíticos (Figura 3A). Prasad (1947), também descreveu estômatos paracíticos em Centella (Apiaceae).
Payne, (1970), também observou que Hydrocotyle umbellata apresenta predominância de estômatos paracíticos, ou seja, a divisão da célula guarda é paralela à célula subsidiária, o que corrobora com este trabalho.
O mesofilo de Uldinia apresenta 1 a 2 camadas de células de parênquima paliçádico e de parênquima lacunoso, sendo que Hydrocotyle apresenta 2 a 3 camadas de paliçádico e 8 a 9 de parênquima lacunoso (Figura 2B).
Poucas informações são encontradas em relação a anatomia do gênero ou da subfamília. A folha de Uldinia difere da folha de Hydrocotyle na ausência de células de colênquima acima e abaixo da nervura (Nestel, 1905)
O rizoma apresenta contorno irregular com variação de 10 a 15 camadas de células de parênquima constituindo o córtex. O cilindro vascular possui feixes colaterais delimitados pela endoderme. O periciclo é sinuoso e envolve totalmente os feixes vasculares. A medula é constituída de células de parênquima de parede fina (Figura 2 F).
Há depósitos de cera epicuticular sem padrão definido (Figura 3 A - B), que promove a impermeabilização e reflete os raios solares e há também predominância de estômatos paracíticos (Figura 3 A). O pecíolo é contornado por colênquima com feixes vasculares colaterais entre eles (Figura 3 C) e o rizoma apresenta endoderme bem delimitada (Figura 3 D).
Constituintes químicos
Entre os metabólitos secundários descritos na literatura para espécies de Hydrocotyle, destacam-se triterpeno de esqueleto oleanano muito oxigenados, saponinas triterpenoidais, flavonóides, compostos poliacetilênicos e leucoceramidas (Figura 4).
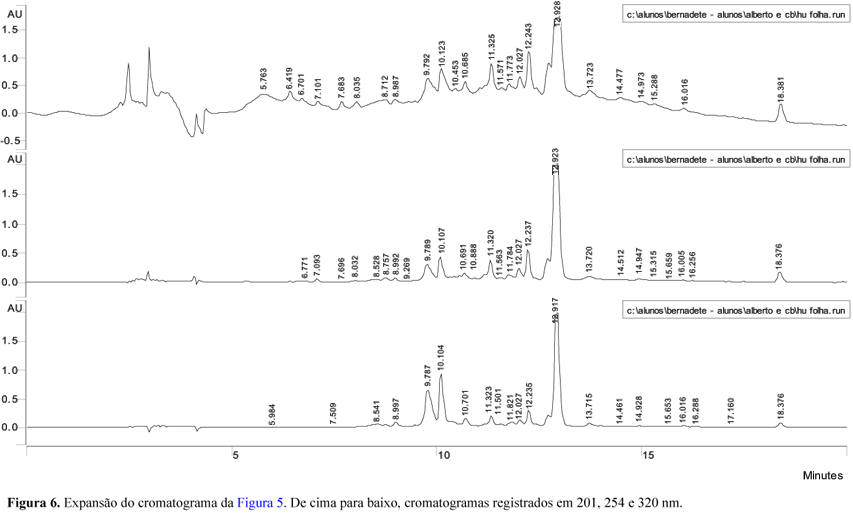
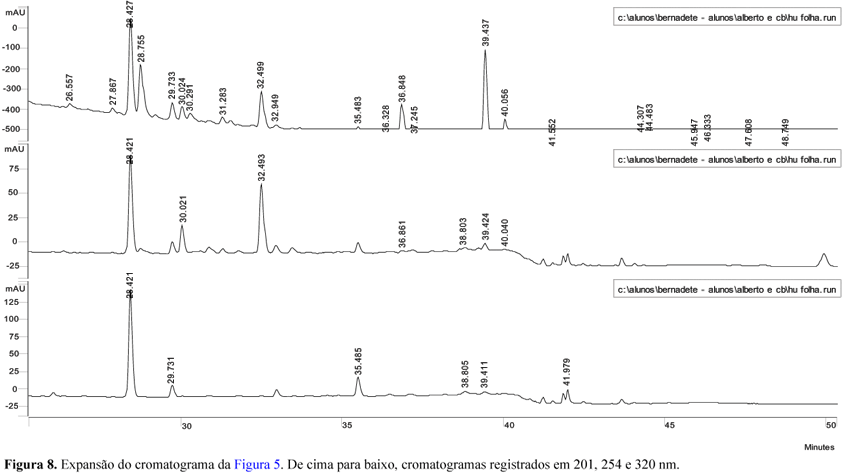
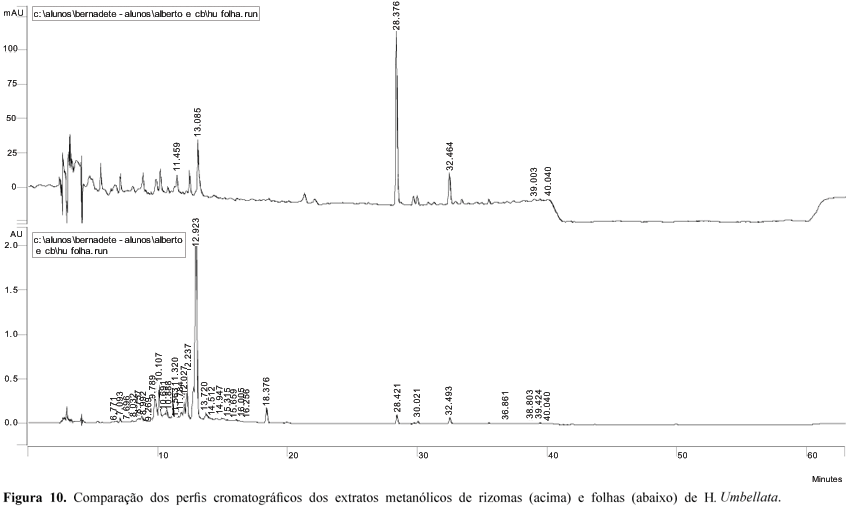
O perfil cromatográfico obtido para o extrato metanólico de folhas de H. umbellata (Figuras 5 a 10) indica a presença de flavonóides (tR = 11,28; 12,00; 12,21 e 13,01 min) e provavelmente de substâncias acetilênicas (tR = 30,00 e 32,51 min.), entre outras. A comparação dos cromatogramas obtidos para os extratos metanólicos de folhas e rizomas de H. umbellata indica constituição parecida para esses dois órgãos do vegetal, apesar das diferenças de intensidade relativa entre os vários picos, denotando diferenças quantitativas entre eles. O rendimento de extrato de rizomas é também sensivelmente menor que o de folhas.
A família Apiaceae (Umbelliferae) é conhecida por apresentar alguns óleos essenciais (Dethier, 1941) na folha como limoneno e linalol (Hadaruga et al., 2005); monoterpenos e cumarinas (Ribeiro & Kaplan, 2002).
Akgul & Bayrak (1988), observaram que o principal componente do óleo de Foeniculum vulgare var. vulgare, é o alfa-pineno, na folha, caule e na umbela.
O linalol é um composto fenólico que inibe o crescimento de bactérias e fungos, funcionando como anti-séptico (Simões & Spitzer, 2003). O limoneno desempenha o papel de proteção contra insetos nas plantas (Vieira et al., 2003).
As cumarinas estão presentes em diferentes partes das plantas tanto nas raízes como nas flores e frutos e podem estar distribuídas em diferentes famílias de Angiospermas como Apiaceae, Rutaceae, Asteraceae nas quais são encontradas com ampla ocorrência (Ribeiro & Kaplan, 2002; Kuster & Rocha, 2003).
Hydrocotyle leucocephala apresentou três compostos diacetilênicos, um monoterpeno e sete ceramidas em extrato metanólico (Ramos et al., 2006).
Em Hydrocotyle sibthorpioides detectou-se 38 componentes dos quais 89,9% são óleos voláteis, com habilidade de inibir algumas bactérias (Mu et al., 1998).
Em Hydrocotyle vulgaris foi encontrada uma substância chamada saponina, a qual apresenta propriedades expectorantes, diuréticas e antiinflamatórias. Hydrocotyle asiática, também apresenta propriedades farmacológicas em suas raízes, atribuídas as saponinas e aos triterpenos, destacando-se como componente principal o asiaticosídeo de uso tópico e interno, encontrado no medicamento Madecassol®. É usado no combate a queimaduras, quelóides e insuficiência venosa, como cicatrizante e ainda em cosméticos, insuficiência venosa crônica, ativo na microcirculação (Schenkel et al., 2003).
Muitas cumarinas possuem odores característicos, sendo utilizadas na indústria de produtos de limpeza e cosméticos, embora sejam classificadas como substâncias tóxicas (Kuster & Rocha, 2003). A substância ativa isolada em Apiaceae é a ostol 7 que apresenta resposta hipotensora de curta duração em cães, além de inibir a agregação plaquetária e relaxar a musculatura lisa e cardíaca (Hoult & Payá, 1996).
Na análise dos óleos essenciais de H. javanica e H. sibthorpioides encontrou-se monoterpenos, sesquiterpenos e fenólicos (Janardhanan & Thoppil, 2002).
Seis novos glicosídeos oleanos foram isolados de Hydrocotyle ranunculoides (Della Greca et al., 1994). Foram extraídos flavonóides das partes aéreas de H. umbellata, entre eles a quercetina (Adams et al., 1989). A quercetina também foi isolada em H. vulgaris (Rzadkowska & Olechnowicz, 1974).
CONCLUSÕES
Hydrocotyle umbellata é considerada daninha, medicinal e tóxica. Apresenta características morfo-anatômicas que permitem sua sobrevivência em condições adversas, como dunas e praias. Suas folhas e raízes possuem metabólitos secundários que possibilitam sua aplicação na indústria química e farmacêutica. Neste caso, é necessária uma análise química mais detalhada para avaliar qualitativa e quantitativamente seus grupos químicos. A partir dos resultados pode-se considerar:
Anatomia Foliar:
As folhas são simples, peltadas, espessas e glabras com nervuras radiadas, bordo crenado-lobado, pecíolo longo e presença de cera epicuticular;
Dorsiventrais, com epiderme unisseriada, parênquima paliçádico de duas a três camadas e parênquima lacunoso de oito a nove camadas de células;
Anfiestomáticas, com predominância de estômatos abaxiais do tipo paracítico;
Pecíolo de contorno irregular, com colênquima sob a epiderme, feixe vascular contornado por esclerênquima e presença de muitos ductos secretores entre os feixes.
Anatomia Radicular:
Rizomas extensos e enterrados na areia, de contorno irregular, com dez a 15 camadas de células constituindo o córtex e endoderme bem delimitada.
Constituintes Químicos Foliares e Radiculares:
Presença de triterpenos, saponinas, flavonóides, compostos poliacetilênicos e leucoceramidas;
Folhas e rizomas apresentam os mesmos constituintes químicos, com diferenças apenas na intensidade entre os picos, o que denota diferença quantitativa entre as substâncias presentes;
O rendimento do extrato dos rizomas é menor que o rendimento das folhas.
AGRADECIMENTOS
À FUNDUNESP pelo apoio concedido. À Profa. Dra. Beatriz Apezzato da Glória (pela concessão do micrótomo no Laboratório de Anatomia Vegetal e ao Prof. Dr. Kitajima pela utilização do Centro de Microscopia Eletrônica ESALQ-USP - Piracicaba, SP).
- Adams AA, Norris JA, Mabry TJ 1989. A flavonoid from Hydrocotyle umbellata L. (Umbelliferae). Rev Latinoamer Quim 20: 67-68.
- Akgul A, Bayrak A 1988. Comparative volatile oil composition of various parts from Turkish bitter fennel (Foeniculum vulgare var. vulgare). Food Chem 30: 319-323.
- Alzugaray D, Alzugaray C 1983. Plantas que curam.São Paulo: Editora Três Livros e Fascículos.
- Araujo DSD, Henriques RPB 1984. Análise florística das restingas do estado do Rio de Janeiro. In: Lacerda, L.D.; Araújo, D.S.D.; Cerqueira, R.; Turcq,B. (orgs) Restingas: Origem, estrutura e processos Niterói: Universidade Federal Fluminense / CEUFF, p.159-193.
- Balbach A 1983. A Flora Nacional na medicina doméstica São Paulo: Editora MVP.
- Bastos MNC 1996. Caracterização das formações vegetais da restinga da Princesa, Ilha de Algodoal-Pará. Belém, 124p. Tese de Doutorado - Universidade Federal do Pará
- Brandão MGL, Cosenza GP, Moreira RA, Monte-Mor RLM 2006. Medicinal plants and other botanical products from the Brazilian Official Pharmacopoeia. Rev Bras Farmacogn 16: 408-420.
- Brandão MGL, Zanetti NNS, Oliveira GRR, Goulart LO, Monte-Mor RLM 2008. Other medicinal plants and botanical products from the first edition of the Brazilian Official Pharmacopoeia. Rev Bras Farmacogn 18: 127-134.
- Britez RM, Santos-Filho A, Reissmann CB, Silva SM, Athayde SF, Lima RX, Quadros RMB 1997. Nutrientes do solo de duas florestas da Planície Litorânea da Ilha do Mel, Paranaguá, Pr. Rev Bras Sci Solo 21: 625-634.
- Carmello SM, Machado SR, Gregório EA 1995. Ultrastructural aspects of the secretory duct development in Lithraea molleoides (Vell.) Engl.(Anacardiaceae). Rev Bras Bot 18: 95-103.
- César O, Monteiro R 1995. Florística e fitossociologia de uma floresta de restinga em Picinguaba (Parque Estadual da Serra do Mar), Município de Ubatuba - SP. Naturalia 20: 89-105.
- Coulter JM, Rose JN 1887. Notes on Umbelliferae of E. United States IV. Bot Gaz 12: 102-104.
- Danilatos GD 1998. Foundations of environmental scanning electron microscopy. Adv Eletron Electron Phys 71: 109-250.
- Della Greca M, Fiorentino A, Monaco P, Previtera L 1994. Oleanane glycosides from Hydrocotyle ranunculoides. Phytochemistry 36: 1479-1483.
- Dethier VG 1941. Chemical factors determing the choice of food plants by Papilo larvae. Am Nat 75: 61-73.
- Fabris LC 1995. Composição florística e fitossociológica de uma faixa de floresta arenosa litorânea do Parque Estadual de Setiba, Município de Guarapari, ES. Rio Claro, 97p. Dissertação de Mestrado - Universidade Estadual Paulista.
- Felipe GM, Alencastro FMMR 1966. Contribuição ao estudo da nervação foliar das compostas do cerrados. I-Tribos Helinieae, Heliantheae, Inuleae, Mutisieae e Senecioneae. An Acad Bras Cienc 38: 125-158.
- Foloni LL, Pitelli RA 2005. Avaliação da sensibilidade de diversas espécies de plantas daninhas aquáticas ao carfentrazone-ethyl, em ambiente controlado. Planta Daninha 23: 329-334.
- Gerritts PO 1964. The aplication of glycol metacrylate in histotechnology: some fundamental principles Germany: Leica GmbH.
- Hadaruga NG, Hadaruga DI, Lupea AX, Paunescu V, Tatu C 2005. Bioactive nanoparticles - 7. Essential oil from Apiaceae and Pinaceae family plants/beta-cyclodextrin supramolecular system. Rev Chimie 56: 876-882.
- Harborne JB 1984. Phytochemical methods: a guide to modern techniques of plant analysis.Chapman and Hall New York: New York.
- Hoult JRS, Payá M 1996. Pharmacologial and biochemical actions of simple coumarins: natural products with therapeutic potential. Gen Pharmacol 27: 713-722.
- Janardhanan M, Thoppil J 2002. Chemical composition of two species of Hydrocotyle (Apiaceae). Acta Pharm 52: 67-69.
- Judd WS, Campbell CS, Kellogg EA, Stevens PF 1999. Plant Systematics: A phylogenetic approach Sunderland: Sinauer Associates, Inc.Publishers.
- Kuster RM, Rocha LM 2003. Cumarinas, cromonas e xantonas. In: Simões, C.M.O.; Schenkel ,E.P.; Gosmann, G.; Mello, J.C.P.; Mentz, L.A.; Petrovick, P.R. Famacognosia: da planta ao medicamento 5. Ed. Porto Alegre/Florianópolis: UFRGS, 1104p.
- Liu M, Wyk BV, Tilney PM 2007a. Irregular vittae and druse crystals in Steganotaenia fruits support a taxonomic affinity with the subfamily Saniculoideae (Apiaceae). South Afr J Bot 73: 252-255.
- Liu M, Wyk, BV, Tilney PM. 2007b. A revision of the genus Marlothiella (Apiaceae). South Afr J Bot 73: 208-213.
- Lobão AQ, Kurtz B 2000. Fitossociologia de um trecho de mata de restinga na Praia Gordas, município de Armação de Búzios, RJ. In: V Simpósio de Ecossistemas Brasileiros. São Paulo, Brasil.
- Lorenzi H 2000. Plantas daninhas do Brasil: terrestres, aquáticas ,parasitas e tóxicas Nova Odessa: Instituto Plantarum.
- Lorenzi H 2002. Plantas medicinais do Brasil: nativas e exóticas cultivadas Nova Odessa: Instituto Plantarum.
- Martins ER, Castro DM, Castellani DC, Dias JE 1998. Plantas medicinais Viçosa.
- Mathias ME 1936. The genus Hydrocotyle in Northern South America. Brittonia 2: 201-237.
- Metcalf CR, Chalk L 1950. Anatomy of the Dicotyledons. 2 vols.Oxford: Clarendon Press, 1500 pp.
- Mu S, Wang Y, Hao X 1998. Study on chemical constituents of volatile oil from Hydrocotyle sibthorpioides Lam. Guizhou Prov Chin Acad Sci 16: 215-217.
- Nestel A 1905. Beitrage zur Kenntnis der Stengel- und Blattanatomie der Umbelliferen. Mitt Bot Mus Univ Zurich 24: 1-126.
- O'Brien TP, Feder N, Mc Cully ME 1964. Polychromatic staining of plant cell walls by toluidine blue. Protoplasma 59: 368-373.
- Payne WW 1970. Helicocytic and allelocytic stomata unrecognized patterns in the Dicotyledonae. Am J Bot 57: 140-147.
- Pereira OJ 1990. Caracterização fitofisionômica da restinga de Setiba - Guarapari/ES. II Simpósio de Ecossistemas da Costa Sul e Sudeste Brasileira São Paulo, Brasil.
- Prasad S 1947. Pharmacological studies of Brahmi, stem and leaf characteristics of Herpestis monniera H.B. and K. and Hydrocotyle asiatica Linn. J Am Pharm Assoc Sci Ed 36: 393-401.
- Ramos F, Takaishi Y, Kawazoe K, Osorio C, Duque C, Awna R, Fujimoto Y, Sato M, Okamoto M, Oshikawa T, Ahmed SU 2006. Immunosuppressive diacetylenes, ceramides and cerebrosides from Hydrocotyle leucocephala. Phytochemistry 67: 1143-1150.
- Razavi SM, Nazemiyeh H, Hajiboland R, Kumarasamy Y, Delazar A, Nahar L, Sarker SD 2008. Coumarins from the aerial parts of Prangos uloptera (Apiaceae). Rev Bras Farmacogn 18: 1-5.
- Ribeiro CVC, Kaplan MAC 2002. Tendências evolutivas de famílias produtoras de cumarinas em angiospermae. Quim Nova 25: 533-538.
- Rzadkowska BH, Olechnowicz SW 1974. Flavonoid compouds in herb pennywort (Hydrocotyle vulgaris). Herba Pol 20: 243-246.
- Schenkel EP, Gosmann G, Athayde ML 2003. Saponinas. In: Simões, C.M.O.; Schenkel, E.P.; Gosmann, G; Mello, J.C.P.; Mentz, L.A. E Petrovick, P.R. Famacognosia: da planta ao medicamento. Porto Alegre/Florianópolis: UFRGS
- Silva SM 1998. As formações vegetais da planície litorânea da Ilha do Mel, Paraná, Brasil: Composição florística e principais características estruturais Campinas, 354p. Tese de Doutorado - Universidade Estadual de Campinas.
- Silva SM, Britez RM, Souza WS, Joly CA 1994. Fitossociologia do componente arbóreo da Floresta de Restinga da Ilha do Mel, Paranaguá, PR. III Simpósio sobre Ecossistemas da Costa Brasileira São Paulo, Brasil.
- Simões CMO, Spitzer V 2003. Óleos voláteis. In: Simões, C.M.O.; Schenkel, E.P.; Gosmann, G; Mello, J.C.P.; Mentz, L.A. E Petrovick, P.R. Famacognosia: da planta ao medicamento. Porto Alegre/Florianópolis: UFRGS.
- Sousa LA, Albuquerque MNL, Stefanini MB 2005. Sazonalidade dos ductos secretores e óleos essenciais de Foeniculum vulgare var. vulgare Mill. (Apiaceae). Rev Bras Farmacogn 15: 155-161.
- Souza VC, Capellari Jr L 2004. A vegetação das dunas e restingas da Estação Ecológica Juréia-Itatins. In: Marques, O.A.V.; Duleba,W. (eds), Estação Ecológica Juréia-Itatins. Ambiente físico, flora e fauna Ribeirão Preto: Holos Editora, p. 103-114.
- Sugyiama M, Mantovani W 1994. Fitossociologia de um trecho de mata de restinga na Ilha do Cardoso, SP. In: III Simpósio de Ecossistemas da Costa Sul e Sudeste Brasileira São Paulo, Brasil.
- Taleb-Contini SH, Santos PA, Veneziani RCS, Pereira AMS, França SC, Lopes NP, Oliveira DCR 2006. Differences in secondary metabolites from leaf extracts of Mikania glomerata Sprengel obtained by micropropagation and cuttings. Rev Bras Farmacogn 16 (Supl.): 596-598.
- Theobald WL 1967. Anatomy and systematic position of Uldinia (Umbelliferae). Britonia 19: 165-169.
- Trindade A 1991. Estudo florístico e fitossociológico do estrato arbustivo-arbóreo de um trecho de floresta arenícola costeira do Parque Estadual das Dunas - Natal - RN. Recife, 78p. Dissertação de Mestrado - Universidade Federal Rural de Pernambuco.
- Verhoeven DT, Verhagen H, Goldbohm RA, van den Brandt PA, van Poppel G 1997. A review of mechanisms underlying anticarcinogenicity by brassica vegetables. Chem Biol Interact 103: 79-129.
- Vieira PC, Fernandes JB, Andrei CC 2003. Plantas inseticidas. In: Simões, C.M.O.; Schenkel, E.P.; Gosmann, G; Mello, J.C.P.; Mentz, L.A. E Petrovick, P.R. Famacognosia: da planta ao medicamento Porto Alegre/Florianópolis: UFRGS.
- Waechter JL 1985. Aspectos ecológicos da restinga do Rio Grande do Sul, Brasil. Comunicação Científica da Pontifícia Universidade Católica do Rio Grande do Sul - Série Botânica 33: 49-68.
- Wagner H 1993. Drogen und ihre Inhalstsstoffe. In: Wagner, H. Pharmazeutische Biologie Gustav Fisher: Stuttgart, p. 522.
Datas de Publicação
-
Publicação nesta coleção
29 Out 2008 -
Data do Fascículo
Set 2008