Resumos
Estima-se que aproximadamente 25% das drogas prescritas em todo o mundo são oriundas de espécies vegetais. Dentre as plantas com alto potencial medicinal, se destaca o Hypericum perforatum L. (HP), planta herbácea perene, pertencente à família Hypericaceae. Extratos orgânicos e aquosos de HP têm sido utilizados na medicina popular e em testes pré-clínicos para o tratamento e prevenção de diversas doenças através de efeitos nefroprotetores, atividades antioxidante, antifúngica, ansiolítica, antiviral e cicatrizante. Estudos clínicos indicaram que esta espécie pode ser útil no tratamento de desordens originadas do sistema nervoso central, especialmente na depressão unipolar. HP contém, ao menos, dez classes de compostos biologicamente ativos, dentre eles antraquinonas/naftodiantronas, derivados de floroglucinol, flavonoides, biflavonas, xantonas, óleos voláteis, aminoácidos, vitamina C, cumarinas, taninos e carotenoides. Ao mesmo tempo em que os constituintes possuem relevantes efeitos farmacológicos, os mesmos podem prejudicar, por antagonismo farmacocinético (interação com algumas enzimas do citocromo), a eficácia de outros fármacos. Devido a relevante importância do HP como agente terapêutico, ressalta-se a importância do desenvolvimento de novos estudos com o intuito de elucidar questões ainda controversas acerca do extrato de HP, e.g., dose, melhor horário para colheita, padronização dos extratos, e possíveis efeitos tóxicos, podendo assim, definir claramente os riscos e benefícios da utilização desta planta.
Hypericum perforatum; depressão; hiperforina; hipericina
It is estimated that approximately 25% of prescribed drugs are derived from plant species. Among the plants with high medicinal potential, it highlights the Hypericum perforatum L. (HP), perennial herbaceous plant belonging to the family Hypericaceae. Organic and aqueous extracts of HP have been used in folk medicine and in pre-clinical testing for the treatment and prevention of several diseases through effects nefroprotetores, antioxidant, antifungal, anxiolytic, wound healing and antiviral activities. Clinical studies indicated that this specie can be useful in the treatment of central nervous system disorders, especially to unipolar depression. HP contains at least ten classes of biologically active compounds, including anthraquinones/naftodiantronas, phloroglucinol derivatives, flavonoids, biflavones, xanthones, volatile oils, amino acids, vitamin C, coumarins, carotenoids and tannins. At the same time that the secondary metabolites have important pharmacological effects, they can impair the effectiveness of other drugs by pharmacokinetic antagonism.
Hypericum perforatum; depression; hyperforin; hypericin
REVISÃO
Aspectos botânicos, químicos, farmacológicos e terapêuticos do Hypericum perforatum L.
Botanical, chemical, pharmacological and therapeutic aspects of Hypericum perforatum L.
Alves, A.C.S.I; Moraes, D.CI; de Freitas, G.B.L.I, * * durinezio@gmail.com ; Almeida, D.J.II
IDepartamento de Farmácia, Universidade Estadual do Centro-Oeste, UNICENTRO/ Campus CEDETEG. Rua Simeão Varela de Sá, 03, Vila Carli. CEP 85040-080. Guarapuava, Paraná, Brasil
IIDepartamento de Ciências Biológicas, Universidade Estadual do Centro-Oeste, UNICENTRO/ Campus CEDETEG. Rua Simeão Varela de Sá, 03, Vila Carli. CEP 85040-080. Guarapuava, Paraná, Brasil
RESUMO
Estima-se que aproximadamente 25% das drogas prescritas em todo o mundo são oriundas de espécies vegetais. Dentre as plantas com alto potencial medicinal, se destaca o Hypericum perforatum L. (HP), planta herbácea perene, pertencente à família Hypericaceae. Extratos orgânicos e aquosos de HP têm sido utilizados na medicina popular e em testes pré-clínicos para o tratamento e prevenção de diversas doenças através de efeitos nefroprotetores, atividades antioxidante, antifúngica, ansiolítica, antiviral e cicatrizante. Estudos clínicos indicaram que esta espécie pode ser útil no tratamento de desordens originadas do sistema nervoso central, especialmente na depressão unipolar. HP contém, ao menos, dez classes de compostos biologicamente ativos, dentre eles antraquinonas/naftodiantronas, derivados de floroglucinol, flavonoides, biflavonas, xantonas, óleos voláteis, aminoácidos, vitamina C, cumarinas, taninos e carotenoides. Ao mesmo tempo em que os constituintes possuem relevantes efeitos farmacológicos, os mesmos podem prejudicar, por antagonismo farmacocinético (interação com algumas enzimas do citocromo), a eficácia de outros fármacos. Devido a relevante importância do HP como agente terapêutico, ressalta-se a importância do desenvolvimento de novos estudos com o intuito de elucidar questões ainda controversas acerca do extrato de HP, e.g., dose, melhor horário para colheita, padronização dos extratos, e possíveis efeitos tóxicos, podendo assim, definir claramente os riscos e benefícios da utilização desta planta.
Palavras-chave: Hypericum perforatum, depressão, hiperforina, hipericina.
ABSTRACT
It is estimated that approximately 25% of prescribed drugs are derived from plant species. Among the plants with high medicinal potential, it highlights the Hypericum perforatum L. (HP), perennial herbaceous plant belonging to the family Hypericaceae. Organic and aqueous extracts of HP have been used in folk medicine and in pre-clinical testing for the treatment and prevention of several diseases through effects nefroprotetores, antioxidant, antifungal, anxiolytic, wound healing and antiviral activities. Clinical studies indicated that this specie can be useful in the treatment of central nervous system disorders, especially to unipolar depression. HP contains at least ten classes of biologically active compounds, including anthraquinones/naftodiantronas, phloroglucinol derivatives, flavonoids, biflavones, xanthones, volatile oils, amino acids, vitamin C, coumarins, carotenoids and tannins. At the same time that the secondary metabolites have important pharmacological effects, they can impair the effectiveness of other drugs by pharmacokinetic antagonism.
Keywords:Hypericum perforatum, depression, hyperforin, hypericin.
INTRODUÇÃO
A utilização de produtos naturais com propriedades terapêuticas é tão antiga quanto à civilização humana e, ao longo do tempo, os produtos de origem mineral, animal e vegetal foram as principais fontes do arsenal terapêutico. Nos últimos anos, tem crescido o interesse nas terapias alternativas e no uso terapêutico de produtos naturais, principalmente aqueles derivados de plantas (Cragg & Newman, 2013; Tabassum, et al. 2014; Lall & Kishore, 2014).
Metabólitos secundários constituem quase que 50% das novas drogas introduzidas no mercado farmacêutico de 1981 até 2010 e, aproximadamente 75% dos agentes anti-infecciosos são produtos naturais ou derivados (Newman & Cragg, 2010). Apesar dos avanços na medicina moderna, aproximadamente 80% da população mundial, particularmente a de países em desenvolvimento, ainda utilizam a plantas medicinais como cuidado de saúde primário (Gurib-Fakim, 2006). Portanto, é evidente que o reino vegetal fornece uma incrível fonte moléculas bioativas (hits) e possíveis fármacos originais. Apesar disto, até 2006 estimava-se que somente 10-15% de todas espécies de plantas foram investigadas (Bisht et al., 2006).
Dentre as plantas com alto potencial medicinal, se destaca o Hypericum perforatum L. (HP). Extratos orgânicos e aquosos de HP têm sido utilizados para o tratamento de diversas doenças na medicina popular, depressão unipolar leve, moderada (Uzbay et al., 2006) e grave (Szegedi et al., 2005), nefroproteção (Nabavi et al., 2012), atividade antioxidante e antifúngica (Mašković et al., 2011), antiviral e cicatrizante (Bukahri et al., 2004). Primeiramente estas indicações surgiram através de estudos empíricos seguidos por testes clínicos. Foi seguindo estas etapas que a avaliação antidepressiva confirmou que os extratos aquosos são tão efetivos quanto os antidepressivos convencionais e com a vantagem de causar menos efeitos colaterais (Bach-Rojecky et al., 2004; Shulz, 2002; Kasper et al., 2010; Russo et al., 2013).
Uma série de metabólitos biologicamente ativos têm sido isolados do extrato do HP, incluindo antraquinonas/naftodiantronas (principalmente hipericina e pseudo-hipericina), derivados de floroglucinol (hiperforina e ad-hiperforina), flavonoides (como rutina, quercetina, quercitrina, isoquercitrina, luteolina miricetina e canferol), biflavonas (I3,II8-biapigenina e amentoflavona), xantonas e óleos voláteis. Além da presença de alguns aminoácidos, vitamina C, cumarinas, taninos e carotenoides (Greeson et al., 2001; Hussain et al., 2009; Russo et al., 2013).
Devido a relevante importância de Hypericum perforatum como agente terapêutico, torna-se necessária a elaboração de uma revisão bibliográfica para um melhor entendimento dos aspectos que envolvem as propriedades terapêuticas, químicas e farmacológicas desse fitoterápico.
Descrição botânica
O gênero Hypericum Linn. pertence à família Hypericaceae, compreendendo mais de 450 espécies, sendo Hypericum perforatum a mais representativa (Vattikuti & Ciddi, 2005; Coleta, 2008).
HP (Figura 1) é uma planta herbácea perene, distribuída pela Europa, Ásia, norte da África e nos Estados Unidos (Peng et al., 2005). É comumente conhecida como hipérico, orelha-de-gato, alecrim-bravo, arruda-de-São-Paulo, arruda-do-campo, milfurada, Erva de São João e St. John`s Wort (Bufalo, 2007). Na maioria das preparações farmacêuticas são utilizadas as partes aéreas da planta (Bufalo, 2007).
Caracteristicamente, a planta apresenta-se glabra com tamanho médio de 50 cm, podendo atingir até cerca de 1 m (Bufalo, 2007; Coleta, 2008). As sementes são pequenas, alongadas e com extremidades arredondadas. Se expostas ao solo em temperaturas altas, germinam após alguns dias (Arncken, 2000).
O caule é arredondado com duas linhas longitudinais salientes, ereto e ramificado no topo. As folhas são ovadas a lineares, com 7 a 40 mm de comprimento, subcordatas, planas ou moderadamente revolutas, com numerosas glândulas transparentes ou glândulas oleosas que secretam óleo formando uma camada incolor sobre as folhas (Bufalo, 2007; Coleta, 2008). Sua consistência e sua superfície são elásticas, de coloração verde-azulada, opaca e sem brilho (Arncken, 2000).
As flores são numerosas, de coloração amarelo-alaranjada brilhantes, dispostas em cimeiras numa espécie de inflorescência paniculada composta. O cálice e a corola são marcados com pontos pretos, as sépalas e as pétalas são em número de cinco. As pétalas são oblongas a elípticas, assimétricas e apresentam numerosas pontuações negras (Bufalo, 2007; Coleta, 2008).
A raiz tem consistência lenhosa e resistente desde a plântula, e com o passar do tempo se torna ainda mais lenhosa. Sua cor é amarelo-acastanhada e sua superfície é coberta por anéis com escamas. Há vários ramos, e seu crescimento muda de direção diversas vezes (Arncken, 2000).
Histoanatomicamente, o ovário é trilocular e apresenta três estigmas. O estigma é característico com forma papilosa apresentando inúmeros idioblastos com pigmentos roxos. A folha é monoestratificada apresentando uma grossa cutícula. O parênquima é paliçádico monoestratificado com abundantes cloroplastos. Apresenta estômatos somente na superfície abaxial, com células estomáticas pequenas que se conectam a uma câmara subestomática pouco profunda. A nervura central é bastante proeminente apresentando feixes vasculares colaterais. O cambio é biestratificado, com o colênquima escasso na superfície adaxial e espesso na superfície abaxial apresentando três camadas de colênquima lacunar (Montenegro et al., 1999).
Principais constituintes químicos bioativos
A composição química de HP atrai a atenção de muitos cientistas, devido a sua grande variedade de metabólitos secundários diferentes. HP contém ao menos dez classes de compostos biologicamente ativos, dentre eles antraquinonas/naftodiantronas, derivados de floroglucinol, flavonoides, biflavonas, xantonas, óleos voláteis, aminoácidos, vitamina C, cumarinas, taninos e carotenoides. A concentração e proporção dos diferentes constituintes na planta estão intimamente relacionadas às condições ambientais e período da colheita, ao processo de secagem e condições de armazenamento. Considerando os dois extratos, orgânico e aquoso, aproximadamente 20% dos compostos presentes em cada extrato apresentam efeitos biológicos (Greeson et al., 2001; Hussain et al., 2009).
Os flavonoides representam 2 a 4% do extrato do HP, sendo que os de maior importância são os derivados glicosilados da quercetina, como hiperosídeo, rutina, quercitrina e isoquercetrina. Os glicosídeos com agliconas como o canferol e miricetina também são encontrados (Patočka, 2003; Nör, 2006).
Os glicosídeos de flavonoides possuem atividade espasmolítica, além de inibirem as enzimas monoaminooxidase A e catecol-O-metiltransferase, porém, o nível desses metabólitos na planta não atinge o índice terapêutico, portanto, não pode ser responsável pela eficácia do extrato bruto de HP. Alguns flavonoides se ligam ao receptor GABA e diversos autores sugerem que os flavonoides do HP agem da mesma maneira (Hanrahan et al., 2011). A quercetina tem sido relatada como carcinogênica, porém esses resultados se baseiam em testes com altas doses do constituinte. Em contraste, outros estudos consideram que a quercetina é um agente antitumoral (Angst et al., 2013; Wang et al., 2014). Devido à presença desses flavonoides, as flores possuem a coloração que atrai os insetos e protege os tecidos da radiação UV, além de apresentarem atividade antioxidante que parece desempenhar um papel importante na atividade antidepressiva do extrato total de HP, e impedir a degradação oxidativa dos outros compostos presentes no interior da matriz da planta (Kopleman et al., 2001; Patočka, 2003).
Em pequenas quantidades, nas partes aéreas do HP, são encontradas as xantonas, dentre elas a 1,3,6,7-tetrahidroxixantona e γ-mangostina. No entanto, as raízes contêm quantidades mais elevadas desses compostos (Zodi, 2011). Sugere-se que as xantonas pertençam a um arsenal químico de defesa empregado pelo HP no combate de fatores de estresse biológico, incluindo as infecções por patógenos e remoção de radicais livres (Crockett et al., 2011). Além das propriedades úteis a planta, as xantonas possuem também utilidades medicinais como anti-inflamatórias, antitumorais, anti-HIV e antimicrobianas (Zodi, 2011). As principas naftodiantronas detectadas no HP são representadas pela hipericina e seu derivado pseudo-hipericina, bem como por seus precursores - proto-hipericina e protopseudo-hipericina (Figura 2) (Karpinnen, 2010).
A concentração de pseudo-hipericina é cerca de duas a quatro vezes mais elevada do que os níveis de hipericina no HP (Greeson, 2001; Patočka 2003). A hipericina é abundante principalmente nas glândulas vermelhas das pétalas e estames das flores (1-14%), o local mais provável de sua biossíntese, mas também pode ser identificada em grande quantidade nas folhas (0,03% a 0,3%) (Zobayed, 2006). Admite-se que a localização glandular destes compostos objetiva proteger os tecidos vegetais da potencial ação tóxica dos mesmos (Walker et al., 2001). Embora a função da hipericina em espécies de Hypericum ainda não esteja totalmente esclarecida, vários estudos propõem que esta, bem como seu derivado (pseudo-hipericina), apresenta um papel de defesa contra patógenos e herbívoros (Sirvent & Gibson, 2002).
Apesar de a hipericina ser considerada o composto responsável pelas atividades antidepressiva (Greeson, 2001), antiviral e antitumoral de HP (Miskovsky, 2002; Kubin et al., 2005), é, possivelmente, o mais poderoso fotossensibilizante natural já descrito (Miskovsky, 2002; Karioti & Bilia, 2010). A ingestão de grandes quantidades da planta por animais demonstrou causar uma condição de severa sensibilidade à luz, conhecida como síndrome do hipericismo (Patočka, 2003). Por essa razão, a fotossensibilização pode ser um potencial efeito adverso observado durante o tratamento com extrato de HP (Zodi, 2011).
Os derivados de floroglucinois são compostos bastante frequentes no gênero Hypericum (Patočka, 2003). Os principais floroglucinóis encontrados em HP são os acilfloroglucinois prenilados hiperforina e seu homólogo ad-hiperforina (Figura 3) (Karppinen, 2010).
Aproximadamente 5% do peso seco de flores e folhas do HP correspondem à hiperforina, mas devido a sua instabilidade química, a concentração deste composto em produtos secos de maneira inapropriada tende a decrescer drasticamente (Zanoli, 2004). De fato, derivados de floroglucinóis degradam-se facilmente quando expostos à luz, ao calor ou oxigênio (Orth, 1999), o que, dificultava o desenvolvimento de estudos que comprovassem sua atividade biológica, não sendo por essa razão, considerado um constituinte farmacologicamente ativo. Porém, atualmente, sabe-se que a hiperforina é o principal componente responsável pela atividade antidepressiva relatada do HP por meio do mecanismo de inibição da recaptura de neurotransmissores, também atribuído ao seu homólogo, a ad-hiperforina (Karpinen, 2010).
Biossíntese dos principais metabólitos ativos
As vias metabólicas que conduzem à biossíntese da hipericina e hiperforina ainda são pouco compreendidas (Boubakir et al., 2005). De acordo com Karpinen (2010), a rota biossintética mais provável para a formação da hipericina tem início com a condensação de uma molécula de acetil coenzima-A (CoA) com sete moléculas de malonil CoA, formando uma cadeia linear octacetídica, que, subsequentemente, sofre ciclização originando a emodina antrona. A reação é catalisada por uma enzima do tipo III da família policetídeo sintase (PKS). A emodina antrona é então oxidada à emodina, provavelmente por meio da ação da emodiantrona oxigenase. A condensação seguida de desidratação de ambas emodina e emodina antrona origina emodina diantrona, esta por sua vez, sofre oxidação fenólica que leva à formação de proto-hipericina. Presume-se que a protopseudo-hipericina origina-se da oxidação do grupo metila da proto-hipericina. A conversão das protoformas em hipericina e pseudo-hipericina é grandemente influenciada pela luz, como também admite-se que a proteína fenólica Hyp-1 desempenhe papel importante nesta etapa. A Figura 4 apresenta um esquema geral de biossíntese da hipericina.
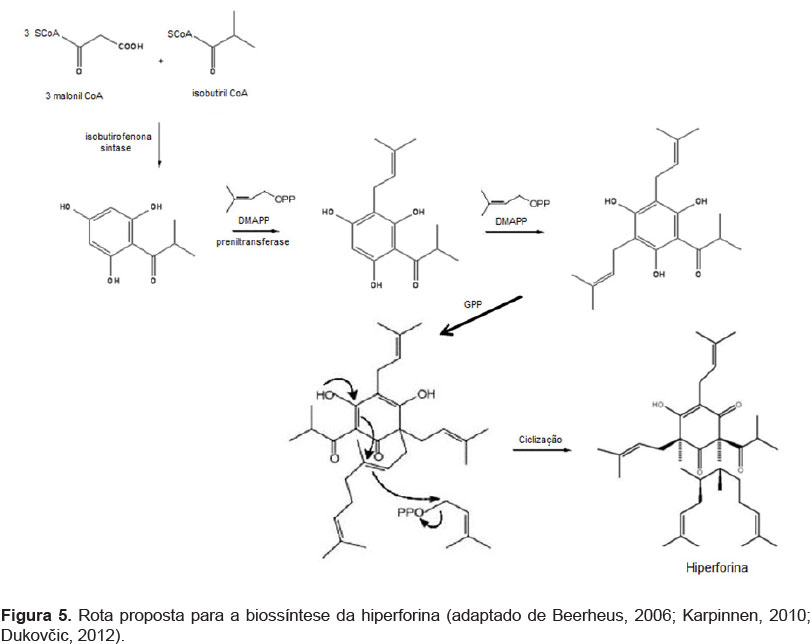
No caso específico da hiperforina, Klingauf et al. (2005), forneceram um subsídio valioso para o estudo de sua biossíntese ao observar a formação de um homólogo deste metabólito, a ad-hiperforina, em culturas de células de Hypericum calycinum. Ao que tudo indica, as células de cultura possuem, além das enzimas chalcona sintase e benzofenona sintase, uma terceira enzima, chamada isobutirofenona sintase, que catalisa a condensação sequencial de uma molécula de isobutiril-CoA com três moléculas de malonil-CoA, gerando um intermediário tetracetídeo, que por sua vez, sofre ciclização, catalisada pela enzima do tipo III da família policetídeo sintase chamada floroisobutirofenona sintase, formando floroisobutirofenona (Klingauf et al., 2005; Beerhues, 2006). Este intermediário sofre uma série de reações de prenilação, para finalmente dar origem ao núcleo hiperforina, como apresentado na Figura 5 (Zodi, 2011; Dukovčic, 2012).
Na biossíntese da ad-hiperforina, ao invés da isobutiril CoA, a 2-metilbutiril-CoA é utilizada como substrato para dar início à reação. O núcleo hiperforina é prenilado em várias etapas utilizando unidades isoprenoides derivadas da via do mevalonato. O primeiro passo da prenilação é catalisado pela enzima dimetilalila difosfato (DMAPP), como doador de grupamentos prenila (Karppinen, 2010).
Atividades farmacológicas
Atividade antidepressiva
A depressão é uma importante causa de desordem psíquica em todo o mundo, acometendo cerca de 121 milhões de pessoas (Hussain et al., 2009). O Hypericum perforatum L. (HP) é um dos poucos antidepressivos naturais, sendo considerado como uma alternativa eficaz a outros agentes terapêuticos no tratamento da depressão (Bach-Rojecky et al., 2004). Diversos países, principalmente europeus, têm utilizado o extrato de HP no tratamento dos quadros depressivos unipolares. Em 1997, foi o medicamento antidepressivo mais empregado na Alemanha, com 3,7 milhões de receitas, quatro vezes mais do que a quantidade prescrita para a fluoxetina (Bahls et al., 2005).
De fato, vários estudos têm comprovado a eficácia terapêutica do HP para o tratamento da depressão leve a moderada. Em estudo realizado por Rahimi et al. (2009), foi possível comparar a eficácia e a tolerabilidade do HP com os antidepressivos inibidores seletivos da recaptação da serotonina (ISRS). Os resultados demonstraram que a taxa da resposta clínica e a redução da pontuação na Escala de Hamilton para a depressão foram similares entre HP e os ISRS's. Além disso, o número de pacientes com eventos adversos não foi diferente entre o extrato de HP os ISRS's, sendo que os eventos adversos pela retirada foram maiores pelos ISRS's do que pelo HP.
Em estudos realizados por Behnke et al. (2002), a atividade do extrato de HP foi comparada à da fluoxetina em pacientes com depressão. Não ocorreu diferença significativa na resposta aos tratamentos. Em pesquisa semelhante desenvolvida por Van Gurp et al. (2002), o extrato do HP nas doses de 900 a 1.800 mg/dia foi comparado à sertralina nas doses de 50 a 100 mg/dia, em pacientes com depressão. Neste estudo também não foram observadas diferenças estatísticas nas taxas de resposta terapêutica.
Martinez et al. (1994) realizaram um estudo randomizado em pacientes que sofriam de depressão maior com padrão sazonal, utilizando 900 mg de HP por dia combinado com a terapia de luz (2 horas/dia). Foi observada redução significativa na pontuação da Escala de Hamilton em todos os grupos estudados, o que sugere que o tratamento farmacológico com HP pode ser uma eficiente terapia para pacientes com desordens afetivas sazonais. Wheatley (1999) também estudou a atividade do HP associado à terapia de luz em pacientes que sofriam da desordem afetiva sazonal e foi demonstrado que ocorreu melhora significativa na ansiedade e insônia, fatores diretamente relacionados ao quadro de depressão.
Hübner & Kirste (2001) relataram que 300 mg do extrato de HP foi potencialmente efetivo no tratamento de crianças com menos de 12 anos que apresentavam sintomas relacionados à depressão e desordens psicovegetativas. As avaliações de conformidade e tolerabilidade foram satisfatórias, com redução dos sintomas maior do que 90% nos participantes na categoria "suave", 85% da categoria "moderadamente afetado" e mais da metade dos classificados como "severos". Para todos os sintomas, existiram evidências claras do efeito benéfico.
Em estudo desenvolvido por Crupi et al. (2011) a administração crônica de HP reverteu o fenótipo afetivo e o efeito ansiogênico induzido pela corticosterona em animais. Portanto, pode-se sugerir que a administração de HP reverte os efeitos negativos do estresse que afetam a maturação de neurônios do hipocampo.
De acordo com Hammerness et al. (2003), a atividade antidepressiva do HP parece ser mediada pelos sistemas serotoninérgicos (5-HT), noradrenérgicos e dopaminérgicos, bem como por meio dos neurotransmissores do ácido gama-aminobutírico (GABA) e do aminoácido glutamato. Porém, a fraca atividade in vitro sugere uma combinação de múltiplos mecanismos. Trabalhos iniciais in vitro relatavam a inibição da monoaminooxidase (MAO) e catecol-O-metiltransferase (COMT) (Pradeep, 2001). No entanto, alguns autores concluíram que as concentrações que causam estas inibições não são suficientes para explicar a atividade antidepressiva. Uma proposta mais recente é que a atividade do HP se faz por meio da inibição da recaptação sináptica da serotonina, norepinefrina e dopamina. Além disso, uma significante regulação negativa da densidade do receptor β1-adrenérgico na região frontal e uma variação quantitativa nos receptores 5-HT2 tem sido demonstrada no córtex de animais depois do tratamento com o extrato de HP (Pradeep, 2001). A regulação negativa do adrenoreceptor é um indicativo clínico comumente relacionado à eficácia antidepressiva durante a administração crônica da maioria dos medicamentos antidepressivos (Vertulani & Sulser, 1975). A ação sobre os receptores serotoninérgicos é dependente da concentração dos constituintes nos extratos, i.e. administração crônica de extratos ricos em xantonas induz um aumento na expressão de 5HT-2 (efeito similar ao observado com eletroconvulsoterapia) (Muruganandam, et al. 2000), enquanto extratos com hiperforina concentrada aparentemente reduzem a expressão deste receptor (efeito também observados com antidepressivos tricíclicos e inibidores seletivos da receptação de serotonina) (Chatterjee, et al. 1998; Greeson, et al. 2001).
Existem algumas indicações de que HP modula certas vias neuroendócrinas, tais como a inibição da expressão da interleucina-6, uma citocina que pode estimular a liberação de cortisol. Sabe-se que o cortisol endógeno elevado está correlacionado com a depressão maior, e tem-se postulado que os inibidores seletivos da recaptação da serotonina podem atenuar a produção de cortisol via antagonismo da liberação de corticotropina (Greeson et al., 2001).
Os vários mecanismos de ação propostos ao longo de anos de estudos sobre a atividade antidepressiva de HP demonstram que o mais provável é que o efeito farmacológico ocorra através de várias vias de sinalização distintas.
Atividade antioxidante
A atividade antioxidante do extrato de HP é bem conhecida, e isto é esperado devido ao alto teor de compostos fenólicos. A maioria das frações ativas são aquelas ricas em flavonoides glicosilados (seguido por pequenas quantidades de ácidos fenólicos) e pobres em biflavonoides (Orčić et al., 2011). Vale ressaltar que extratos de HP ricos em flavonóides (quercetina, luteolina e campferol) e xantonas demonstraram in vitro também a capacidade de inibir a enzima monoamino oxidase (MAO-A e - B), porém ainda sem resultados clínicos associados (Greeson, et al. 2001).
Orčić et al. (2011) observaram que as frações de HP têm potencial de redução significativo, sendo algumas frações (com flavonoides e ácidos fenólicos) mais ativas do que o composto sintético butil-hidróxi-tolueno (BHT). Foi possível observar também a habilidade das frações de HP em neutralizar o radical ânion superóxido (O2-). A presença do superóxido no organismo é geralmente prejudicial, levando a processos degenerativos e morte. Outra propriedade observada do extrato de HP foi a capacidade de eliminação do óxido nítrico. O NO é normalmente produzido no organismo como um mensageiro e como parte da resposta imunológica, a sua reação com O2- produz peroxinitrito (ONOO-) que é altamente reativo e que pode causar vários danos biomoleculares. Assim, a habilidade do extrato de neutralizar o NO e ONOO- pode ter efeitos benéficos.
Zou et al. (2004) realizaram testes in vitro com o extrato de HP e demonstraram também forte atividade antioxidante. O extrato atuou como um agente doador de hidrogênio e redutor do ferro (III) a ferro (II). Além disso, o extrato agiu efetivamente como sequestrador dos radicais ânions superóxido e inibidor da degradação da desoxirribose.
Hunt et al. (2001) observaram a atividade antioxidante do extrato de HP contra o ânion superóxido por meio do efeito sequestrante dos radicais livres da maioria das concentrações testadas. Em outro estudo, Mohanasundari et al. (2006) concluíram que o extrato de HP na dose de 300 mg/Kg administrado em animais melhora a eficácia da atividade antioxidante das enzimas superóxido dismutase, catalase e glutationa peroxidase.
Atividade hipoglicemiante
O diabetes mellitus em ratos, bem como em humanos, está associado com alterações no sistema monoaminérgico cerebral. O diabetes induzido em ratos tem apresentado uma inibição significativa das funções serotoninérgicas em diferentes regiões do cérebro. Alterações similares no sistema serotoninérgico também ocorrem na depressão. Portanto, uma ligação funcional entre o diabetes e a depressão pode existir em nível de sistema monoaminérgico cerebral. O tratamento diário prolongado com HP tem sido relatado por melhorar a hiperglicemia e outros distúrbios metabólitos em animais diabéticos (Husain et al., 2011).
Arokiyaraj et al. (2011) estudaram o efeito hipoglicêmico de HP em ratos. O extrato foi administrado em ratos normais e nos diabéticos em jejum, sendo que foi possível observar a hipoglicemia após 30 minutos. O declínio da glicose no sangue atingiu o seu máximo em 2 horas. Nos ratos diabéticos notou-se, que além da diminuição dos níveis sanguíneos de glicose, ocorreu o aumento dos níveis séricos de insulina. O tratamento com o extrato de HP nas doses de 50, 100 e 200 mg/kg, diminuiu significativamente o conteúdo de glicogênio muscular e hepático, demonstrando que no estado diabético ocorreu o armazenamento de glicogênio defeituoso que foi corrigido parcialmente após a administração do extrato. A administração de HP diminuiu a atividade da glicose-6-fosfatase, além de uma significante redução nos triglicérides e colesterol total séricos dos ratos diabéticos.
Supressão da ingestão do etanol
Uma vez que os distúrbios depressivos e o abuso de álcool podem implicar em alterações neuroquímicas semelhantes do sistema nervoso central, tais como uma hipofunção do sistema serotoninérgico, tem sido levantada a hipótese que o extrato de HP poderia suprimir efetivamente a ingestão de álcool. Estudos realizados em diferentes modelos genéticos de animais do alcoolismo humano demonstram a eficácia do extrato de HP na redução da ingestão de etanol (Zanoli, 2004).
Perfumi et al. (2005) demonstrou que o extrato de HP reduziu significativamente a autoadministração de etanol. Em outro estudo, Coskun et al. (2006) observou que o extrato de HP anula o consumo de etanol aumentado seguido da privação do etanol. Entretanto, testes controlados em humanos ainda necessitam ser feitos para enfim tirarmos conclusões dos efeitos reais em humanos.
Uzbay (2008) observou que HP inibiu a hiperatividade locomotora e os comportamentos estereotipados especialmente na 2º e 6º hora após a retirada do etanol, e a incidência de tremores nos ratos dependentes após 4 horas da retirada de etanol. A dose de 100 mg/kg do extrato de HP produziu significante diminuição na incidência das convulsões audiogênicas constantes na 6º hora após a retirada do etanol. Estes resultados sugerem que o extrato de HP pode ser útil no tratamento do alcoolismo e da síndrome de abstinência do etanol, no entanto, o exato mecanismo ainda necessita ser elucidado. Vale ressaltar, que o efeito sobre receptores GABAA e serotoninérgico estão associados com o tratamento de dependências químicas como cocaína, tabagismo e alcoolismo, porém, o abuso de substância que interagem por estas vias também demonstram riscos de dependência.
Atividade cicatrizante
Em um estudo realizado por Paraguassu & Guedes (2009) foi possível observar o efeito cicatrizante do extrato de HP. Hamsters foram tratados com o extrato de HP incorporado em pomada de aplicação tópica nas concentrações de 250, 500 e 1000 mg. Não foram observadas reações alérgicas ou efeitos adversos nos animais tratados com o extrato da planta. O extrato possui substâncias de composição química variável, sendo que estas apresentam uma característica comum: a capacidade de coagular as albuminas, os metais pesados e os alcaloides. Deste modo, a identificação destas substâncias pode levar ao desenvolvimento de um novo adstringente natural, devido o efeito de causar coagulação e criar uma camada isoladora e protetora na pele, reduzindo a irritabilidade, dor e detendo os pequenos derrames de sangue. Vale ressaltar que mais estudos devem ser realizados para avaliar o potencial fotossensibilizante da pomada. Este efeito foi descrito anteriormente e está diretamente relacionado com a hipericina.
Atividade renoprotetora
Em estudo realizado por Neshat et al. (2011) foi demonstrado que alterações histopatológicas no túbulo intersticial e glomerular de ratos diminuíram por meio da administração de doses baixas (30 mg/Kg) do extrato de HP. Quando administrada uma dose alta (60 mg/Kg) de HP, observou-se a melhora no dano renal.
Como citado em itens anteriores, algumas classes de constituintes presentes no HP são potentes antioxidantes. O estresse oxidativo tem sido implicado na patogênese de várias formas de lesão renal. Este é também o principal ativador do Fator Nuclear kappa B (NF-κB) e, portanto, um indutor do estado inflamatório. Existem várias evidências apontando que o estresse oxidativo aumentado está envolvido no processo inflamatório renal após a obstrução ureteral unilateral não tratada. Assim, em doses baixas HP pode atuar como um agente renoprotetor similar à vitamina E (Neshat et al., 2011).
Atividade antimicrobiana
Milošević & Solujić (2006) estudaram a atividade antimicrobiana do extrato de HP empregando o método de disco difusão e microdiluição. Os resultados indicam que o extrato alcoólico de HP apresenta alta atividade antibacteriana para todas as bactérias testadas neste estudo. A maior inibição foi observada com 25 mg do extrato, sendo esta de 30-50% (zonas de inibição com 6-8,5 mm). As concentrações de 5 a 10 mg do extrato mostraram a menor inibição, de 6,25-15,6% (zonas de inibição de 1-2,5% mm). Pseudomonas glycinea e Azotobacter chrococcum mostraram extrema sensibilidade à presença de 25 mg do extrato de HP, o crescimento bacteriano foi inibido em 53%. Um alto grau de resistência do extrato foi observado para a bactéria Bacillus subtilus, em 25 mg do extrato a zona de inibição foi de 7 mm (25%). A concentração mínima inibitória do extrato alcoólico de HP está na faixa de 1,25-3,5 mg/mL. A atividade antifúngica também foi estudada. Foi concluído que a amostra com concentração de 45 mg/mL do extrato etanólico de HP mostrou maior atividade fungicida. A atividade antifúngica do extrato alcoólico de HP contra amostras dos fungos Penicillium canescens e Fusarium. oxysporum, fez com que diminuísse o número de esporos para 62% e 72%, respectivamente.
Atividade anticonvulsivante
Etemad et al. (2011) avaliaram o efeito anticonvulsivante de HP. Os autores utilizaram a dose de 50 mg/kg de HP administrada em animais e foi observado o atraso do tempo de latência do ataque convulsivo. O fato de o extrato proteger o animal contra convulsões sugere que este contém compostos que facilitam a transmissão GABAérgica. O exato mecanismo pelo qual HP exerce seu efeito na atividade anticonvulsivante ainda não é determinado, e por isso, necessita de mais investigações para elucidar os compostos ativos e mecanismos adjacentes. Talvez realizar estudos de constante de inibição (estudos in vitro) associando o neurotransmissor GABA com extratos de HP poderia responder se o potencial anticonvulsivo ocorre por esta via e qual é a molécula ativa.
Atividade antinociceptiva
Em estudo realizado por Bukahri et al. (2004), o extrato de HP (30-100 mg/kg) reduziu o número de contorções abdominais em camundongos de forma significativa. A inibição máxima observada foi de 88% para 100 mg/kg do extrato administrado via intraperitoneal. Pode-se sugerir que os efeitos analgésicos do HP estão relacionados a processos envolvidos na prevenção da sensibilização dos nociceptores, regulação dos nociceptores sensibilizados e/ou bloqueio dos nociceptores a nível periférico e/ou central. Aparentemente o efeito antinociceptiva do HP é mediado via inibição da síntese da prostaglandina, além dos mecanismos inibitórios centrais. Estes resultados validam o uso tradicional da planta como analgésico e outras condições associadas com a dor.
O efeito analgésico também foi avaliado por dois modelos (contorções por ácido acético e hot plate por formalina), com isso, foi possível avaliar a antinocicepção periférica e central. A administração intraperitonial de 30-100 mg/Kg produziu um efeito analgésico de 75%, efeito duas vezes mais potente do que o ibuprofeno (100 mg/Kg) (Bukhari, et al. 2004).
Estudos mais recentes realizados por Galeotti e colaboradores (Galeotti, et al. 2010) indicam que o efeito analgésico ocorre através da inibição de isoformas de proteína quinase C (PKC) e a fosforilação dessas enzimas.
Atividade antiparkinsoniana
Mohanasundari et al. (2006) induziram uma perda significativa da coordenação muscular em camundongos. Nas alterações das respostas comportamentais em camundongos, encontra-se depleção da dopamina estriatal ou danos estriatais, que é similar ao que ocorre nos humanos na doença de Parkinson. Nos resultados do estudo, foi observada uma redução significativa da dopamina estriatal e metabólitos. O extrato de HP impediu o comprometimento motor de forma dose-dependente e também diminuiu o período de latência do comportamento catatônico, sendo a dose maior utilizada de 300 mg/Kg via oral. Porém, a redução dos níveis de dopamina estriatal foi parcialmente prevenida em todas as doses administradas aos camundongos. Mohanasundari et al. (2006), acrescenta ainda que o extrato de HP reduziu a peroxidação lipídica, possivelmente devido à inibição da MAO-B.
Em outro estudo desenvolvido por Silva et al. (2005), foi demonstrado uma significativa proteção do extrato de HP contra o ascorbato/Fe2+, o qual induz uma peroxidação lipídica nos sinaptossomos corticais de ratos. Enfim, HP pode exercer um significativo efeito neuroprotetor e sua utilização na doença de Parkinson precisa ser mais explorada.
Interações medicamentosas
A popularização do emprego de extratos de plantas medicinais para o tratamento de uma extensa gama de patologias provocou nos últimos anos, não surpreendentemente, o aumento de relatos de interações entre fitoterápicos e fármacos sintéticos (Gohil, 2007). O termo interação medicamentosa é definido como a interferência no efeito de um fármaco por administração prévia ou concomitante de outro fármaco ou de um alimento ou nutriente (Miyasaka & Atallah, 2003).
HP é uma das plantas medicinais mais amplamente utilizadas ao redor do mundo (Parkhomenko & Kashin, 2011), sendo um dos medicamentos fitoterápicos mais bem caracterizadas (Dostalek et al., 2011). Em virtude desses fatos, apresenta um grande número de interações medicamentosas relatadas. Recentemente houve um aumento da preocupação acerca de possíveis interações que podem existir entre HP e alguns fármacos importantes como ciclosporina, inibidores da protease no HIV, substâncias citostáticas, anticoagulantes, anticoncepcionais e hipoglicemiantes orais (Zanoli, 2004).
Fortes evidências demonstradas em estudos pré-clínicos e ensaios clínicos, sugerem que o extrato de HP interfere no metabolismo citocromo-dependente de vários fármacos, especialmente por modular o sistema de isoenzimas do citocromo P450 (CYP 450), em especial o CYP3A4, um dos mais importantes desta família (Moore, 2000; Gurley, 2002; Watkins, 2003; Mai, 2004; Gurley, 2005).
Alguns estudos demonstraram haver redução nas concentrações plasmáticas de teofilina, ciclosporina, varfarina e etinilestradiol/desogestrel quando associados com o extrato de HP (Ernest,1999; Koupparis, 2000). Resultados apresentados por alguns autores mostraram redução nas concentrações plasmáticas de fármacos como a digoxina (Johne et al., 1999) e do indinavir (Pisciteli, 2000). Por outro lado, outros estudos sugerem que HP apresenta efeito inibidor do CYP450. Obach (2000) demonstrou que a hiperforina possui potente atividade inibidora não competitiva frente ao CYP2D6 e competitiva do CYP2C9 e CYP3A4. Recentemente, Dostalek et al. (2011) também observou que o HP é capaz de inibir a atividade da enzima CYP1A2. O autor tratou ratos Wistar com extrato de HP na dose de 100 mg/Kg, uma vez ao dia, por dez dias; utilizando como controles um inibidor comparativo (alfa-naftoflavona, 100 mg/Kg) e um indutor comparativo (omeprazol, 30 mg/Kg). O autor relatou que a atividade do CYP1A2 foi mais inibida pelo extrato de HP do que pelo inibidor controle (P<0,001). Além disso, Dürr et al. (2000), descreveram ainda, uma elevação, in vivo, do nível de glicoproteína-P (GP-P) intestinal, responsável pelo transporte ativo de fármacos através das membranas celulares, como consequência da utilização crônica de extrato de HP. O mesmo resultado foi obtido in vitro após a administração de hipericina. No entanto, de acordo Wang et al. (2004), a hipericina e a hiperforina podem inibir a função efetiva da GP-P.
De acordo com Nathan (2001), estas contradições de resultados podem ser explicadas por um ou mais das seguintes hipóteses: (i) efeitos múltiplos e complexos dos vários constituintes das enzimas envolvidas; (ii) diferenças entre análises de efeitos agudos vs crônicos e, (iii) efeito dose-dependentes.
Detalhes de interações identificadas e seus possíveis mecanismos de ação estão descritos na Tabela 1.
Diante do exposto, é claramente perceptível que HP apresenta alguns efeitos complexos e ainda pouco esclarecidos, principalmente devido à presença de diversos compostos biologicamente ativos com função não totalmente definida. Além disso, seus efeitos sobre a família de enzimas citocromo P450 torna sua utilização restrita, visto que grande parte dos medicamentos é metabolizada pela enzima CYP3A4. Por essas razões, ressalta-se a importância do desenvolvimento de novos estudos com o intuito de definir claramente os riscos e benefícios da utilização desta planta. Estudos de relação estrutura atividade sobre os metabólitos ativos de HP podem identificar regiões toxicofóricas, as quais após modificações planejadas poderiam manter atividade farmacológica e reduzir afinidade sobre o citocromo. O isolamento dos compostos leads para estudos de constante de inibição (Ki) ampliariam o conhecimento da interação com as biomacromoléculas alvo para cada enfermidade discutida e transformaria HP de um fitoterápico para um potente, seletivo e eficaz fármaco.
Recebido para publicação em 15/10/2012
Aceito para publicação em 31/03/2014
- ANGST, E.; PARK, J.L.; MORO, A.; LU, Q.Y.; LU, X.; LI, G.; KING, J.; CHEN, M.; REBER, H.A.; GO, V.L.; EIBL, G.; HINES, O.J. The flavonoid quercetin inhibits pancreatic cancer growth in vitro and in vivo. Pancreas v.42, n.2, p.223-229, 2013.
- ARNCKEN, T. Johanniskraut (Hypericum perforatum L.) als lebendige Imagination der Depression. Elemente der Naturwissenschaft, n.73, p.43-74, 2000.
- AROKIYARAJ, S.; BALAMURUGAN R.; AUGUSTIAN, P. Antihyperglycemic effect of Hypericum perforatum ethyl acetate extract on streptozotocin-induced diabetic rats. Asian Pacific Journal of Tropical Biomedicine, v.1, n.5, p.386-390, 2011.
- ASGARPANAH, J. Phytochemistry, pharmacology and medicinal properties of Hypericum perforatum L. African Journal of Pharmacy and Pharmacology, v. 6, n.19, p.1387-1394, 2012.
- BACH-ROJECKY, L.; KALODERA, Z.; SAMARZIJA, I. The antidepressant activity of Hypericum perforatum L. measured by two experimental methods on mice. Acta Pharmaceutica, v.54, n.2, p.157-162, 2004.
- BAHLS, S.C. Hypericum perforatum in the antidepressant treatment: an update. Arquivos Brasileiros de Psiquiatria, Neurologia Medicinal e Medicina Legal, v.99, n.4, p.24-29, 2005.
- BEERHUES, L. Molecules of interest-hyperforin. Phytochemistry, v.67, n.20, p.2201-2207, 2006.
- BEHNKE, K.; JENSEN, G.S.; GRAUBAUM, H.J.; GRUENWALD, J. Hypericum perforatum versus fluoxetine in the treatment of mild to moderate depression. Advances in Therapy, v.19, n.1, p.43-52, 2002.
- BISHT, D.M.; OWAIS, K.V. Potential of plant-derived products in the treatment of mycobacterial infections. AHMAD, I.F. AQIL, M.O. (Eds.), Modern phytomedicine: turning medicinal plants into drugs, Wiley-VCH, Weinheim (2006), pp. 293 - 312.
- BOUBAKIR, Z.; BEUERLE, T.; LIU, B.; BEERHUES, L. The ďŹrst prenylation step in hyperforin biosynthesis. Phytochemistry, v.66, n.1, p.51-57, 2005.
- BUFALO, A.C. Antidepressivo Hypericum perforatum L. sobre o sistema reprodutivo masculino de ratos Wistar. 2007. 82p. Dissertação (Mestrado - Área de Concentração em Farmacologia) - Departamento de Farmacologia, Universidade Federal do Paraná, Curitiba.
- BUKAHRI, I.A.; DAR, A.; KHAN, R.A. Antinociceptive activity of methanolic extracts of St. John's wort (Hypericum perforatum) preparation. Pakistan Journal of Pharmaceutical Sciences, v.17, n.2, p.13-19, 2004.
- CHATTERJEE, S.S.; NOLDER, M.; KOCH, E.; ERDELMERIER, C. Antidepressant activity of Hypericum perforatum and hyperforin: the neglected possibility. Pharmacopsychiatry, n.31, p. 7 - 15, 1998.
- COLETA, M. Caracterização fitoquímica e neurofarmacológica de plantas usadas na medicina tradicional pelas suas propriedades sedativas 2008. 309p. Tese (Doutorado - Área de Concentração em Farmacognosia e Fitoquímica) - Universidade de Coimbra, Coimbra.
- COSKUN, I.; UZBAY, I.T.; OZTURK, N; OZTURK, Y. Attenuation of ethanol withdrawal syndrome by extract of Hypericum perforatum in Wistar rats. Fundamental & Clinical Pharmacology, v.20, n.5, p.481-488, 2006.
- CRAGG, G.M.; NEWMAN, D.J. Natural products: a continuing source of novel drug leads. Biochimica et Biophysica Acta v.1830, n.6, p.3670-3695, 2013.
- CROCKETT, S.L.; POLLER, B.; TABANCA, N.; PFERSCHY-WENZIG, E-M.; KUNERT, O.; WEDGEB, D.E.; BUCARA, F. Bioactive xanthones from the roots of Hypericum perforatum (common St John's wort). Journal of the Science of Food and Agriculture, v.91, n.3, p.428-434, 2011.
- CRUPI, R.; MAZZON, E.; MARINO, A.; SPADA, G.L.; BRAMANTI, P.; BATTAGLIA, F.; Cuzzocrea, S.; Spina, E. Hypericum perforatum treatment: effect on behaviour and neurogenesis in a chronic stress model in mice. BMC Complementary and Alternative Medicine, v.11, n.1, p.1-10, 2011.
- DOSTALEK, M.; PISTOVCAKOVA, J.; JURICA, J.; SULCOVA, A.; TOMANDL, J. The effect of St. John´s Wort (Hypericum perforatum) on cytochrome P 450 1A 2 activity in perfused rat liver. Biomedical Papers, v.155, n.3, p.253-258, 2011.
- DUKOVČIC, I. Approaches to optimization of hiperforin production in Hypericum perforatum shoot cultures Tese (Doutorado - Área de Concentração em Biologia Farmacêutica) Technical University of Braunscheig, Germany, 2012.
- DÜRR, D.; STIEGER, B.; KULLAK-UBLICK, G. A.; RENTSCH, K. M.; STEINERT, H. C.; MEIER, P. J.; et al. St John's Wort induces intestinal P-glycoprotein/MDR1 and intestinal and hepatic CYP3A4. Clinical Pharmacology & Therapeutics, v.68, n.6, p.598-604, 2000.
- ERNST, E. Second thoughts about safety of St. John's wort. Lancet, v.354, n.9195, p.2014-2015, 1999.
- ETEMAD, L.; HEIDARI, M.R.; HEIDARI, M.; MOSHIRI, M.; BEHRAVAN, E.; ABBASIFARD, M.; AZIMZADEH, B.S. Investigation of Hypericum perforatum extract on convulsion induced by picrotoxin in mice. Pakistan journal of pharmaceutical sciences, v.24, n.2, p.233-236, 2011.
- GALEOTTI, N.; VIVOLI, E.; BILIA, A.R.; VINCIERI, F.F.; GHELARDINI, C. St John's Wort reduces neuropathic pain through a hypericin-mediated inhibition of the protein kinase C and activity. Biochemical Pharmacology, v.79, n.9, p.1327-1336, 2010.
- GOHIL, K.J.; PATEL, J.A. Herb-drug interactions: A review and study based on assessment. Indian Journal of Pharmacology, v.39, n.3, p.129-139, 2007.
- GREESON, J.M.; SANFORD, B.; MONTI, D.A. St. John's wort (Hypericum perforatum): a review of the current pharmacological, toxicological, and clinical literature. Psychopharmacology, v.153, n.4, p.402-414, 2001.
- GURIB-FAKIM, A. Medicinal plants: traditions of yesterday and drugs of tomorrow. Molecular Aspects of Medicine, v.27, n.1, p.1 - 93, 2006.
- GURLEY, B.J.; GARDNER, S.F.; HUBBARD, M.A.; WILLIAMS, D.K.; GENTRY, W.B.; CUI, Y.; ANG, C.Y. Clinical assessment of effects of botanical supplementation on cytochrome P 450 phenotypes in the elderly: St. John´s wort, garlic oil, Panax ginseng and Ginkgo Biloba Drugs Aging v.22, n.6, p.525-539, 2005.
- GURLEY, B.J.; GARDNER, S.F.; HUBBARD, M.A.; WILLIAMS, D.K.; GENTRY, W.B.; CUI, Y.; ANG, C.Y. Cytochrome P 450 phenotipic ratios for predicting herb-drug interactions in humans. Clinical Pharmacology & Therapeutics, v.72, n.6, p.710-727, 2002.
- HAMMERNESS, P.; BASCH, E.; ULBRICHT, C.; BARRETTE, E.P.; FOPPA, I.; BASCH, S.; BENT, S.; BOON, H.; ERNST, E. St. John's wort: a systematic review of adverse effects and drug interactions for the consultation psychiatrist. Psychosomatics, v.44, n.4, p.271-282, 2003.
- HANRAHAN, J.R.; CHEBIB, M.; JOHNSTON, G.A.R. Flavonoid modulation of GABAA receptors Brazilian Journal of Pharmacology, v.163, n.2, p.234 - 245. 2011.
- HENDERSON, L.; YUE, Q. Y.; BERGQUIST, C.; GERDEN, B.; ARLETT, P. St John's wort (Hypericum perforatum): drug interactions and clinical outcomes. The Journal of Clinical Pharmacology, v.54, n.4, p.349-356, 2002.
- HUBNER, W-D.; KIRSTE, T. Experience with St John's Wort (Hypericum perforatum) in children under 12 years with symptoms of depression and psychovegetative disturbances. Phytotherapy Research, v.15, n.4, p.367-370, 2001.
- HUNT, E.J.; LESTER, C.E.; LESTER, E.A.; TACKETT, R.L. Effects of St. John's Wort on free radical production. Life Sciences, v.69, n.2, p.181-90, 2001.
- HUSAIN, G.M.; CHATTERJEE, S.S.; SINGH, P.N.; KUMAR, V. Beneficial effect of Hypericum perforatum on depression and anxiety in a type 2 diabetic rat model. Acta Poloniae Pharmaceutica - Drug Research, v.68, n. 6, p.913-918, 2011.
- HUSSAIN, S.; ANSARI, Z.H.; ARIF, M. Hyperforin: a lead for antidepressants. International Journal of Health Research, v.2, n.1, p.15-22, 2009.
- JOHNE, A.; BROCKMÖLLER, J.; BAUER, S.; MAURER, A.; LANGHEINRICH, M.; ROOTS, I. Pharmacokinetic interaction of digoxin with an herbal extract from St. John's wort (Hypericum perforatum). Clinical Pharmacology & Therapeutics, v.66, n.4, p.338-345, 1999.
- KARIOTI, A.; BILIA, A. R. Hypericins as potential leads for new therapeutics. International Journal of Molecular Sciences, v.11, n.2, p.562-594, 2010.
- KARPPINEN, K. Biosynthesis of hypericins and hyperforin in Hypericum perforatum L. (st. John's wort) - precursors and genes Involved. 2010. 71p. Dissertação (Mestrado - Área de Concentração em Biologia) - Faculdade de Ciência, Universidade de Oulu, Finlândia.
- KASPER, R.; CARACI, F.; FORTI, B.; DRAGO, F.; AGUGLIA, E.; Efficacy and tolerability of Hypericum extract for the treatment of mild to moderate depression. European Neuropsychopharmacology, v.20, n.11, p.747-765, 2010.
- KLINGAUF, P.; BEUERLE, T.; MELLENTHIN, A.; EL-MOGHAZY, S. A. M.; BOUBAKIR, Z.; BEERHUES, L. Biosynthesis of the hyperforin skeleton in Hypericum calycinum cell cultures. Phytochemistry, v.66, n.2, p.139-145, 2005.
- KOPLEMAN, S.H.; NGUYENPHO, A.; ZITO, W.S.; MULLER, F.X.; AUGSBURGER, L.L. Selected physical and chemical properties of commercial Hypericum perforatum extracts relevant for formulated product quality and performance. American Association of Pharmaceuticals Scientists, v.3, n.4, p.1-18, 2001.
- KOUPPARIS, L.S. Harmless herbs: a cause for concern? Anaesthesia, v.55, n.1, p.101-102, 2000.
- KUBIN, A.; WIERRANI, F.; BURNER, U.; ALTH, G.; CRÜNBERGER, W. Hypericin - the facts about a controversial agent. Current Pharmaceutical Design, v.11, n.2, p.233-253, 2005.
- LALL, N.; KISHORE, N.J. Are plants used for skin care in South Africa fully explored? Ethnopharmacology, v.153, n.1, p.61-84, 2014.
- MAI, I.; BAUER, S.; PERLOFF, E.S.; JOHNE, A.; UEHLEKE, B.; FRANK, B.; BUDDE, K.; ROOTS, I. Hyperforin content determines the magnitude of the St. John's wort-cyclosporine drug interaction. Clinical Pharmacology & Therapeutics, v.76, n.4, p.330-340, 2004.
- MARTINEZ, B.; KASPER, S.; RUHRMANN, S.; MOLLER, H.J. Hypericum in the treatment of seasonal affective disorders. Journal of Geriatric Psychiatry and Neurology, v.7, n.1, p.29-33, 1994.
- MAŠKOVIĆ, P.Z.; MLADENOVIĆ, J.D.; CVIJOVIĆ, M.S.; AĆAMOVIĆ-ĐOKOVIĆ, G.; SOLUJIĆ, S.R.; RADOJKOVIĆ, M.M.. Phenolic content, antioxidant and antifungal activities of acetonic, ethanolic and petroleum ether extracts of Hypericum perforatum L. Hemijska industrija, v.65, n.2, p159 - 164, 2011.
- MILOŠEVIĆ, T.; SOLUJIĆ, S. Antimicrobial activity of the Hypericum perforatum L. plant. Bulletin of the Chemists and Technologists of Macedonia, v.25, n.2, p.127-130, 2006.
- MISKOVSKY, P. Hypericin - a new antiviral and antitumor photosensitizer: mechanism of action and interaction with biological macromolecules. Current Drug Targets, v.3, n.1, p.55-84, 2002.
- MIYASAKA, S.; ATALLAH, A. N. Risk of drug interaction: combination of antidepressants and other drugs. Saúde Pública, v.37, n.2, p.212-215, 2003.
- MOHANASUNDARI, M.; SETHUPATHY, S.; SABESAN, M. The effect of Hypericum perforatum extract against the neurochemical and behavioural changes induced by 1-methyl- neurochemical and behavioural 4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) in mice. Indian Journal of Pharmacology, v.38, n.4, p.266-270, 2006.
- MOORE, L.B.; GOODWIN, B.; JONES, S.A. et.al. St. John's wort induces hepatic drug metabolism through activation of the pregnane X receptor. Proceedings of the National Academy of Sciences, v.97, n.13, p.7500-7502, 2000.
- Montenegro, G.R.; PEÑA, R.C.; MUJICA, A.M.; ITURRIAGA, L.; CONZALEZ, L.; TIMMERMANN, B.N. posibilidades de un control botânico analítico de la hierba de San Juan Hypericum Perforatum L. Revista de la Academia Colombiana de Ciencias, v.23, n.88, p.455-460, 1999.
- NABAVIAB, S.F., NABAVIAB, S.M; MOGHADDAMC, A.H.; MAHDAVID, M.R.; EBRAHMZADEHD, M.A. Nephroprotective effect of aqueous extract of aerial parts of Hypericum scabrum L. Toxicological & Environmental Chemistry, v.94, n.4, p.779-785, 2012
- NATHAN, J.P. Hypericum perforatum (St. Jonh's Wort): a non-selective reuptake inhibitor? A review of the recent advances in its pharmacology. Journal of Psychopharmacology, v.15, n.1, p.47-54, 2001.
- NESHAT, M.; AZARMI, Y.; MEHDI, Z.S.; DOUSTAR, Y.; MOUSAVI; G. Effects of Hypericum perforatum (St. John's wort) extract on renal function after unilateral ureteral obstruction in rat. African Journal of Pharmacy and Pharmacology, v.5, n.4, p.457-461, 2011.
- NEWMAN, D.J.; CRAGG, G.M. Natural products as sources of new drugs over the 30 years from 1981 to 2010. Journal of Natural Products, v.75, n.3, p.311 - 335, 2010.
- NÖR, C. Análise química e taxonômica de espécies de Hypericum e avaliação da atividade antiangiogênica 2006. 166p. Dissertação (Mestrado - Área de Concentração em Ciências Farmacêuticas) - Faculdade de Farmácia, Universidade Federal do Rio Grande do Sul, Porto Alegre.
- OBACH, R. S. Inhibition of human cytochrome P450 enzymes by constituents of St. John's Wort, an herbal preparation used in the treatment of depression. Journal of Pharmacology and Experimental Therapeutics, v.294, n.1, p.88-95, 2000.
- OLIVEIRA, A.E; COSTA, D.T. Interações farmacocinéticas entre as plantas medicinais Hypericum perforatum, Ginko biloba e Panax ginseng e fármacos tradicionais. Acta Farmacêutica Bonaerense, v.23, n.4, p.567-578, 2004.
- ORČIĆ, D.Z.; MIMICA-DUKIĆ, N.M.; FRANCIŠKOVIĆ, M.M.; PETROVIĆ, S.S.; JOVIN, E.Đ. Antioxidant activity relationship of phenolic compounds in Hypericum perforatum L. Chemistry Central Journal, v.5, n.34, p.34-41, 2011.
- ORTH, H.C.J.; HAUER, H.; ERDELMEIER, C.A.J.; SCHMIDT, P.C. Orthoforin: The main degradation product of hyperforin from Hypericum perforatum L. Pharmazie, v.54, n.1, p.76-77, 1999.
- PARAGUASSU, L.A.A.; GUEDES, A.S. Avaliação do efeito cicatrizante do hipérico (Hypericum perforatum L.) em ramsters (Mesocricetus auratus). Diálogos & Ciência - Revista da Rede de Ensino FTC, v.3, n.8, p.45-57, 2009.
- PARKHOMENKO, V.M.; KASHIN, A.S. Characteristics of plant communities containing St. John´s Wort (Hypericum perforatum L.) in the Sarotov region. Biology Bulletin, v.38, n.10, p.1023-1030, 2011.
- PATOČKA, J. The chemistry, pharmacology, and toxicology of the biologically active constituents of the herb Hypericum perforatum L. Journal of Applied Biomedicine, v.1, n.2, p.61-70, 2003.
- PENG, Y.; YUAN, J.; YE, J. Determination of active components in St. John's Wort (Hypericum perforatum) by capillary electrophoresis with electrochemical detection. Electroanalysis, v.17, n.12, p.1091-1096, 2005.
- PERFUMI, M.; MATTIOLI, L.; FORTI, L.; MASSI, M.; CICCOCIOPPO, R. Effect of Hypericum perforatum CO2 extract on the motivational properties of ethanol in alcohol-preferring rats. Alcohol and Alcoholism, v.40, n.4, p.291-296, 2005.
- PIOVAN, A.; FILIPPINI, R.; CANIATO, R.; BORSARINI, A.; MALECI, L.B.; CAPPELLETTI, E.M. Detection of hypericins in the 'red glands' of Hypericum elodes by ESI-MS/MS. Phytochemistry, v.65, n.4, p.411-414, 2004.
- PISCITELLI, S.; BURSTEIN, A.H.; CHAITT, D.; ALFARO, R.M.; FALLOON, J. Indinavir concentrations and St. John's wort. Lancet, v.355, n.9203, p.547-548, 2000.
- PRADEEP, J.N. Hypericum perforatum (St John's Wort): a non-selective reuptake inhibitor? A review of the recent advances in its pharmacology. Journal of Psychopharmacology v.15, n.1, p.47-54, 2001.
- RAHIMI, R.; NIKFAR, S.; ABDOLLAHI, M. Eficacy and tolerability of Hypericum perforatum in major depressive disorder in comparison with selective serotonin reuptake inhibitors: A meta-analysis. Progress in Neuro-Psychopharmacology & Biological Psychiatry, v.33, n.1, p.118-127, 2009.
- RATES, S.M.K. Plants as source of drugs. Toxicon, v.39, n.5, p.603-613, 2001.
- RUSSO, E.; SCICCHITANO, F.; WHALLEY, B.J.; MAZZITELLO, C.; CIRIACO, M.; ESPOSITO, S.; PATANÈ, M.; UPTON, R.; PUGLIESE, M.; CHIMIRRI, S.; MAMMÌ, M.; PALLERIA, C.; DE SARRO, G.B. Hypericum perforatum: Pharmacokinetic, Mechanism of Action, Tolerability, and Clinical Drug - Drug Interactions. Phytotherapy Research, Julho, 2013.
- SCHULZ, V.; Clinical trials with hypericum extracts in patients with depression--results, comparisons, conclusions for therapy with antidepressant drugs. Phytomedicine v.9, n.5, p.468-474, 2002.
- SILVA, B.A.; FERRERES, F.; MALVA, J.; DIAS, A.C.P. Phytochemical and antioxidant characterization of Hypericum perforatum alcoholic extracts. Food Chemistry, v.90, n.1-2, p.157-67, 2005.
- SIRVENT, T. & GIBSON, D. Induction of hypericins and hyperforin in Hypericum perforatum L. in response to biotic and chemical elicitors. Physiological and Molecular Plant Pathology, v.60, n.6, p.311-320, 2002.
- SZEGEDI, A.; KOHNEN, R.; DIENEL, A.; KIESER, M. Acute treatment of moderate to severe depression with hypericum extract WS 5570 (St John's wort): randomised controlled double blind non-inferiority trial versus paroxetine. British Medical Journal, v.330, n.7490, p.503-508, 2005.
- TABASSUM, N.; HAMDANI, M. Plants used to treat skin diseases. Pharmacognosy Reviews, v.8, n.15, p.52-60, 2014.
- UZBAY, I.T. Serotonergic anti-depressants and ethanol withdrawal syndrome: A review. Alcohol & Alcoholism, v.43, n.1, p.15-24, 2008.
- UZBAY, T.; KAYIR, H.; COŞKUN, I.; ÖZTÜRK, N.; ÖZTÜRK, Y. Extract of Hypericum perforatum blocks nicotine-induced locomotor activity in mice. Turkish Journal of Pharmaceutical Sciences, v.3, n.1, p.31-40, 2006.
- VAN GURP, G.; METERISSIAN, G.B.; HAIEK, L.N.; MCCUSKER, J.; BELLAVANCE, F. St John's Wort or sertraline? Randomized controlled trial in primary car. Canadian Family Physician, v.48, n.5, p.905-912, 2002.
- VATTIKUTI, U.M.R.; CIDDI, V. An overview on Hypericum perforatum Linn. Natural Product Radiance, v.4, n.5, p.368-381, 2005.
- VERTULANI, J.; SULSER, F. Action of various antidepressant treatments reduces reactivity of noradrenergic cyclic AMPgeneration system in limbic forebrain. Nature, v.257, p.495 - 496, 1975.
- WALKER L.; SIRVENT, T.; GIBSON, D.; VANCE, N. Regional differences in hypericin and pseudohypericin concentrations and five morphological traits among Hypericum perforatum plants in the northwestern United States. Canadian Journal of Botany, v.79, n.10, p.1248-1255, 2001.
- WANG, P.; VADGAMA, J.V.; SAID, J.W.; MAGYAR, C.E.; DOAN, N.; HEBER, D.; HENNING, S.M. Enhanced inhibition of prostate cancer xenograft tumor growth by combining quercetin and green tea. The Journal of Nutritional Biochemistry, v.25, n.1, p.73-80, 2014.
- WANG, E.; BARECHI-ROACH, M.; JONHSON, W.W. Quantitative characterization of direct P-glycoprotein inhibition by St. John's wort constituents hypericin and hyperforin. Journal of Pharmacy and Pharmacology, v.56, n.1, p.123-128, 2004.
- WATKINS, R.E.; MAGLICH, J.M.; MOORE, L.B. et al. A crystal structure of humam PXR in complex with the St. John's wort compound hyperforin. Biochemistry, v.42, n.6, p.1430-1438, 2003.
- WHEATLEY, D. Hypericum in seasonal affective disorder (SAD). Current Medical Research and Opinion, v.15, n.1, p.33-37, 1999.
- ZANOLI, P. Role of Hyperforin in the pharmacological activities of St. John's Wort. CNS Drug Reviews, v.10, n.3, p.203-218, 2004.
- ZOBAYED, S.M.A.; AFREEN, F., GOTO, E.; KOZAI, T. Plant-environment interactions: accumulation of hypericin in dark glands of Hypericum perforatum Annals of Botany, n.4, v.98, p.793-804, 2006.
- ZODI, R. Molecular cloning of benzophenone synthase from Hypericum calycinum cell cultures and attempts toward transformation of Hypericum perforatum 2011. 114p. Dissertação (Doutorado em Ciências Naturais) - Instituto de Biologia Farmacêutica, Universidade Técnica de Carolo-Wilhelmina, Braunschweig.
- ZOU, Y.; LU,Y.; WEI, D. Antioxidant activity of a flavonoid-rich extract of Hypericum perforatum L. in vitro. Journal of Agricultural and Food Chemistry, v.52, n.16, p.5032-5039, 2004.
Datas de Publicação
-
Publicação nesta coleção
11 Set 2014 -
Data do Fascículo
Set 2014
Histórico
-
Recebido
15 Out 2012 -
Aceito
31 Mar 2014