Resumos
INTRODUÇÃO: O período de silêncio cutâneo (PSC) é um reflexo protetor inibitório da coluna vertebral e seus aferentes consistem em fibras nervosas A-delta. Nosso objetivo foi avaliar pacientes com fibromialgia (FM) e controles saudáveis para determinar as diferenças entre os grupos em relação à duração e latência do PSC, e quando presente, determinar se há alguma relação com as características da doença, distúrbios psicológicos e qualidade de vida. MATERIAIS E MÉTODOS: Trinta e dois pacientes com FM e 32 voluntários saudáveis foram incluídos no estudo. Os dois grupos foram comparados em relação à latência e duração do PSC em ambos os membros superiores e inferiores. Características da doença, distúrbios psicológicos e qualidade de vida dos pacientes foram avaliados utilizando o Fibromyalgia Impact Questionnaire (FIQ), e o Short Form-36 (SF-36). Os pacientes com medida de PSC igual ou inferior às do grupo controle foram comparados com aqueles com valores mais elevados do que os controles em termos de características da doença, estado psicológicos e qualidade de vida. RESULTADOS: Latências significativamente prolongadas de PSC nos membros superiores e inferiores foram determinadas em pacientes comparados com os controles. Observou-se que a prolongamento da latência do PSC no membro inferior estava associado com a gravidade da doença e incapacidade funcional. CONCLUSÕES: Latências do PCS nos membros superiores e inferiores em pacientes com FM são mais longas do que em voluntários saudáveis. Além disso, o prolongamento da latência do PSC no membro inferior está associado com a gravidade da doença e incapacidade funcional física.
Fibromialgia; Período de silêncio cutâneo; Deficiência
INTRODUCTION: Cutaneous silent period (CSP) is an inhibitory spinal protective reflex and its afferents consist of A-delta nerve fibers. We aimed to evaluate patients with fibromyalgia (FM) and healthy controls to determine any differences between the groups in terms of CSP duration and latency, and if present, to determine whether there is any relationship with disease characteristics, psychological disorders and quality of life. MATERIALS AND METHODS: Thirty-two patients with FM and 32 healthy volunteers were included in the study. The patient and control groups were compared in terms of CSP latency and duration in both upper and lower extremities. Disease characteristics, psychological disorders and quality of life of patients were assessed using the Fibromyalgia Impact Questionnaire (FIQ) and Short Form-36 (SF-36). Patients with CSP measurements equal to or lower than those of the control group were compared with those with higher values than controls in terms of disease characteristics, psychological status and quality of life. RESULTS: Significantly prolonged CSP latencies in both upper and lower extremities were determined in patients compared to controls. We found that prolongation of CSP latency in the lower extremity is associated with disease severity and functional disability. CONCLUSIONS: CSP latencies in both upper and lower extremities in patients with FM are longer than in healthy volunteers. Moreover, prolongation of CSP latency in the lower extremity is associated with disease severity and physical functional disability.
Fibromyalgia; Cutaneous silent period; Disability
ARTIGO ORIGINAL
Importância do período de silêncio cutâneo na fibromialgia e sua relação com as características da doença, distúrbios psicológicos e qualidade de vida dos pacientes
Ebru UmayI,* * Autor para correspondência. E-mail: ebruumay@gmail.com (E.Umay). ; Umit UlasII; Ece UnluI; Hakan AkgunII; Aytul CakciI; Zeki OdabasiII
IMinistério da Saúde, Ankara Diskapi Yildirim Beyazit Training and Research Hospital, Departamento de Medicina Física e Reabilitação, Ankara, Turquia
IIGulhane Military Medical Academy, Departamento de Neurologia, Ankara, Turquia
RESUMO
INTRODUÇÃO: O período de silêncio cutâneo (PSC) é um reflexo protetor inibitório da coluna vertebral e seus aferentes consistem em fibras nervosas A-delta. Nosso objetivo foi avaliar pacientes com fibromialgia (FM) e controles saudáveis para determinar as diferenças entre os grupos em relação à duração e latência do PSC, e quando presente, determinar se há alguma relação com as características da doença, distúrbios psicológicos e qualidade de vida.
MATERIAIS E MÉTODOS: Trinta e dois pacientes com FM e 32 voluntários saudáveis foram incluídos no estudo. Os dois grupos foram comparados em relação à latência e duração do PSC em ambos os membros superiores e inferiores. Características da doença, distúrbios psicológicos e qualidade de vida dos pacientes foram avaliados utilizando o Fibromyalgia Impact Questionnaire (FIQ), e o Short Form-36 (SF-36). Os pacientes com medida de PSC igual ou inferior às do grupo controle foram comparados com aqueles com valores mais elevados do que os controles em termos de características da doença, estado psicológicos e qualidade de vida.
RESULTADOS: Latências significativamente prolongadas de PSC nos membros superiores e inferiores foram determinadas em pacientes comparados com os controles. Observou-se que a prolongamento da latência do PSC no membro inferior estava associado com a gravidade da doença e incapacidade funcional.
CONCLUSÕES: Latências do PCS nos membros superiores e inferiores em pacientes com FM são mais longas do que em voluntários saudáveis. Além disso, o prolongamento da latência do PSC no membro inferior está associado com a gravidade da doença e incapacidade funcional física.
Palavras-chave: Fibromialgia, Período de silêncio cutâneo, Deficiência
Introdução
A fibromialgia (FM) é uma síndrome de dor crônica, caracterizada por dor generalizada e pontos dolorosos em áreas anatômicas específicas, cuja etiologia ainda não é compreendida, apesar de todas as novas descobertas.1 Alguns sinais e sintomas, incluindo fadiga crônica, dores de cabeça, distúrbios do sono, distúrbios psicológicos, síndrome do intestino irritável e da bexiga irritável, dismenorreia, distúrbios sensoriais tais como parestesia e disestesia sem neuropatia, e fenômeno de Raynaud, são comuns na FM.1,2
Embora a etiopatogenia ainda não esteja totalmente elucidada, estudos relataram que vários fatores podem ser efetivos, como disfunção neuroendócrina e autoimune e predisposição genética.3 Além disso, estudos têm demonstrado que a hiper-excitabilidade dos neurônios espinais e supra-espinais na FM desempenha um papel importante no desenvolvimento e na manutenção da dor crônica.4,5
Estudos que utilizaram o reflexo flexor nociceptivo (RFN) para demonstrar a excitabilidade dos neurônios do corno dorsal da medula espinal, que se formaram com as fibras periféricas C (aferente nociceptivo), relataram que essa excitabilidade em pacientes com FM causa sensibilização central e dor crônica.6,7
O método de avaliação das fibras A-delta (o outro aferente nociceptivo) é o período de silêncio cutâneo (PSC).8 O RFN e o PSC são as partes excitatória e inibidora do mesmo reflexo de proteção da coluna vertebral, respectivamente.9 Embora o PSC tenha sido medido em vários músculos, utilizando diferentes métodos, há apenas um estudo na literatura sore o tema,10 e somente o membro superior foi avaliado nesse estudo. De acordo com nosso conhecimento, nenhum estudo na literatura avaliou a relação entre o PSC e a duração da doença, o nível de dor, o número total de sintomas e pontos dolorosos, a gravidade da FM, os distúrbios psicológicos e a qualidade de vida.
Dessa forma, nosso objetivo foi comparar os pacientes com FM e controles saudáveis para determinar qualquer diferença na duração e na latência do PSC nos membros superiores e inferiores e, na presença do mesmo, determinar a existência de uma relação entre o PSC e características da doença, distúrbios psicológicos e qualidade de vida.
Materiais e métodos
População do estudo
Trinta e dois pacientes internados na Clínica de Medicina Física e de Reabilitação que haviam sido diagnosticados com FM de acordo com os critérios de classificação do American College of Rheumatology (ACR) de 1990 foram incluídos no estudo.1 Trinta e dois voluntários saudáveis que consistiam em funcionários do hospital e parentes de pacientes foram incluídos no estudo como controles.
Os critérios de exclusão para os pacientes e os voluntários foram os seguintes: presença de qualquer doença neurológica central e/ou periférica, tais como neuropatia periférica, radiculopatia ou esclerose múltipla, doença muscular tal como miopatia inflamatória ou miosite, qualquer doença inflamatória, endócrina, cardíaca ou psiquiátrica, osteoartrite, trauma da mão ou do pé, tenossinovite ou histórico de cirurgia. Pacientes grávidas ou amamentando ou os que haviam recebido qualquer medicamento psicotrópico e/ou anti-histamínicos no mês anterior também foram excluídos do estudo.
Os pacientes e voluntários com avaliações musculoesqueléticas e neurológicas normais, incluindo amplitude de movimento, força muscular, sensação superficial e reflexo profundo do tendão, e que tinham parâmetros laboratoriais normais, incluindo hemograma completo, exame de urina completo, ESR, vitamina B12, testes de função da tireoide, e testes bioquímicos, incluindo eletrólitos e enzimas do fígado, rim e músculo foram incluídos no estudo.
Pacientes e voluntários foram informados sobre o estudo e todos forneceram consentimento por escrito antes do início do mesmo. O estudo foi aprovado pelo Comitê de Ética local e foi realizado de acordo com os princípios da Declaração de Helsinki.
Testes eletrofisiológicos
Avaliações eletrofisiológicas foram realizadas no laboratório de eletrofisiologia do Departamento de Neurologia na Gülhane Military Medical Academy usando um dispositivo de eletromiografia (EMG) de 2+8 canais (Medelec Synergy-Oxford, Reino Unido) e de acordo com o protocolo descrito por Oh.11 A temperatura ambiente era de 24 ± 1ºC e a temperatura da pele dos pacientes e dos voluntários era de mais de 32ºC. As medições no membro superior foram realizadas na posição sentada, e as medidas nos membros inferiores foram feitas na posição supina.
Testes de condução nervosa
Testes de condução nervosa sensorial foram realizados nos nervos mediano direito, ulnar esquerdo e sural direito. Testes de condução nervosa motora foram realizados nos nervos mediano direito, ulnar esquerdo, peroneal direito e tibial esquerdo. Latência motora distal (LMD) (ms) e velocidade de condução motora (VCM) em nervos motores e velocidade de condução sensorial (VCS) (m/s) em nervos sensoriais foram registrados.
Avaliação do PSC
Os nervos sensoriais foram estimulados no membro inferior utilizando um eletrodo de barra, e no membro superior com eletrodo em anel. Em primeiro lugar, o limiar sensorial foi encontrado. Para esse propósito, uma corrente eléctrica de 0,5 ms de duração começando com uma intensidade de 0,6 mA foi aplicada lateralmente ao maléolo lateral no membro inferior e ao segundo dedo do membro superior. A menor intensidade, determinada pelo aumento gradual da intensidade até que fosse sentida pelo indivíduo, foi registada como o limiar de intensidade sensorial. As medições do PSC foram realizadas nos membros superior e inferior direitos, utilizando os músculos abductor pollicis brevis (APB) e tibial anterior (TA), respectivamente.
O segundo dedo do membro superior direito foi estimulado, e foram obtidos registros do músculo APB. Antes da gravação, o paciente foi orientado a realizar abdução do polegar com esforço máximo, e a amplitude máxima do potencial de ação da unidade motora (MUAP) foi medida na tela.
Foi solicitado aos indivíduos que realizassem abdução do polegar com amplitudes de MUAP de pelo menos 25% da amplitude máxima de MUAP. Enquanto o paciente executava a abdução, o nervo mediano era estimulado a uma intensidade de 15 vezes o limiar sensorial. Cinco registros foram obtidos a intervalos de 30 segundos. A latência e duração do PSC foram medidas pela média de cinco traçados. O endpoint quando a inibição observável e clara da atividade muscular se iniciava era considerado como a latência do PSC (ms). A duração do PSC (ms) foi determinada medindo o tempo entre o ponto de inibição da atividade muscular e o ponto em que começou a retornar à atividade muscular basal. O nervo sural foi estimulado superficialmente lateralmente ao maléolo lateral no membro inferior direito, e registros foram obtidos do músculo TA utilizando o mesmo método descrito acima.
Testes clínicos
As características da doença, incluindo sua duração, sintomas associados com a FM e o nível de dor foram avaliados. O número de pontos dolorosos e sintomas foram registrados. O número total de sintomas foi calculado e registrado. O nível geral de dor sentida nas últimas 48 horas foi avaliado pela escala visual analógica (EVA) com 0-10 cm.
Para avaliar gravidade da doença, incapacidade funcional e qualidade de vida específica, utilizou-se o questionário Fibromyalgia Impact Questionnaire (FIQ).12 O escore total foi avaliado entre 0-100, com uma pontuação mais elevada mostrando um maior impacto da síndrome sobre o paciente.
Para avaliar possíveis sintomas de depressão nos pacientes, utilizou-se o questionário Beck Depression Inventory (BDI),13 e para avaliar sintomas de ansiedade foi utilizado o Beck Anxiety Inventory (BAI).14 Vinte e uma perguntas do tipo Likert foram feitas com essas escalas, e cada questão foi avaliada entre 0-3.
A qualidade de vida geral dos pacientes foi avaliada com o questionário Short Form-36 (SF-36).15 Assim, foram criados dois subgrupos de escores, como saúde física e saúde mental. O escore total foi avaliado entre 0-100.
Comparações
Os grupos pacientes e controles foram comparados em termos de latência e duração do PSC nos membros superiores e inferiores. Subgrupos foram constituídos de acordo com a latência do PSC e os níveis de duração que foram determinadas como significativamente diferentes entre os grupos com base no PSC médio do grupo controle. Pacientes com medidas de PSC iguais ou abaixo dos valores do grupo controle (grupo 1) foram comparados com pacientes com medições de PSC acima dos valores do grupo controle (grupo 2), em termos de duração da doença, número total de sintomas e pontos dolorosos, nível de dor avaliado pela EVA, escore no FIQ, níveis de depressão e ansiedade e qualidade de vida.
Análise estatística
A análise dos dados foi feita utilizando-se o programa Statistical Package for Social Sciences (SPSS Inc., EUA), versão 11.5, para Windows. As estatísticas descritivas foram apresentadas como média ± desvio padrão e mediana para variáveis contínuas e número de observação (%) para as variáveis nominais, utilizando o teste do qui-quadrado. Diferenças estatisticamente significativas entre os grupos em relação às variáveis contínuas foram estudadas utilizando-se o teste U de Mann-Whitney (de acordo com o teste de Kolmogorov-Smirnov, as variáveis contínuas não apresentavam distribuição normal), e as variáveis nominais com o teste de qui-quadrado de Pearson. A significância da diferença nas variáveis entre os grupos 1 e 2 foi analisada por meio do teste do qui-quadrado de Pearson. A análise de regressão foi utilizada para correlações significativas, utilizando os valores do grupo 1 como a variável dependente. Valores de P < 0,05 foram considerados estatisticamente significantes.
Resultados
A mediana da idade dos 64 participantes incluídos no estudo (46 [71,9%] do sexo feminino, 18 [28,1%] do sexo masculino) era 41,00 (38,53 ± 8,02) anos. A distribuição e comparação das características demográficas e os valores de condução dos nervos motores e sensoriais dos pacientes (n = 32) e de voluntários (n = 32) de acordo com grupos estão apresentados na tabela 1. Não houve diferença significativa entre os grupos em termos de idade, sexo e valores da condução sensorial e motora (P > 0,05).
A distribuição e a comparação da latência e a duração do PSC medidas nos músculos APB e TA de pacientes e controles de acordo com os grupos estão mostradas na tabela 2.
Enquanto as latências médias do PSC nos membros superiores e inferiores dos pacientes eram de 87,25 e 107,75 ms e as durações do PSC eram de 46,25 e 51,15 ms, respectivamente, os valores nos controles eram 80,75 e 101,62 ms (latência) e 48,75 e 54,50 ms (duração), respectivamente.
Latências significativamente prolongadas de PSC em ambos os membros superiores e inferiores foram determinadas nos pacientes em comparação com os indivíduos no grupo controle (P < 0,05).
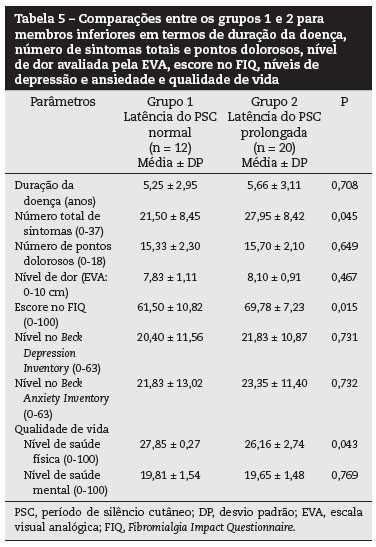
A distribuição de duração da doença, o número total de sintomas e pontos dolorosos, o nível de EVA, o escore no FIQ, os níveis de depressão e ansiedade e a qualidade de vida dos pacientes estão apresentados na tabela 3.
Em relação aos subgrupos formados de acordo com a latência média do PSC no grupo controle (doentes com valores iguais/inferiores versus valores mais elevados em comparação com os controles), observou-se que, embora o número de pacientes com latência normal de PSC no membro superior (grupo 1 para o membro superior) fosse 4 (12,5%), o número de pacientes com latência normal no membro inferior (grupo 1 para a membro inferior) foi 12 (37,5%).
As comparações entre o grupo 1 e o grupo 2 para membros superiores e inferiores, em termos de duração da doença, número total de sintomas e pontos dolorosos, nível de dor avaliada pela EVA, escore no FIQ, níveis de depressão e ansiedade, e qualidade de vida estão mostrados nas tabelas 4 e 5.
Como resultado das comparações, apesar de não haver associação entre o prolongamento da latência do PSC no membro superior e os parâmetros de avaliação, foi detectada uma relação entre o prolongamento da latência do PSC no membro inferior e os números dos sintomas totais, escore no FIQ e nível de saúde física. Assim, houve uma correlação positiva entre o prolongamento da latência do PSC e número total de sintomas e escore no FIQ, e uma correlação negativa entre o prolongamento da latência do PSC e o nível de saúde física.
A análise de regressão feita para correlações significativas usando os valores do grupo 1 como a variável dependente demonstrou que o prolongamento da latência do PSC no membro inferior estava associado com a gravidade da doença e a incapacidade funcional medida através do FIQ (odds ratio [OR]: 0,467, P = 0,002) e nível de saúde física medidos com a sub-escala de saúde física do questionário SF-36 (OR: -0,231, P = 0,024).
Discussão
A FM não está diretamente associada à disfunção de órgãos. Vários polimorfismos genéticos, alterações no eixo hipotálamo-hipófise-adrenal (HHA), concentração anormal de neuropeptídeos e aminas biogênicas, tais como a serotonina, noradrenalina, cortisol e substância P, e alterações de ativação de receptores, tais como N-metil-D-ácido aspártico (NMDA) e glutamato foram descritos em sua etiopatogenia.16
Uma redução dos níveis de mediadores, tais como inibidores de serotonina, e um aumento dos níveis de mediadores excitatórios, tais como a substância P induzida por vários fatores de estresse, trauma ou agentes infecciosos, em indivíduos geneticamente predispostos, podem explicar os sintomas, incluindo distúrbios do sono e psicológicos e fraqueza muscular.17 Níveis inadequados de cortisol, hormônio do crescimento e fator de crescimento insulina-like I devido à disfunção do eixo HHA podem causar sintomas como fadiga e intolerância ao exercício.18
No entanto, essas teorias não são suficientes para explicar a dor crônica e generalizada na FM. Há uma diminuição do limiar de dor em FM e a dor não se limita a pontos dolorosos, havendo um aumento da sensibilidade a estímulos inespecíficos como pressão mecânica e sensações de frio/quente em áreas fora dos locais de pontos dolorosos ou em áreas sem dor espontânea. Além disso, existe um desvio dos mecanismos de dor central.7,19
A literatura tem relatado que a hiperexcitabilidade dos neurônios espinais e supra-espinais desempenha um papel importante no desenvolvimento e na manutenção da dor crônica.4,5
Evidências indiretas como o aumento regional no fluxo sanguíneo cerebral de algumas áreas, alterações do sistema de modulação nociceptiva, sensibilização central, aumento da somação temporal, potenciais evocados tardios, sensibilidade das fibras C e alteração nos níveis de substância P, que são conhecidos por desempenhar um papel eficaz na transmissão da dor em pacientes com FM, têm sido relatados na literatura.20,21
Nociceptores periféricos podem ser estimulados com trauma do tecido e/ou uma up-regulação da expressão do nociceptor. Impulsos nociceptores periféricos são transmitidos para a medula espinal por fibras A delta mielinizadas e C não mielinizadas. Inicialmente, a dor é mediada pela fibra A delta, e a dor crônica ocorre por meio das fibras C com o estímulo contínuo.22 Embora estudos avaliando fibras C por RFN sejam encontrados na literatura,22,23 apenas um estudo avaliou fibras A delta usando a medição do PSC.10
Portanto, nosso objetivo foi comparar os pacientes com FM com controles saudáveis , a fim de avaliar as diferenças da latência e duração do PSC nos membros superiores e inferiores e, quando presente, determinar se havia alguma associação entre PSC e características da doença, distúrbios psicológicos e qualidade de vida.
Com base nos resultados de nosso estudo, apesar de latências significativamente prolongadas do PSC nos membros superiores e inferiores terem sido encontradas nos pacientes em comparação com o grupo controle, não houve diferença significativa entre os grupos em termos de duração do PSC. Além disso, observou-se que o prolongamento da latência do PSC no membro inferior estava correlacionado com a gravidade da doença e a incapacidade funcional física dos pacientes.
O PSC é um reflexo protetor que provoca uma pausa na contração muscular voluntária na presença de estímulos dolorosos de um nervo cutâneo. Os impulsos aferentes que geram o PSC são transportados por fibras A delta, mas o mecanismo central do PSC não é conhecido.24 O PSC é útil para avaliar os componentes e segmentos das fibras A delta (não avaliada por métodos eletrodiagnósticos modernos) e para entender doenças do sistema nervoso central (SNC) com distúrbios motores e sensoriais.25 Alguns estudos têm utilizado o PSC para avaliar a função da via nociceptiva a nível espinal e supraespinal em pacientes com dor neuropática.26
Estudos na literatura têm demonstrado que o PSC foi registrado em várias neuropatias sensoriais, incluindo ataxia de Friedreich, abetalipoproteinemia e doença de Fabry, neuropatias de aprisionamento, como síndromes do túnel do carpo e ulnar, lesões da medula espinal, incluindo mielopatia, radiculopatia, siringomielia e avulsão da raiz e distúrbios do SNC incluindo doença de Parkinson e distonia.25,27-31 Além disso, estudos têm relatado que as medições do PSC podem ser realizadas com vários músculos e com diferentes métodos. Um estudo semelhante ao nosso, realizado por Sahin et al.,10 mostrou que a latência do PSC gravada a partir do músculo APB com a estimulação do quinto dedo da mão de pacientes com FM (n = 28) era maior do que no grupo controle (n = 18), mas não houve nenhuma diferença significativa entre os grupos em termos de duração do PSC. Além disso, apenas o membro superior foi avaliado naquele estudo.
Em nosso trabalho, embora utilizando métodos de estimulação diferentes dos descritos na literatura, um prolongamento significativo da latência do PSC (medido nos músculos APB e TA) em ambos os membros superiores e inferiores, foi encontrado em pacientes em comparação com os controles. Além disso, não houve nenhuma diferença em termos de duração do PSC. Esse resultado é compatível com aquele relatado por Sahin et al.10
Estudos relataram que a latência do PSC ocorre em três momentos: tempo de condução periférica conduzida por fibras A delta, tempo necessário para a inibição na medula espinal, e o tempo da medula espinal até as fibras motoras musculares.32 Nossos resultados são compatíveis com as teorias que citam alterações no caminho da dor. Estudos na literatura relataram que a duração do PSC é reduzida e a latência aumentada em distúrbios de neurônios periféricos, tais como a neuropatia e perda de fibras A delta. Além disso, tanto a latência quanto a duração do PSC são prolongadas na doença de Parkinson e distonia. Nenhum dos nossos pacientes apresentou evidências sugerindo neuropatia em estudos de velocidade de condução ou evidências de perda de fibras A delta tais como mielopatia, radiculopatia ou avulsão da raiz. Estudos em doença de Parkinson têm explicado que a duração prolongada do PSC está relacionada com a atividade de maior duração em circuitos inibitórios na medula espinal.
De acordo com nossos resultados, embora houvesse uma ligeira redução na duração do PSC em pacientes quando comparado ao grupo controle, a diferença não foi estatisticamente significativa. Apesar de nossos pacientes não terem nenhuma doença grave que sugerisse a perda de fibras A delta, Onal et al.,33 em seu estudo realizado com pacientes sem neuropatia de fibras grandes com diabetes mellitus em estágio inicial, e Oz et al.,34 em seu estudo realizado com pacientes com síndrome das pernas inquietas, relataram que a latência prolongada do PSC está relacionada à neuropatia de fibra pequena. Além disso, Ulas et al.35 avaliaram a presença de disautonomia na FM e mostraram que a latência da resposta cutânea simpática é maior do que no grupo controle, e também relataram que esse resultado pode ser um indicador de neuropatia de fibra pequena em pacientes com FM.
À luz dessa informação, acreditamos que nossos pacientes podem ter tido neuropatia de fibra pequena. No entanto, exceto para as possibilidades acima mencionadas, a razão para duração normal do PSC pode estar relacionada com problemas técnicos durante as medições.
Tem sido relatado na literatura que a dor tem dois componentes emocionais. Assim, o efeito da dor principal é o desconforto da sensação, enquanto o efeito da dor secundária é a ocorrência de sentimentos negativos como depressão, raiva e medo.36 A FM afeta a saúde emocional funcional e psicológica, bem como a qualidade de vida dos pacientes, devido à cronicidade da dor. Estudos sobre a patogênese da FM têm demonstrado que a depressão e a ansiedade são afetadas por mecanismos neuroendócrinos semelhantes.37 Como resultado de nosso estudo, apesar de não haver relação entre a latência do PSC e os níveis de ansiedade e depressão, esses últimos estavam acima dos valores normais. Conforme relatado na literatura, esses distúrbios psicológicos podem ser fatores de risco para o desenvolvimento de FM e, teoriza-se que esses distúrbios estão presentes desde o início da doença.38
Os instrumentos usados para medir qualidade de vida podem ser genéricos ou específicos. Usamos o questionário SF-36 para a avaliação genérica e o questionário FIQ para a avaliação específica da qualidade de vida. Estudos na literatura têm relatado que os níveis de qualidade de vida avaliados pelo FIQ e pelo SF-36 em pacientes com FM foram significativamente maiores do que em voluntários saudáveis.39,40 Os resultados não puderam ser comparados, uma vez que não existe nenhum estudo na literatura que investigou latência do PSC em pacientes com FM.
Pagano et al.41 avaliaram a qualidade de vida em pacientes com FM usando FIQ e SF-36, e relataram que o questionário FIQ é melhor para avaliar a qualidade de vida do que o SF-36. Esse estudo também mostrou limitação física funcional em pacientes com FM, reduzida em 10 vezes em comparação com o grupo controle.
Nossos resultados, mostrando que o prolongamento da latência do PSC está associado com os escores de FIQ e a sub-escala da saúde física do SF-36, demonstram que a anormalidade nos caminhos da dor reflete na função física dos pacientes. Além disso, esse resultado pode estar relacionado com uma potencial neuropatia de fibra pequena. Considerando os resultados discutidos acima, a presença de uma potencial neuropatia de fibra pequena nesses pacientes pode explicar a ausência de diferença na saúde mental, de acordo com a sub-escala do SF-36 e os níveis de ansiedade e depressão. Embora estudos de grande escala sejam necessários, acreditamos que a avaliação da latência do PSC em pacientes com FM pode esclarecer a incapacidade funcional dos pacientes.
A associação da latência do PSC na extremidade inferior com a gravidade da doença e limitação da função física pode ser explicada por meio de medições no membro superior, que foram realizadas na posição sentada, enquanto as medições no membro inferior foram realizadas em posição supina, que é mais confortável. Por conseguinte, a manutenção da contração muscular voluntária pode ser mais fácil na posição supina do que na posição sentada. Estudos relataram que a distância do músculo pode ser efetiva na latência e duração do PSC.28,42 O efeito desse reflexo aumenta dos músculos proximais para os distais. O membro superior tem uma via de reflexo mais curta em comparação com o inferior, em termos de comprimento do membro; portanto, a deficiência funcional pode estar associada com o prolongamento da latência do PSC no membro inferior.
Limitações do estudo
Esse estudo está sujeito a diversas limitações. Escalas de avaliação clínica não foram utilizadas no grupo controle; assim, as comparações adequadas não puderam ser realizadas. Além disso, nenhum teste, como biópsia de pele ou o estudo do sistema nervoso autônomo, foi feito para confirmar o diagnóstico de neuropatia de fibra pequena em nosso estudo, impossibilitando assim a declaração de qualquer resultado definitivo.
Conclusão
As latências do PSC, tanto nos membros superiores quanto nos inferiores de pacientes com FM, são mais longas do que em voluntários saudáveis. Acreditamos que esse resultado reforça a teoria de anormalidades na trajetória da dor aos níveis periférico e espinal na patogênese da FM. Essas alterações podem ser causadas por alterações no corno posterior da medula espinal, bem como uma neuropatia de pequenas fibras, devido à perda direta de fibras A delta. Para determinar a causa exata, são necessários estudos que avaliem a fibra A delta e utilizem vários testes simultaneamente. Como um resultado secundário, verificou-se que o prolongamento da latência do PSC no membro inferior está associado com a gravidade da doença e a incapacidade funcional física. Assim, acreditamos que a latência do PSC pode ser utilizada como um método de avaliação para medir a gravidade da doença e a incapacidade física na FM. No entanto, antes de sua utilização como método padrão de medição, estudos de grande escala devem ser realizados e valores normais devem ser estabelecidos.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
Recebido em 26 de setembro de 2012
Aceito em 9 de dezembro de 2012
-
1Wolfe F, Smythe HA, Yunus MB, Bennett RM, Bombardier C, Goldenberg DL, et al. The American College of Rheumatology 1990 Criteria for the Classification of Fibromyalgia. Report of the Multicenter Criteria Committee. Arthritis Rheum. 1990;33(2):160-72.
-
2Weir PT, Harlan GA, Nkoy fl, Jones SS, Hegmann KT, Gren LH, et al. The incidence of fibromyalgia and its associated comorbidities: a population-based retrospective cohort study based on international classification of diseases, 9th revision codes. J Clin Rheumatol. 2006;12(3):124-8.
-
3Ablin J, Cohen H, Buskila D. Mechanisms of disease: genetics of fibromyalgia. Nat Clin Proct Rheumatol. 2006;2:671-8.
-
4Jensen TS, Gottrup H, Kasch H, Nikolajsen L, Terkelsen AJ, Witting N. Has basic research contributed to chronic pain treatment? Acta Anaesthesiol Scand 2001;45:112835.
-
5Woolf CJ, Salter MW. Neuronal plasticity: increasing the gain pain. Science. 2000;288:17659.
-
6Desmeules JA, Cedraschi C, Rapiti E, Baumgartner E, Finckh A, Cohen P, et al. Neurophysiologic evidence for a central sensitization in patients with fibromyalgia. Arthritis Rheum. 2003;48(5):1420-9.
-
7Staud R, Cannon RC, Mauderli AP, Robinson ME, Price DD, Vierck CJ Jr. Temporal summation of pain from mechanical stimulation of muscle tissue in normal controls and subjects with fibromyalgia syndrome. Pain. 2003;102(1-2):87-95.
-
8Leis AA. Cutaneous silent period. Muscle Nerve. 1998;21(10):1243-1245.
-
9Leis AA, Stokic DS, Fuhr P, Kofler M, Kronenberg MF, Wissel J, et al. Nociceptive fingertip stimulation inhibits synergistic motoneuron pools in the human upper limb. Neurology. 2000;14;55(9):1305-9.
-
10Sahin O, Yildiz S, Yildiz N. Cutaneous silent period in fibromyalgia. Neurol Res. 2011; 33(4):339-43.
-
11Oh S. Principles of clinical electromyography. Normal values for common nerve conduction tests. In: Oh S (ed). 2nd ed. Baltimore: Williams and Wilkins Company, 1998; p.84-105.
-
12Sarmer S, Ergin S, Yavuzer G. The validity and reliability of the Turkish version of the Fibromyalgia Impact Questionnaire. Rheumatol Int. 2000;20:9-12.
-
13Hisli N. A study on the Beck Depression Inventory validity. J Psychology. 1988;6(22):118-22.
-
14Ulusoy M, Erkmen H, Sahin N. Turkish Version of the Beck Anxiety Inventory: Psychometric Properties. J Cog Psychother. 1998;12:163-72.
-
15Kocyigit H, Aydemir O, Fisek G, Olmez N, Memis A. The validity and reliability of the Turkish version of the Short Form-36. Drug Ther J. 1999;12:102-6.
-
16Ablin J, Neumann L, Buskila D. Pathogenesis of fibromyalgia - A review. Joint Bone Spine. 2008;75(3):273-9.
-
17Yunus MB. Role of central sensitization in symptoms beyond muscle pain, and the evaluation of a patient with widespread pain. Best Pract Res Clin Rheumatol. 2007;21:481-97.
-
18Dessein PH, Shipton EA, Joffe BI, Hadebe DP, Stanwix AE, Van der Merwe BA. Hyposecretion of adrenal androgens and the relation of serum adrenal steroids, serotonin and insulinlike growth factor-1 to clinical features in women with fibromyalgia. Pain. 1999;83(2):313-9.
-
19Kosek E, Ekholm J, Hansson P. Sensory dysfunction in fibromyalgia patients with implications for pathogenic mechanisms. Pain. 1996;68:37583.
-
20Granot M, Buskila D, Granovsky Y, Sprecher E, Neumann L, Yarnitsky D. Simultaneous recording of late and ultra-late pain evoked potentials in fibromyalgia. Clin Neurophysiol. 2001;112:18817.
-
21Lautenbacher S, Rollman GB. Possible deficiencies of pain modulation in fibromyalgia. Clin J Pain. 1997;13:189-96.
-
22Staud R, Bovee CE, Robinson ME, Price DD. Cutaneous C-fiber pain abnormalities of fibromyalgia patients are specifically related to temporal summation. Pain. 2008;139(2):315-23.
-
23Lim EC, Sterling M, Stone A, Vicenzino B. Central hyperexcitability as measured with nociceptive flexor reflex threshold in chronic musculoskeletal pain: a systematic review. Pain. 2011;152(8):1811-20.
-
24Kofler M, Kumru H, Stetkarova I, Schindler C, Fuhr P. Muscle force up to 50% of maximum does not affect cutaneous silent periods in thenar muscles. Clin Neurophysiol. 2007;118:202530.
-
25Floeter MK. Cutaneous silent periods. Muscle Nerve. 2003;28:391-401.
-
26Truini A, Galeotti F, Biasiotta A, Gabriele M, Inghilleri M, Petrucci MT, et al. Dissociation between cutaneous silent period and laser evoked potentials in assessing neuropathic pain. Muscle Nerve. 2009;39(3):369-73.
-
27Leis AA, Stokic DS, Fuhr P, Kofler M, Kronenberg MF, Wissel J, et al. Nociceptive fingertip stimulation inhibits synergistic motoneuron pools in the human upper limb. Neurology. 2000;14;55(9):1305-9.
-
28Svilpauskaite J, Truffert A, Vaiciene N, Magistris MR. Electrophysiology of small peripheral nerve fibers in man. A study using the cutaneous silent period. Medicina (Kaunas). 2006;42(4):300-13.
-
29Leis AA, Kofler M, Ross MA. The silent period in pure sensory neuronopathy. Muscle Nerve. 1992;15:1345-8.
-
30Pullman SL, Ford B, Elibol B, Uncini A, Su PC, Fahn S. Cutaneous electromyographic silent period findings in brachial dystonia. Neurology. 1996;46:503-8.
-
31Serrao M, Parisi L, Valente G, Martini A, Fattapposta F, Pierelli F, et al. L-Dopa decreases cutaneous nociceptive inhibition of motor activity in Parkinsons disease. Acta Neurol Scand. 2002;105:196-201.
-
32Leis AA. Cutaneous silent period. Muscle Nerve. 1998;21(10):1243-1245.
-
33Onal MR, Ulas UH, Oz O, Bek VS, Yucel M, Taslipinar A, et al. Cutaneous silent period changes in type 2 diabetes mellitus patients with small fiber neuropathy. Clin Neurophysiol. 2010;121:714-8.
-
34Oz O, Erdogan C, Yucel M, Akgun H, Kutukcu Y, Gokcil Z, et al. Effect of pramipexole on cutaneous-silent-period parameters in patients with restless legs syndrome. Clin Neurophysiol. 2012;123:154-9.
-
35Ulas UH, Unlu E, Hamamcioglu K, Odabasi Z, Cakci A, Vural O. Dysautonomia in fibromyalgia syndrome: sympathetic skin responses and RR interval analysis. Rheumatol Int. 2006;26(5):383-7.
-
36Rainville P, Bao QV, Chretien P. Pain-related emotions modulate experimental pain perception and autonomic responses. Pain. 2005;118:306-18.
-
37Yuen KC, Bennett RM, Hryciw CA, Cook MB, Rhoads SA, Cook DM. Is further evaluation for growth hormone (GH) deficiency necessary in fibromyalgia patients with low serum insulinlike growth factor (IGF)-I levels? Growth Horm IGF Res. 2007;17:82-8.
-
38Staud R. Biology and therapy of fibromyalgia: pain in fibromyalgia syndrome. Arthritis Res Ther. 2006;8:208-15.
-
39Bennett RM, Bushmakin AG, Cappelleri JC, Zlateva G, Sadosky AB. Minimal clinically important difference in the fibromyalgia impact questionnaire. J Rheumatol. 2009;36(6):1304-11.
-
40Hoffman DL, Dukes EM. The health status burden of people with fibromyalgia: a review of studies that assessed health status with the SF-36 or the SF-12. Int J Clin Pract. 2008;62(1):115-26.
-
41Pagano T, Matsutani LA, Ferreira EA, Marques AP, Pereira CA. Assessment of anxiety and quality of life in fibromyalgia patients. Sao Paulo Med J. 2004;122(6):252-8.
-
42Romaniello A, Truini A, Galeotti F, De Lena C, Willer JC, Cruccu G. Cutaneous silent period in hand muscle is evoked by laser stimulation of the palm, but not the hand dorsum. Muscle Nerve. 2004;29:870-2.
Datas de Publicação
-
Publicação nesta coleção
16 Set 2013 -
Data do Fascículo
Jun 2013
Histórico
-
Recebido
26 Set 2012 -
Aceito
09 Dez 2012