Resumos
Bothrops alternatus Duméril, Bibron & Duméril, 1854 é uma serpente de importância em saúde pública, com ampla distribuição geográfica, desde o Mato Grosso do Sul até o sudeste do Brasil, chegando até a Argentina e Uruguai, ocupando vários domínios morfoclimáticos. Neste trabalho investigou-se a variação do veneno de adultos de Bothrops alternatus, em função de sua distribuição geográfica no Brasil, comparativamente ao veneno elaborado sob a forma de "pool" desta espécie (veneno referência), que inclui serpentes, em sua maioria, da região do estado de São Paulo. Foram analisadas as atividades letal, coagulante sobre o plasma, proteolítica sobre a caseína e miotóxica, bem como os padrões eletroforéticos de 61 amostras individuais de veneno contrapostas ao "pool". Os resultados mostraram que o veneno de B. alternatus é pouco ativo, comparativamente ao de outros Bothrops Wagler, 1824. A variação individual prevaleceu, não apresentando correlação com as áreas de distribuição geográfica e domínios morfoclimáticos, porém a atividade coagulante das amostras de veneno provenientes do nordeste da distribuição geográfica apresentaram-se menos ativas comparativamente às da porção central da distribuição. Os venenos provenientes das bordas da distribuição apresentaram ações proteolíticas e miotóxicas mais intensas, que estatisticamente não foram significativamente diferentes. As variações individuais prevaleceram.
Biogeografia; variação intraespecífica; atividades do veneno
Bothrops alternatus Duméril, Bibron & Duméril, 1854 snakebites are an important public health problem in Brazil. Such snakes are found from Mato Grosso do Sul (central Brazil) to southeastern Brazil, reaching even Argentina and Uruguay and thereby occupying different morphoclimatic domains. This work investigated venom variation occurring in adult specimens of B. alternatus specimens, according to their geographic distribution in Brazil. The standard venom pool (reference venom) produced by Instituto Butantan, which includes mostly venoms from B. alternatus specimens captured in São Paulo State, was also used for comparison. Lethal, myotoxic, proteolytic (on casein), and coagulant (on human plasma) activities, as well as the electrophoretic patterns of 61 individual venom samples, were evaluated and compared to those of the reference venom pool. Results showed that B. alternatus venom activities are less potent than those of other Bothrops Wagler, 1824 species. A great individual variation was noticed, which could not be correlated with either geographic distribution or morphoclimatic domains. Coagulant activity of venom samples obtained from specimens captured in the northeastern area of B. alternatus distribution was less intense if compared to those obtained from the central zone. Venoms from the peripheric area of B. alternatus distribution presented higher proteolytic and myotoxic activities, but no statistically significant difference was observed. In summary, individual variation predominated over geographic distribution.
Biogeography; intraspecific variation; venom activities
Caracterização individual do veneno de Bothrops alternatus Duméril, Bibron & Duméril em função da distribuição geográfica no Brasil (Serpentes,Viperidae)
Individual characterization of Bothrops alternatus Duméril, Bibron & Duméril venoms, according to their geographic distribution in Brazil (Serpentes, Viperidae)
Marisa M. T. da Rocha; Maria de F. D. Furtado
Laboratório de Herpetologia, Instituto Butantan. Avenida Vital Brazil 1500, Butantan, 05503-900 São Paulo, São Paulo, Brasil. E-mail: bahrocha@uol.com.br; fatifurtado@butantan.gov.br
RESUMO
Bothrops alternatus Duméril, Bibron & Duméril, 1854 é uma serpente de importância em saúde pública, com ampla distribuição geográfica, desde o Mato Grosso do Sul até o sudeste do Brasil, chegando até a Argentina e Uruguai, ocupando vários domínios morfoclimáticos. Neste trabalho investigou-se a variação do veneno de adultos de Bothrops alternatus, em função de sua distribuição geográfica no Brasil, comparativamente ao veneno elaborado sob a forma de "pool" desta espécie (veneno referência), que inclui serpentes, em sua maioria, da região do estado de São Paulo. Foram analisadas as atividades letal, coagulante sobre o plasma, proteolítica sobre a caseína e miotóxica, bem como os padrões eletroforéticos de 61 amostras individuais de veneno contrapostas ao "pool". Os resultados mostraram que o veneno de B. alternatus é pouco ativo, comparativamente ao de outros Bothrops Wagler, 1824. A variação individual prevaleceu, não apresentando correlação com as áreas de distribuição geográfica e domínios morfoclimáticos, porém a atividade coagulante das amostras de veneno provenientes do nordeste da distribuição geográfica apresentaram-se menos ativas comparativamente às da porção central da distribuição. Os venenos provenientes das bordas da distribuição apresentaram ações proteolíticas e miotóxicas mais intensas, que estatisticamente não foram significativamente diferentes. As variações individuais prevaleceram.
Palavras chave: Biogeografia, variação intraespecífica, atividades do veneno.
ABSTRACT
Bothrops alternatus Duméril, Bibron & Duméril, 1854 snakebites are an important public health problem in Brazil. Such snakes are found from Mato Grosso do Sul (central Brazil) to southeastern Brazil, reaching even Argentina and Uruguay and thereby occupying different morphoclimatic domains. This work investigated venom variation occurring in adult specimens of B. alternatus specimens, according to their geographic distribution in Brazil. The standard venom pool (reference venom) produced by Instituto Butantan, which includes mostly venoms from B. alternatus specimens captured in São Paulo State, was also used for comparison. Lethal, myotoxic, proteolytic (on casein), and coagulant (on human plasma) activities, as well as the electrophoretic patterns of 61 individual venom samples, were evaluated and compared to those of the reference venom pool. Results showed that B. alternatus venom activities are less potent than those of other Bothrops Wagler, 1824 species. A great individual variation was noticed, which could not be correlated with either geographic distribution or morphoclimatic domains. Coagulant activity of venom samples obtained from specimens captured in the northeastern area of B. alternatus distribution was less intense if compared to those obtained from the central zone. Venoms from the peripheric area of B. alternatus distribution presented higher proteolytic and myotoxic activities, but no statistically significant difference was observed. In summary, individual variation predominated over geographic distribution.
Key words: Biogeography, intraspecific variation, venom activities.
Os venenos de serpentes são misturas complexas de enzimas e polipeptídeos farmacologicamente ativos (BJARNASON & FOX 1988/89, IWANAGA & SUZUKI 1979), os quais podem apresentar variações na composição, diferenciando-se entre as famílias, gêneros e espécies ou mesmo dentro de uma mesma espécie. Diferenças intra-específicas na composição do veneno são decorrentes de variações geográficas, sexuais, ontogenéticas e sazonais (BRAZIL 1901, MOURA-DA-SILVA et al. 1990 a, b, FURTADO et al. 1991 a, b, CHIPPAUX et al. 1991).
As secreções liberadas por serpentes crotalíneas induzem, geralmente, intenso dano tecidual local ocasionando edema, hemorragia e necrose e, em alguns casos, alterações no sistema de coagulação sangüínea (LOMONTE 1994, OHSAKA 1979). No Brasil, as serpentes do gênero Bothrops têm recebido grande atenção devido à elevada incidência de acidentes, sendo mais de 90% dos casos oficialmente registrados (MINISTÉRIO DA SAÚDE 1998).
A composição do veneno apresenta características particulares, tanto na intensidade como nos tipos de ações, para cada espécie de serpente (FURTADO et al. 1991a, SANCHEZ et al. 1992). Para o gênero Bothrops Wagler, 1824 já foram identificadas variações na composição do veneno em função da distribuição geográfica nas espécies B. jararaca (Wied, 1824), B. neuwiedi Wagler 1824, B. asper (Garman, 1883), B. atrox (Linnaeus, 1758) e B. moojeni Hoge 1966.(SCHENBERG 1961, 1963, ARAGÓN & GUBENSEK 1981, ASSAKURA et al. 1992, RODRIGUES et al. 1998).
A relevância das variações na composição dos venenos influenciados por fatores biológicos como a variação intraespecífica ao nível geográfico, pode auxiliar na identificação de novas populações e mesmo variações individuais dentro de uma espécie de serpente, sendo importante tanto do ponto de vista da pesquisa científica, como na elaboração de pools de veneno para a imunização na produção dos antivenenos ofídicos (RAW et al. 1991).
A urutu, Bothrops alternatus, ocorre no Mato Grosso do Sul e Goiás (Brasil) até a região central da Argentina e limite meridional do Uruguai, ocupando predominantemente áreas abertas (CAMPBELL & LAMAR 1989). Esta serpente é terrestre, possui o corpo robusto e pode atingir cerca de 1.700 mm de comprimento (Fig. 1). Em algumas áreas de ocorrência, destacando-se o Rio Grande do Sul, possui importância médica, sendo responsável por acidentes em humanos (SANTOS-COSTA et. al. 2001).
Popularmente, a urutu ou cruzeira do sul é conhecida por causar acidentes graves, onde se aplica o ditado: "A urutu quando não mata aleija" (PEREIRA 1939/40). Contrariamente à crença popular, estudos indicam que o veneno dessa serpente é pouco ativo quanto às atividades enzimáticas, não apresenta ação amidolítica (FURTADO et. al. 1991b) e possui baixa atividade caseinolítica e fibrinolítica (FURTADO et. al. 1991b, LEITE et. al. 1992, SANCHEZ et al. 1992). Além disso, atua moderadamente sobre o plasma total, fibrinogênio, Fator X e II (FURTADO et. al. 1991b; SANCHEZ et al. 1992). Foram isoladas deste veneno a Balterobin, enzima tipo-trombina (SMOLKA et. al. 1998) e a Bothroalternin (27kDa) que inibe a agregação plaquetária e coagulação do fibrinogênio (CASTRO et al. 1998). Quanto às ações locais, apresenta baixa atividade hemorrágica e necrosante (FURTADO et. al. 1991a, SANCHEZ et al. 1992, ACOSTA PÉREZ et. al. 1998) e não apresenta componentes miotóxicos específicos (LOMONTE et al. 1990, MOURA-DA-SILVA et al. 1990a), causando mionecrose do tipo coagulativa (QUEIROZ & PETTA 1984).
O Instituto Butantan é o principal produtor e fornecedor de venenos para as pesquisas científicas, e também importante produtor dos antivenenos ofídicos utilizados no Brasil. A maior porcentagem de serpentes provêem da região sudeste do país. Devido a ampla distribuição da espécie Bothrops alternatus e ocupação de vários tipos de habitats, não existem informações que permitam afirmar que o veneno de B. alternatus seja semelhante ao longo de sua distribuição.
Neste trabalho procuramos investigar a composição protéica por meio de eletroforese em SDS-PAGE, as atividades letal, coagulante sobre o plasma, proteolítica sobre a caseína e miotóxica do veneno da espécie B. alternatus, de amostras individuais e com acurada e ampla procedência geográfica.
MATERIAL E MÉTODOS
Venenos
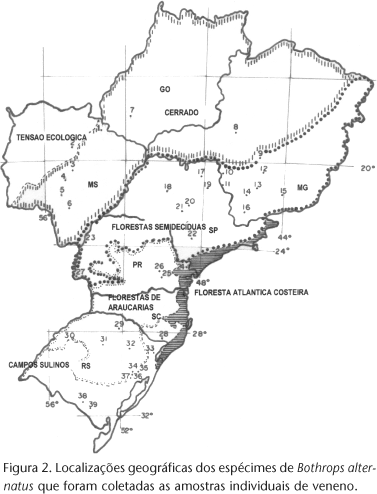
Foram coletadas 61 amostras individuais do veneno de Bothrops alternatus adultos, secas a vácuo ou liofilizadas (Tab. I e Fig. 2), e um "pool" de venenos de B. alternatus de exemplares provenientes, em sua maioria, do Estado de São Paulo, o qual será utilizado como veneno referência. Armazenadas a 20ºC e as soluções de veneno sendo preparadas no momento do uso.
Eletroforese
A separação das proteínas foi realizada por meio da técnica de eletroforese em SDS-PAGE na concentração em gradiente de 7,5 a 17,5%, conforme o método de LAEMMLI (1970). Em todas as corridas foi aplicada, para comparação, uma amostra do veneno referência e o Padrão de Peso Molecular (Pharmacia) 94 kDa (Fosforilase b), 67 kDa (Albumina bovina), 43 kDa (Ovoalbumina), 30 kDa (Anidrase carbônica), 20,1 kDa (Inibidor de Tripsina) e 14,4 kDa (Alfa-Lactoalbumina).
Atividade Coagulante
A atividade coagulante das amostras de veneno foi determinada por meio da Dose Mínima Coagulante sobre o Plasma (DMC-P), sendo definida como a menor quantidade de veneno, em mg de veneno seco por litro de solução teste, capaz de coagular em 60 segundos, a 37ºC, uma solução padronizada de plasma eqüino citratado (THEAKSTON & REID 1983).
As amostras de veneno foram diluídas em solução salina 0,85% em diferentes concentrações: 0,031; 0,062; 0,125; 0,25; 0,5 e 1,0 mg/ml e testadas com auxílio de Fibrômetro Fibro Systen TM modelo 5 marca BBL. O tempo de coagulação foi obtido adicionando-se às alíquotas de 200 µl da solução de plasma, mantidas a 37ºC, 100µl de cada solução de veneno. Os valores para as DMC-P foram obtidos por meio da análise de regressão linear do tempo de coagulação sobre a quantidade de veneno e calculados em escala logarítimica.
Atividade Proteolítica
A determinação da atividade proteolítica do veneno de B. alternatus foi realizada conforme o método de LOMONTE & GUTIÉRREZ (1983), que utiliza a caseína como substrato. Um mililitro da solução de caseína 1% foi adicionado a 1ml de solução de cada amostra de veneno, nas concentrações de 200 e 400 µg. As amostras foram incubadas por 30min a 37ºC; em seguida as reações foram interrompidas mediante a adição de 3,0ml de ácido tricloroacético a 5% e, mantidos em repouso por 30min. à temperatura ambiente; a seguir os tubos foram centrifugados e as absorbâncias dos sobrenadantes lidas a 280nm.
A atividade proteolítica foi expressa em U/mg e obtida pela fórmula:
Atividade Miotóxica
Para a avaliação da atividade miotóxica dos venenos utilizou-se o método de quantificação dos níveis séricos da enzima creatina-quinase (CK) conforme GUTIÉRREZ et al. (1980). Um total de 100 µl da solução de veneno, na concentração de 50 µg, foi inoculada, i.m., no coxim da pata direita posterior em camundongos NIH (n = 5) pesando de 18 a 22g. Os animais controle foram inoculados com salina 0,85% estéril.
As amostras de sangue foram coletadas, via plexo ocular, e centrifugadas (centrífuga Tomy 120) seis horas após a injeção de veneno. Após a obtenção dos soros, foram imediatamente quantificados os níveis séricos de CK conforme determinado pelos Kits da Sigma Diagnostics (USA) Creatine Phoskinase (CK) Quantitative Colorimetric Detremination in Serun or Plasma at 500-400 nm Procedure nº 520.
Letalidade
Para a determinação da atividade tóxica de algumas amostras, foram preparadas diluições crescentes dos venenos, com solução fisiológica 0,85%. Foram inoculados 0,5 ml i.p. de cada uma das diluições em grupos de quatro camundongos. A quantidade de animais mortos para cada dose de veneno foi observada em um período de 24 e 48 horas. A Dose Letal 50% (DL50) foi calculada pela análise de probitos (FINNEY 1971), usando-se o número total de camundongos mortos por dose de veneno durante o período de observação (VILLARROEL et al. 1978/79).
Análise da distribuição geográfica
Os resultados das atividades testadas nas amostras de veneno de B. alternatus foram analisados segundo os domínios fitogeográficos e morfoclimáticos (AB'SABER 1977, IBGE 1993).
Análise estatística
Nas análises estatísticas (VANZOLINI 1993, ZAR 1999) foram utilizados testes paramétricos, ANOVA, para verificação da significância da variação entre os valores médios obtidos nas atividades proteolítica, coagulante sobre plasma e miotóxica das amostras de venenos individuais da espécie Bothrops alternatus. Para a análise das DL50% foi utilizada a metodologia descrita por LITCHFIELD & WILCOXON (1949), utilizando-se o programa estatístico STATATM, versão 8.0.
RESULTADOS
Na análise dos perfís eletroforéticos das amostras dos venenos de B. alternatus (62 amostras), os principais componentes mostraram mobilidades eletroforéticas em SDS-PAGE similares, onde apresentaram maior número de bandas protéicas de peso molecular entre 67 e 28 kDa (Fig. 3 apresenta-se algumas amostras selecionadas, da área de distribuição geral da amostragem utilizada). Nas amostras distinguem-se 15 bandas, embora nenhum dos venenos possua todas. Além disso, três bandas foram conservativas, estando presentes na totalidade dos venenos, uma banda majoritária de aproximadamente 55 kDa, uma na região de 27 e na região de 14 kDa. Maior variabilidade no número de bandas protéicas foram encontradas nas regiões entre 30 e 57 kDa (Fig. 3).
Na determinação da ação coagulante do veneno de B. alternatus, as amostras apresentaram-se, em sua maioria, com baixa atividade sobre o plasma equino, com valores acima de 200 mg/litro (Tab. I, Figs 2 e 4A).
As amostras do estado de Minas Gerais (Tab. I, Figs 2 e 4A), correspondentes às amostras 13 a 16 (Florestas Semidecíduas) e regiões de Florestas de Araucária no Paraná (amostras 25 e 26) foram menos ativas sobre o plasma, com valores das DMC-P acima de 250 mg/litro, inclusive venenos que não apresentaram ação coagulante sobre o plasma, com o método aqui empregado (amostras 13, 14, 16, 25 e 26 Tab. I). Nas demais áreas, sejam Cerrado, Florestas Semidecíduas, Floresta de Araucária bem como os Campos Sulinos, os valores das DMC-P foram variados. As amostras não variaram significativamente (ANOVA F 0,05; 5,45 = 1,4898; p > 0,025).
Das 62 amostras analisadas, 61,3% apresentaram valores para a atividade proteolítica entre 40 e 60 U/mg (Tab. I e Figs 2 e 4B), sendo que a análise dos venenos com relação à área geográfica de origem mostrou que nas regiões de Cerrado à oeste da distribuição (amostras 2 a 7) e sul de Minas Gerais e norte de São Paulo (Florestas semidecíduas amostras 13 a 18) apresentaram valores acima de 50 U/ml, não sendo estas variações de valores significativos (ANOVA F 0,05; 5,54 = 0,389; p > 0,05).
A cinética da ação miotóxica induzida por 50 µg do veneno referência injetado i.m. em camundongos mostrou atividade máxima desta ação por volta das seis horas após sua inoculação. Do total de 54 amostras analisadas, 74,1% apresentaram valores da liberação de Creatino Kinase de até 60 U/ml (Tab. I, Figs 2 e 4C). Observando-se os valores obtidos para as amostras e suas respectivas áreas de origem geográfica nota-se que na área central da distribuição (amostras 22 a 29), do sul de São Paulo ao norte do Rio Grande do Sul obteve-se a maioria dos valores acima de 60 U/ml. Todas as áreas das extremidades da distribuição amostral apresentaram pouca variação na atividade miotóxica, com a maioria das amostras apresentando valores que não ultrapassaram 60 U/ml. Nas demais amostras, os valores apresentam ampla variação no que se refere a ação miotóxica, não sendo significativamente diferentes (ANOVA F 0,05; 6,46 = 2,07; p > 0.025).
Os valores obtidos para as doses letais 50% das amostras Sidrolândia A (MS), Jataí (GO), Itapecerica (SP), Buri (SP), Promissão (SP), Palmeira A (PR), Bagé C (RS) e Charqueadas (RS) estão compreendidos no intervalo de confiança da amostra referência (2,5 - 4,7 mg/Kg) (Tab. II).
As amostras Palmeira A e Bagé C apresentaram valores próximos entre si: 2,3 mg/Kg (Intervalo de Confiança = 1,4 - 3,1) e 2,2 mg/Kg (Intervalo de Confiança = 1,4 - 2,9), sendo significantemente mais tóxicas, enquanto que a amostra de Jataí foi a menos tóxica, com uma DL50% igual a 4,1 mg/Kg (Intervalo de Confiança = 3,1 - 5,4) quando comparadas com a amostra referência (limite de confiança de 95% e p < 0.05).
DISCUSSÃO E CONCLUSÕES
Entre as espécies de Bothrops de áreas abertas B. alternatus é bastante generalista, sendo uma espécie típica de interflúvio, ocupando áreas ripárias próximas a matas de galeria e áreas de campos mais secas, como campo limpo, campo sujo e campo úmido (BRAZIL 1911, AMARAL 1978, CAMPBELL & LAMAR 1989, NOGUEIRA 2001).
Os venenos de serpentes apresentam várias funções, tais como: imobilização, morte e digestão da presa, além de poder ser utilizado contra predadores (MEBS 1999). Ao contrário da maioria das espécies do gênero (generalistas e com variação ontogenética na dieta), B. alternatus é uma espécie especialista em mamíferos em todas as fases da vida (MARTINS et al. 2002).
O veneno de B. alternatus foi analisado quanto a variações das atividades letal, coagulante, proteolítica e miotóxica, bem como os padrões eletroforéticos em SDS-PAGE de 61 amostras individuais, buscando cobrir a ampla distribuição geográfica da espécie, e um "pool" de vários exemplares, representando, teoricamente, o veneno da espécie e denominado veneno referência.
A técnica de eletroforese, que permite uma grande resolução dos padrões de proteínas dos venenos, onde seus componentes podem ser separados e identificados comparativamente (JIMENEZ-PORRAS 1964a, JONES 1976, RAEL et al. 1984, AIRD & KAISER 1985, MOURA-DA-SILVA 1990b, MOURA-DA-SILVA et al. 1991, MENDONZA et al. 1992, TAN & PONNUDURAI 1992, ASSAKURA et al. 1992) possibilitou observar uma similaridade nos perfís eletroforéticos das diversas amostras com pequena variação no número, disposição e intensidade das bandas.
TAN & PONNUDURAI (1992) estudaram os padrões eletroforéticos de B. alternatus, dentre outras espécies, sobre PAGE e SDS-PAGE, sem que as variações tanto no número quanto na disposição das bandas, fossem consideradas como atributos de importância diferencial. Contudo, as variações nas disposições das bandas protéicas têm sido consideradas relevantes na separação de espécies, subespécies e populações dentro de uma mesma espécie (JIMÉNEZ-PORRAS 1964a, b, AIRD & KAISER 1985, JAYANTHI & VEERABASAPPA-GOWDA 1988). Neste trabalho optou-se por considerar as variação menos evidentes pois poderão contribuir para futuros estudos das relações genéticas deste grupo (WILLIAMS et al. 1988). Além disso, pode-se estimar as atividades biológicas e enzimáticas das toxinas em cada uma das "zonas", por meio da inferência dos pesos moleculares das proteínas ativadoras das ações em diferentes espécies do gênero Bothrops (THEAKSTON & KAMIGUTI 2002).
Na zona I (entre os pesos 67 e 40 kDa) os venenos botrópicos apresentam toxinas que são metaloproteinases e/ou proteases, assim como a Bothropasin, do veneno de B. jararaca (MANDELBAUM et al. 1982, MANDELBAUM & ASSAKURA 1988). Além disso, são citadas dentro desta faixa de peso molecular proteínas hemorrágicas como as HF1 e HF2, localizadas entre os pesos de 46 e 62 kDa do veneno de B. asper (GUTIÉRREZ & LOMONTE 1989) e as NHFa (46kDa) e NHFb (58kDa), de ação hemorrágica e proteolítica do veneno de B. neuwiedi (MANDELBAUM et al. 1982). Assim, pode-se aferir que a banda majoritária ocorrente em todas as amostras, com peso molecular de aproximadamente 55kDa, trata-se possivelmente da Alternagin, uma zinco-metaloproteinase isolada do veneno de B. alternatus (SOUZA et al. 2000).
A ação proteolítica apresentou-se como a mais homogênea das atividades testadas, porém com as amostras mais ativas (valores > 60 U/mg) provenientes das extremidades da distribuição. Os resultados da atividade caseinolítica foram semelhantes ao valores padronizados: 48,8 (SD ± 3,0) e 47,3(SD ± 3,6) para os venenos secos a vácuo e liofilizado respectivamente (FURTADO et al. 1991b). Em média, obtivemos o valor de 48,9 U/mg, sendo que para os venenos de B. atrox, B. jararaca, B. jararacussu e B. moojeni os valores da atividade caseinolítica variaram entre 95,8 a 203,0 U/mg (FURTADO et al. 1991b).
Os componentes da zona II (entre 40 e 20 kDa) estão relacionados com a atividade proteolítica e ação sobre os componentes da cascata de coagulação, ativando ou inibindo, sendo chamadas de serinoproteases segundo SERRANO et al. (1993), que identificaram a MSP (38 kDa) do veneno de B. moojeni e também outras toxinas com ações enzimáticas como a Botrocetin (ANDREWS & BERNDT 2000), Bothrojaracin (MONTEIRO et al. 1997), Bothrombin (SMOLKA et al. 1998, NISHIDA et al. 1994), todas isoladas do veneno de B. jararaca e com ações sobre o sistema de coagulação sangüínea.
A presença de uma proteína de peso molecular de 27 kDa constantes em todas as amostras analisadas, possivelmente é a Bothroalternin, uma lectina tipo C que atua como inibidor da trombina, isolada do veneno de B. alternatus (CASTRO et al. 1998).
A coagulação sangüínea nos acidentes botrópicos é um dos efeitos mais importantes, pois esta ação pode desencadear uma coagulação vascular maciça ou ainda, tornar o sangue incoagulável devido ao consumo do fibrinogênio. NAHAS et al. (1979) testaram os venenos de vinte e seis espécies de serpentes, determinando para o veneno de B. alternatus três ações específicas: tipo-trombina, protrombina e ativador do Fator X.
A atividade coagulante foi variável nas amostras testadas, não apresentando um padrão geográfico definido, porém as amostras menos ativas se destacaram ao nordeste da distribuição amostral. A maioria das amostras apresentou valores para a DMC-P entre 200 e 400 mg/litro considerados baixos quando comparados com os valores para B. jararaca e B. moojeni, que são 90,6 e 19,3 mg/litro, respectivamente (FURTADO et al. 1991b).
As frações de atividade miotóxica, geralmente fosfolipases, localizam-se aproximadamente entre 13 e 16 kDa nos venenos de serpentes do gênero Bothrops (GITIÉRREZ et al. 1986, NISENBOM et al. 1986, HOMSI-BRANDEBURGO et al. 1988, GUTIÉRREZ & LOMONTE 1989, LOMONTE et al. 1990, MOURA-DA-SILVA et al. 1990a, SERRANO et al. 1993).
A zona III dos perfis eletroforéticos (Fig. 3), referente ao peso molecular de 14,4 kDa é uma fosfolipase A2 isolada por NISENBOM et al. (1986) responsável pela ação miotóxica no veneno de B. alternatus.
Na cinética, a atividade máxima do veneno referência de B. alternatus foi observada seis horas após a inoculação do veneno (dados não apresentados), ao contrário de outras espécies onde a ação máxima ocorre na terceira hora (GUTIÉRREZ et al. 1980, GUTIÉRREZ & LOMONTE 1989).
De modo geral, os venenos também foram pouco ativos quanto à ação miotóxica quando comparados com os venenos das espécies B. atrox, B. erytromelas Amaral 1923, B. jararaca, B. jararacussu Lacerda 1884, B. moojeni, B. neuwiedi e B. pradoi (Hoge 1948) (MOURA-DA-SILVA et al. 1991)
Assim como nas outras atividades, a atividade miotóxica nos venenos estudados não apresentou um padrão de distribuição, contudo observou-se que as amostras da região central da distribuição (sul de São Paulo, Paraná, Santa Catarina e norte do Rio Grande do Sul) foram mais ativas.
A atividade tóxica letal, na maioria das amostras de veneno analisadas, apresentaram os mesmos valores encontrado para a espécie em FURTADO et al. (1991a), variando de 1,4 a 5,4 mg/Kg. Estes dados reforçam a relativa baixa atividade letal do veneno de B. alternatus, quando comparado com o veneno de B. jararaca que é de 1,2 a 1,4 mg/Kg (FURTADO et al. 1991a).
Os resultados obtidos demonstram que não há correlação entre as atividades biológicas e enzimáticas do veneno de espécie B. alternatus com a distribuição biogeográfica, uma vez que a variação individual prevaleceu, pois as análises estatísticas não mostraram valores significativamente diferentes em todas as ações aferidas.
Assim, na composição do pool de veneno representativo da espécie B. alternatus para constituir o antígeno botrópico a ser utilizado na imunização de cavalos para a produção do antiveneno botrópico, usado na terapêutica do tratamento dos acidentes ofídicos em humanos, pode-se utilizar espécimes de procedências geográficas diferentes, independentemente.
Além disso, os resultados das análises das várias atividades aqui apresentadas, demonstram que este veneno é pouco ativo, confirmando as informações da literatura, e, contrariando relatos descrevendo a gravidade dos acidentes causados por "urutu" (BRAZIL 1901, 1911, PEREIRA 1939/40, QUEIROZ & PETTA 1984), onde estão envolvidos outros fatores como: o tamanho do animal, comportamento defensivo da espécie, quantidade de veneno disponível e quantidade de veneno injetada no local da picada (RIBEIRO & JORGE 1990).
AGRADECIMENTOS
Aos pesquisadores Giuseppe Puorto, Wilson Fernandes e ao técnico Valdir Germano do Instituto Butantan; ao Coordenador do Lab. de Herpetologia do Museu de Ciências e Tecnologia da PUCRS, Marcos Di Bernardo; à Moema Leitão de Araújo (NOPA RS); à pesquisadora Rosana Zumach Guimarães, da Secretaria de Estado de Saúde do Paraná e ao biólogo Sérgio Morato; ao Dr. Nelson Jorge da Silva, Núcleo de Ofiologia de Goiânia; à Dra. Maria Lúcia, da UNIFENAS; ao Dr. Ulisses Simon, do Departamento de Toxicologia e Farmacologia de Secretaria de Saúde do MS, por terem realizado as extrações e pela doação das amostras de veneno. À Silvia Regina Travaglia Cardoso e Marcelo Larami Santoro, pesquisadores do Instituto Butantan, pela colaboração nas análises estatísticas.
Recebido em 05.VIII.2004; aceito em 17.V.2005.
- ACOSTA DE PÉREZ, O.; P. KOSCINCZUK; P. TEIBLER; M. SÁNCHEZ NEGRETTE; R. RUIZ, S. MARUÑAK & G. BOGARRÍN. 1998. Actividades hemorrágica y edematizante y alteraciones histológicas en almohadilla plantar del ratón inducidas por venenos de serpientes de los géneros Bothrops y Crotalus de Argentina. Toxicon, London, 36 (8): 1165-1172.
- AB'SABER, A.W. 1977. Os Domínios Morfoclimáticos na América do Sul. Geomorfologia. São Paulo, Universidade de São Paulo, Instituto de Geografia, 21p.
- AIRD, S.D. & I. KAISER. 1985. Comparative studies on three rattlesnake toxins. Toxicon, London, 23 (3): 361-374.
- AMARAL, A. 1978. Serpentes do Brasil. Iconografia colorida. São Paulo, Ed. Melhoramentos, Edusp, 2ª ed., 246p.
- ANDREWS, R. & M.C. BERNDT. 2000. Snake venom modulatorsn of platelet adhesion receptors and their ligants. Toxicon, London, 38 (5): 775-791.
- ARAGÓN, F. & F. GUBENSEK. 1981. Bothrops asper venom from the Atlantic and Pacific zones of Costa Rica. Toxicon, London, 19 (6): 797-805.
- ASSAKURA, M.T.; M.F. FURTADO & F.R. MANDELBAUM. 1992. Biochemical and biological differentiation of the venoms of the Lancehead Vipers (Bothrops atrox, Bothrops asper, Bothrops marajoensis and Bothrops moojeni). Comparative Biochemistry and Phisiology, Oxford, 102B (4): 727-732.
- BJARNASON, J. & J.W. Fox. 1988/89. Hemorrhagic toxins snake venoms. Journal Toxicology-Toxin Reviews, New York, 7: 121-209.
- BRAZIL, V. 1901. Contribuição ao estudo do veneno ophidico. I. O veneno de algumas espécies brazileiras. Revista Medica de São Paulo, São Paulo, 4: 296-375.
- BRAZIL, V. 1911. A defesa contra o ophidismo. São Paulo, Pocai & Weiss, 152p.
- CAMPBELL, J.A. & LAMAR, W.W. 1989. The Venomous Reptiles of Latin América. London, Comstok, 6th ed., 425p.
- CASTRO, H.C.; D.L.S. DUTRA; A.L. OLIVEIRA-CARVALHO & R.B. ZINGALI. 1998. Bothroalternin, a thrombin inhibitor from the venom of Bothrops alternatus Toxicon, London, 36(12): 1903-1912.
- CHIPPAUX, J.P.; V. WILLIAMS & J. WHITE. 1991. Review article: snake venom variability: methods of study, results and interpretation. Toxicon, London, 29 (11): 1279-1303.
- FINNEY, D.J. 1971. Probit analysis. Cambridge University Press, 3rd ed., 333p.
- FURTADO, M.F.D.; G.M.D.D. COLLETO & W. DIAS DA SILVA. 1991a. Controle de qualidade dos venenos animais e dos correspondentes antivenenos. I. Padronização dos métodos de ensaio das atividades bioquímicas e farmacológicas dos venenos de algumas espécies do gênero Bothrops e Crotalus usando amostras secas à temperatura ambiente ou liofilizadas. Memórias do Instituto Butantan, São Paulo, 53 (2): 149-159.
- FURTADO, M.F.D.; M. MARUYAMA; A.S. KAMIGUTI & L.C. ANTONIO. 1991b. Comparative study of nine Bothrops snake venoms from adult female snakes and their ofspring. Toxicon, London, 29 (2): 219-226.
- GUTIÉRREZ, J.M. & B. LOMONTE. 1989. Local tissue damage induced by Bothrops snake venoms, a review. Memórias do Instituto Butantan, São Paulo, 51 (14): 211-233.
-
18GUTIÉRREZ, J.M.; O. ARROYO & R. BOLAÑOS. 1980. Mionecrosis, hemorragia y edema inducidos por el veneno de Bothrops asper en ratón blanco. Toxicon, London, 18: 603-610.
- GUTIÉRREZ, J.M.; B. LOMONTE & L. CERDAS. 1986. Isolation and partial characterization of a myotoxin from the venom of the snake Bothrops nummifer Toxicon, London, 24 (9): 885-894.
- HOMSI-BRANDEBURGO, M.I.; L.S. QUEIROZ; H. SANTO-NETO; L. RODRIGUES-SIMIONI & J.R. GIGLIO. 1988. Fractionation of Bothrops jararacussu snake venom: Partial chemical characterization and biological activity of bothropstoxin. Toxicon, London, 26 (2): 615-627.
- IBGE. 1993. Mapa de vegetação do Brasil. Rio de Janeiro, Fundação Instituto Brasileiro de Geografia e Estatística, 2ª edição.
- IWANAGA, S. & T. SUZUKI. 1979. Enzimes in snake venom, p. 684-750. In: C.Y. LEE (Ed.). Snake Venoms. Berlin, Springer-Verlag, 1129p.
- JAYANTHI, G.P. & T. VEERABASAPPA-GOWDA. 1988. Geographical variation in India in the composition and lethal pontency of Russell's Viper (Vipera russelli) venom. Toxicon, London, 26 (3): 257-264.
- JIMÉNEZ-PORRAS, J.M. 1964a. Venom proteins of the fer-de-lance, Bothrops atrox, from Costa Rica. Toxicon, London, 2: 155-166.
- JIMÉNEZ-PORRAS, J.M. 1964b. Intraspecific variations in composition of venom of the jumping viper, Bothrops nummifera Toxicon, London, 2: 187-195.
- JONES, J.M. 1976. Variations of venom proteins in Agkistrodon snakes from North America. Copeia, Philadelfia, 3: 558-562.
- LAEMMLI, U.K. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, London, 227: 680-685.
- LEITE, L.C.C.; M.F.D. FURTADO; T.C. CORREA & I. RAW. 1992. Characterization of the snake venoms from seven brazilian species of Bothrops by FPLC anion-exchange chromatography. Comparative Biochemistry and Physiology, Oxford, 102B (3): 515-520.
- LITCHFIELD, J.T. & F. WILCOXON. 1949. A simplified method of evaluating dose-effect experiments. Journal of Pharmacology and Experimental Therapeutics, Bethesda, 96: 99-113.
- LOMONTE, B. 1994. Tissue damage and inflammation induced by snake venoms. Sweden, University of Göteborg, 87p.
-
31LOMONTE, B. J.M. GUTIÉRREZ. 1983. La actividad proteolítica de los venenos de serpientes de Costa Rica sobre la caseína. Revista de Biologia Tropical, San Jose, 31 (1): 37-40.
- LOMONTE, B.; J.M. GITIÉRREZ; M.F.D. FURTADO; R. OTERO; J.P. ROSSO; O. VARGAS; E. CARMONA & M.E. ROVIRA. 1990. Isolation of basic myotoxins from Bothrops moojeni and Bothrops atrox snake venoms. Toxicon, London, 28 (10): 1137-1146.
- MANDELBAUM, F.R. & M.T. ASSAKURA. 1988. Antigenic relationships of hemorrhagic factors and proteinases isolated from the venom of three species Bothrops snakes. Toxicon, London, 26 (4): 379-385.
- MANDELBAUM, F.R.; A.P. REICHEL & M.T. ASSAKURA. 1982. Isolation and characterization of a proteolytic enzime from the venom of the snake Bothrops jararaca(Jararaca). Toxicon, London, 20 (6): 955-972.
- MARTINS, M.; O.A.V. MARQUES & I. SAZIMA. 2002. Ecological and phylogenetic correlates of feeding habitats in Neotropical pitvipers of the genus Bothrops, p. 307-328. In: G. SCHUETT; M. HÖGGREN; H.W. GREENE (Eds). Biology of the Vipers. Carmel, Biological Sciences Press, 580p.
- MEBS, D. 1999. Snake venom composition and evolution of viperidae. Kaupia, Darmstadt, 8: 145-148.
- MENDONZA, C.E.C.; T. BHATTI & A.R. BHATTI. 1992. Eletrophoretic analysis of snake venoms. Journal of Chromatography, Amsterdan, 580: 355-363.
- MINISTÉRIO DA SAÚDE. 1998. Manual de diagnóstico e tratamento de acidentes por animais peçonhentos Brasília, Fundação Nacional de Saúde, 131p.
- MONTEIRO, R.Q.; C.R. CARLINI; J.A. GUIMARÃES; C. BON & R.B. ZINGALI. 1997. Distinct Bothrojaracin isoforms produced by individual jararaca (Bothrops jararaca) snakes. Toxicon, London, 35 (5): 649-657.
- MOURA-DA-SILVA, A.M.; D.F. CARDOSO & M.M. TANIZAKI. 1990a. Differences in distribution on myotoxic proteins in venoms from different Bothrops species. Toxicon, London, 28 (11): 1293-1301.
- MOURA-DA-SILVA, A.M.; M.R. D'IMPÈRIO LIMA; A.K. NISHIKAWA; C.I. BRODSKYN; M.C. DOS SANTOS; M.F.D. FURTADO; W. DIAS DA SILVA & I. MOTA. 1990b. Antigenic cross-reativity of venoms obtained from snakes of genus Bothrops Toxicon, London, 28 (1): 181-188.
- MOURA-DA-SILVA, A.M.; H. DESMOND; G. LAING & R.D.G. THEAKSTON. 1991. Isolation and comparison of myotoxins isolated from venoms of different species of Bothrops snakes. Toxicon, London, 29 (6): 713-723.
- NAHAS, L.; A.S. KAMIGUTI & A.R. BARROS. 1979. Trombin-like and Factor X-activator components of Bothrops snake venoms. Trombosis Haemostasis, Stuttgard, 41: 314-328.
- NISENBOM, H.E.; J.C. PERAZZO; A.J. MONSERRAT & J.C. VIDAL. 1986. Contribution of Phospholipase A2 to the lethal potency of Bothrops alternatus (víbora de la cruz) venom. Toxicon, London, 24(8): 807-817.
- NISHIDA, S.; Y. FUJIMURA; S. MIURA; Y. OZAKI; Y. USAMI; M. SUZUKI; K. TITANI; E. YOSHIDA; M. SUGIMOTO; A. YOSHIDA & H. FUKUI. 1994. Purification and characterization of Bothrombin, a fibrinogen-clotting serine protease from the venom of Bothrops jararaca Biochemistry, New York, 33: 1843-1849.
- NOGUEIRA, C.C. 2001. New records of squamate reptiles in Central Brazilian Cerrado II: Brasilia region. Herpetological Review, Kansas, 32(4): 285-287.
- OHSAKA, A. 1979. Hemorrhagic, necrotizing and edema-forming effects of snakes venoms, p. 481-546. In: C.Y. LEE (Ed.). Snake venoms, handbook of experimental pharmacology. Berlin, Springer, 1129p.
- PEREIRA, N.B. 1939/40. Lesões necróticas determinadas pela Urutu. Revista de Cirurgia de São Paulo, São Paulo, 5 (1939-40): 477-490.
- QUEIROZ, L.S. & C.A. PETTA. 1984. Histopatological changes caused by venom of Urutu snake (Bothrops alternatus) in mouse skeletal muscle. Revista do Instituto de Medicina Tropical de São Paulo, São Paulo, 26 (5): 247-253.
- RAEL, E.D.; R.A. KNIGHT & H. ZEPEDA. 1984. Eletrophoretic variations of Mojave rattlesnake (Crotalus scutulatus scutulatus) venoms and migration diferences of Mojave toxin. Toxicon, São Paulo, 22 (6): 980-985.
- RAW, I.; R. GUIDOLIN; H.G. HIGASHI; E.M.A. KELEN. 1991. Antivenins in Brazil: preparation, p. 557-581. In: A.T. TU. Handbook of natural toxins. New York, Marcel Dekker, vol. 15, 832p.
- RIBEIRO, L.A. & M.T. JORGE. 1990. Epidemiologia e quadro clínico dos acidentes por serpentes Bothrops jararaca adultas e filhotes. Revista do Instituto de Medicina Tropical de São Paulo, São Paulo, 32: 436-442.
- RODRIGUES, V.M.; A.M. SOARES; A.C. MANCIN; M.R.M. FONTES; M.I. HOMSI-BRANDEBURGO; J.R. GIGLIO. 1998. Geographic variations in teh composition of myotoxins from Bothrops neuwiedi snake venoms: biochemical characterization and biological activity. Comparative Biochemistry and Physiology, Oxford, A 121 (1998): 215-222.
- SANCHEZ, E.F.; T.V. FREITAS; D.L. FERREIRA-ALVES; D.T. VELARDE; M.R. DINIZ; M.N. CORDEIRO; G. AGOSTINI-COTTA & C.R. DINIZ. 1992. Biological activities of venoms from south american snakes. Toxicon, London, 30 (1): 95-103.
- SANTOS-COSTA, M.C.; A.B. OUTERAL; F.M. D'AGOSTINI & L.H. CAPPELLARI. 2001. Freqüência de acidentes ofídicos na região da grande Porto Alegre e cidades próximas, Rio Grande do Sul, Brasil. Comunicações do Museu de Ciências e Tecnologia da PUCRS, Série Zoologica, Porto Alegre, 14 (1): 89-93.
- SCHENBERG, S. 1961. Análise imunológica (micro-difusão em gel) de venenos individuais de Bothrops jararaca Ciência e Cultura, São Paulo, 13: 225-230.
- SCHENBERG, S. 1963. Immunological (ouchterlony method). Identification of intrasubspecies qualitative differences in snake venom composition. Toxicon, London, 1: 67-75.
- SERRANO, S.M.T.; C.A.M. SAMPAIO & F.R. MANDELBAUM. 1993. Basic proteinases from Botrhops moojeni (caissaca) venom – II. Isolation of the metaloproteinases MPB. Comparison of the proteolytic activity on natural substrates by MPB, MSP1 and MSP2. Toxicon, London, 31 (4): 483-492.
- SMOLKA, M.B.; S. MARANGONI; B. OLIVEIRA & J.C. NOVELLO. 1998. Purification and partial characterization of a thrombin-like enzime, Balterobin, from the venom of Bothrops alternatus Toxicon, London, 36 (7): 1059-1063.
- SOUZA, D.H.F.; M.R.C. IEMMA; L.L. FERREIRA; J.P. FARIA; M.L.V. OLIVA; R.B. ZINGALI; S. NIEWIAROWSKI; H.S. SELISTRE-DE-ARAUJO. 2000. The disintegrin-like domain of the snake venom metalloprotease Alternagin inhibits a2b1 integrin mediated cell adhesion. Archives of Biochemistry and Biophysics, London, 384 (2): 341-350.
- TAN, N.H. & G. PONNUDURAI. 1992. A comparative study on the eletrophoretic patterns of snake venoms. Comparative Biochemistry Physiology, Oxford, 102B (1): 103-109.
- THEAKSTON, R.D.G. & A.S. KAMIGUTI. 2002. A list animal toxins and some other natural products with biological activity. Toxicon, London, 40 (2002): 579-651.
- THEAKSTON, R.D.G. & H.A. REID. 1983. Development of simple standard assay procedures for the characterization of snake venoms. Bulletin of the World Health Organization, Genebra, 61 (6): 949-956.
- VANZOLINI, P.E. 1993. Métodos Estatísticos Elementares em Sistemática Zoológica. São Paulo, Editora Hucitec, 130p.
- VILLARROEL, M.S.; F. ZELANTE; R. ROLIM ROSA; R.S. FURLANETTO. 1978/79. Padronização da titulação da atividade tóxica de venenos botrópicos, em camundongos. Memórias do Instituto Butantan, São Paulo, 42/43: 311-323.
- WILLIAMS, V.; J. WHITE; T.D. SCHWANER & A. SPARROW. 1988. Variation in venom proteins from isolated population of Tiger snakes (Notechis ater niger, N. scutatus) in south Australia. Toxicon, London, 26 (11): 1067-1075.
- ZAR, J.H. 1999. Biostatistical Analysis. New Jersey, Prentice-Hall Inc., 4th ed., 662p.
Datas de Publicação
-
Publicação nesta coleção
15 Ago 2005 -
Data do Fascículo
Jun 2005
Histórico
-
Recebido
05 Ago 2004 -
Aceito
17 Maio 2005