Resumos
OBJETIVO: Avaliar os efeitos do uso de cloreto de gadolínio como pré-tratamento e tratamento em um modelo experimental de pancreatite em ratos induzida por tauracolato de sódio a 3%. MÉTODOS: Ratos Wistar foram divididos em cinco grupos: grupo SF - controle com solução fisiológica intra-ductal e IV; grupo TS - controle com PA induzida por tauracolato de sódio a 3% e solução fisiológica a 0,9% IV; grupo GD - controle com SF intra-ductal e cloreto de gadolínio IV; grupo GDTS - pré-tratamento com GD (24h antes da indução da PA) e grupo TSGD - tratamento com GD (1h após a indução da PA). Foi realizado dosagem sérica de amilase, transaminases e TNF-á; determinação da atividade da MPO no tecido pulmonar; histologia pancreática e pulmonar. RESULTADOS: O número de animais mortos antes do término previsto do experimento foi significativamente maior no grupo TSGD (p=0,046). Os escores de pancreatite e de dano pulmonar foram mais elevados nos grupos que utilizaram tauracolato em comparação aos grupos com infusão intra-ductal de solução salina. Não houve diferenças nas demais variáveis estudadas na comparação entre os grupos TS; GDTS e TSGD. CONCLUSÃO: Não foram demonstrados benefícios com o uso de cloreto de gadolínio de forma profilática e terapêutica.
Tauracolato de sódio; Cloreto de gadolínio; Pancreatite aguda; Dano pulmonar
OBJECTIVE: To evaluate the effects of the use of gadolinium chloride before and after induction of acute pancreatitis with sodium taurocholate 3% in rats. METHODS: Wistar rats were divided into five groups: SF - control with saline intra-ductal and IV; GD control with saline intra-ductal and gadolinium chloride IV; TS - with AP control induced by sodium taurocholate 3% and saline IV; GDTS - pre-treatment with GD (24 hours before the induction of AP) and TSGD - treatment with GD (1 hour after the induction of AP). Analysis was made in serum amylase, transaminases and TNF-á; determination of the MPO activity in lung tissue, lung and pancreatic histology. RESULTS: The number of dead animals before the end of the experiment was significantly higher in TSGD (P = 0.046). The scores of pancreatitis and lung damage were higher in the groups that used sodium taurocholate compared to groups with intra-ductal infusion of saline solution. There were no differences in other variables studied when comparing TS, GDTS and TSGD groups. CONCLUSION: The benefits with the use of gadolinium chloride as a prophylactic and therapeutic drug were not demonstrated.
Sodium taurocholate; Gadolinium chloride; Acute pancreatitis; Lung injury
ARTIGOS ORIGINAIS
Efeitos do cloreto de gadolínio na pancreatite induzida por tauracolato de sódio em ratos
Effects of gadolinium chloride on sodium taurocholate-induced pancreatitis in rats
Diego da Fonseca MossmannI; Maria Isabel Albano EdelweissII; Jane Maria KulczynskiIII; Norma Anair Possa MarroniIV; Nélson Alexandre KretzmannV; Catiele AntunesVI; Oscar Augusto BirkhanVI; Alessandro Bersch Osvaldt, TCBC-RSVII
IMestre em Ciências Cirúrgicas pela Universidade Federal do Rio Grande do Sul - UFRGS - Porto Alegre - BR
IIDoutora em Patologia pela Universidade de São Paulo - USP, São Paulo - BR
IIIDoutora em Tisiologia e Pneumologia pela Universidade Federal do Rio Grande do Sul - UFRGS, Porto Alegre - BR
IVDoutora em Fisiologia do Laboratório de Hepatologia Experimental-Fisiologia do Hospital de Clínicas de Porto Alegre - RS-BR
VDoutor em Hepatologia pelo Programa de Pós-Graduação em Medicina: Hepatologia da Universidade Federal de Ciências da Saúde de Porto Alegre - UFCSPA - RS-BR
VIEstudante de graduação, Faculdade de Medicina da Universidade Federal do Rio Grande do Sul - UFRGS - RS-BR
VIIProfessor do Programa de Pós-Graduação em Ciências Cirúrgicas da UFRGS - Porto Alegre - BR
Endereço para correspondência Endereço para correspondência: Diego da Fonseca Mossmann E-mail: dmossmann@gmail.com
RESUMO
OBJETIVO: Avaliar os efeitos do uso de cloreto de gadolínio como pré-tratamento e tratamento em um modelo experimental de pancreatite em ratos induzida por tauracolato de sódio a 3%.
MÉTODOS: Ratos Wistar foram divididos em cinco grupos: grupo SF - controle com solução fisiológica intra-ductal e IV; grupo TS - controle com PA induzida por tauracolato de sódio a 3% e solução fisiológica a 0,9% IV; grupo GD - controle com SF intra-ductal e cloreto de gadolínio IV; grupo GDTS - pré-tratamento com GD (24h antes da indução da PA) e grupo TSGD - tratamento com GD (1h após a indução da PA). Foi realizado dosagem sérica de amilase, transaminases e TNF-á; determinação da atividade da MPO no tecido pulmonar; histologia pancreática e pulmonar.
RESULTADOS: O número de animais mortos antes do término previsto do experimento foi significativamente maior no grupo TSGD (p=0,046). Os escores de pancreatite e de dano pulmonar foram mais elevados nos grupos que utilizaram tauracolato em comparação aos grupos com infusão intra-ductal de solução salina. Não houve diferenças nas demais variáveis estudadas na comparação entre os grupos TS; GDTS e TSGD.
CONCLUSÃO: Não foram demonstrados benefícios com o uso de cloreto de gadolínio de forma profilática e terapêutica.
Descritores: Tauracolato de sódio. Cloreto de gadolínio. Pancreatite aguda. Dano pulmonar.
ABSTRACT
OBJECTIVE: To evaluate the effects of the use of gadolinium chloride before and after induction of acute pancreatitis with sodium taurocholate 3% in rats.
METHODS: Wistar rats were divided into five groups: SF - control with saline intra-ductal and IV; GD control with saline intra-ductal and gadolinium chloride IV; TS - with AP control induced by sodium taurocholate 3% and saline IV; GDTS - pre-treatment with GD (24 hours before the induction of AP) and TSGD - treatment with GD (1 hour after the induction of AP). Analysis was made in serum amylase, transaminases and TNF-á; determination of the MPO activity in lung tissue, lung and pancreatic histology.
RESULTS: The number of dead animals before the end of the experiment was significantly higher in TSGD (P = 0.046). The scores of pancreatitis and lung damage were higher in the groups that used sodium taurocholate compared to groups with intra-ductal infusion of saline solution. There were no differences in other variables studied when comparing TS, GDTS and TSGD groups.
CONCLUSION: The benefits with the use of gadolinium chloride as a prophylactic and therapeutic drug were not demonstrated.
Key words: Sodium taurocholate. Gadolinium chloride. Acute pancreatitis. Lung injury.
INTRODUÇÃO
A inflamação pancreática local leva à produção de citocinas que são responsáveis diretamente pela morbidade e mortalidade da pancreatite aguda1-7. Estudos experimentais mostraram o envolvimento do fígado, mais precisamente das células de Kupffer, no processo de amplificação da resposta inflamatória sistêmica através da ativação destas células pelas citocinas produzidas pelo pâncreas inflamado2, 4, 8-14.
O bloqueio destas células por cloreto de gadolínio, dado de forma profilática, mostrou-se promissor em alguns estudos experimentais em que foi observado diminuição de mortalidade e de dano pulmonar 2, 4,15. Por outro lado, os efeitos desta droga não estão totalmente esclarecidos, uma vez que ela têm sido utilizada apenas como pré-tratamento 2, 4, 8, 11, 13, 15-17.
Este estudo tem como objetivo avaliar os efeitos do uso de gadolínio antes e após a indução da pancreatite em ratos através do modelo experimental com infusão de tauracolato de sódio no ducto bílio-pancreático.
MÉTODOS
Foram utilizados para o estudo 65 ratos Wistar (Rattus norvergius albicuns), machos, adultos, com peso entre 233 g e 450 g. Foi realizada a reposição dos animais que não sobreviveram até a realização da eutanásia para manter a distribuição estabelecida, pelo cálculo amostral, de cinco animais nos grupos SF e GD, e nove animais nos demais grupos. A divisão dos grupos experimentais ocorreu conforme a tabela 1. O protocolo de pesquisa foi aprovado pelo Comitê de Ética em Pesquisa do Grupo de Pesquisa e Pós-Graduação do Hospital de Clínicas de Porto Alegre sob nº06-259. Todos os animais receberam cuidados de acordo com os critérios estabelecidos no Guide for Care and Use of Laboratory Animals.
Indução da pancreatite aguda
Conforme o protocolo utilizado, os animais, após jejum de 6 horas, foram anestesiados com cloridrato de ketamina (50 mg/kg), juntamente com cloridrato de xilazina (20 mg/kg) intraperitonial. O procedimento cirúrgico foi o seguinte: laparotomia mediana com comprimento aproximado de 2 cm seguida de exteriorização do duodeno com identificação do pâncreas e do ducto bílio-pancreático na face mesentérica da alça duodenal (Figura 1A). Após foi realizada uma duodenotomia puntiforme na borda antimesentérica no lado oposto à abertura do ducto. A canulação transpapilar do ducto bílio-pancreático foi realizada com cateter nº 24 G por aproximadamente 5 mm, evitando danificar o pâncreas (Figura 1B)18. Após foi realizado a oclusão temporária do ducto bílio-pancreático ao nível do hilo hepático com clampe vascular delicado que permaneceu até o término da infusão (Figura 1C). A indução da pancreatite foi realizada por infusão retrógrada de 0,5mL de taurocolato de sódio a 3% (Taurocholic acid sodium salt hydrate - synthesized from cholic acid) através de bomba de infusão numa velocidade de 0.1mL/min19.
Após a remoção do clampe, o cateter foi retirado, o orifício duodenal suturado com fio monofilamentar agulhado de polipropileno 7-0 e o abdômen fechado em plano único com fio monofilamentar de nylon 4-0.
Nos grupos SF e GD os procedimentos foram realizados de forma idêntica com exceção da injeção de tauracolato que foi substituído por solução salina. No grupo pré-tratamento (GDTS) foi realizado a infusão de cloreto de gadolínio a 4% (gadolinium (III) chloride anhydrous) na dose de 10mg/kg (aproximadamente 0.250 mL) pela veia jugular 24 horas antes da indução da pancreatite15. No grupo tratamento (TSGD), o cloreto de gadolínio foi infundido uma hora após a indução. O controle foi realizado com a infusão de solução salina.
A eutanásia ocorreu 24 horas após o início do experimento por exsanguinação. Foram anestesiados conforme previamente descrito. Após a cavidade torácica foi aberta por esternotomia mediana, coletado 3 a 4 mL de sangue por punção cardíaca e removidos os pulmões através de dissecção.
Em seguida, a cavidade abdominal foi aberta por extensão da incisão anterior e realizada a remoção do pâncreas.
Coleta e preparação de amostras
O sangue foi coletado através de punção cardíaca e acondicionado em tubos plásticos que foram centrifugados a 5000 rpm por 10 minutos sendo o soro separado e estocado a -80ºC. O pulmão direito foi coletado, para análise da atividade da mieloperoxidase (indicador indireto de infiltrado neutrofílico pulmonar), por meio de dissecção delicada seguida de lavagem do mesmo com solução salina com EDTA a 10%, acondicionamento em papel alumínio, congelação em nitrogênio líquido e, após, armazenado a -80ºC. Os tecidos pancreático e pulmonar (pulmão esquerdo) foram conservados em formalina tamponada a 10% por 24 horas.
Os animais foram excluídos do estudo pelos seguintes critérios: animais cujo pâncreas foi danificado durante a canulação do ducto bílio-pancreático ou quando houve perfuração do ducto durante este procedimento; óbitos antes do término previsto do experimento (24 horas); e amostras de sangue hemolisadas.
Análise histopatológica
Pâncreas
Após dissecção das peças, as mesmas foram processadas em blocos de parafina e realizados cortes de 0.5 micra sendo que cada lâmina foi composta por duas amostras coradas pela técnica de hematoxilina-eosina. As lâminas foram numeradas aleatoriamente de maneira a não permitir sua identificação e examinadas por patologista experiente em patologia experimental pancreática, utilizando uma adaptação da escala padronizada de Schmidt et al18. Foram pesquisados edema, necrose acinar, hemorragia no parênquima e no tecido gorduroso, necrose gordurosa e infiltrado leucocitário intralobular e perivascular, cuja graduação permitia a avaliação de um escore total de 28 pontos.
Pulmão
A análise microscópica do tecido pulmonar foi realizada de forma semelhante, sendo avaliados: edema intra-alveolar, hemorragia intra-alveolar e infiltrado neutrofílico. Os escores seguiram a seguinte graduação: 0-ausente; 1-leve; 2-moderado; 3-intenso; 4-muito intenso.
Critérios histopatológicos
Pâncreas
1) Edema: presença de líquido seroso ou alargamento dos espaços intercelulares, inter-acinares, interlobulares e interlobares;
2)HE 100X.
Neutrófilos
Necrose Acinar: considerada como alterações degenerativas citoplasmáticas com a presença de núcleos degenerados, ou em cariólise;
3)HE 200X;
Necrose gordurosa / esteato-necrose: necrose do tecido adiposo, de cor azulada, associada ou não à hemorragia no tecido peripancreático ou intrapancreático;
4) Hemorragia: presença de eritrócitos fora do leito vascular;
5)Infiltrado perivascular: presença de polimorfonucleares e mononucleares adjacentes a vasos sanguíneos ou em diapedese, permeando a parede vascular;
6) Infiltrado intralobular: presença de polimorfonucleares e mononucleares dentro do parênquima lobular.
Pulmão
HE 200X
1) Edema intra-alveolar: presença de líquido seroso dentro do alvéolo pulmonar;
2)HE 500X;
Hemorragia intra-alveolar: presença de eritrócitos dentro dos alvéolos;
3)HE 500X
Infiltrado neutrofílico pulmonar: presença de polimorfonucleares nos septos alveolares ou dentro dos alvéolos.
Análise bioquímica
Foram realizadas dosagens de amilase em duplicata utilizando teste enzimático colorimétrico (valores de referência baseados em ratos sem pancreatite: 530-810 U/L)20. As transaminases (AST e ALT) foram dosadas em duplicata utilizando teste UV. Valores de referência: AST (81±11.7 U/L); ALT (51±12.3 U/L). A atividade da enzima mieloperoxidase (MPO) foi utilizada como indicativo da atividade neutrofílica inflamatória no pulmão. As amostras de tecido pulmonar foram armazenadas em nitrogênio líquido. No dia do ensaio, para cada 50 mg de peso do tecido, foram adicionados 500 µL de tampão de homogeneização (brometo de hexadeciltrimetilamonia 50 mM e tampão fosfato de potássio 0.1 M). Os tecidos foram homogeneizados, submetidos ao ultra-som (40 Hz) por 15 segundos, congelados e descongelados por três vezes em nitrogênio líquido, e centrifugados a 3000 rpm por 30 min a 4ºC. Para a reação da cinética enzimática adicionou-se 140 µL de tampão fosfato de potássio (0.1 M), 10 µL de amostra, 10 µL de orto-dianisidina 2% e logo antes da leitura foi adicionado 12 µL de H2O2 20 mM. A cinética enzimática foi analisada em placa de 96 poços a 450 nm. Os resultados foram expressos em absorvância/min/mg de proteína.
As concentrações de TNF-αnas amostras de soro foram realizadas através do método de ELISA, segundo instruções do fabricante (Kit RAT TNF-alpha). O limite inferior de detecção do TNF-αpara este método foi de 10 pg/mL.
Análise estatistica
As variáveis qualitativas foram descritas através de freqüências absolutas e relativas percentuais, com comparação entre os grupos pelo teste de qui-quadrado. As variáveis quantitativas com distribuição simétrica foram descritas pela média e desvio padrão e as com distribuição assimétrica pela mediana, mínimo e máximo.
Para a comparação do nível sérico médio de amilase, AST, ALT, MPO e TNF-αnos diferentes grupos foram realizadas análises de variância (ANOVA) seguidas de teste post Hoc de Tukey para comparação múltipla. Para a comparação dos escores histológicos de pancreatite aguda e do dano pulmonar nos diferentes grupos foi utilizado o teste de Kruskal-Wallis e posteriormente foi feita a transformação por postos das variáveis com distribuição assimétrica, sendo estes postos comparados pelo teste post hoc de Tukey. Poder da amostra de 90% e nível de significância de 5%. Foi utilizado o programa SPSS (Statistical Package for the Social Sciences) versão 14.0 para análise estatística dos dados.
RESULTADOS
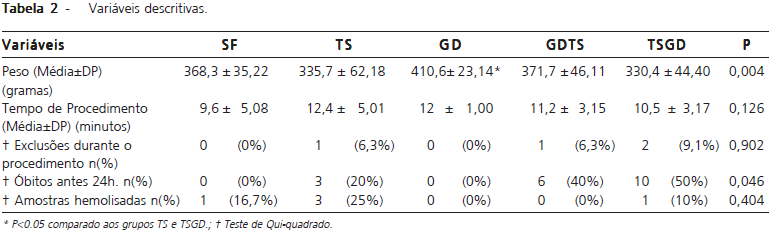
Dos 65 animais utilizados no estudo, quatro foram excluídos devido à perfuração do ducto bílio-pancreático durante a sua canulação (n=2 / grupos GDTS e TSGD) e óbito durante a anestesia (n=2 / grupos TS e TSGD) (Tabela 2). Considerando os 61 animais restantes, 19 (31.1%) morreram após a indução da pancreatite, no período anterior a realização da eutanásia, e, por isso, não foram utilizados na análise bioquímica e histológica. Estes estavam distribuídos da seguinte forma: 3/15 no grupo TS, 6/15 no grupo GDTS e 10/20 no grupo TSGD. A análise estatística evidenciou uma perda significativamente maior de animais no grupo TSGD (P=0.046). Não houve óbitos antes do tempo determinado para o término do experimento nos grupos controle SF e GD (Tabela 2).
Dos 42 animais (68.9%) que sobreviveram até o fim do experimento, cinco amostras sanguíneas estavam hemolisadas e foram excluídas (1/6 no grupo SF, 3/12 no grupo TS, e 1/10 no grupo TSGD) (Tabela 2).
O total de perdas foi 28/65 (43.07%) animais, 1/6 (16.66%) no grupo SF, 0/5 (0%) grupo GD, 7/16 (43.75%) grupo TS, 7/16 (43.75%) grupo GDTS e 13/22 (59.09%) grupo TSGD.
Análise bioquímica
Todos os animais tiveram confirmação laboratorial de pancreatite aguda através da dosagem de amilase, expressa em U/L, que foi, pelo menos, três vezes o limite superior do valor de referência (tabela 3). A tabela 3 também mostra os resultados da dosagem de TNF-αe da atividade da MPO.
Análise historológica
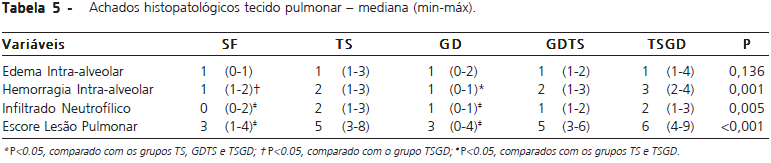
A necrose acinar foi significativamente mais intensa nos grupos que tiveram indução de pancreatite por tauracolato de sódio (TS, GDTS e TSGD) em comparação com o grupo SF. O escore total do dano pancreático foi significativamente maior nos grupos TS e GDTS em comparação com o grupo SF. O escore de lesão pulmonar foi mais elevado nos grupos com pancreatite induzida por tauracolato de sódio não havendo diferenças atribuídas ao uso de cloreto de gadolínio. Os demais índices histológicos de pancreatite e lesão pulmonar estão expostos nas tabelas 4 e 5 respectivamente.
DISCUSSÃO
O modelo experimental adotado foi baseado na técnica descrita por Aho et al. e escolhido por ser o que reproduz pancreatite semelhante à induzida por cálculos biliares em humanos, além de permitir o estudo da resposta inflamatória sistêmica19.
A concentração de tauracolato de sódio utilizada foi estabelecida de acordo com os estudos realizados por Aho et al. e Tonini et al. que demonstraram taxas de mortalidade variadas conforme a concentração utilizada19,21. Com concentração de 1% a mortalidade observada foi de 9% em 24 horas, sendo inferior à observada nos casos graves de pancreatite aguda em humanos21. O tauracolato de sódio a 4.5% e 5% produz taxas muito elevadas que variam de 71.4% em 72 horas e 100% em 31 horas, respectivamente, o que prejudica a avaliação de medidas terapêuticas19. Utilizando concentração a 3%, houve 23.5% de mortalidade em 72 horas nos ratos estudados por Aho et al 19.
Optamos por utilizar uma concentração intermediária de 3% que propicia taxa de mortalidade próxima à encontrada na pancreatite aguda grave em humanos e que permite o estudo da resposta inflamatória sistêmica após 24 horas da indução.
Quanto à perda de animais antes do período determinado para o término do experimento (24 horas), observamos 20% de óbitos no grupo TS representado por ratos com pancreatite, compatível com a encontrada no estudo de Aho et al. 19. Tendo em vista que os animais mortos eram verificados no dia seguinte à indução da pancreatite, não utilizamos estes ratos devido ao tempo impreciso do óbito o que não propiciou a coleta das amostras de forma adequada.
Os óbitos ocorreram apenas nos grupos com pancreatite induzida por tauracolato de sódio. Nos grupos GDTS e TSGD, nos quais, foi utilizado cloreto de gadolínio antes e após a indução da pancreatite, a taxa de mortalidade observada no período anterior à eutanásia foi de 40 e 50%, respectivamente, sendo significativamente maior no grupo TSGD. Gloor et al. demonstraram, em experimento que induzia pancreatite aguda em camundongos através de dieta deficiente em colina e suplementada com etionina, diminuição da mortalidade com o uso de cloreto de gadolínio em comparação com o grupo controle (52% vs 86% em 10 dias - P <0.001)4. Portanto, reservadas as diferenças metodológicas, houve um contraste acentuado entre as taxas de mortalidade comparadas a este estudo. Houve indução de pancreatite aguda em todos os grupos comprovada pelos achados histológicos, sendo mais intensa nos grupos que utilizaram tauracolato de sódio, estando de acordo com outros estudos realizados 19,22,23. A elevação dos escores nos grupos que utilizaram solução fisiológica pode ser explicada pela hipertensão ductal ocasionada durante a infusão. Esperávamos que houvesse aumento significativo dos escores avaliados nos grupos TS, GDTS e TSGD em comparação como os grupos SF e GD. No entanto não houve diferenças com o grupo controle - GD, o que pode sugerir efeito potencializador do cloreto de gadolínio no dano pancreático.
De acordo com outros estudos não houve influência do uso de cloreto de gadolíno nos níveis séricos de amilase 4, 8,15 e nos escores histológicos de pancreatite 2, 4, 11, 15, 16.
O TNF-α foi utilizado como marcador de inflamação sistêmica. Houve pequena expressão na dosagem de TNF-α, sugerindo resposta inflamatória sistêmica discreta. Por outro lado, houve tendência de maior produção de TNF nos grupos em que foi utilizado o tauracolato de sódio 3% (TS, GDTS e TSGD) quando comparados aos grupos controle (SF e GD). Todavia, esperávamos que houvesse diminuição nos níveis de TNF-αnos grupos que utilizaram tratamento com gadolínio (GDTS e TSGD). Ao contrário, houve aumento significativo no grupo que utilizou gadolínio uma hora após a indução da pancreatite (grupo TSGD) em comparação aos grupos controle SF e GD (P = 0.008).
O estudo realizado por Gloor et al. observou valores de TNF-α consideravelmente mais elevados nos grupos com pancreatite, apresentando diminuição com o uso de cloreto de gadolínio como pré-tratamento4. Os demais estudos também demonstram diminuições nos níveis séricos de TNF-α, que variam de 21% a 55%, com o uso de cloreto de gadolínio 2, 4, 8, 15. No nosso estudo, não houve o efeito esperado do cloreto de gadolínio na diminuição dos níveis de TNF-α, da mesma forma que outros estudos. Em experimento realizado para pesquisar dano hepático em ratos Wistar com exposição à lipopolissacarídeos e submetidos ao bloqueio de células de Kupffer com cloreto de gadolínio também foi relatado a ausência de efeito desta droga nos níveis de citocinas e de TNF-α24. Em outro estudo realizado por Gloor et al. a diminuição de 21% nos níveis de TNF-αno grupo pré-tratado com cloreto de gadolínio não foi estatisticamente significativa em comparação ao grupo sem tratamento16.
A dosagem da atividade da mieloperoxidase no tecido pulmonar é um marcador de infiltração neutrofílica. Houve uma tendência de obtenção de valores superiores de MPO nos grupos que tiveram indução de pancreatite por tauracolato de sódio, porém foram significativamente maiores nos grupos TS e GDTS em comparação ao grupo SF (P = 0.019). Da mesma forma que a dosagem de TNF-α, eram esperados valores mais elevados de MPO nos grupos com pancreatite. Foram relatadas diminuições que variavam de 22% a 43% nos níveis de atividade da mieloperoxidase nos grupos que utilizaram gadolínio como pré-tratamento em comparação com os grupos com pancreatite 2, 4, 8, 15, 16.
O dano pulmonar foi avaliado por escores histológicos que tenderam a ser maiores nos grupos com pancreatite induzida por tauracolato em comparação aos que foi infundida solução salina. Houve aumento significativo do escore de lesão pulmonar nos grupos TS e TSGD em comparação aos grupos SF e GD. Era esperado que houvesse diferenças entre o grupo TS e os grupos controle SF e GD e que os grupos que utilizaram cloreto de gadolínio como tratamento e pré-tratamento tivessem escores inferiores ao encontrados no grupo TS. O uso do gadolínio não diminuiu os escores de lesão pulmonar nos ratos estudados ao contrário dos estudos realizados por Gloor et al. e Liu et al. que mostraram diminuição de 25 e 29%, respectivamente, nos escores de dano pulmonar nos ratos pré-tratados com gadolínio 2,15. Em outro estudo realizado por Gloor et al houve diminuição de apenas 7% no dano pulmonar sem significância estatística16.
O modelo experimental utilizado induziu pancreatite aguda em todos os grupos, sendo mais intensa nos grupos submetidos à infusão de tauracolato de sódio a 3%. Por outro lado, não houve evidência inequívoca de resposta inflamatória sistêmica pelos baixos valores de TNF-αe MPO observados nos grupos com pancreatite induzida por tauracolato de sódio. Apesar de ter sido demonstrado histologicamente o dano pulmonar, não foi possível avaliar de forma substancial os benefícios com o uso de cloreto de gadolínio de forma profilática e de forma terapêutica. O número maior de perdas de animais nos grupos com pancreatite aguda e que utilizaram cloreto de gadolínio sugere haver efeito adverso desta droga neste modelo experimental.
Agradecimentos
Ao FIPE (Fundo de Incentivo à Pesquisa e Eventos) do Hospital de Clínicas de Porto Alegre pelo suporte financeiro.
À Profª. Drª. Roseli de Oliveira Möllerke (in memorian) pelo seu auxílio e incentivo prestado na realização do experimento.
Recebido em 19/06/2009
Aceito para publicação em 20/08/2009
Conflito de interesse: nenhum
Fonte de financiamento: FIPE (Fundo de Incentivo à Pesquisa e Eventos) do Hospital de Clínicas de Porto Alegre.
Estudo realizado no Centro de Cirurgia Experimental do Hospital de Clínicas de Porto Alegre e pelo Programa de Pós-Graduação em Ciências Cirúrgicas da Universidade Federal do Rio Grande do Sul, Brasil.
- 1. Frossard JL, Steer ML, Pastor CM. Acute pancreatitis. Lancet. 2008; 371(9607):143-52.
- 2. Gloor B, Blinman TA, Rigberg DA, Todd KE, Lane JS, Hines OJ et al. Kupffer cell blockade reduces hepatic and systemic cytokine levels and lung injury in hemorrhagic pancreatitis in rats. Pancreas. 2000; 21(4):414-20.
- 3. Granger J, Remick D. Acute pancreatitis: models, markers, and mediators. Shock. 2005; 24 Suppl 1:45-51.
- 4. Gloor B, Todd KE, Lane JS, Lewis MP, Reber HA. Hepatic Kupffer cell blockade reduces mortality of acute hemorrhagic pancreatitis in mice. J Gastrointest Surg. 1998; 2(5):430-5.
- 5. Beger HG, Rau BM. Severe acute pancreatitis: Clinical course and management. World J Gastroenterol. 2007; 13(38):5043-51.
- 6. Pandol SJ, Saluja AK, Imrie CW, Banks PA. Acute pancreatitis: bench to the bedside. Gastroenterology. 2007; 133(3):1056.e1-1056.e25.
- 7. Papachristou GI, Whitcomb DC. Inflammatory markers of disease severity in acute pancreatitis. Clin Lab Med. 2005; 25(1):17-37.
- 8. Folch E, Prats N, Hotter G, López S, Gelpi E, Roselló-Catafau J et al. P-selectin expression and Kupffer cell activation in rat acute pancreatitis. Dig Dis Sci. 2000; 45(8):1535-44.
- 9. Folch-Puy E. Importance of the liver in systemic complications associated with acute pancreatitis: the role of Kupffer cells. J Pathol. 2007; 211(4):383-8.
- 10. Hoyos S, Granell S, Heredia N, Bulbena O, Closa D, Fernández-Cruz L. Influence of portal blood on the development of systemic inflammation associated with experimental acute pancreatitis. Surgery. 2005; 137(2):186-91.
- 11. Pastor CM, Vonlaufen A, Georgi F, Hadengue A, Morel P, Frossard JL. Neutrophil depletion-but not prevention of Kupffer cell activation-decreases the severity of cerulein-induced acute pancreatitis. World J Gastroenterol. 2006; 12(8):1219-24.
- 12. Closa D, Bardají M, Hotter G, Prats N, Gelpí E, Fernández-Cruz L et al. Hepatic involvement in pancreatitis-induced lung damage. Am J Physiol. 1996; 270(1 Pt 1):G6-13.
- 13. Murr MM, Yang J, Fier A, Gallagher SF, Carter G, Gower WR Jr et al. Regulation of Kupffer cell TNF gene expression during experimental acute pancreatitis: the role of p38-MAPK, ERK1/2, SAPK/JNK, and NF-kappaB. J Gastrointest Surg. 2003; 7(1):20-5.
- 14. Closa D, Sabater L, Fernández-Cruz L, Prats N, Gelpí E, Roselló-Catafau J. Activation of alveolar macrophages in lung injury associated with experimental acute pancreatitis is mediated by the liver. Ann Surg. 1999; 229(2):230-6.
- 15. Liu HB, Cui NQ, Li DH, Chen C. Role of Kupffer cells in acute hemorrhagic necrotizing pancreatitis-associated lung injury of rats. World J Gastroenterol. 2006; 12(3):403-7.
- 16. Gloor B, Todd KE, Lane JS, Rigberg DA, Reber HA. Mechanism of increased lung injury after acute pancreatitis in IL-10 knockout mice. J Surg Res. 1998; 80(1):110-4.
- 17. Gallagher SF, Yang J, Baksh, Haines K, Carpenter H, Epling-Burnette PK et al. Acute pancreatitis induces FasL gene expression and apoptosis in the liver. J Surg Res 2004; 122(2):201-9.
- 18. Schmidt J, Rattner DW, Lewandrowski K, Compton CC, Mandavilli U, Knoefel WT et al. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 1992; 215(1):44-56.
- 19. Aho HJ, Koskensalo SM, Nevalainen TJ. Experimental pancreatitis in the rat. Sodium taurocholate-induced acute haemorrhagic pancreatitis. Scand J Gastroenterol. 1980; 15(4):411-6.
- 20. Festugato M, Coelho CP, Fiedler G, Machado FP, Gonçalves MC, Bassani FR et al. Hyperbaric oxygen therapy effects on tissue lesions in acute pancreatitis. Experimental study in rats. JOP. 2008; 9(3):275-82.
- 21. Tonini KC, Speranzini MB, Neves MM, Rodrigues C, Goldenberg S. Pancreatite aguda necro-hemorrágica induzida por tauracolato de sódio. Estudo das lesões anatomopatológicas em ratos. Acta Cir Bras. 1993; 8(3):96-103.
- 22. Aho HJ, Suonpaa K, Ahola RA, Nevalainen TJ. Experimental pancreatitis in the rat. Ductal factors in sodium taurocholateinduced acute pancreatitis. Exp Pathol 1984; 25(2):73-9.
- 23. Aho HJ, Nevalainen TJ, Aho AJ. Experimental pancreatitis in the rat. Development of pancreatic necrosis, ischemia and edema after intraductal sodium taurocholate injection. Eur Surg Res. 1983; 15(1):28-36.
- 24. Granado M, Martin AI, Priego T, Villanua MA, Lopez-Calderon A. Inactivation of Kupffer cells by gadolinium administration prevents lipopolysaccharide-induced decrease in liver insulin-like growth factor-I and IGF-binding protein-3 gene expression. J Endocrinol. 2006; 188(3):503-11.
Endereço para correspondência:
Datas de Publicação
-
Publicação nesta coleção
29 Out 2010 -
Data do Fascículo
Ago 2010
Histórico
-
Recebido
19 Jun 2009 -
Aceito
20 Ago 2009