Resumos
Biocerâmicas porosas tem aplicações biomédicas importantes como preenchimento de defeitos ósseos e scaffolds na engenharia de tecidos. A hidroxiapatita (HA, Ca10(PO4)6(OH)2) que apresenta semelhança química e estrutural com a fase mineral dos ossos e dos dentes, é biocompatível e osteocondutiva, e tem excelente afinidade química e biológica com os tecidos ósseos. Este trabalho teve como objetivo desenvolver biocerâmicas porosas HA para utilização como scaffold para regeneração óssea empregando-se a técnica de réplica da esponja polimérica. A pasta biocerâmica de HA foi obtida por via úmida utilizando hidróxido de cálcio [Ca(OH)2] e ácido fosfórico (H3PO4) e impregnada em esponjas de poliuretano com diferentes densidades. Tratamento térmico a 600°C por 1h foi realizado para eliminação da esponja seguido da sinterização a 1100°C por 2 horas. Os scaffolds apresentaram a HA como fase majoritária, elevada porosidade (> 70%) e poros com tamanhos variando na ordem de macro (>100μm) e microporosidade (1-20μm), sendo estes fatores adequados para a aplicação como scaffolds para regeneração óssea.
biocerâmicas; fosfato de cálcio; regeneração óssea
Porous bioceramics have important biomedical applications such as bone defect fillers and tissue engineering scaffolds. The hydroxyapatite (HA, Ca10 (Po4)6(OH)2) shows resemblance to the mineral phase of bone and teeth, it is biocompatible and osteoconductive, and has excellent chemical and biological affinity to bone tissue. The aim of this work is to develop HA porous bioceramics for bone regeneration using the replica of the polymeric sponge technique. The HA slurry bioceramic was obtained by wet method using by the calcium hydroxide [Ca (OH) 2] and phosphoric acid (H3PO4) and impregnated polyurethane sponges with different densities. Heat treatment at 600 ° C for 1h was accomplished to eliminate the sponge followed by sintering at 1100 ° C for 2 hours. The scaffolds showed HA as major phase, high porosity (> 70%) and pores with sizes ranging in the order of macro (> 100μm) and microporosity (1-20μm), and these factors are suitable for application as scaffolds for bone regeneration.
bioceramics; calcium phosphate; bone regeneration
Desenvolvimento de biocerâmicas porosas de hidroxiapatita para utilização como scaffolds para regeneração óssea
Development of hydroxiapatite porous bioceramics for use as scaffolds for bone regeneration
Fook, A.C.B.M.I; Aparecida, A.H.II; Fook, M.V.L.I
IDepartamento de Engenharia de Materiais - Universidade Federal de Campina Grande CP: 10034 - 58109-970, Campina Grande, PB. e-mail: acarol_brasil@hotmail.com; marcusvinicius@dema.ufcg.edu.br IIInstituto de Química - Unesp - Araraquara. e-mail: anahi_iq_unesp@hotmail.com
RESUMO
Biocerâmicas porosas tem aplicações biomédicas importantes como preenchimento de defeitos ósseos e scaffolds na engenharia de tecidos. A hidroxiapatita (HA, Ca10(PO4)6(OH)2) que apresenta semelhança química e estrutural com a fase mineral dos ossos e dos dentes, é biocompatível e osteocondutiva, e tem excelente afinidade química e biológica com os tecidos ósseos. Este trabalho teve como objetivo desenvolver biocerâmicas porosas HA para utilização como scaffold para regeneração óssea empregando-se a técnica de réplica da esponja polimérica. A pasta biocerâmica de HA foi obtida por via úmida utilizando hidróxido de cálcio [Ca(OH)2] e ácido fosfórico (H3PO4) e impregnada em esponjas de poliuretano com diferentes densidades. Tratamento térmico a 600°C por 1h foi realizado para eliminação da esponja seguido da sinterização a 1100°C por 2 horas. Os scaffolds apresentaram a HA como fase majoritária, elevada porosidade (> 70%) e poros com tamanhos variando na ordem de macro (>100μm) e microporosidade (1-20μm), sendo estes fatores adequados para a aplicação como scaffolds para regeneração óssea.
Palavras-chaves: biocerâmicas, fosfato de cálcio, regeneração óssea.
ABSTRACT
Porous bioceramics have important biomedical applications such as bone defect fillers and tissue engineering scaffolds. The hydroxyapatite (HA, Ca10 (Po4)6(OH)2) shows resemblance to the mineral phase of bone and teeth, it is biocompatible and osteoconductive, and has excellent chemical and biological affinity to bone tissue. The aim of this work is to develop HA porous bioceramics for bone regeneration using the replica of the polymeric sponge technique. The HA slurry bioceramic was obtained by wet method using by the calcium hydroxide [Ca (OH) 2] and phosphoric acid (H3PO4) and impregnated polyurethane sponges with different densities. Heat treatment at 600 ° C for 1h was accomplished to eliminate the sponge followed by sintering at 1100 ° C for 2 hours. The scaffolds showed HA as major phase, high porosity (> 70%) and pores with sizes ranging in the order of macro (> 100μm) and microporosity (1-20μm), and these factors are suitable for application as scaffolds for bone regeneration.
Keywords: bioceramics, calcium phosphate, bone regeneration.
1 INTRODUÇÃO
A estratégia usual para tratamento de defeitos ósseos resultantes de traumas e patologias é o preenchimento com osso autólogo. Porém, essa técnica tem sido restringida devido à disponibilidade limitada de material, às complicações cirúrgicas e de prejuízo do sítio de colheita [1, 2]. Uma alternativa para o enxerto ósseo é a substituição por materiais sintéticos. Na engenharia de tecido ósseo, o scaffold poroso é um dos componentes essenciais para regeneração óssea, servindo como carreador ou suporte para interações celulares e matriz extracelular óssea fornecendo um suporte estrutural para o tecido recém formado [3, 4].
A composição e a arquitetura do scaffold desempenham papéis cruciais na capacidade de colonização das células. O material deve ser biocompatível, bioreabsorvível cujos produtos da dissolução sejam metabolizados pelo organismo, osteocondutor e, de preferência osteoindutor [5]. Quanto à arquitetura, um scaffold deve ser tridimensional e altamente poroso com uma rede de poros interconectados para crescimento celular/tecidual e transporte de nutrientes e resíduos metabólicos [6]. A porosidade aumenta a área superficial disponível para a justaposição osso-implante e a osseointegração, consequentemente, o período de ligação interfacial entre o implante e o osso é reduzido [7, 8].
A Hidroxiapatita [Ca10(PO4)6(OH)2] é uma das cerâmicas mais biocompatíveis devido à semelhança com os constituintes minerais dos ossos e dentes humanos. Esse material tem sido sintetizado e utilizado para fabricação de diversas formas de implantes, tais como, blocos, grânulos ou recobrimentos, igualmente densos ou porosos [9]. Essa cerâmica é termodinamicamente estável em pH fisiológico e participa ativamente das ligações ósseas, formando forte ligação química com o tecido ósseo [10, 11]. Visto que a HA porosa é mais reabsorvível e mais osteocondutiva do que a HA, há um grande interesse no desenvolvimento de materiais para reposição óssea de HA porosa sintética para preenchimento de defeitos ósseos [12].
Diversas técnicas são utilizadas na produção de scaffolds, dentre elas o método de incorporação de partículas orgânicas voláteis, gel-casting de espumas e a técnica de replicação de esponjas poliméricas [13]. Entre esses, o método réplica da esponja polimérica tem recebido atenção particular por produzir scaffolds com alta porosidade e com poros interconectados [6, 14].
Segundo Karageorgiou e Kaplan [15], o tamanho mínimo necessário para o crescimento de células ósseas é de 100 - 200 μm. Poros menores entre 75 - 100 μm resultam no crescimento de tecido osteóide não mineralizado. Poros menores ainda, entre 10 - 75 μm permitem a penetração apenas de tecido fibroso, o que ajuda na fixação mecânica da peça. Klawiter et al. [16] e Whang et al. [17], demonstraram através de experimentos o efeito do tamanho do poro na regeneração de tecidos. Os poros de 5 μm permitem a neovascularização, entre 5-15 μm para crescimento de fibroblastos, 40-100 μm para crescimento da matriz osteóide e 100-350 μm para regeneração óssea.
O objetivo do presente estudo foi desenvolver suportes porosos de HA para regeneração óssea utilizando a técnica réplica da esponja polimérica e avaliar a influência da densidade da esponja polimérica na porosidade, tamanho de poros, distribuição de tamanho de poros e microestrutura dos suportes porosos
2 MATERIAIS E MÉTODOS
2.1 Obtenção da Pasta Biocerâmica de Hidroxiapatita (HA)
Para a obtenção da pasta biocerâmica de Hidroxiapatita (HA) utilizou-se o processo de via úmida, ou seja, precipitação à partir de uma suspensão de hidróxido de cálcio [Ca(OH)2] e uma solução de ácido fosfórico (H3PO4) , ambas na concentração de 2,0mol/L, na proporção Ca/P referente à HA (Ca/P = 1,67). O aparato experimental foi desenvolvido e adaptado pelo Grupo de Biomateriais da UAEMa/UFCG. Para evitar as contaminações, foi utilizada água deionizada para o preparo das soluções de Ca(OH)2 e H3PO4. A solução de Ca(OH)2 foi previamente aquecida até 80ºC sob agitação constante. Em seguida, a solução de H3PO4, à temperatura ambiente, foi adicionada lentamente, a uma razão de 5mL/min. Após a completa adição do ácido, o produto obtido permaneceu sob agitação à temperatura de 100°C por um período de aproximadamente 50 minutos, para obter-se uma uma consistência pastosa. A pasta biocerâmica obtida permaneceu em repouso até atingir a temperatura de 30ºC.
2.2 Obtenção dos Scaffolds de HA - Técnica da Réplica da Esponja Polimérica
Para a obtenção de scaffolds porosos de HA foi utilizada a técnica da réplica da esponja polimérica. Esse método consiste em inicialmente selecionar uma esponja polimérica de acordo com a densidade, uma vez que esse fator apresenta relação direta com a estrutura final dos scaffolds.
A fim de obter estruturas porosas de fosfato de cálcio com macroporosidades de célula aberta baseado na réplica de um substrato poroso, foram adotadas como substratos esponjas poliméricas de poliuretano com densidades variadas e cortadas em formato retangular com dimensões de 30 x 20 x 20 mm3. As esponjas de poliuretano foram adquiridas no comércio local e apresentaram uma eficiente habilidade de preenchimento. Durante o processo de sinterização a esponja de poliuretano foi completamente eliminada em uma temperatura de aproximadamente 550ºC [3].
Na determinação da densidade das esponjas utilizou-se o cálculo da densidade geométrica. Os valores das densidades das espumas utilizadas estão apresentados na Tabela 1.
Essas esponjas foram imersas na pasta biocerâmica obtida, realizando em seguida a compressão manual das mesmas para eliminar o excesso da pasta, o ar e promover a total adsorção. A secagem dos corpos de prova foi realizada em estufa a 110°C por 24 horas, seguida pelo processo de sinterização a 1100ºC por 2 horas com isoterma a 600°C por 1 hora a uma taxa de aquecimento de 10ºC/min.
2.3 Técnicas de Caracterização das Biocerâmicas
As análises dos scaffolds foram realizadas após o tratamento térmico utilizando-se as técnicas: espectroscopia na região do infravermelho com transformada de Fourier (FTIR), difração de raios-X (DRX), microscopia eletrônica de varredura (MEV), espectroscopia por energia dispersiva de raios-X (EDX) e porosimetria de mercúrio.
A análise de espectroscopia no infravermelho com transformada de Fourier (FTIR) foi realizada nos pós obtidos à partir da moagem dos scaffolds desenvolvidos empregando-se um espectrômetro AVATAR TM 360 ESP Nicolet com varredura de 4000 a 400 cm-1.
Neste trabalho, utilizou-se um difratômetro de raios X SIEMENS D5000 com varredura angular entre 10 e 70º, na montagem de Bragg-Brentano, utilizando-se radiação de Cu(kα1) com passo de 0,05 (2θ), sendo que o tempo de passo foi de 1.0 segundos para cada amostra. A análise por DRX foi realizada nos pós obtidos à partir da moagem dos scaffolds desenvolvidos.
A caracterização por microscopia eletrônica de varredura (MEV) dos suportes porosos foi realizada no equipamento fabricado pela JEOL-JSM, modelo T-330 A, acoplado com sistema para micro análise química por Espectroscopia de Energia Dispersiva - EDX.
A avaliação da porosidade quanto à distribuição e tamanho de poros foi realizada utilizando a técnica de porosimetria de intrusão de mercúrio no equipamento Micromeritics - Autopore III 9410.
3 RESULTADOS E DISCUSSÃO
3.1 Espectroscopia no Infravermelho com Transformada de Fourier (FTIR)
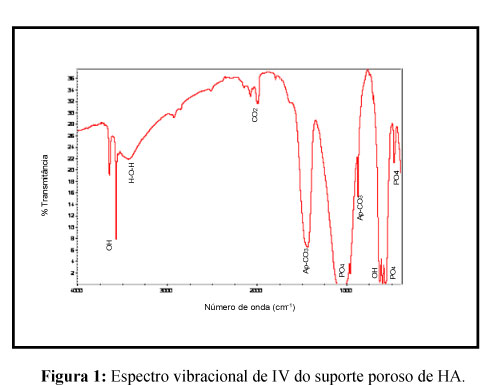
A Figura 1 apresenta o espectro de FTIR dos scaffolds desenvolvidos. As bandas na região de 475, 580 e 1100 cm-1 correspondem às vibrações de estiramentos e flexões dos grupos PO43-. As bandas em torno de 640, 3400 e 3590 cm-1 são atribuídas ao estiramento dos grupos hidroxila, OH-, característicos da HA. A banda na região 2100 cm-1 identificado em todas as amostras pode ser atribuído ao CO2 adsorvido do meio ambiente. As bandas em torno de 880 e 1435 cm-1 são atribuídas à incorporação de grupos CO32-proveniente do ar, visto que as amostras foram produzidas em atmosfera aberta e em solução aquosa. A análise do DRX, Figura 2, confirma que os scaffolds desenvolvidos são compostos por HA, pois todos os picos correspondem a esta fase (JCPDS # 86-740).
As Figuras 3 a 5 apresentam os scaffolds obtidos utilizando-se as diferentes esponjas de poliuretano de densidades variadas. Para discutir as morfologias dos scaffolds desenvolvidos é importante estabelecer uma classificação quanto ao tamanho dos poros. A União Internacional de Química Pura e Aplicada - "International Union of Pure Applied Chemistry" (IUPAC) classificação do tamanho de poro proposta pela para aplicação na área de catálise [18] em microporos (< 2 nm), mesoporos (2-50 nm) e macroporos (> 50 nm). Bohner et al. [19] classificaram os poros de scaffolds para substituição óssea com dimensões de 1-20 μm como microporos e macroporos > 100 μm, apesar destes terem dimensões que vão muito além da escala de classificação da IUPAC.
Analisando-se as Figuras 3 a 5 observa-se que o aumento da densidade da espuma utilizada provocou uma diminuição dos microporos (1-20μm) e um aumento de poros maiores (50-150μm). Os microporos observados contribuem diretamente para formação de interconectividade entre os poros [20].
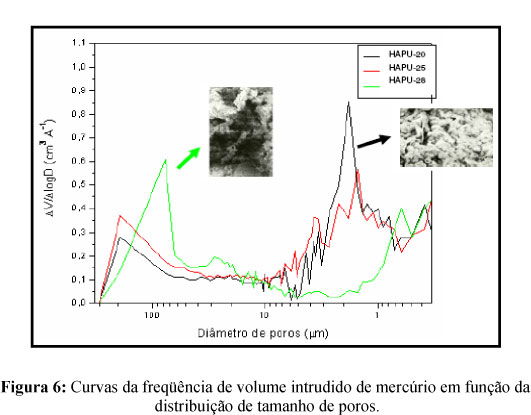
A Figura 6 apresenta a distribuição diferencial do tamanho de poros dos scaffolds desenvolvidos. Observa-se que as amostras obtidas apresentaram uma distribuição bimodal de poros. A primeira distribuição se estendeu de 1,0 - 10,0 μm e a segunda no intervalo de 60 - 250 μm. Observa-se ainda uma relação direta entre a densidade da espuma utilizada e a dimensão dos poros nas amostras dos suportes. Os suportes obtidos com a espuma de maior densidade (HAPU-28) apresentaram uma freqüência maior de poros de maior tamanho (> 60 μm). Entretanto, a maior freqüência de poros de tamanhos entre 1,0-2,0 μm foi observada nas amostras dos suportes (HAPU-20).
As diferenças entre as espumas são notadas em termos de volume de porosidade total dos suportes, Tabela 2.
Verificou-se que os suportes que utilizaram como substratos as espumas de menor densidade (HAPU-20) foram os que apresentaram menor porosidade. Esse resultado mostra que espumas que possuem uma massa menor para um mesmo volume, têm mais espaços vazios e então a pasta cerâmica encontra mais espaço para se difundir entre os poros, diminuindo assim a porosidade total dos suportes.
A interconectividade é a característica principal da porosidade que tem se confirmado ao longo de vários estudos, como sendo responsável pela manutenção e crescimento do tecido ósseo, pelo transporte de nutrientes e drenagem de líquidos intersticiais [21-23]. Poros com dimensões próximas de 5 μm, ainda podem facilitar a migração iônica que ocorre inicialmente entre a superfície do implante e o plasma sangüíneo, influenciando de maneira positiva a dinâmica de adsorção celular, a capilaridade e a permeabilidade dos fluidos corpóreos, que poderiam contribuir na dissolução desta cerâmica [21, 23].
A presença de poros com diâmetros superiores a 100 μm demonstra que os suportes de HA obtidos pela técnica réplica da esponja polimérica são adequados à regeneração óssea. Visto que um osteoblasto ocupa uma área de 700 μm2 [24], consequentemente um tamanho de poro acima de 100 μm é compatível com a osteocondução [25]. Isso mostra que os poros dos suportes de HA são suficientemente extensos para acomodar células.
As relações Ca/P determinadas pela análise semi-quantitativa de EDX apresentaram um desvio estequiométrico, contudo não houve modificações estruturais perceptíveis no padrão de difração de raios-X. Esse comportamento pode ser atribuído a incorporação de grupos CO32- nos sítios PO43- ou OH-. Como as amostras foram obtidas em atmosfera aberta e em solução aquosa, o grupo carbonato pode ter sido originado através do CO2 presente no ar [26, 27].
Segundo MOREIRA et al. [28] a estrutura da hidroxiapatita, Ca10(PO4)6(OH)2 por ser aberta e hospedeira permite a substituição de todos os seus íons, Ca2+, PO43- e OH-, mantendo a eletroneutralidade. A presença dos íons CO32- nos sítios do PO43- (sítio B) e OH- (sítio A) pelo íon provoca a contração do eixo a e b e expansão do eixo c com conseqüente diminuição do volume da célula unitária; diminuição da cristalinidade; aumento da solubilidade; variação nas posições atômicas e mudança na morfologia dos cristalitos. E no presente caso foi feita alguma análise? Pois pode influir na utilização desejada.
4 CONCLUSÕES
As condições operacionais de obtenção da pasta biocerâmica e os respectivos tratamentos térmicos, foram eficientes para a obtenção de scaffolds de HA.
A variação da densidade das esponjas não provocou a formação de morfologias diferentes. Contudo, houve uma relação direta entre a distribuição e tamanho dos poros e a densidade da espuma.
As análises por MEV revelaram scaffolds com poros interconectados com tamanhos variados na ordem de macro (>100μm) e microporosidade (1-20μm) em menor ou maior grau dependendo da densidade da esponja utilizada na produção das amostras, resultados estes que foram comprovados pela análise de porosimetria por intrusão de mercúrio. Os suportes porosos HAPU-28 destacaram-se por apresentar maior porosidade total em comparação com os suportes produzidos com esponja de menor densidade (HAPU-20 e HAPU-25).
Os suportes porosos de HA desenvolvidos nesse estudo apresentaram uma combinação de fatores essenciais para a aplicação desses materiais como substitutos ósseos, tais como alta porosidade (>70%), composição química, interconectividade e tamanhos dos poros adequados à regeneração óssea.
5 AGRADECIMENTOS
Os autores gostariam de agradecer a Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pela bolsa de mestrado e a Unesp/IQ/Araraquara pela colaboração experimental.
6 BIBLIOGRAFIA
Data de envio: 01/05/09
Data de aceite: 10/05/10
Autor Responsável: FOOK, A.C.B.M.
- [1] OLIVEIRA, A.A.R., OLIVEIRA, J.R., ORÉFICE , R.L., MANSUR, H.S., PEREIRA, M.M., "Avaliação das propriedades mecânicas de espumas híbridas de vidro bioativo/álcool polivinílico para aplicação em engenharia de tecidos", Revista Matéria, v. 12, n. 1, pp. 140 - 149, 2007.
- [2] GALEA, L.G., et al. "Bone substitute: transforming β-tricalcium phosphate porous scaffolds into monetice", Biomaterials, v. 29, pp. 3400-3407, 2008.
- [3] RAMAY, H.R., ZHANG, M., "Preparation of porous hydroxyapatite scaffolds by combination of the gel-casting and polymer sponge methods", Biomaterials, v. 24, pp. 3293-3302, 2003.
- [4] ZHAO, J., et al., "A study on improving mechanical properties of porous HA tissue engineering scaffolds by hot isostatic pressing", Biomedical Materials, v. 1, pp. 188-192, 2006.
- [5] SENGERS, B.G., et al, "Computational modelling of cell spreading and tissue regeneration in porous scaffolds", Biomaterials, v. 28, pp. 1926-1940, 2007.
- [6] BUCKLEY, C.T., O'KELLY, K.U., "Regular scaffold fabrication techniques for investigations in tissue engineering", Topics in Bio-Mechanical Engineering, pp. 147-166, 2004.
- [7] VERCIK, L.C.O., et al, "Recobrimento de apatitas "in vitro" sobre titânio: influência do tratamento térmico", Eclética Química, v. 28, n. 1, 2003.
- [8] CAMPOS, S.D., et al,"Biomateriais à base de Na2O-CaO-SiO2-P2O5 preparados com serragem e com glucose de milho: influência na porosidade e na cristalinidade", Cerâmica, v. 51, p. 274-279, 2005.
- [9] BILLOTTE, W.G., "Ceramic Biomaterials", The Biomedical Engineering Handbook: 2. ed., Boca Raton: CRC Press LLC, 2006.
- [10] VAZ, G.J.O., et al "Cerâmicas com alta porosidade para scaffolds", In: Congresso Latino Americano de Órgãos Artificiais e Biomateriais, 4. Agosto, 2006.
- [11] ROSSI, A.M., et al, "A ciência e tecnologia das biocerâmicas", Revista do CBPF, Disponível em: http://portal.cbpf.br/protected/Pages/divulgacao/pdfs/BioMat.pdf, Acesso em: Julho, 2006.
- [12] SWAIN, S.K., "Processing of porous hydroxyapatite scaffold", Thesis, Department of Ceramic Engineering, National Institute of Technology, Rourkela, 2009.
- [13] SANTOS, S.R.A., et al, "Produção de scaffolds porosos para regeneração óssea", In: 4ş Congresso Latino Americano de Órgãos Artificiais e Biomateriais, Agosto, 2006.
- [14] JO, I-H. et al, "Highly porous hydroxyapatite scaffolds with elongated pores using stretched polymeric sponges as novel template", Materials Letters, v. 63, pp. 1702-1704, 2009.
- [15] KARAGEORGIOU, V., KAPLAN, D., "Porosity of 3D biomaterial scaffolds and osteogenesis", Biomaterials, v. 26, pp. 5474-5491, 2005.
- [16] KLAWITTER, J.J., HULBERT, S.F., "Application of porous ceramics for the attachment of load-bearing internal orthopedic applications", Journal of Biomedical Materials Research Symposium, v. 2, n. 161, 1971.
- [17] WHANG, K., et al, "Engineering bone regeneration with bioabsorbable scaffolds with novel microarchitecture", Tissue Engineering, v. 5, n. 35, 1999.
- [18] INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY (IUPAC). Gold book Desenvolvido por IUPAC, USA. Disponível em: http://goldbook.iupac.org/M03906.html Acesso em 15 jan. 2010.
- [19] BOHNER, M., et al, "Synthesis and characterization of porous β-tricalcium phosphate blocks", Biomaterials, v. 26, pp. 6099-6105, 2005.
- [20] TEIXEIRA, S., et al, "Physical characterization of hydroxyapatite porous scaffolds for tissue engineering", Materials Science and Engineering C, v. 29, pp. 1510-1514, 2009.
- [21] RATNER, B.D., et al, "An introduction to materials in medicine", San Diego: Academic Press, 1996.
- [22] LIEBSCHNER, M.A.K., WETTERGREEN, M.A., "Topics in tissue engineering", 1 ed. Ashammakhi ε Ferretti, USA, 2003.
- [23] YASZEMSKI, M.J., et al, "Evolution of bone transplantation: molecular, cellular and tissue strategies to engineer human bone", Biomaterials, v. 17, pp. 175-85, 1996.
- [24] THOMSON, R.C., et al, "Hydroxyapatite fiber reinforced poly (α-hydroxy ester) foams for bone regeneration", Biomaterials, v. 19, pp. 1935-1943, 1998.
- [25] NARBAT, M.K., et al, "Fabrication of porous hydroxyapatite-gelatin composite scaffolds for bone tissue engineering", Iranian Biomedical Journal, v. 10, n. 4, pp. 215-223, 2006.
- [26] CHENG, Z. H., et al, "FTIR Study on incorporation of CO2 into calcium hydroxyapatite", Journal of the Chemical Society, Faraday Transactions, v. 94, n. 10, pp. 1501-1505, 1998.
- [27] ARAÚJO, T.S., "Produção de hidroxiapatita pura e dopada para aplicação em biosensores", 99 p. Dissertação de M.Sc. em Física, Universidade Federal de Sergipe, São Cristóvão, 2006.
- [28] MOREIRA, E.L., et al, "Análise estrutural de uma hidroxiapatita carbonatada por difração de raios-X", Revista do CBPF Disponível em: http://cbpfindex.cbpf.br/publication_pdfs/EMC2006ENVIO.2006_12_21_10_23_10.pdf Acesso em: Janeiro, 2008.
Datas de Publicação
-
Publicação nesta coleção
21 Dez 2010 -
Data do Fascículo
2010
Histórico
-
Recebido
01 Maio 2009 -
Aceito
10 Maio 2010