Resumos
OBJETIVO:
Avaliar possíveis fatores associados à perda de anticorpos para o vírus da hepatite A (VHA) sete anos após a imunização primária e resposta à revacinação em crianças nascidas de mães soropositivas para HIV nos pacientes soronegativos para Hepatite A.
MÉTODOS:
Quantificação de anticorpos para o VHA por meio da eletroquimioluminescência foi feita em 39 adolescentes acompanhados no Ambulatório de Aids Pediátrica da Universidade Federal de São Paulo (Unifesp): 29 infectados pelo HIV e 10 expostos e não infectados (ENI) pelo HIV, com mediana de idade, respectivamente, de 12,8 e 13,4 anos. Todos receberam duas doses da vacina VHA (Havrix(r)) em 2002.
RESULTADOS:
A mediana da idade na época da imunização primária (IP) era de 5,4 anos para o grupo HIV e 6,5 anos para o grupo ENI. As crianças dos dois grupos apresentaram anticorpos para o VHA > 20 mUI/mL após a IP. Sete anos após, o grupo ENI apresentava mediana de anticorpos = 253,5 mUI/mL e o grupo HIV = 113,0 mUI/mL (Mann-Whitney; p=0,085). Todo grupo ENI e 23/29 (79,3%) do grupo HIV mantiveram anticorpos contra o VHA sete anos após IP. Os níveis de anticorpos para hepatite A na primovacinação foram o único fator independentemente associado à manutenção desses anticorpos decorridos sete anos. O grupo que perdeu soropositividade para VHA foi revacinado e 83,3% (5/6) responderam com anticorpos >20 mUI/mL.
CONCLUSÕES:
Os níveis de anticorpos obtidos na primovacinação no grupo HIV foram o principal fator associado à perda de anticorpos após imunização VHA
HIV; Crianças e adolescentes; Vacina de hepatite A; Imunossupressão
OBJECTIVE:
To assess possible factors associated with the loss of antibodies to hepatitis A 7 years after the primary immunization in children of HIV-infected mothers and the response to revaccination in patients seronegative for hepatitis A.
METHODS:
Quantification of HAV antibodies by electrochemiluminescence was performed in 39 adolescents followed up at the Pediatric Aids Clinic of Federal University of São Paulo (Unifesp): 29 HIV-infected (HIV group) (median age: 12.8 years) and 10 HIV-exposed but non-infected (ENI group) (median age: 13.4 years). All of them received two doses of HAV vaccine (Havrix(r)) in 2002.
RESULTS:
The median age at primary immunization (PI) was 5.4 years for HIV group and 6.5 years for ENI group. All children, from both groups, had antibodies to HAV >20 mIU/mL after PI. Seven years later, the ENI group showed a median concentration of antibodies = 253.5 mIU/mL, while the HIV group = 113.0 mIU/mL (Mann-Whitney test, p=0.085). All ENI group and 23/29 (79.3%) from HIV group mantained HAV antibodies 7 years after PI. The levels of hepatitis A antibodies in the primary vaccination were the only factor independently associated with maintaining these antibodies for 7 years. The group that lost HAV seropositivity was revaccinated and 83.3% (5/6) responded with antibodies >20 mUI/mL.
CONCLUSIONS:
The antibodies levels acquired in the primary vaccination in the HIV group were the main factor associated with antibodies loss after HAV immunization.
HIV; Adolescent and children; Hepatitis A vaccine; Immunossupression
Introdução
Nos últimos anos, os avanços no diagnóstico, tratamento e acompanhamento clínico e laboratorial da infecção pelo vírus da imunodeficiência humana (HIV) em crianças permitiram maior sobrevida e melhor qualidade de vida para essa população.11 Brady MT, Oleske JM, Williams PL, Elgie C, Mofenson LM, Dankner WM, et al. Declines in mortality rates and changes in causes of death in HIV-1-infected children during the HAART era. J Acquir Immune Defic Syndr. 2010;53:86-94. and 22 Matida LH, Ramos AN Jr, Heukelbach J, Hearst N, Brazilian Study Group on Survival of Children with Aids. Continuing improvement in survival for children with acquired immunodeficiency syndrome in Brazil. Pediatr Infect Dis J. 2009;28:920-2. Nesse sentido, é importante vacinar crianças infectadas pelo HIV que chegarão à idade adulta e acompanhar a manutenção de anticorpos após a vacinação.
Monitorar e revacinar, quando necessário, os pacientes infectados pelo HIV pode prevenir surtos de doenças imunopreveníveis nessa população.33 Sutcliffe CG, Moss WJ. Do children infected with HIV receiving Haart need to be revaccinated? Lancet Infect Dis. 2010;10:630-42. Proteger adolescentes infectados pelo HIV contra a infecção pelo vírus da hepatite A (VHA) é necessário, na medida em que a coinfecção HIV/VHA pode influenciar a evolução clínica da hepatite A44 Costa-Mattioli M, Allavena C, Poirier AS, Billaudel S, Raffi F, Ferré V. Prolonged hepatitis A infection in an HIV-1 seropositive patient. J Med Virol. 2002;68:7-11. e associar-se a um aumento da replicação do HIV.55 Ridolfo AL, Rusconi S, Antinori S, Balotta C, Galli M. Persisting HIV-1 replication triggered by acute hepatitis A virus infection. Antivir Ther. 2000;5:15-7. and 66 Gallego M, Robles M, Palacios R, Ruiz J, Nuño E, Márquez M, et al. Impact of acute hepatitis A virus (HAV) infection on HIV Viral Load in HIV-Infected patients and influence of HIV infection on acute HAV infection. J Int Assoc Physicians Aids Care (Chic). 2011;10:40-2. Além disso, durante a adolescência, esses indivíduos estão mais sujeitos aos agravos hepáticos quando expostos a doenças sexualmente transmissíveis, ao uso prolongado de antirretrovirais e às doenças oportunistas.
Estudo prévio feito no Centro de Atendimento da Disciplina de Infectologia Pediátrica da Universidade Federal de São Paulo (CEADIPe/Unifesp)77 Gouvea AF, De Moraes-Pinto MI, Ono E, Dinelli MI, Machado DM, Weckx LY, et al. Immunogenicity and tolerability of hepatitis A vaccine in HIV-infected children. Clin Infect Dis. 2005;41:544-8. mostrou que duas doses da vacina contra hepatite A, além de bem toleradas, determinaram título de anticorpos acima de 20 mUI/mL em crianças com exposição perinatal ao HIV, tanto as infectadas quanto aquelas expostas e não infectadas (ENI).
O objetivo deste estudo foi analisar a persistência de anticorpos contra o VHA sete anos após a imunização primária e os possíveis fatores associados, assim como a resposta à revacinação de crianças e adolescentes com exposição perinatal ao HIV.
Método
Estudo de coorte prospectivo com intervenção feito entre dezembro de 2009 e janeiro de 2011 no Centro de Atendimento da Disciplina de Infectologia Pediátrica (CEADIPe) da Universidade Federal de São Paulo (Unifesp) e aprovado pelo Comitê de Ética em Pesquisa do Hospital São Paulo/Universidade Federal de São Paulo (Unifesp). O termo de Consentimento Livre e Esclarecido foi assinado pelos pais ou responsáveis dos adolescentes incluídos no estudo (CEP 1710/06).
Um estudo prévio de soroprevalência no serviço identificou crianças e adolescentes soronegativos para a hepatite A88 Gouvea AF, Moraes-Pinto MI, Machado DM, Carmo FB, Beltrao SC, Cunegundes KS, et al. The prevalence of hepatitis A antibodies in HIV exposed and/or infected children and adolescents. J Pediatr (Rio J). 2005;81:205-8. que receberam entre 2002 e 2003 duas doses da vacina hepatite A (Havrix; Glaxo SmithKline Beecham, Rixensart, Bélgica), com intervalo de seis meses.77 Gouvea AF, De Moraes-Pinto MI, Ono E, Dinelli MI, Machado DM, Weckx LY, et al. Immunogenicity and tolerability of hepatitis A vaccine in HIV-infected children. Clin Infect Dis. 2005;41:544-8. Na época da imunização primária,77 Gouvea AF, De Moraes-Pinto MI, Ono E, Dinelli MI, Machado DM, Weckx LY, et al. Immunogenicity and tolerability of hepatitis A vaccine in HIV-infected children. Clin Infect Dis. 2005;41:544-8. foram incluídos apenas os infectados pelo HIV por transmissão vertical e excluídos da pesquisa os pacientes que apresentavam evidência sorológica de infecção prévia pelos vírus da hepatite A, B ou C, os que haviam recebido imunoglobulina nos últimos seis meses, aqueles que estavam em uso de imunossupressor ou as crianças infectadas pelo HIV que pertenciam à categoria clínica C e à categoria imunológica 3.
Dentre os 32 pacientes infectados pelo HIV que receberam a imunização primária,77 Gouvea AF, De Moraes-Pinto MI, Ono E, Dinelli MI, Machado DM, Weckx LY, et al. Immunogenicity and tolerability of hepatitis A vaccine in HIV-infected children. Clin Infect Dis. 2005;41:544-8. dois não estavam atualmente em acompanhamento regular no serviço e um recebeu dose adicional de vacina de hepatite A. Portanto, foram incluídos no estudo atual 29 pacientes infectados pelo HIV (Grupo HIV). Entre os 27 pacientes expostos ao HIV e não infectados que receberam a imunização primária, 77 Gouvea AF, De Moraes-Pinto MI, Ono E, Dinelli MI, Machado DM, Weckx LY, et al. Immunogenicity and tolerability of hepatitis A vaccine in HIV-infected children. Clin Infect Dis. 2005;41:544-8. somente 10 (Grupo ENI) permaneceram em acompanhamento no serviço e foram incluídos no estudo atual. Assim, foram incluídos para participar desta pesquisa 39 desses sujeitos que mantinham acompanhamento regular no serviço.
Os dados clínicos dos pacientes foram obtidos a partir de revisão dos prontuários médicos: categoria clínica e imunológica para infecção pelo HIV (CDC 1994);99 Centers for Disease Control and Prevention. Revised classification system for human immunodeficiency virus infection in children less than 13 years of age. MMWR. 1994;43:1-10. medidas de peso e estatura usadas para o cálculo do escore z de índice de massa corpórea (zIMC) e escore z de estatura/idade (zE/I), seguindo o padrão de referência e a preconização da Organização Mundial da Saúde;1010 World Health Organization. The WHO child growth standards. Growth reference data for 5-19 years. Geneva: WHO; 2007. intercorrências clínicas; hospitalizações e idade de início da terapia antirretroviral recebida pelo Grupo HIV.
Como parte do acompanhamento clínico de rotina, os pacientes do Grupo HIV fizeram avaliação de linfócitos T CD4+ e da carga viral (CV) do HIV a cada quatro meses. Os linfócitos T CD4+ foram avaliados por citometria de fluxo (FACS Calibur, BD Biosciences, Franklin Lakes, USA). A quantificação da carga viral do HIV foi feita apor RT-PCR (Cobas Amplicor) HIV-1 Monitor kit (Roche Diagnostics System, Basel, Switzerland) e pela Bayer Versant human immunodeficiency virus type 1 (HIV-1) RNA 3.0 (B-DNA) (Bayer, Tarrytown, New York). Foram coletados os seguintes dados: contagem de linfócitos T CD4+ e carga viral do HIV 30 dias após a primovacinação e sete anos após.
A quantificação de anticorpos totais contra o VHA usou a eletroquimoluminescência, por meio do kit comercial Elecsys Anti-VHA (Roche Diagnostics, Indianapolis, USA) sete anos após imunização primária. Amostras de plasma com concentração de anticorpos ≥20 mIU/mL foram considerados positivas e <20 mIU/mL foram considerados negativas. Foi feita nova dosagem de anticorpos para hepatite A pela técnica de eletroquimioluminescência nas amostras armazenadas referentes a 30 dias após a primovacinação (há sete anos).
Todos os pacientes com concentração de anticorpos < 20 mIU/mL para o VHA receberam duas doses da mesma vacina usada na primovacinação há sete anos (Havrix(r)), administrada por via intramuscular com intervalo de seis meses entre as doses.
A análise estatística para variáveis categóricas foi feita por meio do teste do qui-quadrado e as quantitativas pelo teste de Mann-Whitney. Os fatores associados à manutenção de anticorpos para hepatite A acima de 20 UI/mL foram analisados por meio de regressão logística uni e multivariada. Assim, na busca de possíveis fatores que pudessem diferenciar os pacientes do Grupo HIV que perderam a soropositividade para o VHA (anticorpos anti-VHA <20 mIU/mL) durante o período e aqueles que mantiveram a soropositividade, alguns eventos clínicos, virológicos e imunológicos foram avaliados. O cálculo da razão de chance (odds ratio) foi feito a partir da transformação logarítmica para as variáveis da contagem de linfócitos T CD4+, carga viral do HIV e quantificação de anticorpos para VHA. Considerando-se o tamanho da amostra (n total = 29), o modelo multivariado poderia ter, no máximo, duas variáveis explicativas, além da constante de ajuste do modelo. Dessa forma, para verificar qual (is) variável (is) mostrava(m)-se independentemente associada(s) à resposta, ajustaram-se modelos que continham no máximo duas das seguintes variáveis: contagem de linfócitos T CD4+ na primovacinação (CD4 PV), contagem de linfócitos T CD4+ sete anos após a primovacinação (CD4 sete anos pós-PV), carga viral sete anos após a primovacinação (CV sete anos pós-PV), episódio de herpes zoster e anticorpos para o vírus da hepatite A após a primovacinação (AC VHA pós-PV). As variáveis CV sete anos pós-PV e AC VHA pós-PV entraram no ajuste como numéricas, uma vez que, na análise univariada, CV sete anos pós-PV não produziu ajuste no odds ratio quando categorizada e AC VHA pós-PV apresentou grande variabilidade no intervalo de confiança quando categorizada. Adotou-se como estatisticamente significante p<0,05. A análise estatística foi feita com o Statistical Package for Social Science 16.0 (SPSS Inc. Chicago,IL, USA).
Resultados
Os dois grupos avaliados eram semelhantes quanto à idade, ao escore z E/I e ao escore z IMC (tabela 1). Todos os indivíduos do grupo ENI e 23/29 dos indivíduos do grupo HIV permaneceram soropositivos para hepatite A (anticorpos anti-HVA ≥20 mIU/mL) (tabela 1). A concentração de anticorpos contra VHA não apresentou diferença estatisticamente significativa entre os dois grupos sete anos após a imunização primária (Grupo HIV: 113,0 mIU/mL e Grupo ENI: 253,5 mIU/mL; Mann-Whitney, p=0,08). Ambos os grupos (HIV e ENI) apresentaram queda significativa da concentração de anticorpos contra o VHA nos sete anos após a primovacinação ( fig. 1).
Anticorpos contra hepatite A no Grupo HIV e no Grupo ENI 30 dias e sete anos após imunização primária.
Os seguintes eventos apresentaram diferença estatisticamente significativa entre os grupos na análise univariada: número de pacientes com herpes zoster, concentração de anticorpos um mês após a primovacinação, contagem de linfócitos T CD4+ na primovacinação e sete anos após (tabela 2). No modelo multivariado, a única variável que se mostrou independentemente associada à manutenção de anticorpos para hepatite A acima de 20 mUI/mL foi a concentração de anticorpos para hepatite A atingida um mês após a primovacinação, fosse ela avaliada quantitativamente ou de forma categorizada (anticorpos acima ou abaixo de 1.000 mUI/mL).
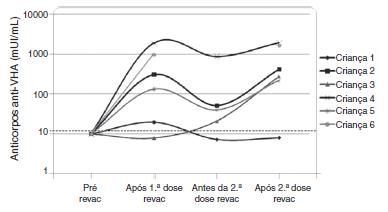
Os seis pacientes que perderam a soropositividade para o VHA foram revacinados com duas doses da vacina contra hepatite A (Havrix(r)) e cinco responderam com concentrações de anticorpos acima de 20 mUI/mL. A concentração de anticorpos contra o VHA está apresentada na figura 2 nos seguintes momentos: um mês após a 1a dose da revacinação, imediatamente antes da 2a dose de revacinação e um mês após a 2a dose de revacinação.
Dinâmica dos níveis plasmáticos dos anticorpos contra hepatite A após a revacinação nos seis pacientes do grupo HIV sem níveis protetores de anticorpos sete anos após a imunização primária. Observação: a amostra da criança 6 imediatamente antes da 2ª dose de revacinação foi perdida.
A tabela 3 e as Figura 3 and Figura 4 mostram aspectos clínicos, virológicos e imunológicos dos pacientes que perderam a soropositividade para hepatite A nesse período de sete anos de acompanhamento.
Manifestações clínicas apresentadas pelas crianças que não mantiveram níveis de anticorpos protetores para hepatite A sete anos após a vacinação
Evolução da carga viral, em quatro momentos: 30 dias após vacinação primária (VP), sete anos após VP, imediatamente antes da 1a e da 2a doses da revacinação (revac) nos seis pacientes do grupo HIV que não responderam à revacinação.
Evolução da contagem de células T CD4+ em quatro momentos: 30 dias após vacinação primária (VP), sete anos após VP, imediatamente antes da 1a e da 2a doses da revacinação (revac) nos seis pacientes do grupo HIV que não responderam à revacinação.
Discussão
A vacina contra o VHA é reconhecida como altamente imunogênica em indivíduos saudáveis.1111 Abarca K, Ibánez I, Perret C, Vial P, Zinsou JA. Immunogenicity, safety, and interchangeability of two inactivated hepatitis A vaccines in Chilean children. Int J Infect Dis. 2008;12:270-7. and 1212 Bell BP, Negus S, Fiore AE, Plotnik J, Dhotre KB, Williams J, et al. Immunogenicity of an inactivated hepatitis A vaccine in infants and young children. Pediatr Infect Dis J. 2007;26:116-22. Além disso, os níveis séricos de anticorpos permanecem por longos períodos após a vacinação. Bian et al., em 2010, na China, ao avaliar 110 crianças saudáveis vacinadas contra o VHA, obtiveram média geométrica de 61,6 mIU/mL de anticorpos, com persistência de anticorpos em 99,1% de indivíduos, decorridos 10 anos do esquema de imunização.1313 Bian GL, Ma R, Dong HJ, Ni HX, Hu FJ, Chen YR, et al. Long-term clinical observation of the immunogenicity of inactivated hepatitis A vaccine in children. Vaccine. 2010;28:4798-801.
Neste estudo, observamos que 79% dos adolescentes e das crianças infectadas pelo HIV por transmissão vertical mantiveram a soropositividade contra o VHA, decorridos sete anos do esquema de imunização primária com duas doses da vacina. Esses resultados foram semelhantes, do ponto de vista estatístico, quando comparados com os do grupo de dez adolescentes expostos e não infectados pelo HIV, em que 100% mantiveram soropositividade para o VHA (qui-quadrado, p=0,174) ( tabela 1). Também não se observou diferença estatística entre a mediana dos níveis de anticorpos dos dois grupos sete anos após a vacinação primária ( fig. 1). A impossibilidade de avaliar todas as crianças imunizadas no estudo anterior 7 pode ter sido responsável pela ausência de significância estatística entre os dois grupos (erro tipo II ou erro ß). Entretanto, vale a pena ressaltar que, para o modelo final (aquele que apresentou apenas AC VHA pós-PV), o poder obtido, fixando-se a em 5%, foi de 98,6%. Isso indica que esse modelo teve alta probabilidade de detectar uma real diferença entre os grupos.
Outros grupos avaliaram a persistência de anticorpos contra o VHA por períodos menores do que o analisado no presente estudo e incluíram pacientes com imunossupressão grave. Rigaud et al.,1414 Rigaud M, Borkowsky W, Muresan P, Weinberg A, Larussa P, Fenton T, et al. Impaired immunity to recall antigens and neoantigens in severely immunocompromised children and adolescents during the first year of effective highly active antiretroviral therapy. J Infect Dis. 2008;198:1123-30. em 2008, obtiveram 72% de soroconversão após quatro semanas da vacinação, com queda para 66% na semana 52. Weinberg et al.,1515 Weinberg A, Huang S, Fenton T, Patterson-Bartlett J, Gona P, Read JS, et al. Virologic and immunologic correlates with the magnitude of antibody responses to the hepatitis A vaccine in HIV-infected children on highly active antiretroviral treatment. J Acquir Immune Defic Syndr. 2009;52:17-24. em 2009, mostraram soroconversão de 97% na semana oito após a vacinação, com queda para 90% 18 meses depois. O grupo de pacientes infectados pelo HIV aqui estudado mostrou queda de 100% para 79% no percentual de indivíduos com concentração de anticorpos ≥20 mIU/mL para o VHA em sete anos. Há evidências de queda dos níveis de anticorpos vacinais para outros antígenos na população de crianças infectadas pelo HIV,33 Sutcliffe CG, Moss WJ. Do children infected with HIV receiving Haart need to be revaccinated? Lancet Infect Dis. 2010;10:630-42. mesmo quando em terapia antirretroviral e revacinadas.166 Gallego M, Robles M, Palacios R, Ruiz J, Nuño E, Márquez M, et al. Impact of acute hepatitis A virus (HAV) infection on HIV Viral Load in HIV-Infected patients and influence of HIV infection on acute HAV infection. J Int Assoc Physicians Aids Care (Chic). 2011;10:40-2. A proporção de crianças infectadas pelo HIV imunes caiu de 88% para 85% no caso do sarampo, de 84% para 61% no caso da caxumba e de 100% para 79% no caso da rubéola, três anos após a revacinação.1616 Aurpibul L, Puthanakit T, Sirisanthana T, Sirisanthana V. Persistence of measles, mumps, and rubella protective antibodies 3 years after revaccination in HIV-infected children receiving antiretroviral therapy. Clin Infect Dis. 2010;50:1415-8. Choudhury e Matin,1717 Choudhury SA, Matin F. Subnormal and waning immunity to tetanus toxoid in previously vaccinated HIV-infected children and response to booster doses of the vaccine. Int J Infect Dis. 2013;17:e1249-51. em 2013, avaliaram a persistência de anticorpos para toxoide tetânico em 24 crianças infectadas pelo HIV e observaram níveis acima de >0,1 UI/mL em 62% das crianças infectadas e 100% dos controles. Esses autores ainda demonstraram que 71% responderam à revacinação com níveis maiores do que 0,16 UI/mL. Salientaram que crianças infectadas pelo HIV necessitam de dose de reforço de toxoide tetânico antes do tempo preconizado, que é de cinco a 10 anos.
Vários fatores parecem estar implicados na resposta à vacinação e na manutenção da soropositividade de anticorpos em indivíduos infectados pelo HIV. O estado imunológico1818 Kosalaraksa P, Srirompotong U, Newman RW, Lumbiganon P, Wood JM. Serological response to trivalent inactive influenza vaccine in HIV-infected children with different immunologic status. Vaccine. 2011;29:3055-60. and 1919 Kourkounti S, Papaizos V, Leuow K, Kordosis T, Antoniou C, Hepatitis A. Vaccination and immunological parameters in HIV-infected patients. Viral Immunol. 2013;26:357-63. e a carga viral do HIV2020 Overton ET, Nurutdinova D, Sungkanuparph S, Seyfried W, Groger RK, Powderly WG. Predictors of immunity after hepatitis A vaccination in HIV-infected persons. J Viral Hepat. 2007;14:189-93. no momento da vacinação são reconhecidamente importantes. Da mesma forma, a evolução clínica, imunológica e virológica2121 Crum-Cianflone NF, Wilkins K, Lee AW, Grosso A, Landrum ML, Weintrob A, et al. Long-term durability of immune responses after hepatitis A vaccination among HIV-infected adults. J Infect Dis. 2011;203:1815-23. deve influenciar a manutenção dos níveis de anticorpos vacinais. A presença de coinfecção, como hepatite C, e o sexo masculino foram associados com menor resposta à vacina de hepatite A em pacientes adultos infectados pelo HIV.2222 Mena G, García-Basteiro AL, Llupià A, Díez C, Costa J, Gatell JM, et al. Factors associated with the immune response to hepatitis A vaccination in HIV-infected patients in the era of highly active antiretroviral therapy. Vaccine. 2013;31:3668-74. A manutenção de anticorpos específicos contra antígenos vacinais está relacionada à melhor maturação e preservação do compartimento de células B de memória, quando se inicia a terapia antirretroviral combinada precocemente em crianças.2323 Pensieroso S, Cagigi A, Palma P, Nilsson A, Capponi C, Freda E, et al. Timing of Haart defines the integrity of memory B cells and the longevity of humoral responses in HIV-1 vertically-infected children. Proc Natl Acad Sci USA. 2009;106:7939-44. No estudo atual, as crianças que perderam os anticorpos para hepatite A iniciaram a terapia antirretroviral mais tardiamente, embora esse dado não tenha sido estatisticamente significativo (p=0,19).
A progressão da doença causada pelo HIV ocorre mesmo em pacientes que recebem terapia antirretroviral e fazem seguimento clínico rigoroso. Os seis pacientes que perderam a soropositividade para o VHA foram os que mais apresentaram comprometimento clínico e imunológico no período e apenas 50% deles recebiam terapia antirretroviral, embora todos tivessem indicação de tratamento. Salienta-se que, ao longo desses sete anos, os seguintes dados foram observados (fig. 3): a) A carga viral aumentou nos pacientes 1 e 2; b) Quatro pacientes (1,3,5 e 6) apresentaram progressão clínica da doença, o que agravou sua categoria clínica (CDC-1994); c) Quatro pacientes (1,2,5 e 6) apresentaram pioria da imunossupressão, o que agravou sua categoria imunológica (CDC-1994); d) Os pacientes (2,4 e 6), que apresentaram as mais altas concentração de anticorpos para o VHA após a revacinação, foram os que tinham maior contagem de células T CD4+ na época da imunização primária (fig. 4). O único paciente que não respondeu à revacinação (paciente 1 na fig. 4) foi o que apresentou mais intercorrências clínicas, com comprometimento nutricional importante, queda do zIMC e comprometimento imunológico no período após vacinação. Interessante observar que, no momento da 1ª dose de revacinação, esse adolescente apresentava carga viral indetectável, respondeu com concentração de anticorpos 19,7 mUI/mL para o VHA. À medida que apresentou evidências de replicação viral do HIV, os títulos de anticorpos para o VHA voltaram a cair (fig. 2), mesmo após receber uma 2a dose da revacinação e apresentar elevação da contagem de células T CD4+ (de 65 células/mm3 para 285 células/mm3 no período entre a 1a e a 2a doses da revacinação).
O pequeno número de sujeitos na amostra, particularmente no Grupo ENI, que caracteristicamente abandona o acompanhamento logo após definir sua situação de não infectados, e a grande variabilidade dos dados podem ter comprometido a análise estatística de nossos achados. Mesmo assim, foi possível demonstrar a importância do monitoramento temporal da concentração de anticorpos após vacina de hepatite A nos pacientes infectados pelo HIV. Embora todos os adolescentes expostos e não infectados pelo HIV tenham mantido soropositividade para o VHA, 21% dos adolescentes infectados pelo HIV perderam a soropositividade para hepatite A sete anos após a imunização primária, particularmente aqueles que apresentaram mais intercorrências clínicas e imunossupressão mais acentuada. É encorajador, entretanto, verificar que a revacinação determina resposta de produção de anticorpos em níveis superiores a 20 mUI/mL na maioria dos pacientes estudados. Vale ressaltar que não foram identificados, na literatura, outros estudos que tenham avaliado a relação entre títulos pós-vacinais de anticorpos e sua persistência em longo prazo, nem a possível relação entre eventos clínicos e manutenção desses anticorpos.
Para manter a proteção contra hepatite B há recomendações nacionais2424 Brasil Ministério da Saúde. Secretaria de Vigilância em Saúde departamento de vigilância epidemiol6gica. Manual dos centros de referencia para imunobiol6gicos especiais. 3rd ed. Brasília: Ministério de Saúde; 2006. e internacionais2525 American Academy of Pediatrics. Hepatitis B. In: Pickering LK, Backer CJ, Kimbelin DW, Long SS, editors. Red book: report of the committee on infectious disease. Elk Grove Village: American Academy of Pediatrics; 2012. p. 369-90. de revacinar indivíduos imunossuprimidos que perderam seus anticorpos. Essa recomendação ainda não existe em relação à hepatite A, mas os dados aqui apresentados sugerem que, para crianças e adolescentes infectados pelo HIV, o acompanhamento da titulação dos anticorpos é necessário e a revacinação é desejável para manter níveis protetores de anticorpos. Sabe-se que pacientes infectados pelo HIV devem ser vacinados o mais precocemente possível, em um momento em que ainda não tenham comprometimento imunológico. Pode-se concluir, com base na análise multivariada aqui apresentada, que os níveis de anticorpos para hepatite A na primovacinação constituem o único fator independentemente associado à manutenção desses anticorpos decorridos sete anos. Essa associação também foi vista por Sharapov et al.2626 Sharapov UM, Bulkow LR, Negus SE, Spradling PR, Homan C, Drobeniuc J, et al. Persistence of Hepatitis A vaccine induced seropositivity in infants and young children by maternal antibody status: 10-year follow-up. Hepatology. 2012;56:516-22. Uma resposta menos intensa na primovacinação sugere um comprometimento imunológico já nesse momento. Apesar disso, 83,3% dos pacientes soronegativos para hepatite A responderam à revacinação, embora o tempo de duração desses anticorpos seja algo a ser estudado futuramente.
Agradecimentos
À Professora Adriana Sanudo pela contribuição na análise estatística.
References
-
1Brady MT, Oleske JM, Williams PL, Elgie C, Mofenson LM, Dankner WM, et al. Declines in mortality rates and changes in causes of death in HIV-1-infected children during the HAART era. J Acquir Immune Defic Syndr. 2010;53:86-94.
-
2Matida LH, Ramos AN Jr, Heukelbach J, Hearst N, Brazilian Study Group on Survival of Children with Aids. Continuing improvement in survival for children with acquired immunodeficiency syndrome in Brazil. Pediatr Infect Dis J. 2009;28:920-2.
-
3Sutcliffe CG, Moss WJ. Do children infected with HIV receiving Haart need to be revaccinated? Lancet Infect Dis. 2010;10:630-42.
-
4Costa-Mattioli M, Allavena C, Poirier AS, Billaudel S, Raffi F, Ferré V. Prolonged hepatitis A infection in an HIV-1 seropositive patient. J Med Virol. 2002;68:7-11.
-
5Ridolfo AL, Rusconi S, Antinori S, Balotta C, Galli M. Persisting HIV-1 replication triggered by acute hepatitis A virus infection. Antivir Ther. 2000;5:15-7.
-
6Gallego M, Robles M, Palacios R, Ruiz J, Nuño E, Márquez M, et al. Impact of acute hepatitis A virus (HAV) infection on HIV Viral Load in HIV-Infected patients and influence of HIV infection on acute HAV infection. J Int Assoc Physicians Aids Care (Chic). 2011;10:40-2.
-
7Gouvea AF, De Moraes-Pinto MI, Ono E, Dinelli MI, Machado DM, Weckx LY, et al. Immunogenicity and tolerability of hepatitis A vaccine in HIV-infected children. Clin Infect Dis. 2005;41:544-8.
-
8Gouvea AF, Moraes-Pinto MI, Machado DM, Carmo FB, Beltrao SC, Cunegundes KS, et al. The prevalence of hepatitis A antibodies in HIV exposed and/or infected children and adolescents. J Pediatr (Rio J). 2005;81:205-8.
-
9Centers for Disease Control and Prevention. Revised classification system for human immunodeficiency virus infection in children less than 13 years of age. MMWR. 1994;43:1-10.
-
10World Health Organization. The WHO child growth standards. Growth reference data for 5-19 years. Geneva: WHO; 2007.
-
11Abarca K, Ibánez I, Perret C, Vial P, Zinsou JA. Immunogenicity, safety, and interchangeability of two inactivated hepatitis A vaccines in Chilean children. Int J Infect Dis. 2008;12:270-7.
-
12Bell BP, Negus S, Fiore AE, Plotnik J, Dhotre KB, Williams J, et al. Immunogenicity of an inactivated hepatitis A vaccine in infants and young children. Pediatr Infect Dis J. 2007;26:116-22.
-
13Bian GL, Ma R, Dong HJ, Ni HX, Hu FJ, Chen YR, et al. Long-term clinical observation of the immunogenicity of inactivated hepatitis A vaccine in children. Vaccine. 2010;28:4798-801.
-
14Rigaud M, Borkowsky W, Muresan P, Weinberg A, Larussa P, Fenton T, et al. Impaired immunity to recall antigens and neoantigens in severely immunocompromised children and adolescents during the first year of effective highly active antiretroviral therapy. J Infect Dis. 2008;198:1123-30.
-
15Weinberg A, Huang S, Fenton T, Patterson-Bartlett J, Gona P, Read JS, et al. Virologic and immunologic correlates with the magnitude of antibody responses to the hepatitis A vaccine in HIV-infected children on highly active antiretroviral treatment. J Acquir Immune Defic Syndr. 2009;52:17-24.
-
16Aurpibul L, Puthanakit T, Sirisanthana T, Sirisanthana V. Persistence of measles, mumps, and rubella protective antibodies 3 years after revaccination in HIV-infected children receiving antiretroviral therapy. Clin Infect Dis. 2010;50:1415-8.
-
17Choudhury SA, Matin F. Subnormal and waning immunity to tetanus toxoid in previously vaccinated HIV-infected children and response to booster doses of the vaccine. Int J Infect Dis. 2013;17:e1249-51.
-
18Kosalaraksa P, Srirompotong U, Newman RW, Lumbiganon P, Wood JM. Serological response to trivalent inactive influenza vaccine in HIV-infected children with different immunologic status. Vaccine. 2011;29:3055-60.
-
19Kourkounti S, Papaizos V, Leuow K, Kordosis T, Antoniou C, Hepatitis A. Vaccination and immunological parameters in HIV-infected patients. Viral Immunol. 2013;26:357-63.
-
20Overton ET, Nurutdinova D, Sungkanuparph S, Seyfried W, Groger RK, Powderly WG. Predictors of immunity after hepatitis A vaccination in HIV-infected persons. J Viral Hepat. 2007;14:189-93.
-
21Crum-Cianflone NF, Wilkins K, Lee AW, Grosso A, Landrum ML, Weintrob A, et al. Long-term durability of immune responses after hepatitis A vaccination among HIV-infected adults. J Infect Dis. 2011;203:1815-23.
-
22Mena G, García-Basteiro AL, Llupià A, Díez C, Costa J, Gatell JM, et al. Factors associated with the immune response to hepatitis A vaccination in HIV-infected patients in the era of highly active antiretroviral therapy. Vaccine. 2013;31:3668-74.
-
23Pensieroso S, Cagigi A, Palma P, Nilsson A, Capponi C, Freda E, et al. Timing of Haart defines the integrity of memory B cells and the longevity of humoral responses in HIV-1 vertically-infected children. Proc Natl Acad Sci USA. 2009;106:7939-44.
-
24Brasil Ministério da Saúde. Secretaria de Vigilância em Saúde departamento de vigilância epidemiol6gica. Manual dos centros de referencia para imunobiol6gicos especiais. 3rd ed. Brasília: Ministério de Saúde; 2006.
-
25American Academy of Pediatrics. Hepatitis B. In: Pickering LK, Backer CJ, Kimbelin DW, Long SS, editors. Red book: report of the committee on infectious disease. Elk Grove Village: American Academy of Pediatrics; 2012. p. 369-90.
-
26Sharapov UM, Bulkow LR, Negus SE, Spradling PR, Homan C, Drobeniuc J, et al. Persistence of Hepatitis A vaccine induced seropositivity in infants and young children by maternal antibody status: 10-year follow-up. Hepatology. 2012;56:516-22.
-
Financiamento Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp), Brasil 09/17275-7 Auxílio à Pesquisa.
Datas de Publicação
-
Publicação nesta coleção
Apr-Jun 2015
Histórico
-
Recebido
08 Maio 2014 -
Aceito
25 Set 2014