Resumos
O diagnóstico parasitológico deve ser realizado de maneira apropriada, com maior sensibilidade e especificidade para a detecção dos parasitas intestinais, uma vez que dele dependerá o tratamento específico. Foi desenvolvido um estudo comparativo para avaliar a concordância entre os métodos Kato-Katz e coprotest® na detecção de helmintos em 332 indivíduos do município de Pedro de Toledo. Destacou-se uma diferença significativa para Trichuris trichiura, 16,2% no Kato-Katz e 7,5% no coprotest®. Devido a essa diferença compararam-se amostras positivas e negativas do método de coprotest® com número de ovos por grama de fezes (opg) obtido pelo método de Kato-Katz. Quando o método de coprotest® era negativo, contaram-se 65 opg de Trichuris trichiura pelo Kato-Katz e quando o coprotest® era positivo, esse número foi maior, 199 opg. O coprotest® mostrou-se inferior ao Kato-Katz nas infecções de baixa carga parasitária.
Parasitas intestinais; Diagnóstico; Técnicas parasitológicas
Parasitological diagnosis should be appropriately conducted with high sensitivity and specificity so that intestinal parasite can be detected as the specific treatment depends on this result. A comparative study was developed to evaluate the concordance between the Kato-Katz and coprotest® methods in the detection of helminthes in 332 individuals in Pedro de Toledo. A significant difference was found in the case of the Trichuris trichiura - 16.2% with the Kato-Katz method and 7.5% with the coprotest® method. Therefore, the positive and negative samples of the coprotest® method were compared with the number of eggs per gram of feces (epg) obtained by the Kato-Katz method. When the coprotest® method was negative, 65 epg of Trichuris trichiura were found by the Kato-Katz method and when the coprotest® was positive the epg according to the Kato-Katz were far higher, 199 epg, which demonstrated that the coprotest® was inferior to the Kato-Katz method regarding low intensity infections.
Intestinal parasites; Diagnosis; Parasitological techniques
ARTIGO ARTICLE
Estudo comparativo de técnicas parasitológicas: Kato-Katz e coprotest®
A comparative study of the parasitological techniques: Kato-Katz and coprotest®
Célia Regina MendesI; Angela Terezinha Lauand Sampaio TeixeiraII; Rosana Aparecida Trevisan PereiraII; Luis Candido de Souza DiasI
IFaculdade de Ciências Médicas da Universidade Estadual de Campinas, Campinas, SP
IIHospital de Clínicas da Universidade Estadual de Campinas, Campinas, SP
Endereço para correspondência Endereço para correspondência Dra. Célia Regina Mendes R. Buarque de Macedo 358/24 13075-000 Campinas, SP Tel: 55 19 3212-3443 e-mail: biomendes1968@hotmail.com
RESUMO
O diagnóstico parasitológico deve ser realizado de maneira apropriada, com maior sensibilidade e especificidade para a detecção dos parasitas intestinais, uma vez que dele dependerá o tratamento específico. Foi desenvolvido um estudo comparativo para avaliar a concordância entre os métodos Kato-Katz e coprotest® na detecção de helmintos em 332 indivíduos do município de Pedro de Toledo. Destacou-se uma diferença significativa para Trichuris trichiura, 16,2% no Kato-Katz e 7,5% no coprotest®. Devido a essa diferença compararam-se amostras positivas e negativas do método de coprotest® com número de ovos por grama de fezes (opg) obtido pelo método de Kato-Katz. Quando o método de coprotest® era negativo, contaram-se 65 opg de Trichuris trichiura pelo Kato-Katz e quando o coprotest® era positivo, esse número foi maior, 199 opg. O coprotest® mostrou-se inferior ao Kato-Katz nas infecções de baixa carga parasitária.
Palavras-chaves: Parasitas intestinais. Diagnóstico. Técnicas parasitológicas.
ABSTRACT
Parasitological diagnosis should be appropriately conducted with high sensitivity and specificity so that intestinal parasite can be detected as the specific treatment depends on this result. A comparative study was developed to evaluate the concordance between the Kato-Katz and coprotest® methods in the detection of helminthes in 332 individuals in Pedro de Toledo. A significant difference was found in the case of the Trichuris trichiura - 16.2% with the Kato-Katz method and 7.5% with the coprotest® method. Therefore, the positive and negative samples of the coprotest® method were compared with the number of eggs per gram of feces (epg) obtained by the Kato-Katz method. When the coprotest® method was negative, 65 epg of Trichuris trichiura were found by the Kato-Katz method and when the coprotest® was positive the epg according to the Kato-Katz were far higher, 199 epg, which demonstrated that the coprotest® was inferior to the Kato-Katz method regarding low intensity infections.
Key-words: Intestinal parasites. Diagnosis. Parasitological techniques.
Em laboratório de rotina é importante fazer mais de um método de concentração para detectar as formas parasitárias de protozoários e helmintos, principalmente quando há uma baixa carga parasitária. Outros métodos seriam específicos em função da suspeita clínica, como por exemplo, o de Rugai na vigência de estrongiloidíase e o de Willis para ancilostomíase3.
O método de coprotest®2, modificação do método de Ritchie9 é uma associação das técnicas de centrifugação e sedimentação, podendo ser detectados ovos e larvas de helmintos e cistos, oocistos de protozoários.
Kato-Katz é um método qualiquantitativo, muito usado para o diagnóstico de helmintos. Alguns helmintos como Schistosoma mansoni, Ascaris lumbricoides, Trichuris trichiura e ancilostomatídeos podem ter sua carga parasitária avaliada8.
O presente trabalho propõe comparar a sensibilidade, especificidade, valores preditivos e concordância (coeficiente Kappa) entre os métodos parasitológicos Kato-Katz e coprotest®.
MATERIAL E MÉTODOS
Este estudo foi realizado em amostras de fezes coletadas no município de Pedro de Toledo, no Vale do Ribeira, Estado de São Paulo, no período de 1999 a 2000.
Técnica de Kato-Katz. Foi utilizado o método de Kato et al8. As fezes foram coletadas no campo (Pedro de Toledo), a fresco, em coletor universal e processadas dentro de 24 horas. Foram realizadas 3 lâminas por paciente. Todo o material foi examinado ao microscópio e feita a contagem dos ovos.
Técnica de coprotest®. As fezes foram coletadas no campo, a fresco, em coletor universal. O processamento desta técnica foi realizado de acordo com as instruções do fabricante (NL-Comércio Exterior Ltda SP Brasil). Para cada paciente realizou-se a leitura de 3 lâminas.
Análise estatística. Utilizou-se programa Epi-Info, da Organização Mundial de Saúde4. Verificou-se a relação entre os métodos para cada parasita, utilizando-se tabelas de dupla entrada para cruzamento dos resultados com o respectivo padrão-ouro6. Por meio dessas tabelas, obtiveram-se as seguintes medidas: sensibilidade, especificidade, valores preditivos positivo e negativo e coeficiente Kappa, também conhecido como coeficiente de correlação intraclasse.
RESULTADOS
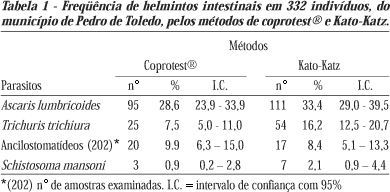
Foram recebidas amostras de fezes de 332 indivíduos do município de Pedro de Toledo, SP (Tabela 1).
Dentre as 332 amostras, fez-se uma comparação dos métodos coprotest® e Kato-Katz para helmintos (Tabela 1) e para os ancilostomatídeos foi possível comparar somente 202 amostras. Destaca-se diferença estatisticamente significativa, com intervalo de confiança com 95%, na taxa de infecção de T. trichiura pelos métodos de Kato-Katz (16,2%) e coprotest® (7,5%).
Adotando-se o método de Kato-Katz como padrão, calcularam-se as medidas de exatidão com relação ao coprotest® para helmintos intestinais (Tabela 2). As medidas de exatidão para A. lumbricoides foram bastante concordantes entre as duas técnicas (Kappa de 0,81). Deve-se ter a precaução ao se analisar o baixo Kappa para S. mansoni (Kappa de 0,39), uma vez que foram analisados apenas 7 indivíduos infectados.
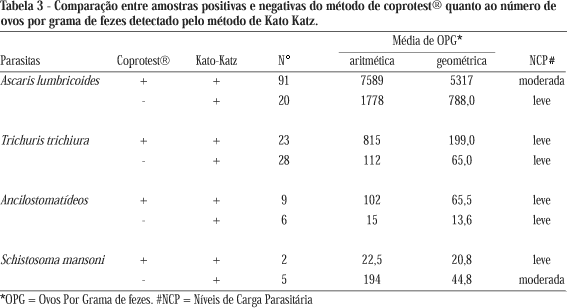
Devido à discrepância das percentagens observadas em indivíduos parasitados por Trichuris trichiura, 7,5% pelo coprotest® e 16,2% pelo Kato-Katz (Tabela 1), comparou-se amostras positivas e negativas do método de coprotest® (método qualitativo) com o número de ovos por grama de fezes obtido pelo método de Kato-Katz (Tabela 3). Quando o método de coprotest® foi negativo, o número de ovos por grama de fezes pelo Kato-Katz foi menor (65) e quando o coprotest® foi positivo, o número de ovos por grama de fezes pelo Kato-Katz foi maior (199).
DISCUSSÃO
A aplicação de diferentes métodos de exame de fezes torna-se necessária tendo em vista a variabilidade morfológica e biológica apresentada pelos parasitas. Ao compararmos os métodos coprotest® e Kato-Katz (Tabela 1), usou-se o método de Kato-Katz como padrão, uma vez que o kit comercial coprotest® foi recentemente lançado no mercado e era de nosso interesse avaliar seu desempenho, comparando-o com técnicas já usadas em laboratórios de Patologia Clínica.
Ao compararmos os métodos de Kato-Katz e coprotest® para ancilostomatídeos, constatamos que o índice Kappa foi de apenas 0,43, indicando uma baixa concordância (Tabela 2). Quando ambos os métodos foram positivos (Tabela 3), a média geométrica de ovos por grama de fezes para Kato-Katz foi maior (65,5 opg) e quando o coprotest® foi negativo e Kato-Katz positivo, essa média foi menor (13,6 opg). Nesse caso, o resultado foi dependente da quantidade de ovos na amostragem analisada.
Da mesma forma, foi constatada a diferença na taxa de infecção por T. trichiura em relação as mesmas técnicas (Kato-Katz 16,6% e coprotest® 7,5%) (Tabela 1). Com relação às medidas de exatidão entre os dois métodos (Tabela 2), obteve-se um Kappa intermediário de 0,54. Ao avaliarmos a intensidade de infecção (Tabela 3) foi verificado para T. trichiura que quando o método de coprotest® foi negativo e Kato-Katz positivo (Tabela 3), a média geométrica do número de ovos por grama de fezes para o método Kato-Katz foi menor (65 opg) e quando ambos foram positivos a média geométrica de ovos por grama de fezes para o método Kato-Katz foi maior (199 opg). Quando a carga parasitária para o método de Kato-Katz foi baixa, o método de coprotest® foi negativo (Tabela 3).
Para os ancilostomatídeos, foi possível comparar somente 202 amostras devido ao tempo transcorrido entre a preparação das lâminas e sua leitura (Tabela 1). O método de Kato-Katz preconiza que para ancilostomatídeos as lâminas sejam lidas em até 2 horas após sua preparação, o que nem sempre foi possível.
Além da carga parasitária ser limitante no uso do coprotest®, outros aspectos merecem ser discutidos. Assim, apesar do uso de aproximadamente 140mg de fezes para o método de coprotest® e 129mg de fezes para o método de Kato-Katz (43mg por lâmina), este último mostrou-se mais sensível. No método de Kato-Katz as fezes são clarificadas sem qualquer diluição, enquanto no método de coprotest®, embora a quantidade de material seja um pouco maior, provavelmente perde-se parte do material e de formas parasitárias durante seu processamento, nas seguintes etapas: na diluição com formol a 10% em que se utiliza parte do material diluído (7ml); o uso do acetato de etila como desengordurante também favorece a perda do material fecal, visto que há a formação de uma camada sobrenadante de ±0,5cm de espessura, composta de restos fecais misturados com detritos de gordura que é sempre desprezada. O método de coprotest® utiliza fezes consistentes, pastosas, semipastosas e até mesmo líquidas. Os restos alimentares comuns ao método coprotest® não existem no método de Kato-Katz, pois só se analisa o material tamizado. No presente estudo, evitamos o uso de fezes diarréicas e mucosas, sendo analisadas apenas fezes formadas. Domingues et al5 obtiveram uma maior concentração e homogeneização no método de Kato-Katz, quando evitaram também alguns fatores que para eles levariam a resultados imprecisos, como por exemplo, fezes diarréicas, muco e resíduos. Portanto, quando estes interferentes são evitados, permite-se ao método, uma melhor homogeneidade, assim como uma maior concentração.
Araújo et al1 padronizaram metodologia que permitiu a quantificação de ovos de helmintos por meio do método de coprotest® e avaliaram a sua aplicabilidade em estudos epidemiológicos. Comparando-se os resultados qualitativos do coprotest® com os obtidos pelo método de Kato-Katz, os autores observaram uma boa concordância para S. mansoni, A. lumbricoides e T. trichiura. Quando o número de ovos por grama de fezes foi abaixo de 100, o coprotest® quantitativo foi inferior ao Kato-Katz. Essa limitação dos dois métodos em detectar ovos em amostras de indivíduos com baixa carga parasitária, pode levar a uma determinação subestimada da prevalência das parasitoses. O mesmo ocorreu no presente trabalho, pois quando as amostras foram positivas no Kato-Katz para T. trichiura e ancilostomatídeos e negativas para o método de coprotest®, a carga parasitária detectada no método de Kato-Katz foi mais baixa, 65 opg para T. trichiura e 13,6 opg para ancilostomatídeos. Por outro lado, quando ambos os métodos foram positivos, a carga parasitária foi maior, 199 opg para T. trichiura e 65,5 opg para ancilostomatídeos.
Por ter sido o coprotest® inferior ao Kato-Katz para detecção de T. trichiura, não é aconselhável usá-lo como único método de concentração em uma rotina laboratorial, quando as cargas parasitárias são baixas.
Recebido para publicação em 28/11/2003
Aceiro em 16/11/2004
Estudo aprovado pelo comitê de Ética da Faculdade de Ciências Médicas, da UNICAMP (Processo no. 57/2000).
- 1. Araújo AJVS, Kanamura HY, Dias LCS, Gomes JF, Araújo SM. Coprotestâ: quantificação de ovos de helmintos em amostras fecais utilizando-se sistema de diagnóstico comercial. Jornal Brasileiro de Patologia e Medicina Laboratorial 39: 115-124, 2003.
- 2. Cerqueira FL. Coprotest: Metodologia Confiável Para o Exame Parasitológico de Fezes. Laes 9( supl 51): 5-12, 1988.
- 3. De Carli GA. Parasitologia Clínica Seleção de Métodos e Técnicas de Laboratório para o Diagnóstico das Parasitoses Humanas. Editora Atheneu - São Paulo, Rio de Janeiro e Belo Horizonte, 2001.
- 4. Dean AG, Dean JA, Colulombier D, Brendel KA, Smith DC, Burtom AH, Dicker RC, Sullivan KM, Fargan RF, Arner TG. EpiInfo version 6: a word processing database, and statistics program for public health on IBM compatible microcomputer. Atlanta, Georgia, 1995.
- 5. Domingues L, Silveira M, Vanderlei MI, Kelner S 1980. Possíveis fatores que alteram os resultados da Coproscopia Quantitativa de Ovos de S. mansoni pelo método de Kato-Katz. Revista do Instituto de Medicina Tropical de São Paulo 22 (supl 3): 114-117, 2000.
- 6. Fleiss JL. Statistical Methods for Rates and Proportions. New York. John Wiley & Sons, 2nd edição, 1981.
- 7. Garcia LS. Diagnostic Medical Parasitology. Fourth Edition. ASM Press. Washington, DC. 2001,
- 8. Katz N, Chaves A, Pellegrino J. A simple device for quantitative stool thick-smear technique in Schistosomiasis mansoni. Revista do Instituto de Medicina Tropical de São Paulo 14 (supl 6): 397- 400, 1972.
- 9. Ritchie LS. An ether sedimentation technique for routine stool examination. Bulletin of the United States Army Medical Deparment 8: 326, 1948.
Datas de Publicação
-
Publicação nesta coleção
30 Mar 2005 -
Data do Fascículo
Abr 2005
Histórico
-
Recebido
28 Nov 2003 -
Aceito
16 Nov 2004