Resumos
O trabalho foi desenvolvido com o objetivo de se verificar a influência de Saccharomyces cerevisiae na forma de produto comercial, fermento biológico fresco para panificação, na atividade e no padrão eletroforético da peroxidase em folhas de milho e sorgo. As preparações de Saccharomyces utilizadas foram representadas por suspensões de células e seus respectivos filtrados, autoclavados ou não. A análise dos extratos obtidos dessas gramíneas mostrou que suspensões de células e os filtrados dessas suspensões, tratadas termicamente ou não, foram efetivos em ocasionar alterações na atividade e padrão eletroforético da peroxidase em milho e sorgo. Além de se mostrarem termoestáveis, os extratos obtidos de células intactas ou homogeneizadas de S. cerevisiae apresentaram baixa atividade de peroxidase, indicando que as alterações na atividade e perfil eletroforético da enzima nas plantas eram decorrentes do próprio tecido vegetal. Finalmente, os resultados sugerem que as alterações ocorridas com a peroxidase nas gramíneas estudadas, em resposta ao tratamento com S. cerevisiae, refletem o "reconhecimento" das células ou metabólitos da levedura por parte das plantas, acarretando uma alteração no metabolismo normal das mesmas.
Saccharomyces cerevisiae; peroxidase; eletroforese; milho; sorgo
The aim of this work was to test the effect of Saccharomyces cerevisiae, in a commercial baker's yeast form, on the activity and changes in the electrophoretic pattern of peroxidase in maize and sorghum leaves. The yeast treatment included spray of cell suspensions and their filtrates, autoclaved or not, which were able to cause changes in the peroxidase activity and electrophoretic pattern in maize and sorghum. Besides being thermostable, the extracts from intact or homogenized S. cerevisiae cells exhibited low peroxidase activity, indicating that the changes in the enzyme, activity and pattern, were due only to the plant tissue. Finally, the results suggest that the changes in peroxidase in maize and sorghum leaves in response to the treatment with S. cerevisiae, indicate a possible recognition of the yeast cells or their metabolites by these plants.
Saccharomyces cerevisiae; peroxidase; electrophoresis; maize; sorghum
ALTERAÇÕES NA ATIVIDADE E NO PERFIL ELETROFORÉTICO DA PEROXIDASE EM FOLHAS DE MILHO (Zea mays) E SORGO (Sorghum bicolor) TRATADAS COM LEVEDURA (Saccharomyces cerevisiae)
M.C. RONCATTO1,3; S.F. PASCHOLATI2
1Pós-Graduanda do Curso de Microbiogia Agrícola-ESALQ/USP.
2Depto. de Fitopatologia-ESALQ/USP, C.P. 9, CEP: 13418-900 - Piracicaba, SP.
3Bolsista CAPES.
RESUMO: O trabalho foi desenvolvido com o objetivo de se verificar a influência de Saccharomyces cerevisiae na forma de produto comercial, fermento biológico fresco para panificação, na atividade e no padrão eletroforético da peroxidase em folhas de milho e sorgo. As preparações de Saccharomyces utilizadas foram representadas por suspensões de células e seus respectivos filtrados, autoclavados ou não. A análise dos extratos obtidos dessas gramíneas mostrou que suspensões de células e os filtrados dessas suspensões, tratadas termicamente ou não, foram efetivos em ocasionar alterações na atividade e padrão eletroforético da peroxidase em milho e sorgo. Além de se mostrarem termoestáveis, os extratos obtidos de células intactas ou homogeneizadas de S. cerevisiae apresentaram baixa atividade de peroxidase, indicando que as alterações na atividade e perfil eletroforético da enzima nas plantas eram decorrentes do próprio tecido vegetal. Finalmente, os resultados sugerem que as alterações ocorridas com a peroxidase nas gramíneas estudadas, em resposta ao tratamento com S. cerevisiae, refletem o "reconhecimento" das células ou metabólitos da levedura por parte das plantas, acarretando uma alteração no metabolismo normal das mesmas.
Descritores: Saccharomyces cerevisiae, peroxidase, eletroforese, milho, sorgo
CHANGES IN ACTIVITY AND ELECTROPHORETIC PATTERN OF PEROXIDASE IN MAIZE (Zea mays) AND SORGHUM (Sorghum bicolor) LEAVES AFTER TREATMENT WITH YEAST (Saccharomyces cerevisiae)
ABSTRACT: The aim of this work was to test the effect of Saccharomyces cerevisiae, in a commercial baker's yeast form, on the activity and changes in the electrophoretic pattern of peroxidase in maize and sorghum leaves. The yeast treatment included spray of cell suspensions and their filtrates, autoclaved or not, which were able to cause changes in the peroxidase activity and electrophoretic pattern in maize and sorghum. Besides being thermostable, the extracts from intact or homogenized S. cerevisiae cells exhibited low peroxidase activity, indicating that the changes in the enzyme, activity and pattern, were due only to the plant tissue. Finally, the results suggest that the changes in peroxidase in maize and sorghum leaves in response to the treatment with S. cerevisiae, indicate a possible recognition of the yeast cells or their metabolites by these plants.
Key Words: Saccharomyces cerevisiae, peroxidase, electrophoresis, maize, sorghum
INTRODUÇÃO
A ativação dos mecanismos de resistência nas plantas pode se constituir em método prático para o controle das doenças vegetais (Ryals et al., 1996). Esses mecanismos, que podem ser bioquímicos e/ou estruturais, atuam de forma dinâmica e coordenada, permitindo que a planta se defenda do ataque dos patógenos (Pascholati & Leite, 1995).
A defesa ativa das plantas contra fitopatógenos pode envolver alterações na atividade de enzimas chaves no metabolismo primário e secundário (Leite & Pascholati, 1995; Pascholati & Leite, 1995). A peroxidase, presente nos tecidos das plantas, é uma enzima conhecida por participar de vários processos fisiológicos, incluindo a oxidação de compostos fenólicos e a biossíntese do hormônio vegetal etileno e lignina (Abeles & Biles, 1991; Asada, 1992; Gaspar et al., 1982). Alterações na sua atividade durante o desenvolvimento das doenças nas plantas tem sido correlacionadas com a expressão de resistência em diferentes sistemas patógeno-hospedeiro (Hammerschmidt et al., 1982; Oliveira et al., 1997).
As respostas de defesa podem ser induzidas por elicitores bióticos (preparações de microrganismos ou de plantas ) e abióticos (compostos orgânicos ou inorgânicos) (Leite et al., 1997). Os elicitores de origem microbiana (exógenos) podem ser representados por fungos, células bacterianas, partículas virais, homogenatos livres de células, etc. No caso dos elicitores endógenos, os mesmos são formados por fragmentos de material constituinte da parede celular da planta (oligogalacturonídeos), os quais são liberados pela ação de enzimas degradadoras da parede, produzidas por fungos e bactérias ou pelas próprias células danificadas da planta (Pascholati & Leite, 1995).
Vários trabalhos evidenciaram a capacidade da levedura Saccharomyces cerevisiae na proteção de plantas de alface, café, cevada, eucalipto, maracujá-azedo amarelo, milho e sorgo contra fitopatógenos (Martins, 1991; Piccinin, 1995; Silva & Pascholati, 1992; Reglinski et al., 1994, 1995; Stangarlin & Pascholati, 1994). A proteção se deve a mecanismos operando ao nível de pré e pós-penetração dos tecidos vegetais pelos patógenos (Silva & Pascholati, 1992; Piccinin, 1995), porém pouco se conhece a respeito dos mesmos.
Diante do exposto, para a elucidação dos mecanismos de ação de S. cerevisiae no fenômeno de proteção de plantas contra fitopatógenos, o presente trabalho procurou demonstrar a capacidade das preparações da levedura em alterar o metabolismo de plantas de milho e sorgo, com base na atividade da enzima peroxidase.
MATERIAL E MÉTODOS
O presente trabalho foi conduzido no laboratório de Fisiologia do Parasitismo e casa-de-vegetação do Departamento de Fitopatologia da Escola Superior de Agricultura "Luiz de Queiroz" ESALQ/USP, em Piracicaba, SP.
Foram utilizadas sementes de milho pipoca (Z. mays L.) cv. "South American Mushroom" (Sementes Selecionadas AD Ltda), AGX-7393 (Agroceres) e sementes de sorgo (Sorghum bicolor Moench.) cv. Brandes (CNMS/EMBRAPA de Sete Lagoas- MG). Para a obtenção das plântulas, as sementes foram semeadas em vasos de alumínio, com solo previamente esterilizado, os quais foram mantidos em casa-de-vegetação por 25-30 dias, ou seja até as plantas atingirem o estádio de 7a folha verdadeira.
As suspensões de levedura foram obtidas a partir do "Fermento Biológico Fresco Fleischmann" (Fleischmann Royal Jundiaí -SP), diluído em água destilada estéril (25mg/ml), autoclavadas (SA) ou não autoclavadas (S). Os filtrados das suspensões de células, autoclavados após a filtragem (FA) ou não autoclavados (F), foram obtidos pela filtragem através de membrana Millipore (0,45mm). Por sua vez, o tratamento FSA foi representado por filtrado de supensão de células autoclavadas, previamente a filtragem.
A aspersão das preparações de levedura foram feitas sobre as folhas com atomizador manual, sendo o tratamento controle representado por água destilada estéril. Após a aspersão, as plantas foram mantidas em fotoperíodo (14 horas luz), a temperatura de 28ºC, sob umidade relativa alta. As amostras dos tecidos de milho e sorgo, equivalente a 0,3g cada, foram retiradas durante diferentes intervalos de tempo e mantidas em congelador. A seguir, utilizando-se o método descrito por Cadena-Gomez & Nicholson (1987), com algumas modificações, as amostras congeladas foram homogeneizadas em 10 ml de tampão fosfato 0,01 M (pH 6,0) em aparelho Sorwall-Omni-mixer (1 min à velocidade máxima). O homogeneizado foi filtrado em papel de filtro comum e em seguida, centrifugado à 20.000g durante 25 min a 4°C, sendo o sobrenadante obtido considerado como extrato enzimático, para a deteminação da atividade da peroxidase e conteúdo proteico. Por outro lado, para a determinação da atividade da peroxidase e conteúdo proteico em células de S. cerevisiae, as suspensões foram homogeneizadas (células homogeneizadas - CH) ou não (células intactas - CI) em tampão fosfato 0,01M (pH 6,0), sendo centrifugadas a 20.000 g durante 25 min a 4°C, e o sobrenadante considerado como o extrato enzimático.
A atividade da peroxidase foi determinada à 30°C através de método espectrofotométrico direto, pela medida da conversão do guaicol em tetraguaiacol a 470 nm, como descrito por Hammerschmidt et al. (1982). A mistura da reação continha 0,1 ml do extrato proteico e 2,9 ml de uma solução com 250 ml de guaiacol e 306 ml de peróxido de hidrogênio em 100 ml de tampão fosfato 0,01M (pH 6,0). A cubeta de referência continha 3 ml da solução com 250 ml de guaiacol e 306 ml de peróxido de hidrogênio em 100 ml de tampão fosfato 0,01 M (pH 6,0). A atividade da peroxidase foi expressa como atividade específica (unidade de absorbância/min/mg proteina), sendo a determinação de proteínas efetuada de acordo com o método de Bradford (1976), tendo albumina de soro bovino (ASB) como padrão.
Amostras de tecido de milho e sorgo, coletadas 0 e 48 hs após o tratamento com as preparações de S. cerevisiae, foram submetidas ao mesmo processo de extração das peroxidases descrito acima. Os sobrenadantes foram colocados no interior de sacos de diálise (limite de exclusão molecular 12.000-16.000 daltons) e concentrados a 4°C com polietilenoglicol 20.000. Após 4-6 horas, os resíduos no interior dos sacos foram retomados em 1 ml de tampão de extração. As amostras tiveram a concentração proteica ajustada pelo método de Bradford (1976), tomando-se por base a amostra que apresentava menor quantidade de proteínas, sendo então submetidas a eletroforese nativa.
A eletroforese anódica em gel de poliacrilamida foi conduzida utilizando-se gel de poliacrilamida 4% (gel concentrador) e 10% (gel separador), tendo como tampão de corrida Tris-glicina pH 8,9 (0,75 g Tris + 3,6 g glicina em 1.000ml de água destilada) e azul de bromofenol a 0,25%, como corante de corrida. Após a aplicação das amostras (50 ml por pocinho), a placa foi mantida a 4°C sob voltagem constante de 80 V até o final da corrida, interrompendo-se a eletroforese quando o corante atingiu o final do gel. Para a visualização das bandas de peroxidase, como áreas de coloração marrom, foi utilizado o método descrito por Lusso (1989), com algumas modificações, usando-se solução contendo 250ml de guaiacol e 306 ml de peróxido de hidrogênio em 100 ml de tampão fosfato 0,01 M (pH 6,0). Após 30 min à temperatura ambiente, os géis foram lavados com água destilada e tratados com ácido acético 7% durante 15 minutos, sendo novamente lavados e armazenados em água destilada. A seguir, os géis foram fotografados e analisados em densitômetro a 405 nm, apenas para se identificar as bandas que representavam as isoenzimas.
RESULTADOS E DISCUSSÃO
Atividade da peroxidase: Quando folhas de milho foram tratadas com S. cerevisiae, as mesmas exibiram maior atividade de peroxidase 48 e 72 horas após o tratamento com suspensão (S) e filtrado de suspensão autoclavada (FSA), em relação ao tratamento controle com água ou suspensão de células autoclavadas (Figura 1). Por sua vez, a atividade da peroxidase em folhas de sorgo tratadas com as diferentes preparações de S. cerevisiae mostrou-se maior maior em todos os tratamentos e intervalos de tempos após 24 horas em relação ao tratamento controle (Figura 2).
- Atividade da peroxidase em extratos de folhas de milho (cv. AGX-7393), coletados até 72 horas após o tratamento com preparações de Saccharomyces cerevisiae ou aspersão com água destilada estéril (controle). Barras representam +/- erro padrão da média. Tratamentos: ¨ água; n suspensão; u suspensão autoclavada; x filtrado de suspensão autoclavada.
- Atividade da peroxidase em extratos de folhas de sorgo (cv. Brandes), coletados até 72 horas após o tratamento com Saccharomyces cerevisiae ou aspersão com água destilada estéril (controle). Barras representam +/- erro padrão da média. Tratamentos: ¨água; n suspensão; u suspensão autoclavada; x filtrado de suspensão autoclavada.
A atividade da peroxidase em extratos obtidos de células de S. cerevisiae intactas ou homogeneizadas, quando comparadas com a atividade da peroxidase em tecidos de milho e sorgo, foi baixa (Figura 3). Porém, as células homogeneizadas exibiram maior atividade da enzima em relação a suspensão com células intactas. Após 24 horas, observou-se uma diminuição da atividade da enzima em amostras obtidas de células intactas e homogeneizadas.
- Atividade da peroxidase em extratos obtidos de células de Saccharomyces cerevisiae intactas ou homogeneizadas. Barras representam +/- erro padrão da média. Tratamentos: células intactas;
Perfil eletroforético da peroxidase: O padrão isoenzimático de folhas de milho tratadas com preparações de S. cerevisiae comercial mostrou a presença de duas novas isoenzimas (2 e 3) em resposta aos tratamentos com suspensão (S) e suspensão autoclavada (SA), e o desaparecimento da isoenzima 1 no tratamento suspensão (S). Quanto a intensidade de coloração das bandas, aparentemente as isoenzimas 4, com valor de MR 0,14 a 0,15 nos tratamentos suspensão (S) e filtrado (F), exibiram maior intensidade de coloração em relação aos demais tratamentos (Figura 4).
- Diagrama da eletroforese anódica em gel de poliacrilamida de extratos de folhas de milho (cv. "South America Mushroon"), obtidos após 48 horas e tratados com Saccharomyces cerevisiae. Tratamentos: (C) controle-água; (S) suspensão; (SA) suspensão autoclavada; (F) filtrado; (FA) filtrado autoclavado. (IG) Interseção entre os géis concentrador e de corrida. Gel corado com guaiacol para a visualização de isoenzimas de peroxidase. Números correspondem as bandas individuais das isoenzimas. MR= mobilidade relativa.
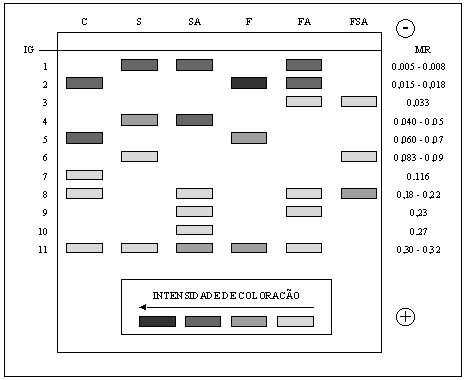
Amostras de folhas de sorgo tratadas com preparações de levedura, quando submetidas a eletroforese, evidenciaram em relação ao tratamento controle, a presença de três novas isoenzimas (1, 4 e 6) no tratamento suspensão (S), quatro (1, 4, 9 e 10) em suspensão autoclavada (SA), três (1, 3 e 9) em filtrado autoclavado (FA) e duas (3, 6) em filtrado de suspensão autoclavada (FSA) (Figura 5). Por sua vez, observou-se o desaparecimento de quatro isoenzimas (2, 5, 7 e 8) em suspensão (S), três (2, 5 e 7) em suspensão autoclavada (SA), duas (7, 8) em filtrado (F), duas (5, 7) em filtrado autoclavado (FA) e quatro (2, 5, 7 e 11) em filtrado de suspensão autoclavada (FSA). Quanto a coloração das bandas, as isoenzimas 1 e 4 (MR 0,005-0,008 e 0,040-0,05) não existentes no tratamento controle, exibiram a maior intensidade.
- Diagrama da eletroforese anódica em gel de poliacrilamida de extratos de folha de sorgo (cv. Brandes), obtidos após 48 horas e tratados com preparações de Saccharomyces cerevisiae. Tratamentos: (C) controle-água; (S) suspensão; (SA) suspensão autoclavada; (F) filtrado; (FA) filtrado autoclavado; (FSA) filtrado de suspensão autoclavada. (IG) Interseção entre os géis concentrador e de corrida. Gel corado com guaiacol para visualização de isoenzimas de peroxidase. Números correspondem as bandas individuais das isoenzimas. MR= mobilidade relativa.
Vários trabalhos relataram anteriormente o uso de preparações de S. cerevisiae na proteção de plantas contra fitopatógenos e a possível indução de mecanismos de resistência latentes (Martins, 1991; Reglinsk et al., 1994, 1995; Piccinin; 1995; Silva & Pascholati, 1992; Stangarlin & Pascholati, 1994). No presente trabalho, preparações de células da levedura ou seus filtrados, tratadas ou não termicamente, alteraram a atividade da peroxidase em tecidos de milho e sorgo. As alterações ocorridas na atividade da enzima nesses tecidos, quando do tratamento com S. cerevisiae, provavelmente deve-se ao fato da planta "reconhecer" a levedura ou seus metabólitos e portanto, alterar o metabolismo normal em resposta ao possível invasor. Pode-se verificar que, nem sempre a presença de células vivas de S. cerevisiae foi necessária para que ocorressem tais alterações, visto que os filtrados foram também efetivos. Além disso, células autoclavadas e filtrados autoclavados continuaram a exibir atividade biológica, demonstrando que os mesmos não são termolábeis. Mudanças na atividade da peroxidase em plantas inoculadas com microrganismos, quando comparadas com plantas não inoculadas, têm sido relatadas em várias interações patógeno-hospedeiro (Arora & Bajaj, 1985; Reuveni & Bothma, 1985).
Sendo a peroxidase encontrada em microrganismos (Hoagland, 1990), procurou-se avaliar a capacidade da S. cerevisiae em exibir atividade de peroxidase. Os ensaios mostraram uma baixa atividade da enzima em células intactas ou homogeneizadas, no período de 24 horas, indicando que a contribuição da levedura é quase desprezível no aumento da atividade peroxidativa no tecido tratado.
Quanto as isoperoxidases em tecidos de milho e sorgo tratados com S. cerevisiae, os resultados demonstram o aparecimento de novas bandas e o desaparecimento de algumas delas em relação ao controle. Diversos trabalhos relatam sobre o surgimento de novas isoperoxidases em tecidos vegetais em resposta tanto a inoculação com microrganismos, como a injúria mecânica (Cadena-Gomez & Nicholson, 1987; Van Loon, 1986).
Finalmente, com base nos resultados apresentados, pode-se sugerir que metabólitos produzidos pelas células de S. cerevisiae bem como componentes da parede celular da levedura, podem estar agindo como elicitores na alteração da atividade da peroxidase nos tecidos das gramíneas estudadas. Existe a possibilidade de que esta(s) substância (s) elicitoras(s) seja(m) polissacarídeos como glucanas e mananas, pois estes carboidratos são encontrados em grandes quantidades nas paredes celulares das leveduras ( Rose, 1993). A natureza química e o modo de ação desses metabólitos carecem de estudos posteriores.
CONCLUSÕES
- Preparações de células da levedura S. cerevisiae, obtidas de fermento biológico fresco, mostraram-se efetivas na alteração da atividade e padrão isoenzimático da peroxidase em folhas de milho e sorgo;
- A presença de células da levedura mostrou-se desnecessária para que as alterações enzimáticas ocorressem, uma vez que os filtrados das suspensões também mostraram-se efetivos;
- Os metabólitos de S. cerevisiae mostraram-se termoestáveis, em função da manutenção da atividade biológica.
Recebido para publicação em 27.10.97
Aceito para publicação em 31.03.98
- ABELES, F.B.; BILES, C. L. Characterization of peroxidases in lignifing peach fruit endocarp. Plant Physiology, v.95, p.269-273, 1991.
- ARORA, Y.K.; BAJAJ, K.L. Peroxidase and polyphenol oxidase associated with induced resistance of mung bean to Rhizoctonia solani Kuhn. Phytopathologische Zeitschrift, v.114, p.325-331, 1985.
- ASADA, K. Ascorbate peroxidase - a hydrogen peroxide-scavenging enzyme in plants. Physiologia Plantarum, v.85, p.235-241, 1992.
- BRADFORD, M.M. A rapid and sensitive method for the quantitation of microgram quanties of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, v.72, p.248-254, 1976.
- CADENA-GOMEZ, G.; NICHOLSON, R.L. Papilla formation and associated peroxidase activity: A non-specific response to attempted fungal penetration of maize. Physiological and Molecular Plant Pathology, v.31, p.51-67, 1987.
- GASPAR, T.; PENEL, C.; THORPE, T.; GREPPIN, H. Peroxidases 1970-1980: a survey of their biochemical and physiological roles in higher plants. Geneva: University of Geneva Press, 1982. 324p.
- HAMMERSCHMIDT, R.; NUCKLES, E.M.; KUC, J. Association of enhanced peroxidase activity with induced systemic resistance of cucumber to Colletotrichum lagenarium. Physiological Plant Pathology, v.20, p.73-82, 1982.
- HOAGLAND, R.E. (Ed.) Microbes and microbial products as herbicides Washington: American Chemical Society, 1990. p.87-113: Biochemical responses of plants to pathogens.
- LEITE, B.; PASCHOLATI, S.F. Hospedeiro: alteraçőes fisiológicas induzidas por fitopatógenos. In: BERGAMIN FILHO, A.; KIMATI, H.; AMORIM, L. (Ed.) Manual de Fitopatologia: princípios e conceitos. 3. ed. Săo Paulo: Agronômica Ceres, 1995. v.1, cap.21, p.393-416.
- LEITE, B.; RONCATO, L.D.; PASCHOLATI, S.F.; LAMBAIS, M.R. Reconhecimento e transduçăo de sinais moleculares em interaçőes planta-fungos patogęnicos. In: LUZ, C.W.; FERNANDES, J.M.S.; PRESTES, A.M.; PICININI, E.C. (Ed.) Revisăo anual de patologia de plantas Passo Fundo, 1997. v.5, p.235-280.
- LUSSO, M.F.G. Alteraçőes na atividade e no perfil eletroforético da enzima peroxidase em mesocótilos e folhas de milho (Zea mays L.) em resposta ŕ inoculaçăo com Helminthosporium maydis, raça 0, Helminthosporium carbonum raça 1 e ŕ injúria mecânica. Piracicaba, 1989. 109 p. Dissertaçăo (Mestrado) - Escola Superior de Agricultura "Luiz de Queiroz", Universidade de Săo Paulo.
- MARTINS, E.M.F. Controle da ferrugem do cafeeiro (Hemileia vastratix) através da induçăo de resistęncia. In: BETTIOL, W. (Ed.) Controle biológico de doenças de plantas Brasília: EMBRAPA, 1991. cap.24, p.345-363.
- OLIVEIRA, R.F.; PASCHOLATI, S.F.; LEITE, B. Papilla formation and peroxidase activity in Mimosa scabrella hipocotyls inoculated with the non-pathogen Colletotrichum graminicola Fitopatologia Brasileira, v.22, n.2, p.195-197, 1997.
- PASCHOLATI, S.F.; LEITE, B. Hospedeiro: mecanismos de resistęncia. In: BERGAMIN FILHO, A.; KIMATI, H.; AMORIM, L. (Ed.) Manual de Fitopatologia: princípios e conceitos. 3. ed. Săo Paulo: Agronômica Ceres, 1995. v.1, cap.22, p.417- 453.
- PICCININ, E. Uso de Saccharomyces cerevisiae na proteçăo de plantas de sorgo (Sorghum bicolor), maracujá amarelo (Passiflora edulis) e eucalipto (Eucaliptus spp) contra fitopatógenos fúngicos e bacterianos. Piracicaba, 1995. 107p. Dissertaçăo (Mestrado) - Escola Superior de Agricultura "Luiz de Queiroz", Universidade de Săo Paulo.
- REGLINSKI, T.; LYON, G.D.; NEWTON, A. C. Assessment of the control of barley powdery mildew in the field. Journal of Plant Diseases and Protection, v.101, p.1-10, 1994.
- REGLINSKI, T.; LYON, G.D.; NEWTON, A.C. The control of Botrytis cinerea and Rhizoctonia solani on lettuce using elicitors extracted from yeast cell walls. Journal of Plant Diseases and Protection, v.102, p.257-266, 1995.
- REUVENI, R.; BOTHMA, G.C. The relationship between peroxidase activity and resistance to Sphaerotheca fuliginea in melons. Phytopathologische Zeitschrift, v.114, p.260-267, 1985.
- ROSE, A.H. Composition of the envelope layers of Saccharomyces cerevisiae in relation to flocculation and ethanol tolerance. Journal of Applied Bacteriology Symposium Supplement, v.74, n.22, p.110S-118S, 1993.
- RYALS, J.A.; NEUENSCHWANDER, U.H.; WILLITS, M.G.; MOLINA, A.; STEINER, H.-Y.; HUNT, M.D. Systemic acquired resistance. Plant Cell, v.8, p.1809-1819, 1996.
- SILVA, S.R.; PASCHOLATI, S.F. Saccharomyces cerevisiae protects maize plants, under greenhouse conditions, against Colletotrichum graminicola Zeitschrift für Pflanzenkrankleinten und Pflanzenschutz, v.99, n.2, p.159-167, 1992.
- STANGARLIN, J.R.; PASCHOLATI, S.F. Proteçăo de plantas de milho pipoca contra Exserohilum turcicum pelo uso de Saccharomyces cerevisiae Summa Phytopathologica, v.20, n.1, p.16-21, 1994.
- VAN LOON, L.C. The significance of changes in peroxidase in diseased plants. In: GREPPIN, H.; PENEL, C.; GASPAR, TH. (Ed.) Molecular and physiological aspects of plant peroxidase Geneva: Imprimierie Nationals, 1986. p.405- 418.
Datas de Publicação
-
Publicação nesta coleção
14 Maio 1999 -
Data do Fascículo
1998
Histórico
-
Recebido
27 Out 1997 -
Aceito
31 Mar 1998