Resumos
Este estudo investigou o impacto da aplicação de gesso agrícola e de uma fonte rica em enxofre sobre as características microbianas e bioquímicas de um latossolo vermelho escuro cultivado com repolho. As aplicações de gesso foram de 134, 268 e 402 kg de S/ha. Foram incluídos um tratamento controle, sem enxofre, um contendo a adubação normal de sulfato de amônio (402kg de S/ha) e outro com adubo verde (20t/ha de lab-lab, peso seco). Em resposta a adições crescentes de enxofre no solo verificou-se que enquanto o número de bactérias totais aumentou, o número de bactérias Gram-negativas diminuiu. Os demais grupos de microrganismos, Bacillus spp, actinomicetos e fungos, não variaram significativamente ou não apresentaram uma resposta satisfatória. O aumento do número de bactérias totais, em relação ao controle, foi de 29 a 60% na rizosfera e de 15 a 107% na não-rizosfera, respectivamente. O número de microrganismos na rizosfera foi de 5 a 251 % superior ao da não-rizosfera. A biomassa microbiana da rizosfera aumentou nos tratamentos com sulfato de amônio e adubo verde, permanecendo invariável na não-rizosfera. Confirmando os resultados da contagem microbiana, a biomassa microbiana também aumentou na rizosfera em relação à da não-rizosfera. A atividade da desidrogenase e da urease aumentou em relação ao controle, não se constatando, no entanto, efeito na atividade da arilsulfatase. A produção de repolho foi superior ao controle de 52,5 a 81,1 %. Concentrações crescentes de enxofre foram observadas no solo e na parte aérea do repolho.
gesso agrícola; bactérias; fungos; desidrogenase; urease; arilsulfatase
The present study investigated the impact of the application of gypsum and of a sulfur-rich source on the microbial and biochemical characteristics of a dark red latossol used for cabbage cultivation. Gypsum was applied in amounts of 134, 268, and 402 kg S/ha. The following controls were included: a treatment with no sulfur; fertilization with ammonium sulfate (402 kg S/ha); and organic matter (20 t/ha lab-lab, dry weight). Application of increasing sulfur doses to the soil led to an increase in total number of bacteria and a decrease in Gram-negative bacteria. The remaining groups of microorganisms, Bacillus spp, actinomycetes and fungi, did not vary significantly or did not present a satisfatory response. The increase in total number of bacteria compared to control was 29 to 60% in the rhizosphere and 15 to 107% in the non-rhizosphere, with the number of microorganisms in the rhizosphere exceeding the number of microorganisms in the non-rhizosphere by 5 to 251%. The microbial biomass of the rhizosphere increased in the treatments with ammonium sulfate and organic matter and was unchanged in the non-rhizosphere. In agreement with microbial count data, the microbial biomass also increased in the rhizosphere compared to the non-rhizosphere. Dehydrogenase and urease activity increased in comparison to the control, although no effect was observed on arylsulfatase activity. Cabbage production on treated soil was 52.2 to 81.1% higher as compared to the control. Increasing sulfur concentrations were observed in the soil and in the cabbage aerial portion.
gypsum; bacteria; fungi; dehydrogenase; urease; arylsulfatase
ATIVIDADE MICROBIANA E PROPRIEDADES BIOQUÍMICAS DO SOLO RESULTANTES DA APLICAÇÃO DE GESSO AGRÍCOLA NA CULTURA DO REPOLHO1 1 Trabalho realizado com recursos do CNPq e da FUNDUNESP.
E. NAHAS2,3, J.H. DELFINO2,3; L.C. ASSIS2
2Depto. de Microbiologia-FCAVJ/UNESP, C.P. 354, CEP: 14870-000 - Jaboticabal, SP.
3Bolsista do CNPq.
RESUMO: Este estudo investigou o impacto da aplicação de gesso agrícola e de uma fonte rica em enxofre sobre as características microbianas e bioquímicas de um latossolo vermelho escuro cultivado com repolho. As aplicações de gesso foram de 134, 268 e 402 kg de S/ha. Foram incluídos um tratamento controle, sem enxofre, um contendo a adubação normal de sulfato de amônio (402kg de S/ha) e outro com adubo verde (20t/ha de lab-lab, peso seco). Em resposta a adições crescentes de enxofre no solo verificou-se que enquanto o número de bactérias totais aumentou, o número de bactérias Gram-negativas diminuiu. Os demais grupos de microrganismos, Bacillus spp, actinomicetos e fungos, não variaram significativamente ou não apresentaram uma resposta satisfatória. O aumento do número de bactérias totais, em relação ao controle, foi de 29 a 60% na rizosfera e de 15 a 107% na não-rizosfera, respectivamente. O número de microrganismos na rizosfera foi de 5 a 251 % superior ao da não-rizosfera. A biomassa microbiana da rizosfera aumentou nos tratamentos com sulfato de amônio e adubo verde, permanecendo invariável na não-rizosfera. Confirmando os resultados da contagem microbiana, a biomassa microbiana também aumentou na rizosfera em relação à da não-rizosfera. A atividade da desidrogenase e da urease aumentou em relação ao controle, não se constatando, no entanto, efeito na atividade da arilsulfatase. A produção de repolho foi superior ao controle de 52,5 a 81,1 %. Concentrações crescentes de enxofre foram observadas no solo e na parte aérea do repolho.
Descritores: gesso agrícola, bactérias, fungos, desidrogenase, urease, arilsulfatase
MICROBIAL ACTIVITY AND BIOCHEMICAL PROPERTIES OF THE SOIL RESULTING FROM THE APPLICATION OF GYPSUM ON CABBAGE CROP
ABSTRACT: The present study investigated the impact of the application of gypsum and of a sulfur-rich source on the microbial and biochemical characteristics of a dark red latossol used for cabbage cultivation. Gypsum was applied in amounts of 134, 268, and 402 kg S/ha. The following controls were included: a treatment with no sulfur; fertilization with ammonium sulfate (402 kg S/ha); and organic matter (20 t/ha lab-lab, dry weight). Application of increasing sulfur doses to the soil led to an increase in total number of bacteria and a decrease in Gram-negative bacteria. The remaining groups of microorganisms, Bacillus spp, actinomycetes and fungi, did not vary significantly or did not present a satisfatory response. The increase in total number of bacteria compared to control was 29 to 60% in the rhizosphere and 15 to 107% in the non-rhizosphere, with the number of microorganisms in the rhizosphere exceeding the number of microorganisms in the non-rhizosphere by 5 to 251%. The microbial biomass of the rhizosphere increased in the treatments with ammonium sulfate and organic matter and was unchanged in the non-rhizosphere. In agreement with microbial count data, the microbial biomass also increased in the rhizosphere compared to the non-rhizosphere. Dehydrogenase and urease activity increased in comparison to the control, although no effect was observed on arylsulfatase activity. Cabbage production on treated soil was 52.2 to 81.1% higher as compared to the control. Increasing sulfur concentrations were observed in the soil and in the cabbage aerial portion.
Key Words: gypsum, bacteria, fungi, dehydrogenase, urease, arylsulfatase
INTRODUÇÃO
Além da deficiência natural de enxofre nos solos de regiões tropicais, a mudança no comportamento decorrente da utilização de adubos e formulações concentradas, com menores teores de enxofre, a redução no uso de enxofre elementar como fungicida, o aumento de programas de despoluição, além de outras práticas agrícolas acarretaram redução nos níveis de enxofre no solo e significativo aumento de demanda desse elemento por decorrência do aumento da produtividade agrícola (Wainwright, 1984; Vitti, 1988).
A adubação orgânica está sujeita à decomposição microbiana para haver liberação de enxofre, entre outros elementos minerais, num processo que está sob regulação das condições do ambiente. Um dos fertilizantes químicos utilizados para suprir as necessidades das plantas é o enxofre elementar que necessita ser oxidado no solo por grupos específicos de microrganismos S-oxidantes até a forma de sulfato (Gupta et al. 1988; Lee et al. 1988). O gesso agrícola resultante da produção de fertilizantes fosfatados, além de ser utilizado como fonte de cálcio e enxofre para crescimento das plantas tem sido empregado como condicionador, diminuindo a toxidez de alumínio em solos ácidos ou corrigindo solos salinos (Summer, 1992). Nesse sentido, inúmeros trabalhos têm mostrado as qualidades do gesso agrícola como fonte de cálcio em macieira em regiões onde o pH e o teor de Ca trocável são baixos (Suzuki et al., 1992), na neutralização do efeito tóxico do alumínio em culturas anuais e pastagens (Guimarães, 1985) ou, ainda, como fonte de enxofre em arroz, feijão, soja, trigo, sorgo sacarino, café e pastagens (Vitti et al., 1985).
O cálcio e o enxofre são componentes essenciais dos microrganismos e como tal podem influenciar o crescimento e a atividade da população microbiana, influenciando, em consequência, inúmeros processos metabólicos importantes nas transformações dos elementos no solo, favorecendo ou não a disponibilidade dos nutrientes para as plantas.
O objetivo deste trabalho foi o de verificar se doses crescentes de gesso agrícola influem na produtividade de repolho cultivado em campo e, especialmente, na população de grupos específicos de microrganismos, na biomassa e na atividade microbiana. Ao mesmo tempo, determinou-se o teor de enxofre residual no solo e na planta de repolho.
MATERIAL E MÉTODOS
Solo: o repolho foi cultivado em um Latossolo Roxo cuja composição química foi incluída na TABELA 1.
Semeadura: a semeadura foi feita em bandejas contendo terra vegetal, utilizando-se sementes da variedade Matsukase de repolho (Brassica oleraceae) adaptada para verão. O transplante foi feito aos 35 dias após a semeadura.
Condução do ensaio: o solo foi arado e gradeado por duas vezes e a seguir sulcado para receber a mistura de adubos. As mudas foram transplantadas para covas dispostas no espaçamento de 1,00 x 0,50m. Foi realizada uma pulverização contra a lagarta rosca e duas capinas. A colheita foi feita aos 105 dias após o plantio.
Adubação: a mistura de adubos foi aplicada em sulcos, variando-se a forma do enxofre, como segue: (a) controle (sem S); (b) 134kg de S (gesso agrícola, gesso 1); (c) 268kg de S (gesso agrícola, gesso 2); (d) 402kg de S (gesso agrícola, gesso 3); (e) 402kg de S (sulfato de amônio); (f) S na forma de adubo verde. As quantidades de nutrientes aplicadas foram as seguintes, por ha: N - 350kg (na forma de uréia, sendo metade no plantio e metade aos 45 dias em cobertura, após o transplante das mudas); P2O5 - 700kg (superfosfato triplo); K2O - 400kg (cloreto de potássio); Bo - 3kg (bórax, tetraborato de sódio); Mo - 2,5kg (molibdato de sódio); e adubo verde (lab-lab moído) - 20t (peso seco). Todos os fertilizantes e o adubo verde foram adicionados 1 mês antes do transplante das mudas.
Coleta do material: amostras de terra foram retiradas logo após a colheita, na profundidade 0 - 20 cm, utilizando-se trado tipo holandês, na situação junto às raizes do repolho (rizosfera) ou entre plantas, na linha de plantio (não-rizosfera). As amostras destinadas às análises microbiológicas foram conservadas em geladeira a 4ºC até o momento de utilizá-las. Para as demais amostras, a terra foi seca em estufa com circulação forçada de ar a 45-50ºC por 4-5 dias e, a seguir, peneirada em peneira de 2 mm de malha e guardada em sacos pláticos. As plantas de repolho foram cortadas a 2cm do colo e colocadas para secar em estufa com circulação forçada de ar, à temperatura de 50-60ºC até peso constante.
Contagem do número de microrganismos: a partir de 10 g de solo peso úmido foi feita uma diluição decimal com pirofosfato de sódio 0,1% (p/v). Alíquotas das suspensões foram transferidas às placas de Petri contendo meio de Bunt & Rovira (1955) para contagem de bactérias aeróbias totais, Bacillus spp (as suspensões das diluições foram aquecidas em banho maria à temperatura de 80-85 ºC por 10 min antes de sua transferência para o meio de cultura) e bactérias Gram-negativas (ao meio foi acrescido 5 mg/ml de cristal violeta); meio amido-caseina (Kuster & Williams, 1964) acrescido de antibióticos (Williams & Davies, 1965), para contagem de actinomicetos; e meio de Martin (1950), acrescido de uma mistura de penicilina e estreptomicina na quantidade de 0,1 g/l e de 70 mg/ml de rosa de Bengala, para contagem de fungos totais. Foi utilizado o método de Frostegard et al. (1991), para se determinar a biomassa microbiana.
Análises enzimáticas: a determinação da atividade da desidrogenase foi feita pelo método de Casida (1977), da urease, pelo método de McGarity & Myers (1967) e da arilsulfatase, pelo método de Tabatabai & Bremner (1970). A atividade específica da desidrogenase é dada em mg de trifenilformazan liberado em 24 h por 1 g do solo seco; da urease, em mg NH4+-N liberado em 3 h por 1 g de solo seco; e da arilsulfatase, em mg p-nitrofenol liberado em 1 h por 1 g de solo seco.
Análises químicas: o teor de sulfato no solo e no material vegetal foi determinado pelo método de Vitti (1988).
Análise estatística: foi utilizado delineamento em blocos casualizados com 6 tratamentos e 5 repetições. Os resultados das contagens microbianas foram transformados em ln (x+1) e as médias foram comparadas pelo teste de Tukey ao nível de probabilidade de 5%.
RESULTADOS E DISCUSSÃO
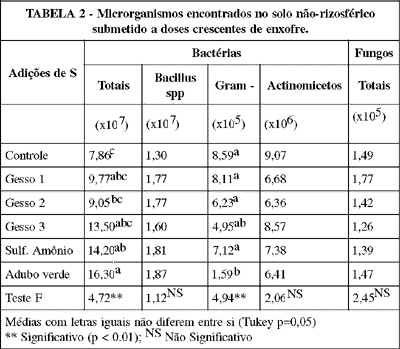
A TABELA 2 reune os dados das contagens microbianas no solo não-rizosférico. O número de bactérias totais e de Gram-negativas variou significativamente, permanecendo invariáveis o de bactérias esporuladas, actinomicetos e de fungos. A aplicação de adubo verde aumentou significativamente o número de bactérias totais em relação ao controle. Esta resposta não foi verificada nos demais tratamentos, embora se constate aumento das contagens com o aumento das dosagens de enxofre. O número de bactérias Gram-negativas respondeu de forma contrária, isto é, maiores números foram encontrados nos tratamentos com menores quantidades de enxofre aplicadas. A adição de adubo verde, inclusive, desfavoreceu significativamente o número de bactérias Gram-negativas. Higashida & Takao (1986) obtiveram correlação negativa entre o teor de C total e o número de bactérias totais e Gram-negativas, contudo mencionam que esse não é um efeito depressivo da matéria orgânica, mas sim resultante da variação do pH do solo. Como neste trabalho não se constatou variação do pH, outro efeito pode ter ocorrido, possivelmente a redução de nitrogênio disponível (Holding, 1960).
Na rizosfera, verificou-se que o número de bactérias totais, Gram-negativas e de actinomicetos variou significativamente (TABELA 3). Contudo, nenhum efeito foi verificado sobre o número de Bacillus spp e de fungos. O número de bactérias totais foi influenciado pelas quantidades de enxofre aplicadas no solo, embora sem diferença significativa. As maiores contagens foram obtidas nos tratamentos gesso 2 e lab-lab e as menores nos tratamentos controle e sulfato de amônio. Pela aplicação de adubo verde, houve uma redução do número de bactérias Gram-negativas de 72 %.
O significativo aumento da população bacteriana em decorrência da aplicação de adubo verde pode ser corroborado por outros trabalhos (Goyal et al., 1992; Nahas et al., 1994). O aumento do número de bactérias totais e actinomicetos como resultado da adição de gesso foi também mencionado por Bajpai et al. (1976). Contudo, nenhuma tendência consistente no número de fungos e actinomicetos na rizosfera e não-rizosfera foi obtida pela incorporação de fosfogesso em citrus (Smith et al., 1989).
Comparando-se os dados das TABELAS 2 e 3 verifica-se que houve aumento apreciável dos números dos microrganismos na rizosfera em relação a não-rizosfera. Assim as bactérias totais aumentaram 12 %, Bacillus spp, 5 %, bactérias Gram-negativas, 104 %, actinomicetos, 251 % e os fungos, 23 % e da biomassa microbiana de 7,8 %, provavelmente favorecidos por substâncias produzidas nas proximidades das raízes (Lynch, 1983). Esses resultados provavelmente propiciaram o aumento da atividade enzimática da desidrogenase e da urease em 39 e 25 %, respectivamente.
A biomassa microbiana variou de 25,16 a 26,73 mg CO2-C/g solo seco na rizosfera e de 23,31 a 25,90 mg CO2-C/g solo seco na não-rizosfera, portanto, um aumento na rizosfera de 7,8 % na média, possivelmente refletindo os resultados de contagem microbiana (TABELA 4). No solo não-rizosférico não se encontrou diferença significativa entre os valores encontrados. Na rizosfera, os maiores valores observados foram nos solos adicionados de matéria orgânica e de sulfato de amônio que diferiram dos outros tratamentos, exceto do solo adubado com gesso 3. Este resultado pode ser explicado em parte pelo aumento na disponibilidade de C decorrente da adição de material orgânico (Sakamoto & Oba, 1991), mas não pelo sulfato de amônio, mesmo porque esse fertilizante não favoreceu o crescimento da população microbiana (TABELA 3). Carter (1986) considerou que a redução na biomassa microbiana seja um efeito direto da aplicação de gesso e não uma alteração das características químicas do solo.
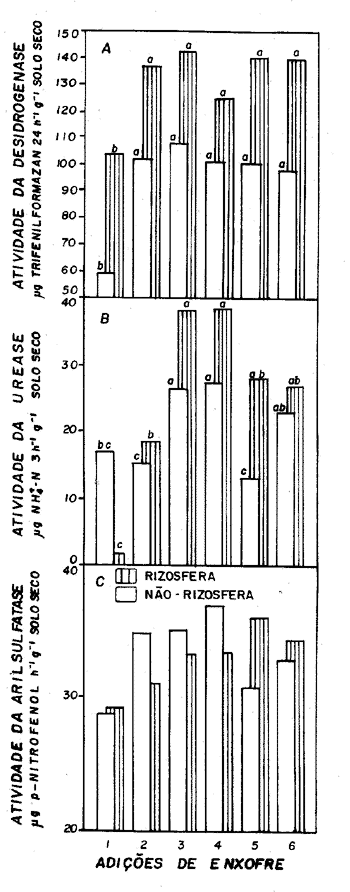
As atividades enzimáticas da desidrogenase, da urease e da sulfatase estão resumidas na Figura 1. Com relação à atividade da desidrogenase verificou-se que aumentou com a aplicação de enxofre quando se comparou com o controle (Figura 1A). Contudo esse aumento não foi proporcional às quantidades de S aplicadas, havendo inclusive decréscimo com doses maiores de gesso agrícola. Maior atividade foi constatada nas proximidades das raízes das plantas que no solo. Da mesma forma que para a desidrogenase, foi constatada diferença significativa entre os resultados obtidos com a atividade da urease aumentando com a aplicação de S em relação ao controle, porém até apenas o tratamento gesso 3 (Figura 1B). Os resultados decorrentes da adição de sulfato de amônio e de adubo verde na não-rizosfera não diferiram do controle. Diferentemente das outras enzimas ensaiadas, a atividade da arilsulfatase não foi influenciada pela aplicação de enxofre (Figura 1C). Os dados obtidos neste trabalho mostraram que a atividade enzimática da arilsulfatase variou de 28,72 a 36,95 mg p-nitrofenol/h.g solo seco na não-rizosfera e de 29,17 a 36,06 mg p-nitrofenol/h.g solo seco na rizosfera.
- Atividades enzimáticas da desidrogenase (1A), da urease (1B), e da arilsulfatase (1C) em latossolo que recebeu doses crescentes de enxofre. Adições de enxofre: (1) Controle; (2) Gesso 1; (3) Gesso 2; (4) Gesso 3; (5) Sulfato de amônio; (6) Adubo verde. Médias com letras iguais, na rizosfera ou na não-rizosfera, não diferem entre si (Tukey p=0,05).
A atividade enzimática tem sido relacionada com diferentes parâmetros bióticos e abióticos do solo (Higashida & Takao, 1986). O teor de SO42-S aumentou tanto na rizosfera como na não-rizosfera, acima do controle, em decorrência da aplicação de enxofre e mesmo no tratamento com adubo verde. Com relação à urease, verificou-se que a atividade aumentou em decorrência do crescimento da população microbiana favorecida por uma fonte de carbono como a glicose (Lloyd & Sheaffe, 1973). Alto teor de matéria orgânica foi encontrada no solo utilizado neste trabalho (TABELA 1). Contudo, o teor de matéria orgânica não explicaria porque, além do adubo verde, a adição de enxofre aumentou a atividade da urease acima do controle, de modo que além da fonte de C outro fator pode ter favorecido esse estímulo da atividade. Pode-se supor que a adição de enxofre possa ter propiciado relações mais equilibradas em termos de nutrientes essenciais nos microrganismos produtores da enzima.
A atividade da desidrogenase é decorrente da atividade microbiana, sendo estimulada pela adição de matéria orgânica ao solo (Fraser et al., 1988) e de enxofre, como se observa neste estudo. Confirmando esse resultado, Goyal et al. (1992) mostraram que a atividade da desidrogenase aumentou com a adição de fertilizante orgânico e inorgânico, exceto em solo que recebeu nitrato que serve como aceptor de elétrons. Embora se constate um pequeno aumento em relação ao controle, não se encontrou efeito da aplicação de enxofre sobre a atividade da arilsulfatase, confirmando Castellano & Dick (1990). De modo diferente, Gupta et al. (1993) verificaram que a atividade desta enzima correlacionou-se com o teor de carbono orgânico.
Os resultados referentes ao enxofre no solo mostraram uma variação de 12,67 a 55,04 mg SO4-S/g solo seco no solo não-rizosférico e de 16,72 a 67,27 mg SO4-S/g solo seco na rizosfera (TABELA 4). Em ambos os casos, a concentração de S aumentou significativamente pela aplicação de gesso agrícola. Constatou-se também aumento da concentração de S nos tratamentos onde foram adicionados sulfato de amônio ou adubo verde, que diferiram do controle. Analisando-se os resultados referentes ao enxofre na planta verifica-se que variaram de 7,25 a 12,27 mg S/g matéria seca. A medida em que se aumentou o teor de S aplicado no solo, aumentou-se também o teor de S na parte aérea da planta. O tratamento com adubo verde não diferiu significativamente do controle. Na TABELA 4, observa-se o efeito da aplicação de enxofre na produção de repolho. Os menores valores foram encontrados nos tratamentos controle e gesso 1 e os maiores valores nos tratamentos adicionados de matéria orgânica e gesso 3. Essas características não diferiram muito com a aplicação de sulfato de amônio quando comparadas com a aplicação de gesso agrícola. Um aumento no peso de 152,5 a 181,1 % foi verificado pelo aumento nos teores de enxofre no solo. Um aumento significativo foi proporcionado pela aplicação de adubo verde.
CONCLUSÃO
A aplicação de doses crescentes de enxofre, em particular de gesso agrícola, aumentou o número de bactérias totais, a biomassa microbiana, as atividades da desidrogenase e da urease no solo e a produção de repolho. Foi constatado efeito da rizosfera onde os parâmetros analisados foram superiores aos encontrados na fração não-rizosférica.
Recebido para publicação em 30.01.96
Aceito para publicação em 25.04.97
- BAJPAI, P.D.; GUPTA, B.R.; SINGH, C. Some microbiological studies in salt-affected soils-II: Effect of gypsum and mulch on selected soil microflora and evolution of carbon dioxide. Journal of Indian Society of Soil Science, v.24, p.48-52, 1976.
- BUNT, J.S.; ROVIRA, A.D. Microbiological studies of some subantartic soils. Journal of Soil Science, v.6, p.ll9-l28, l955.
- CARTER, M.R. Microbial biomass and mineralizable nitrogen in solonetzic soils: influence of gypsum and lime amendments. Soil Biology and Biochemistry, v.18, p.531-537, 1986.
- CASIDA Jr., L.E. Microbial metabolic activity in soil as measured by dehydrogenase determinations. Applied and Environmental Microbiology, v.34, p.630-636, 1977.
- CASTELLANO, S.D.; DICK, R.P. Cropping and sulfur fertilization influence on sulfur transformations in soil. Soil Science Society of America Journal, v.54, p.114-121, 1990.
- FRASER, D.G.; DORAN, J.W.; SAHS, W.W.; LESOING, W. Soil microbial populations and activities under conventional and organic management. Journal of Environmental Quality, v.17, p.585-590, 1988.
- FROSTEGARD, A.; TUNLID, A.; BAATH, E. Microbial biomass measured as total lipid phosphate in soils of different organic content. Journal of Microbiological Methods v.14, p.151-163, 1991.
- GOYAL, S.; MISHRA, M.M.; HOODA, I.S.; SINGH, R. Organic matter-microbial biomass relationships in field experiments under tropical conditions: effects of inorganic fertilization and organic amendments. Soil Biology and Biochemistry, v.24, p.1081-1084, 1992.
- GUIMARĂES, P.C.T. O gesso agrícola na neutralizaçăo de alumínio nas camadas subsuperficiais do solo: aplicaçőes ŕs culturas anuais e perenes. In: SEMINÁRIO SOBRE O USO DO FOSFOGESSO NA AGRICULTURA, 1., Brasília, 1985. Anais. Brasília: IBRAFOS, 1985. p.145-168.
- GUPTA, V.V.S.R.; FARREL, R.E.; GERMIDA, J.J. Activity of arylsulfatase in Saskatchewan soils. Canadian Journal of Soil Science, v.73, p.341-347, 1993.
- GUPTA, V.V.S.R.; LAWRENCE, J.R.; GERMIDA, J.J. Impact of elemental sulfur fertilization on microbial biomass and enzyme activities. Canadian Journal of Soil Science, v.68, p.463-473, 1988.
- HIGASHIDA, S.; TAKAO, K. Relations between soil microbial activity and soil properties in grassland. Soil Science and Plant Nutrition, v.32, p.587-597, 1986.
- HOLDING, A.J. The properties and classification of the predominant Gram-negative bacteria occurring in soil. Journal of applied Bacteriology, v.23, p.515-525, 1960.
- KUSTER, E.; WILLIAMS, S.T. Selection of media for isolation of streptomycetes. Nature, v.202, p.928-929, 1964.
- LEE, A.; WATKENSON,J.H.; LAUREN, D.R. Factors affecting oxidation rates of elemental sulphur in a soil under a ryegrass dominant sward. Soil Biology Biochemistry, v.20, p.809-8l6, 1988.
- LLOYD, A.B.; SHEAFFE, M.J. Urease activity in soil. Plant and Soil, v.39, p.71-80, 1973.
- LYNCH, J.M. Soil biotechnology Oxford: Blackwell, 1983. 191p.
- McGARITY, J.W.; MYERS M.G. A survey of urease activity in soil of Northern New South Wales. Plant and Soil, v.27, p.217-238, 1967.
- MARTIN, J.P. Use of acid, rose bengal, and streptomycin in the plate method for estimating soil fungi. Soil Science, v.69, p.215-232, 1950.
- NAHAS, E.; FORNASIERI, D.J.; ASSIS, L.C. Resposta ŕ inoculaçăo de fungo solubilizador de fósforo em milho. Scientia Agricola, v.51, p.463-469, 1994.
- SAKAMOTO, K.; OBA, Y. Relationship between the amount of organic material applied and soil biomass content. Soil Science and Plant Nutrition, v.37, p.387-397, 1991.
- SMITH, G.S.; NEMEC, S.; GOULD, A.B.; SONODA, R.M. Effect of deep-tillage and soil amendments on growth of rough lemon citrus and root and soil microflora population densities. Proceedings of Soil and Crop Science Society of Florida, v.48, p.165-172, 1989.
- SUMMER, M.E. Uso atual do gesso no mundo em solos ácidos. In: SEMINÁRIO SOBRE O USO DO GESSO NA AGRICULTURA, 2., Uberaba, 1992. Uberaba: Ibrafos, 1992. p.7-40.
- SUZUKI, A.; BASSO, C; WILMS, F.W.W. O uso do gesso como fonte complementar de cálcio em macieira. In: Seminário sobre o uso do gesso na agricultura, 2., Uberaba, 1992. Uberaba: Ibrafos, l992. p.225-240.
- TABATABAI, M.A.; BREMNER, J.M. Arylsulfatase activity of soils. Soil Science Society of American Proceedings, v.34, p.225-229, 1970.
- VITTI, G.C. Avaliaçăo e interpretaçăo do enxofre no solo e na planta Jaboticabal: FUNEP, 1988. 37p.
- VITTI, G.C.; FERREIRA, M.E.; MALAVOLTA, E. Respostas de culturas anuais e perenes. In: SEMINÁRIO SOBRE O USO DO FOSFOGESSO NA AGRICULTURA, 1., Brasília, 1985. Anais. Brasília: IBRAFOS, 1985. p.17-44.
- WAINWRIGHT, M. Sulfur oxidation in soils. Advances in Agronomy, v.37, p.349-396, l984.
- WILLIAMS, S.T.; DAVIES, F. L. Use of antibiotics for selective isolation and enumeration of actinomycetes in soil. Journal of General Microbiology, v.38, p.251-261, 1965.
Datas de Publicação
-
Publicação nesta coleção
03 Fev 1999 -
Data do Fascículo
Set 1997
Histórico
-
Aceito
25 Abr 1997 -
Recebido
30 Jan 1996