Resumos
As condições de crescimento e os requerimentos nutricionais de Arthrobotrys oligospora, um fungo nematófago, foram investigados em meio líquido. O organismo foi incubado em meio sintético, a 30º C e em cultura estacionária. O perfil da curva de crescimento do fungo ajustou-se a uma equação de 3º grau, mesmo após 15 dias de incubação. A temperatura e o pH ótimos para produção de micélio foram observados a 25º C e pH 5,0, respectivamente. Contudo, não foram observadas diferenças significativas entre a produção de biomassa nas temperaturas de 25º C e 30º C ou pH 5.0 e 6.0. Várias fontes de carbono foram utilizadas pelo fungo, porém a maior produção de biomassa foi verificada com maltose e sacarose. Das fontes de nitrogênio testadas, várias proteínas (triptona, extrato de levedura, caseína, peptona e casaminoácidos) e fontes inorgânicas (nitrato de sódio e cloreto de amônio) estimularam a maior produção de biomassa. Das várias vitaminas experimentadas, o crescimento do fungo aumentou 2,2 vezes com riboflavina e 2,3 vezes com a mistura biotina e tiamina em relação ao controle, sem vitamina. De modo geral, constatou-se, após o período de incubação, que o pH inicial do meio de cultura pode aumentar até 8,4. Estes resultados sugerem que as variáveis estudadas podem ter papel importante no crescimento do organismo no solo.
temperatura; pH; vitamina; fonte de carbono; de nitrogênio
The growth conditions and the nutritional requirements of Arthrobotrys oligospora, a nematophagous fungus, were investigated in liquid culture. The organism was incubated in a synthetic medium, at 30º C in a static culture. Time course of growth was adjusted to a 3º degree equation, even after 15 days of incubation. Optimal temperature and pH for mycelium production were observed at 25º C and pH 5.0, respectively. However, significant differences were not found among the biomass production at temperatures 25º C and 30º C or pH 5.0 and 6.0. Several carbon sources were used by the fungus, but the highest biomass production were attained with maltose and sucrose. Of the nitrogen sources tested, several proteins (tryptone, yeast extract, casein, peptone and casaminoacids) and inorganic sources (sodium nitrate and ammonium chloride) stimulated the highest biomass yield. Of the several vitamins tested, fungus growth with riboflavin enhanced 2,2 times and 2,3 times with the mixture biotin and thiamin in relation to the control, without vitamin. In general, it was verified, after the incubation period, that the initial pH of the culture may enhance for up to 8,4. These results suggest that the studied variables may play important role in the growth of the organism in soil.
temperature; pH; vitamin; carbon source; nitrogen source
ARTIGOS/ARTICLES
Nutrição e crescimento do fungo nematófago Arthrobotrys oligospora
Eliane R. CardosoI, Luiz CarlosAssisII; Ely NahasII
IEx-aluna do Programa de PG em Microbiologia Agropecuária da FCAV/UNESP Jaboticabal
IIDepartamento de Produção Vegetal, UNESP/ FCAV, 14884-900 Jaboticabal, SP, Brasil, E-mail: enahas@fcav.unesp.br
RESUMO
Cardoso, E.R.; Assis, L.C; Nahas, E. Nutrição e crescimento do fungo nematófago Arthrobotrys oligospora. Summa Phytopathologica, v.35, n.4, p.267-272, 2009
As condições de crescimento e os requerimentos nutricionais de Arthrobotrys oligospora, um fungo nematófago, foram investigados em meio líquido. O organismo foi incubado em meio sintético, a 30o C e em cultura estacionária. O perfil da curva de crescimento do fungo ajustou-se a uma equação de 3o grau, mesmo após 15 dias de incubação. A temperatura e o pH ótimos para produção de micélio foram observados a 25o C e pH 5,0, respectivamente. Contudo, não foram observadas diferenças significativas entre a produção de biomassa nas temperaturas de 25o C e 30o C ou pH 5.0 e 6.0. Várias fontes de carbono foram utilizadas pelo fungo, porém a maior produção de biomassa foi verificada com maltose e sacarose. Das fontes de nitrogênio testadas, várias proteínas (triptona, extrato de levedura, caseína, peptona e casaminoácidos) e fontes inorgânicas (nitrato de sódio e cloreto de amônio) estimularam a maior produção de biomassa. Das várias vitaminas experimentadas, o crescimento do fungo aumentou 2,2 vezes com riboflavina e 2,3 vezes com a mistura biotina e tiamina em relação ao controle, sem vitamina. De modo geral, constatou-se, após o período de incubação, que o pH inicial do meio de cultura pode aumentar até 8,4. Estes resultados sugerem que as variáveis estudadas podem ter papel importante no crescimento do organismo no solo.
Palavras-chave adicionais: temperatura; pH; vitamina; fonte de carbono; de nitrogênio
ABSTRACT
Cardoso, E.R.; Assis, L.C; Nahas, E. Nutrition and growth of the nematophagous fungus Arthrobotrys oligospora. Summa Phytopathologica, v.35, n.4, p.267-272, 2009
The growth conditions and the nutritional requirements of Arthrobotrys oligospora, a nematophagous fungus, were investigated in liquid culture. The organism was incubated in a synthetic medium, at 30o C in a static culture. Time course of growth was adjusted to a 3o degree equation, even after 15 days of incubation. Optimal temperature and pH for mycelium production were observed at 25o C and pH 5.0, respectively. However, significant differences were not found among the biomass production at temperatures 25o C and 30o C or pH 5.0 and 6.0. Several carbon sources were used by the fungus, but the highest biomass production were attained with maltose and sucrose. Of the nitrogen sources tested, several proteins (tryptone, yeast extract, casein, peptone and casaminoacids) and inorganic sources (sodium nitrate and ammonium chloride) stimulated the highest biomass yield. Of the several vitamins tested, fungus growth with riboflavin enhanced 2,2 times and 2,3 times with the mixture biotin and thiamin in relation to the control, without vitamin. In general, it was verified, after the incubation period, that the initial pH of the culture may enhance for up to 8,4. These results suggest that the studied variables may play important role in the growth of the organism in soil.
Keywords: temperature; pH; vitamin; carbon source; nitrogen source
Dentre os fungos predadores que capturam e matam nematóides no solo, Arthrobotrys é provavelmente um dos gêneros mais importante e certamente o mais promissor (5). Dentre as diferentes espécies, o fungo A. oligospora é considerado um efetivo agente nematófago e tem sido encontrado em diferentes ambientes. Espécies do gênero Arthrobotrys têm sido encontradas em solos com alto conteúdo de matéria orgânica, em substratos para cultivo de cogumelos e em solos próximos às excreções de gado estabulado (15). Mais especificamente, Nguyen et al. (22) relataram que o crescimento de A. oligospora foi inversamente relacionado à razão carbono:nitrogênio (C:N). A atividade predadora é estimulada pela presença de nematóides ou substâncias derivadas dos nematóides (3). Segundo Jaffee (14), A. oligospora é um fungo celulolítico e o nematóide constitui uma fonte potencial de nitrogênio.
O crescimento rápido e a produção abundante de micélio são dois fatores importantes para a disseminação e sobrevivência dos fungos em condições ambientais, embora o crescimento micelial não esteja relacionado com a capacidade de um isolado em predar nematóides. A. oligospora tem sido considerado fungo sapróbio, podendo crescer em substratos disponíveis do solo, diferentemente do fungos essencialmente parasitas (24). Portanto, o conhecimento dos requerimentos nutricionais podem indicar as condições de seu desenvolvimento nos diferentes ambientes.
Diversos meios de cultura têm sido utilizados para o crescimento de A. oligospora. Oliveira et al. (23) compararam o crescimento de cinco isolados do fungo Arthrobotrys em três meios de cultura e constataram que o melhor meio foi o de Kado e Heskett. O meio com 0,01% peptona de soja suplementado com fenilalanina e valina foi empregado para produção de micélio com anéis constritores (1, 29). A adição de fosfato a este meio inibiu a produção de micélio com anéis constritores (1).Contudo, o meio mínimo é o mais adequado para se avaliar os requerimentos nutricionais dos fungos (6). O meio líquido LNM (low-nutrient medium) suplementado com fontes de C, N e P foi utilizado para produção de lectinas (4).
A. oligospora cresce em meios de cultura naturais ou sintéticos em condições adequadas de temperatura e pH (16). Dias & Ferraz (9) concluíram que a temperatura de 25oC foi a melhor para o crescimento de Arthrobotrys spp. e que o pH do meio de cultura não influenciou a produção micelial.
Comparando-se o efeito de diferentes fontes de C e N, constatou-se ótimo crescimento quando no meio de cultura foram utilizadas manose e uréia, respectivamente (13). Carboidratos como glicose e sorbose inibiram a captura de Cooperia punctata por A. musiformes e A. robusta (3). Saxena et al. (27) reportaram que para o bom crescimento do fungo há necessidade de tiamina, biotina e ácido 4-aminobenzóico. Estes relatos sugerem que o fungo Arthrobotrys oligospora responde de modo diferente a diferentes fontes de carbono e de nitrogênio quando crescido no ambiente do solo em condições de captura ou não de nematóides. A introdução de um agente nematófago no solo depende da existência de condições ecológicas adequadas ou que podem ser criadas e enquanto não se conhecer mais sobre os fatores que afetam a atividade destes fungos, seu potencial como agentes de controle não se terá sucesso.
O objetivo deste estudo foi avaliar as condições ótimas de crescimento deste fungo, utilizando-se diversas fontes de carbono, nitrogênio e vitaminas. O efeito da temperatura e do pH do meio de cultura no crescimento foram também avaliados.
MATERIAL E MÉTODOS
Manutenção do fungo no laboratório
O fungo Arthrobotrys oligospora pertence ao filo Ascomycota, classe Ascomycetes, família Orbiliaceae e foi gentilmente cedido pelo Laboratório de Nematologia do Departamento de Fitossanidade da FCAV/UNESP. Utilizou-se o meio complexo de Martin (18) tendo a seguinte composição (por litro): 10,0 g glicose, 0,5 g KH2PO4, 0,5 g K2HPO4,0,5 g MgSO4.7H2O, 5,0 g peptona, 0,5 g extrato de levedura e 15,0 g ágar. O pH foi ajustado para 5,6. O fungo foi crescido em placas de Petri contendo o meio de cultura durante 15 dias à 30 ºC, e, a seguir, foi conservado em geladeira (5 ºC) pelo prazo máximo de 30 dias, quando então foi renovado.
Meio de cultura liquido
Foi utilizado meio de cultura de Czapeck (7) contendo (por litro): 2,0 g NaNO3, 0,5 g KCl, 0,5 g MgSO4. 7H2O, 1,0 g K2HPO4, 0,01 g FeSO4. 7H2O, 30,0 g sacarose. Quando não mencionado, foram adicionados 200µg L-1 de tiamina e 200 µg L-1 biotina no momento da inoculação. O pH foi ajustado para 6,0.
Preparação do inóculo
Procedeu-se a extração dos esporos de placas de Petri inoculadas com A. oligospora com auxílio de uma espátula e 10 ml de água destilada esterilizada. A suspensão foi homogeneizada e transferida para tubos que foram agitados fortemente em agitador de tubos durante 10 segundos, e a seguir, filtrada em funil contendo gaze estéril. O número de esporos foi determinado em câmara de Neubauer. A concentração do inóculo foi ajustada para 1 x 105 esporos/ml e 0,5 ml desta suspensão foi adicionado a 50 ml de meio de cultura.
Crescimento do fungo A. oligospora
Em meio de cultura de Czapeck (7), estacionário, incubou-se o fungo por um período de 1 a 15 dias à uma temperatura de 30 ºC, realizando-se análises diárias do peso seco e do pH final do meio de cultura. O micélio foi separado do meio de cultura, através da filtração á vácuo empregando-se funil de Buchner, contendo papel de filtro Whatman N.º1, previamente seco à 105 °C por 24 horas. Foi medido o volume final do filtrado, após a retirada do micélio e o pH final. O crescimento do fungo foi quantificado em termos de peso seco micelial por ml de meio de cultura. Para isso, o micélio obtido após filtração, foi transferido para estufa à 105 ºC por 24 horas e, a seguir, pesado para se determinar o peso seco.
Efeito do pH no crescimento de A. oligospora
O meio de cultura foi ajustado para os valores de pH 3,0; 4,0; 5,0; 6,0; 7,0 e 8,0 empregando-se soluções de HCl 0,5M ou NaOH 0,5M. Após esterilização, caso necessário, o pH do meio de cultura foi novamente corrigido com estas soluções, em condições assépticas. O fungo foi inoculado e a seguir incubado por 8 dias à temperatura de 30o C.
Efeito da temperatura no crescimento de A. oligospora
O fungo foi inoculado no meio de cultura e crescido nas temperaturas de 20, 25, 30 e 35o C, por 8 dias.
Efeito das diferentes fontes de carbono no crescimento de A. oligospora .
Quando se pretendeu verificar o efeito das fontes de carbono, a sacarose foi substituída pelos carboidratos listados na Tabela 2. A concentração das fontes de carbono foi equivalente à da sacarose, isto é, 12,64 g C/l. As fontes de carbono foram esterilizadas separadamente do meio de cultura por filtração em filtro com porosidade de 45 mm, previamente esterilizado e adicionadas no momento da inoculação de forma asséptica. Os polissacarídeos (amido solúvel, pectina e celulose) foram adicionados na concentração de 1 g/l.
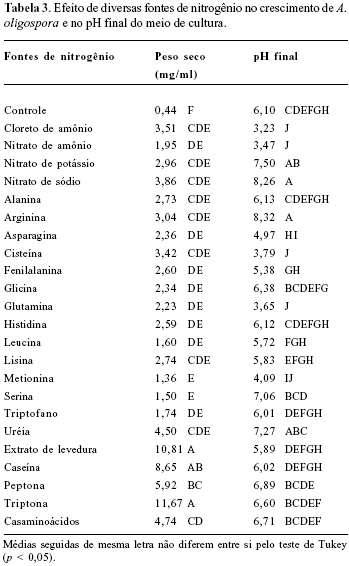
Efeito das diferentes fontes de nitrogênio no crescimento de A. oligospora
Quando se pretendeu avaliar o efeito da fontes de nitrogênio, o NaNO3 foi substituído pelas fontes nitrogenadas listadas na Tabela 3. A concentração das fontes de nitrogênio foi equivalente a do NaNO3, isto é, 0,33 N/l. As fontes de nitrogênio peptona, extrato de levedura, caseína e casaminoácidos foram adicionadas na concentração de 1 g/l. As diferentes fontes de nitrogênio foram esterilizadas juntamente com o meio de cultura.
Efeito das diferentes vitaminas e fatores de crescimento no crescimento de A. oligospora .
Quando se pretendeu avaliar o efeito das vitaminas, tiamina e biotina foram substituídas pelas vitaminas listadas na Tabela 4. As diferentes fontes de vitaminas foram esterilizadas separadamente do meio de cultura por filtração em filtro com porosidade de 45 mm, previamente esterilizado e, no momento da inoculação, adicionadas de forma asséptica.
Delineamento experimental e análise estatística
Para a análise estatística dos dados, utilizou-se delineamento experimental inteiramente casualizado e a análise de variância foi feita utilizando-se o programa SAS. Equações de regressão e coeficientes de determinação (R2) foram calculadas para verificar as relações entre o crescimento do fungo e o tempo de incubação. As médias foram comparadas pelo teste de Tukey.
RESULTADOS E DISCUSSÃO
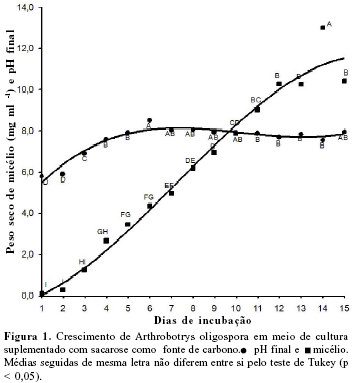
0 fungo A .oligospora foi crescido pelo período de 1 a 15 dias e os resultados obtidos de massa micelial e pH final estão na Figura 1. Estes resultados foram submetidos a análise de regressão, verificando-se que os valores de R2 foram semelhantes para as equações de 1o a 3o grau (Tabela 1), porém a produção micelial que melhor explica os resultados obtidos ajustou-se a uma curva de 3o grau. Esta curva apresenta uma fase de crescimento ascendente até o 14o dia, uma fase estacionária, do 14 ao 17o dia, e uma fase de declínio, após o 17o dia (dados não mostrados). Nas condições deste estudo, pode-se deduzir que até o 14o dia o fungo estaria apto a produzir as enzimas e outros compostos característicos do metabolismo primário (7) e necessários à predação dos nematóides O crescimento de A. conoides foi semelhante ao do A.oligospora deste estudo, obtendo-se aumento linear de biomassa até o 13o dia, seguida de uma fase estacionária (8). 0s valores de pH medidos diariamente, após a separação do micélio, mostraram alcalinização progressiva do meio de cultivo que culminou no 6o dia de incubação (pH 8,5), diminuindo, posteriormente, até 8,0 no 15o dia (Figura 1). Os resultados obtidos com os valores do pH final também se ajustaram a uma curva de 3o grau (Tabela 1). Possivelmente, o aumento do pH pode ser resultante da absorção seletiva de íons do meio de cultura (2).
Constatou-se aumento do crescimento de 49 vezes no 6o dia de incubação, quando foi observado o valor máximo de pH (pH = 8,5) e de 117 vezes no 15o dia em relação ao peso de micélio observado no 1o dia de incubação. Portanto, nestas condições, o aumento do pH final observado no meio de cultura não deve ter influído no crescimento do fungo. A partir do 6o dia de incubação, não houve variação do pH final (Tukey, p < 0,05).
0s resultados do efeito do pH inicial do meio de cultivo sobre o crescimento do fungo e o pH final do meio de cultura estão resumidos na Figura 2. 0 maior crescimento de A. oligospora ocorreu em pH inicial 5,0, obtendo-se 6,4 mg ml-1 peso seco. Este resultado assemelha-se ao obtido por A. conoides embora não tenha sido encontrada diferença com o crescimento máximo nos valores de pH inicial 4,0 e 6,0 (8). O crescimento do fungo foi reduzido de até 69 % e de até 21% em relação ao ótimo, respectivamente, para os valores de pH inicial inferiores ou superiores ao ótimo, mostrando que o crescimento desse fungo é bastante sensível à variação dos valores de pH inicial. Apesar do decréscimo de 21% em relação ao ótimo, não houve diferença significativa (p > 0,05) no peso seco micelial. Diferentemente dos resultados obtidos neste estudo, nenhuma influência do pH no crescimento de diversas espécies de Arthrobotrys em meio sólido foi constatada, porém maior esporulação foi obtida nos valores de pH inicial 4 e 6 (9).
Acompanhando o crescimento do fungo, observou-se aumento do pH final, que variou de 6,6 a 8,6 (Figura 2). Contudo, nenhuma diferença significativa no pH final foi observada a partir do pH inicial 4,0. Aparentemente, estes resultados contrapõem aos obtidos na Figura 1. Porém, foi relatado que diferentes enzimas contidas nos esporos são ativadas ou desativadas durante as fases de germinação, crescimento e estacionária dos fungos (28). Portanto, é possível admitir que as condições fisiológicas do fungo ora em crescimento podem ser diferentes das dos esporos inoculados no meio de cultura que devem responder de forma diversa à variação do pH inicial.
A temperatura ótima de crescimento do fungo A. oligospora foi de 25o C (6,4 mg ml-1 peso seco) e decresceu de 10%, 26% e 71% quando o fungo foi incubado nas temperaturas de 30oC, 20oC e 35oC, respectivamente (Figura 3). Contudo, não foi encontrada diferença significativa entre a produção micelial nas temperaturas de 25 e 30o C. A tendência da curva obtida com os resultados do pH final foi semelhante à do crescimento do fungo, embora o decréscimo do pH tenha sido menor para as mesmas temperaturas: 4%, 7% e 26%. Também, não foi encontrada diferença significativa entre os valores de pH final nas temperaturas de 25 e 30o C. Contrastando com os resultados obtidos neste estudo, a temperatura ótima de crescimento radial de um isolado de A. oligospora em corn-meal agar (CMA) ou faecal agar, após 14 dias de incubação, foi de 20 °C quando comparada com 10o C e 15o C (11). O crescimento radial de A. oligospora em meio CMA ocorreu na temperatura entre 20o C e 25o C e a captura de Heligmosomoides polygyrus entre 25o C e 28o C (19). A temperatura ótima de crescimento de A. conoides em meio líquido foi de 28o C (8), portanto uma temperatura mais próxima à encontrada neste trabalho. Também, maior crescimento e esporulação foram também obtidos na temperatura de 25o C por diferentes espécies de Arthrobotrys cultivadas em meio sólido (9).
Inúmeras fontes de carbono foram examinadas para avaliar sua habilidade para promover o crescimento de A. oligospora (Tabela 2). Considerando os extremos de crescimento micelial de 0,18 a 4,93 mg micélio ml-1, as fontes de carbono foram
divididas em três classes arbitrárias, isto é, as que proporcionaram alto crescimento do fungo, maior que 3,4 mg ml-1 (sacarose e maltose), médio, de 1,9 a 3,3 mg ml-1 (amido, rafinose, D-manitol, D-ribose, D-manose e D-frutose) e baixo crescimento, até 1,8 mg ml-1 (demais fontes de C). Portanto, A. oligospora tem crescimento limitado na maioria das fontes de carbono, possivelmente devido a sua inabilidade de absorver estes componentes (ausência de um sistema de transporte para o interior da célula). Muitas destas fontes de carbono tem sido encontradas no solo e na rizosfera, porém, observa-se que um número limitado de componentes pode suportar o crescimento rápido de A. oligospora. Estes resultados foram comparáveis aos observados com os fungos Acremonium coenophialum com 0 111 mg 20 ml-1(17) e Cordyceps sinensis com 0,96 4,45 g l-1 (10), crescidos em diversas fontes de carbono.
A maior produção de biomassa foi observada com os dissacarídeos maltose (4,93 mg micélio ml-1, peso seco) e sacarose (3,86 mg ml-1), que não diferiram significativamente entre si (p < 0,05), seguidos da hexose frutose (3,11 mg ml-1) (Tabela 2) e representam um aumento da massa micelial de 27,4, 21,4 e 17,3 vezes, respectivamente, em relação ao menor peso seco obtido com L-arabitol (0,18 mg ml-1). A incorporação destes carboidratos em A. oligospora não tem sido elucidada. Em outros fungos ocorre através de sistemas induzidos de transporte ativo dos açúcares ou dos hidrolisados inicialmente por sacarases em monossacarídeos assimiláveis (26).
Diferentes respostas foram obtidas do valor de pH final do meio de cultura, algumas delas aumentando e outras diminuindo o valor do pH inicial (pH 6,0). O maior valor foi obtido quando a fonte de carbono utilizada foi a pectina (pH 8,4), seguida de acetato, sacarose e frutose (pH 8,3) e o menor com ramnose (pH 5,9).
Dependendo da fonte de nitrogênio, o crescimento micelial variou de 1,36 a 11,67 mg ml-1 ou, excluindo-se as proteínas que foram adicionadas na quantidade de 1% e as quantidades de N não foram precisas, de 1,36 a 4,50 mg ml-1 (Tabela 3). Considerando os extremos de produção de biomassa, as fontes de nitrogênio foram divididas em três classes arbitrárias, isto é, as que proporcionaram baixo crescimento do fungo, até 2,3 mg ml-1 (metionina, serina, leucina e triptofano, nitrato de amônio, glutamina e glicina), médio, de 2,4 a 3,4 mg ml-1 (asparagina, histidina, fenilalanina, alanina, lisina, nitrato de potássio, arginina e cisteína) e alto crescimento, maior que 3,5 mg ml-1 (cloreto de amônio, nitrato de sódio, uréia, casaminoácidos, peptona, caseína, extrato de levedura e triptona). As fontes de nitrogênio que propiciaram maior crescimento fúngico que o obtido com o nitrato de sódio de 3,86 mg ml-1, com exceção da uréia, foram proteínas (Tabela 3). As proteínas devem ser degradadas por enzimas extracelulares para que ocorra sua assimilação (7). Esta propriedade confere aos fungos predadores de nematóides a habilidade de penetrar no hospedeiro. A identificação e o papel destas enzimas tem sido estudado em A. oligospora por vários autores (1, 29) e estão envolvidas na infecção do nematóides. As fontes de nitrogênio que propiciaram baixo e médio crescimento incluíram fontes inorgânicas e aminoácidos. Entre as fontes de nitrogênio inorgânico, a maior produção micelial de A. oligospora foi com nitrato de sódio que não diferiu significativamente do crescimento observado com cloreto de amônio ou nitrato de potássio. Há evidência de que nos fungos a assimilação de nitrato é induzida por meio de um sistema de transporte ativo. Relatos mostraram que no fungo Pisolithus tinctorius a enzima nitrato redutase foi induzida na presença de nitrato (2).
0 valor do pH final do meio de cultura variou de 3,2 a 8,3 significando que diminuiu para algumas fontes de nitrogênio e aumentou para outras em relação ao pH inicial (Tabela 3). Fontes inorgânicas de nitrogênio e orgânicas, incluindo aminoácidos e proteínas propiciaram tanto a diminuição como o aumento do pH final (Tabela 3). A diminuição do pH na presença de amônio pode ser devida à secreção de ácidos orgânicos, como foi observado em Aspergillus niger (20).
Entre as diversas vitaminas utilizadas no meio de cultura, biotina + tiamina foram as mais efetivas para o crescimento de A. oligospora, obtendo-se um peso seco de 6,98 mg micélio peso seco ml-1 e em seguida riboflavina (6,83 mg ml-1) e inositol (6,68 mg ml-1) (Tabela 4). O aumento do peso seco proporcionado pela mistura biotina + tiamina foi de 2,3 vezes em relação ao controle e de 2,2 vezes pela riboflavina ou inositol. Portanto, o crescimento deste fungo depende da produção destas vitaminas por outros organismos do solo, onde é encontrado, para seu ótimo crescimento. Foi obtido maior crescimento do fungo quando foi utilizado extrato de levedura (9,29 mg ml-1) em relação à mistura biotina + tiamina. Contudo, o extrato de levedura pode ter influído como fonte de nitrogênio (Tabela 3). O efeito da mistura biotina + tiamina está de acordo com resultados obtidos por outros autores (12, 25).
Muitas das vitaminas hidrossolúveis utilizadas neste estudo são precursoras de coenzimas que tem função catalítica na célula. Foi relatado que A. conoides, outro fungo predador de nematóide, também necessita destas vitaminas quando crescido em meio salino tendo glicose como fonte de carbono (8). Tiamina e biotina são provavelmente as vitaminas mais requeridas pelos fungos. A biotina em Neurospora crassa (21) e a tiamina em Acremonium coenophialum (17) foram essenciais para o máximo crescimento destes fungos em meio salino.
AGRADECIMENTOS
À FAPESP pela concessão de auxílio financeiro para o desenvolvimento do projeto de pesquisa e ao CNPq pela concessão de bolsa para um dos autores (EN).
REFERÊNCIAS BIBLIOGRÁFICAS
01. Åhman, J.; Johansson, T.; Olsson, M.; Punt, P.J. ; Van Den Hondel, C.A.M.J.J.; Tunlid, A. Improving the pathogenicity of a nematode-trapping fungus by genetic engineering of a subtilisin with nematotoxic activity. Applied and Environmental Microbiology, Washington, v.68, p.3408-3415, 2002.
02. Aouadj, R.; Es-Sgaouri, A; Button,B. Étude de la stabilité et de quelques propriétés de la nitrate réductase du champignon ectomycorhizien Pisolithus tinctorius. Cryptogamie Mycologie, Issy les Moulineaux, v.21, n.3, p.187-202, 2000.
03. Araújo, J.V. Inibição de captura de larvas infectantes de Cooperia punctata por fungos do gênero Arthrobotrys, utilizando carboidratos e lectinas. Revista Brasileira de Parasitologia Veterinária, São Paulo, v.10, n.1 , p.7-11, 2001.
04. Balogh, J.; Tunlid, A.; Rosén, S. Deletion of a lectin gene does not affect the phenotype of the nematode-trapping fungus Arthrobotrys oligospora. Fungal Genetics and Biology, Amsterdam, v.39, p.128-135, 2003.
05. Barron, G. L. Predatory fungi, wood decay, and the carbon cycle. Biodiversity, Canberra, v.4, p.3-9, 2003.
06. Barroso, C. B.; Pereira, G.T.; Nahas, E. Solubilization of CaHPO4 and AlPO4 by Aspergillus niger in culture media with different carbon and nitrogen sources. Brazilian Journal Microbiology, São Paulo, v.37, n.4, p.434-438, 2006.
07. Carlile, M. J.; Watkinson, S. C. The fungi. London: Academic Press, 1996. 486p.
08. Coscarelli, W.; Pramer, D. Nutrition and growth of Arthrobotrys conoides. Journal of Bacteriology, Washington, v.84, n.1, p.6064, 1962.
09. Dias, W.P.; Ferraz, S. Crescimento e esporulação de Arthrobotrys spp. em diferentes substratos, meios de cultura, pH e níveis de temperatura. Nematologia Brasileira, São Paulo, v.17, n.2, p.168-181, 1993.
10. Dong, C.H.; Yao, Y,J. Nutritional requirements of mycelial growth of Cordyceps sinensis in submerged culture. Journal of Applied Microbiology, Bedford, UK, v.99, p. 483-492, 2005.
11. Fernández, A. S.; Larsen, M.; Wolstrup, J.;Grønvold, J.; Nansen, P.; Bjørn, H. Growth rate and trapping efficacy of nematode-trapping fungi under constant and fluctuating temperatures. Parasitology Research, Berlin, v.85, n.8/9, p.661-668, 1999.
12. Friman, E.; Olsson, S.; Nordbring-Hertz. Heavy trap formation by Arthrobotrys oligospora. FEMS Microbiology Ecology, Reading, UK, v.31, p.17-21, 1985.
13. Greuning, M-Van; Eicker, A.; Van-Greuning, M. The morphology and physiology of Arthrobotrys oligospora, a weed mould on mushroom beds of Agaricus bisporus. Mushroom Research, v.1, p. 33-38, 1992.
14. Jaffee, B. A. Wood, nematodes, and the nematode-trapping fungus Arthrobotrys oligospora. Soil Biology and Biochemistry, Oxford, v.36, n.7, p.1171-1178, 2004.
15. Kanitkar, S. I.; Kanitkar, R.U. Nematodes capture by Arthrobotrys oligospora KTS 1001 A nematode hungry fungus. 2003. Disponível em: <http://www.biologicalresearch.com/india>. Acesso em: 10 set. 2007.
16. Kim, D.J.; Riggs, R.D. Biological control. American Phytopathological Society: Washington, 1992. p.133-142.
17. Kulkarni, R.K.; Nielsen, B.D. Nutritional requirements for growth of a fungus endophyte of tall fescue grass. Mycologia, New York, v.78, n.5, p.781-786, 1986.
18. Martin, J. P. Use of acid, rose bengal, and streptomycin in the plate method for estimating soil fungi. Soil Science, Maynard, v. 69, p. 215 232, 1950.
19. Morgan, M.; Behnke, J.M.; Lucas, J. A.; Peberdy, J. F.. In vitro assessment of the influence of nutrition, temperature and larval density on trapping of the infective larvae of Heligmosomoides polygyrus by Arthrobotrys oligospora, Duddingtonia flagrans and Monacrosporium megalosporum. Parasitology, Cambridge, v..115, v.3, p.303-10, 1997.
20. Nahas, E. Phosphate solubilizing microorganisms: Effect of carbon, nitrogen, and phosphorus sources. In Velázquez, E.; Rodríguez-Barrueco, C. (Ed.). First International Meeting on Microbial Phosphate Solubilization. Salamanca, Springer, Book Series: Development in Plant and Soil Sciences, v.102, 2007. p.111-115.
21. Nahas, E.; Terenzi, H.F.; Rossi, A. Effect of carbon source and pH on the production and secretion of acid phosphatase (EC 3.1.3.2.) and alkaline phosphatase (EC 3.1.3.1.) in Neurospora crassa. Journal of General Microbiology, London, v.128, p.2017 2021, 1982.
22. Nguyen, Vi L.; Justin L. Bastow, Bruce A. Jaffee and Don R. Strong. Response of nematode-trapping fungi to organic substrates in a coastal grassland soil. Mycological Research, Kew, Surrey, v.111, n.7, p.856-862, 2007.
23. Oliveira, R. D. L.; Ferraz, S.; Alfenas, A. C.; Dias-Arieira, C. R. Caracterização morfológica e isoenzimática de espécies de Arthrobotrys oligospora no Brasil. Nematologia Brasileira, São Paulo, v.26, p.181-197, 2002.
24. Persmark, L.; Banck, A.; Jansson, H-B. Population dynamics of nematophagous fungi and nematodes in an arable soil: vertical and seasonal fluctuations. Soil Biology and Biochemistry, Oxford, v.28, n.8, p.1005-1014, 1996.
25. Rosén, S.; Sjollema, K.; Veenhuis,M.; Tunlid, A. A cytoplasmic lectin produced by the fungus Arthrobotrys oligospora functions as a storage protein during saprophytic and parasitic growth. Microbiology, London, v.127, p.2593-2604, 1997.
26. Rubio, M.C.; Navarro, A.R. Regulation of invertase synthesis in Aspergillus niger. Enzyme and Microbial Technology, v.39, n.4, p.601-606, 2006.
27. Saxena, G.; Dayal, R., Mukerji, K. G. Nutritional studies on nematode- trapping fungi. Folia Microbiologica, Prague, v.34, p.42-48, 1989.
28. Schmit, J.C.; Brody, S. Biochemical genetics of Neurospora crassa conidial germination. Bacteriological Reviews, Washington, v.40, n.1, p.1-41,1976.
29. Tunlid, A.; Jansson, S. Protease and their involvement in the infection and immobilization of nematodes by the nematophagous fungus. Applied and Environmental Microbiology, Washington , v.57, n.10, p. 2868-2872, 1991.
Data de chegada: 24/11/2007
Aceito para publicação em: 08/10/2008
- 01. Åhman, J.; Johansson, T.; Olsson, M.; Punt, P.J. ; Van Den Hondel, C.A.M.J.J.; Tunlid, A. Improving the pathogenicity of a nematode-trapping fungus by genetic engineering of a subtilisin with nematotoxic activity Applied and Environmental Microbiology, Washington, v.68, p.3408-3415, 2002.
- 02. Aouadj, R.; Es-Sgaouri, A; Button,B. Étude de la stabilité et de quelques propriétés de la nitrate réductase du champignon ectomycorhizien Pisolithus tinctorius Cryptogamie Mycologie, Issy les Moulineaux, v.21, n.3, p.187-202, 2000.
- 03. Araújo, J.V. Inibição de captura de larvas infectantes de Cooperia punctata por fungos do gênero Arthrobotrys, utilizando carboidratos e lectinas. Revista Brasileira de Parasitologia Veterinária, São Paulo, v.10, n.1 , p.7-11, 2001.
- 04. Balogh, J.; Tunlid, A.; Rosén, S. Deletion of a lectin gene does not affect the phenotype of the nematode-trapping fungus Arthrobotrys oligospora Fungal Genetics and Biology, Amsterdam, v.39, p.128-135, 2003.
- 05. Barron, G. L. Predatory fungi, wood decay, and the carbon cycle. Biodiversity, Canberra, v.4, p.3-9, 2003.
- 06. Barroso, C. B.; Pereira, G.T.; Nahas, E. Solubilization of CaHPO4 and AlPO4 by Aspergillus niger in culture media with different carbon and nitrogen sources. Brazilian Journal Microbiology, São Paulo, v.37, n.4, p.434-438, 2006.
- 07. Carlile, M. J.; Watkinson, S. C. The fungi London: Academic Press, 1996. 486p.
- 08. Coscarelli, W.; Pramer, D. Nutrition and growth of Arthrobotrys conoides Journal of Bacteriology, Washington, v.84, n.1, p.6064, 1962.
- 09. Dias, W.P.; Ferraz, S. Crescimento e esporulação de Arthrobotrys spp. em diferentes substratos, meios de cultura, pH e níveis de temperatura. Nematologia Brasileira, São Paulo, v.17, n.2, p.168-181, 1993.
- 10. Dong, C.H.; Yao, Y,J. Nutritional requirements of mycelial growth of Cordyceps sinensis in submerged culture. Journal of Applied Microbiology, Bedford, UK, v.99, p. 483-492, 2005.
- 11. Fernández, A. S.; Larsen, M.; Wolstrup, J.;Grønvold, J.; Nansen, P.; Bjørn, H. Growth rate and trapping efficacy of nematode-trapping fungi under constant and fluctuating temperatures. Parasitology Research, Berlin, v.85, n.8/9, p.661-668, 1999.
- 12. Friman, E.; Olsson, S.; Nordbring-Hertz. Heavy trap formation by Arthrobotrys oligospora FEMS Microbiology Ecology, Reading, UK, v.31, p.17-21, 1985.
- 13. Greuning, M-Van; Eicker, A.; Van-Greuning, M. The morphology and physiology of Arthrobotrys oligospora, a weed mould on mushroom beds of Agaricus bisporus Mushroom Research, v.1, p. 33-38, 1992.
- 14. Jaffee, B. A. Wood, nematodes, and the nematode-trapping fungus Arthrobotrys oligospora Soil Biology and Biochemistry, Oxford, v.36, n.7, p.1171-1178, 2004.
- 15. Kanitkar, S. I.; Kanitkar, R.U. Nematodes capture by Arthrobotrys oligospora KTS 1001 A nematode hungry fungus. 2003. Disponível em: <http://www.biologicalresearch.com/india>. Acesso em: 10 set. 2007.
- 16. Kim, D.J.; Riggs, R.D. Biological control American Phytopathological Society: Washington, 1992. p.133-142.
- 17. Kulkarni, R.K.; Nielsen, B.D. Nutritional requirements for growth of a fungus endophyte of tall fescue grass. Mycologia, New York, v.78, n.5, p.781-786, 1986.
- 18. Martin, J. P. Use of acid, rose bengal, and streptomycin in the plate method for estimating soil fungi. Soil Science, Maynard, v. 69, p. 215 232, 1950.
- 19. Morgan, M.; Behnke, J.M.; Lucas, J. A.; Peberdy, J. F.. In vitro assessment of the influence of nutrition, temperature and larval density on trapping of the infective larvae of Heligmosomoides polygyrus by Arthrobotrys oligospora, Duddingtonia flagrans and Monacrosporium megalosporum. Parasitology, Cambridge, v.115, v.3, p.303-10, 1997.
- 20. Nahas, E. Phosphate solubilizing microorganisms: Effect of carbon, nitrogen, and phosphorus sources. In Velázquez, E.; Rodríguez-Barrueco, C. (Ed.). First International Meeting on Microbial Phosphate Solubilization Salamanca, Springer, Book Series: Development in Plant and Soil Sciences, v.102, 2007. p.111-115.
- 21. Nahas, E.; Terenzi, H.F.; Rossi, A. Effect of carbon source and pH on the production and secretion of acid phosphatase (EC 3.1.3.2.) and alkaline phosphatase (EC 3.1.3.1.) in Neurospora crassa Journal of General Microbiology, London, v.128, p.2017 2021, 1982.
- 22. Nguyen, Vi L.; Justin L. Bastow, Bruce A. Jaffee and Don R. Strong. Response of nematode-trapping fungi to organic substrates in a coastal grassland soil. Mycological Research, Kew, Surrey, v.111, n.7, p.856-862, 2007.
- 23. Oliveira, R. D. L.; Ferraz, S.; Alfenas, A. C.; Dias-Arieira, C. R. Caracterização morfológica e isoenzimática de espécies de Arthrobotrys oligospora no Brasil. Nematologia Brasileira, São Paulo, v.26, p.181-197, 2002.
- 24. Persmark, L.; Banck, A.; Jansson, H-B. Population dynamics of nematophagous fungi and nematodes in an arable soil: vertical and seasonal fluctuations. Soil Biology and Biochemistry, Oxford, v.28, n.8, p.1005-1014, 1996.
- 25. Rosén, S.; Sjollema, K.; Veenhuis,M.; Tunlid, A. A cytoplasmic lectin produced by the fungus Arthrobotrys oligospora functions as a storage protein during saprophytic and parasitic growth. Microbiology, London, v.127, p.2593-2604, 1997.
- 26. Rubio, M.C.; Navarro, A.R. Regulation of invertase synthesis in Aspergillus niger Enzyme and Microbial Technology, v.39, n.4, p.601-606, 2006.
- 27. Saxena, G.; Dayal, R., Mukerji, K. G. Nutritional studies on nematode- trapping fungi. Folia Microbiologica, Prague, v.34, p.42-48, 1989.
- 28. Schmit, J.C.; Brody, S. Biochemical genetics of Neurospora crassa conidial germination. Bacteriological Reviews, Washington, v.40, n.1, p.1-41,1976.
- 29. Tunlid, A.; Jansson, S. Protease and their involvement in the infection and immobilization of nematodes by the nematophagous fungus. Applied and Environmental Microbiology, Washington , v.57, n.10, p. 2868-2872, 1991.
Datas de Publicação
-
Publicação nesta coleção
20 Jan 2010 -
Data do Fascículo
Dez 2009
Histórico
-
Aceito
08 Out 2008 -
Recebido
24 Nov 2007