Resumos
Desde sua descrição, há mais de 40 anos, a pesquisa de anticorpos (Ac) contra antígenos (Ag) tiroideanos tem tido papel importante no diagnóstico da patologia tiroideana. A tiróide é freqüentemente acometida por doenças autoimunes, daí o interesse pela definição dos Ag tiroideanos que podem estar envolvidos no processo. O primeiro Ag reconhecido foi a tireoglobulina, seguido do "fator microssomal", mais tarde identificado como a peroxidase tiroideana, o receptor de TSH e mais recentemente outros Ag como o cotransportador de sódio e iodo (sodium/iodide symporter, NIS). As metodologias evoluíram dos ensaios iniciais por hemaglutinação até o emprego atual de Ag recombinantes, marcadores alternativos e células transfectadas. Atualmente as indicações clínicas da pesquisa de Ac anti-tiroideanos são bem definidas, sendo o de maior aplicação a pesquisa de Ac anti-peroxidase, que é o que apresenta maior especificidade e sensibilidade para a definição da presença de doença autoimune tiroideana. A pesquisa de Ac anti-tireoglobulina é fundamental como complemento da dosagem de tireoglobulina no acompanhamento de pacientes com carcinoma diferenciado de tiróide. Já a pesquisa de Ac anti-receptor de TSH tem indicação precisa na definição da presença de doença de Graves. As indicações de pesquisa de Ac contra outros Ag tiroideanos não têm, atualmente, indicações comprovadas. A contínua evolução metodológica deverá aumentar ainda mais as indicações e utilidades da pesquisa de Ac contra Ag tiroideanos.
Anticorpos anti-tiróide; Anticorpos anti-peroxidase tiroidiana; Anticorpos anti-tireoglobulina; Anticorpos anti-receptor de TSH
Since the first publication, more than 40 years ago, laboratory tests for the presence of antibodies (Ab) to thyroid antigens (Ag) have played a pivotal position in the diagnosis of thyroid diseases. Thyroid is a common target for autoimmune diseases, hence the interest in the definition of the thyroid Ag that could be involved in the process. The first Ag to be recognized was thyroglobulin, followed by the "microsomal Ag", later identified with thyroid peroxidase, the TSH receptor and, more recently, other Ag like the sodium/iodide symporter (NIS). The methodologies employed evolved from the initial hemaglutination assays, to the present use of recombinant Ag, alternative labels and transfected cells. Today the clinical uses of a test to detect the presence of Ab against thyroid Ag are very well defined. The most useful test is the detection of anti-peroxidase Ab, the test with greatest sensitivity and specificity for the presence of autoimmune thyroid diseases. The anti-thyroglobulin test is mandatory as a complement for the measurement of thyroglobulin in the follow-up of patients with differentiated thyroid cancers. The anti-TSH receptor test has its main use in the definition of the presence of Graves’ disease. Tests for the presence of Ab against other thyroid Ag have no clear indication at the moment. The continuous methodological developments will certainly increase the utility of tests for anti-thyroid Ab.
Anti-thyroid antibodies; Anti-thyroid peroxidase antibodies; Anti-thyroglobulin antibodies; Anti-TSH receptor antibodies
PERSPECTIVAS
Anticorpos anti-tiróide: aspectos metodológicos e importância diagnóstica
Anti-thyroid antibodies: methodological aspects and diagnostic significance
José Gilberto H. Vieira; Teresa S. Kasamatsu; Omar M. Hauache; Rui M.B. Maciel
Disciplina de Endocrinologia, Departamento de Medicina, Universidade Federal de São Paulo (UNIFESP/EPM); e Fleury Centro de Medicina Diagnóstica, São Paulo, SP
Endereço para correspondência Endereço para correspondência José Gilberto H. Vieira Fleury Centro de Medicina Diagnóstica Av. General Waldomiro de Lima 508 04344-070 São Paulo, SP
RESUMO
Desde sua descrição, há mais de 40 anos, a pesquisa de anticorpos (Ac) contra antígenos (Ag) tiroideanos tem tido papel importante no diagnóstico da patologia tiroideana. A tiróide é freqüentemente acometida por doenças autoimunes, daí o interesse pela definição dos Ag tiroideanos que podem estar envolvidos no processo. O primeiro Ag reconhecido foi a tireoglobulina, seguido do "fator microssomal", mais tarde identificado como a peroxidase tiroideana, o receptor de TSH e mais recentemente outros Ag como o cotransportador de sódio e iodo (sodium/iodide symporter, NIS). As metodologias evoluíram dos ensaios iniciais por hemaglutinação até o emprego atual de Ag recombinantes, marcadores alternativos e células transfectadas. Atualmente as indicações clínicas da pesquisa de Ac anti-tiroideanos são bem definidas, sendo o de maior aplicação a pesquisa de Ac anti-peroxidase, que é o que apresenta maior especificidade e sensibilidade para a definição da presença de doença autoimune tiroideana. A pesquisa de Ac anti-tireoglobulina é fundamental como complemento da dosagem de tireoglobulina no acompanhamento de pacientes com carcinoma diferenciado de tiróide. Já a pesquisa de Ac anti-receptor de TSH tem indicação precisa na definição da presença de doença de Graves. As indicações de pesquisa de Ac contra outros Ag tiroideanos não têm, atualmente, indicações comprovadas. A contínua evolução metodológica deverá aumentar ainda mais as indicações e utilidades da pesquisa de Ac contra Ag tiroideanos.
Descritores: Anticorpos anti-tiróide; Anticorpos anti-peroxidase tiroidiana; Anticorpos anti-tireoglobulina; Anticorpos anti-receptor de TSH
ABSTRACT
Since the first publication, more than 40 years ago, laboratory tests for the presence of antibodies (Ab) to thyroid antigens (Ag) have played a pivotal position in the diagnosis of thyroid diseases. Thyroid is a common target for autoimmune diseases, hence the interest in the definition of the thyroid Ag that could be involved in the process. The first Ag to be recognized was thyroglobulin, followed by the "microsomal Ag", later identified with thyroid peroxidase, the TSH receptor and, more recently, other Ag like the sodium/iodide symporter (NIS). The methodologies employed evolved from the initial hemaglutination assays, to the present use of recombinant Ag, alternative labels and transfected cells. Today the clinical uses of a test to detect the presence of Ab against thyroid Ag are very well defined. The most useful test is the detection of anti-peroxidase Ab, the test with greatest sensitivity and specificity for the presence of autoimmune thyroid diseases. The anti-thyroglobulin test is mandatory as a complement for the measurement of thyroglobulin in the follow-up of patients with differentiated thyroid cancers. The anti-TSH receptor test has its main use in the definition of the presence of Graves disease. Tests for the presence of Ab against other thyroid Ag have no clear indication at the moment. The continuous methodological developments will certainly increase the utility of tests for anti-thyroid Ab.
Keywords: Anti-thyroid antibodies; Anti-thyroid peroxidase antibodies; Anti-thyroglobulin antibodies; Anti-TSH receptor antibodies
DESDE A DESCRIÇÃO, POR ROITT E COLS. em 1956 (1), da presença de anticorpos anti-tiroglobulina no soro de pacientes com tiroidite de Hashimoto, a origem autoimune de algumas das principais patologias tiroideanas passou a ser considerada e estudada. Na mesma época, foi descrito o desenvolvimento de tiroidite linfocítica em animais imunizados com antígenos tiroideanos homólogos (2), bem como o fenômeno da presença, no soro de pacientes com doença de Graves, de um fator estimulante da função tiroideana de ação prolongada (Long-Acting Thyroid Stimulator, LATS) (3), que, posteriormente, foi caracterizado como uma imunoglobulina. Desde então, a pesquisa de anticorpos circulantes contra antígenos tiroideanos tem tido importante papel no estudo de várias patologias tiroideanas muito freqüentes, em especial a tiroidite autoimune crônica, ou tiroidite de Hashimoto, além do hipertiroidismo conseqüente à estimulação endógena observada na doença de Graves.
Anticorpos contra diversos antígenos tiroideanos forma descritos, tais como a tiroglobulina (Tg), a peroxidase tiroideana (TPO), o receptor de TSH, o co-transportador de sódio e iodo (Sodium-Iodide symporter, NIS), um segundo antígeno coloidal independente da tiroglobulina (CA2), além de outros antígenos clonados a partir de bibliotecas de DNA complementar de origem tiroideana. Na realidade, do ponto de vista prático, anticorpos contra Tg, TPO e receptor de TSH são os que têm importância clínica comprovada e é sobre eles que vamos discorrer nesta revisão, e complementarmente sobre os anticorpos contra o NIS, que ainda se encontram em fase de estudos preliminares.
O papel da pesquisa da presença de anticorpos contra antígenos tiroideanos tem sido cada vez mais destacado, em especial com as publicações recentes salientando sua importância preditiva em populações, e seu papel na linha de frente da definição de patologias tiroideanas comuns (4-7). Um aspecto adicional é a dependência da percentagem de positividade do teste com relação à idade da população estudada, desde que observa-se um nítido aumento da freqüência de testes positivos em grupos etários mais idosos (8). Destas constatações deriva a necessidade de melhor compreensão e correta avaliação das qualidades e limitações das diferentes metodologias. Estas informações devem ser amplamente divulgadas, e devem ser consideradas quando da interpretação de um resultado laboratorial. O assunto adquire mais complexidade com a dificuldade de comparação entre metodologias devido à extrema diversidade de métodos existentes, associada à diversidade da resposta imunológica em diferentes pacientes. Com relação a este último aspecto, diversos estudos têm demonstrado a complexidade imunológica dos diferentes antígenos tiroideanos, e a diversidade de resposta observada nos pacientes (9-11), além de um fato complicador adicional que é a observação de que a tiroglobulina e a peroxidase tiroideana têm alguns epítopos comuns (12,13). Apesar das tentivas que têm sido feitas procurando uma padronização a nível mundial (14), os resultados ainda são método dependentes e acabam gerando dúvidas e dificuldades de interpretação. Recente publicação da National Academy of Clinical Biochemistry, versando sobre a utilidade das dosagens laboratoriais no diagnóstico e monitoramento de doenças tiroideanas, discute profundamente todos os testes disponíveis e suas utilidades, inclusive os testes para a pesquisa de anticorpos antiróide. O texto completo é disponível via Internet no site http://www.nacb.org. O intuito desta revisão é tentar clarear um pouco o tema, atualizando o conhecimento sobre o assunto, dando ênfase a aspectos metodológicos e à real importância da medida dos diferentes anticorpos em várias condições clínicas.
ASPECTOS METODOLÓGICOS GERAIS
A evolução dos métodos empregados para a pesquisa dos diferentes anticorpos contra antígenos tiroideanos reflete a evolução metodológica em geral. Os primeiros métodos empregados foram hemaglutinação (1,15) e bioensaio (3), seguindo-se diversas outras metodologias, na medida em que técnicas mais sensíveis, específicas, simples e rápidas foram sendo disponíveis ao longo destes mais de 40 anos de evolução. Assim, ensaios baseados em imunofluorescência indireta foram empregados, bem como diversos tipos de ensaios competitivos baseados no emprego do antígeno marcado (com diferentes marcadores) e ensaios não competitivos baseados em captura/revelação com anti-IgG marcada, imunoprecipitação e outras variáveis metodológicas. Adicione-se a este vasto arsenal alguns ensaios específicos, como os bioensaios in vitro para a pesquisa de anticorpos anti-receptor de TSH (16,17).
Na realidade, os resultados da pesquisa dos anticorpos anti-tiróide, em especial dos anticorpos anti-Tg e anti-TPO, são bastante dependentes dos métodos empregados. Um primeiro aspecto, bastante óbvio, se refere à sensibilidade dos métodos. Assim, encontramos maior percentagem de casos positivos quando empregamos radioimunoensaio para a medida de anticorpos anti-TPO do que encontrávamos com os antigos ensaios baseados em hemaglutinação (8). Um segundo aspecto a ser considerado já é bastante mais complexo e se refere aos antígenos empregados, desde que via de regra estes são diferentes (purificados segundo metodologias diversas e com grau de pureza também diverso) quando comparamos diferentes ensaios de diferentes procedências. Como a resposta imunológica varia individualmente e é, até prova em contrário, policlonal, e os antígenos em questão são proteínas complexas, é de se esperar uma resposta bastante variável de indivíduo a indivíduo (9,18). A conseqüência desta observação, associada à utilização de antígenos diversos, acarreta resultados diferentes com os diversos métodos disponíveis. Na maioria dos casos, existe uma boa correlação entre eles (19,20), porém, numericamente, os resultados podem ser muito distintos.
Esta última observação levanta um terceiro aspecto metodológico que deve ser considerado, o do padrão de referência empregado. Diferentemente de qualquer dosagem de uma substância definida, estamos tratando de determinar e quantificar resposta imunológica com todas as variáveis já descritas. A solução atual, se bem que não ideal, é a utilização de pools de soros positivos, arbitrariamente calibrados, e distribuídos em escala mundial com o objetivo de tentar auxiliar na uniformização dos resultados. Assim, o National Institute for Biological Standards and Control (NIBSC), localizado na Inglaterra e pertencente à rede de laboratórios da Organização Mundial de Saúde (WHO), distribui três preparações:
a. 1st International Reference Preparation, anti-thyroglobulin serum, human, NIBSC code 65/93, que é empregado para padronizar as determinações de anticorpos anti-tiroglobulina, contendo 1000 unidades internacionais por ampola;
b. Anti-Thyroid Microsome serum, NIBSC research standard, code 66/387, empregado para padronizar as determinações de anticorpos anti-TPO, contendo 1000 unidades internacionais por ampola;
c. 1st International Standard, 1995, thyroid stimulating antibody, serum, human, NIBSC code 90/672, empregado para as determinações de anticorpos anti-receptor de TSH, contendo 0,1 unidades internacionais por ampola.
Evidentemente, por serem preparações baseadas em pools de soros positivos, apresentam as mesmas limitações citadas para os soros de pacientes individuais, se bem que minimizadas por se tratar de mistura de vários soros. Exemplificando estas limitações, o padrão de anti-Tg também é positivo para anti-TPO e vice-versa, como ocorre freqüentemente na prática.
Um último aspecto metodológico refere-se à definição do valor de corte a ser empregado, ou melhor, responder à pergunta prática: a partir de que valor consideramos um resultado positivo? Quando estudamos metodologias mais estandardizadas, a comparação quantitativa entre métodos permite, no caso de concordância, a aceitação de valores normais tradicionais. Neste caso, como a concordância numérica entre métodos é, como já vimos, bastante rara, é necessário o emprego de metodologias mais estritas para a definição dos valores de corte. Dentre estas, destaca-se a construção de curvas ROC (receiver-operating characteristic), considerado o melhor instrumento para a definição da utilidade clínica de um teste laboratorial (21). A construção de uma curva ROC incorpora resultados obtidos em patologias definidas por um padrão-ouro e resultados obtidos em populações normais. Como sempre, existe superposição de valores (como ocorre na grande maioria dos testes laboratoriais), a definição do valor de corte dependerá da pré-definição da sensibilidade e/ou da especificidade diagnósticas (22).
ANTICORPOS ANTI-TIROGLOBULINA (Tg)
A tiroglobulina é quantitativamente a proteína mais importante da tiróide e, desde a descrição pioneira de Roitt e cols. em 1956 (1), sabemos estar envolvida no fenômeno da resposta autoimune. Sendo uma proteína complexa, de alto peso molecular e com variações importantes de estrutura (23,24), não é de estranhar que as respostas autoimunes observadas em diferentes pacientes e em diferentes patologias apresentem variações significativas (9). Os primeiros métodos descritos baseavam-se em técnicas de hemaglutinação passiva, sendo seu resultado expresso em diluição ("título") (25). Estes métodos, apesar de sua leitura semi-quantitativa e de sua sensibilidade não ótima, serviram de base para os primeiros estudos clínicos, incluindo o trabalho pioneiro de Medeiros-Neto e col. em nosso meio (26). A evolução metodológica da pesquisa de anticorpos anti-Tg acompanhou a evolução técnica geral, e atualmente são disponíveis métodos altamente sensíveis e automatizados para o teste. A especificidade e valor preditivo dos resultados depende muito do antígeno (tiroglobulina) utilizado no teste, mas existe uma satisfatória comparação em termos de sensibilidade e especificidade diagnósticas entre os métodos mais comumente empregados (19,27). No entanto, uma comparação entre os testes mais antigos, por hemaglutinação, e os novos parece indicar que os últimos apresentam maior sensibilidade diagnóstica (8,27). Um fator adicional de complexidade é a observação de que o grau de iodinação da tiroglobulina altera sua estrutura, o que poderia acarretar em diferenças de resposta individual e, conseqüentemente, na detecção por diferentes ensaios, na dependência do aporte de iodo (28).
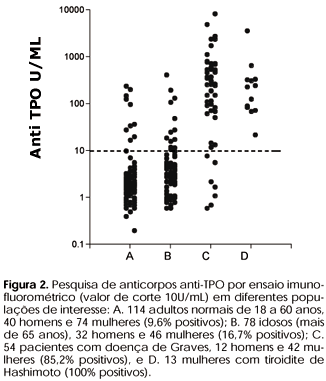
Com o advento de testes rotineiros para a pesquisa de anticorpos anti-TPO, uma pergunta prática se impôs: é realmente necessária a pesquisa dos dois tipos de anticorpos (anti-Tg e anti-TPO) no estudo de pacientes suspeitos de serem portadores de doenças autoimunes tiroideanas? Alguns estudos baseados em metodologias atualmente não mais empregadas mostravam serem os dois testes equivalentes, sendo que em percentagem significativa de casos somente um dos dois era positivo (29). No entanto, a maioria dos dados recentes disponíveis demonstra com clareza que, quando o objetivo é o diagnóstico de patologias autoimunes da tiróide, a determinação de anticorpos anti-TPO apresenta sensibilidade e especificidade superiores (6,20,30). Esta observação está demonstrada nas figuras 1 e 2, que apresentam os resultados por nós obtidos em 4 diferentes populações testadas quanto à presença de anticorpos anti-Tg por ensaio imunofluorométrico (figura 1) e anti-TPO por ensaio imunofluorométrico (figura 2) (31). O exame detalhado da figura 1 mostra a percentagem crescente de valores falso-positivos com o aumento da idade e as percentagens significativas de valores falso-negativos obtidos em pacientes que indubitavelmente apresentavam patologia auto-imune da tiróide. Estes dados não são surpreendentes e são plenamente compatíveis com os dados da literatura para métodos semelhantes (6,8). Uma utilidade indiscutível da pesquisa de anticorpos anti-Tg é como complemento à dosagem de tiroglobulina, fundamental no seguimento de pacientes com carcinoma diferenciado de tiróide (32). Além disso, a determinação de anticorpos anti-Tg parece ter valor prognóstico complementar nesses pacientes em seguimento de carcinoma diferenciado de tiróide. Isto porque espera-se que esses pacientes apresentem uma involução dos níveis de anticorpos após a extirpação total do tecido tiroideano (33).
Uma variante relativamente rara dos anticorpos anti-Tg são aquelas que cruzam com tiroxina e triiodotironina (34). Como os hormônios tiroideanos são formados dentro da estrutura da tiroglobulina, não seria de estranhar que alguns anticorpos apresentem reatividade contra T4 e/ou T3. Estes anticorpos são, em geral, de baixa afinidade, porém podem interferir de maneira significativa nos ensaios de T3 e T4 totais ou livres (35).
ANTICORPOS ANTI-PEROXIDASE TIROIDEANA (TPO)
A descrição de um segundo antígeno tiroideano, diferente da tiroglobulina, foi feita com base em observações de estudos de imunofluorescência que mostravam reatividade localizada na membrana celular e no seu citoplasma, além do colóide. Por sua localização, o antígeno passou a ser descrito como "antígeno microssomal" (36). Hoje sabe-se, com base em estudos comparativos e bioquímicos, que na realidade o "antígeno microssomal" é a peroxidase tiroideana (37-40). A peroxidase tiroideana (TPO) é uma glicoproteína de membrana composta de 933 aminoácidos e com peso molecular entre 105 e 110kDa na sua forma monomérica, e de 220 a 230kDa na forma dimérica funcional (41). A TPO é uma molécula complexa e vários epítopos foram descritos em sua estrutura, sendo alguns caracterizados como dominantes (42).
Os métodos para determinação da presença de anticorpos contra o "fator microssomal" e, posteriormente, contra a peroxidase tiroideana apresentaram evolução semelhante à observada para os métodos para a medida de anticorpos anti-Tg. De início, os métodos eram semi-quantitativos, baseados em técnicas de hemaglutinação (43), tendo a metodologia evoluído para ensaios mais precisos, sensíveis e automatizados (20,44,45). Um dos problemas, já mencionados na introdução, é a dificuldade em se comparar resultados obtidos com diferentes metodologias. Este aspecto pode ser visualizado na figura 3, onde estão representados os resultados por nós obtidos (dados não publicados) com dois métodos comerciais bastante atuais em uma série de soros positivos para anticorpos anti-TPO. Fica evidente a excelente correlação entre os métodos, mas com valores absolutos bastante diferentes, apesar da preparação de referência ser a mesma para os dois métodos. Uma das explicações teóricas para o fenômeno seria o tipo de antígeno empregado, desde que antígenos recombinantes e antígenos extraídos de tecido humano apresentam comportamento imunológico diferente (46).
Alguns estudos amplos e bem conduzidos mostraram claramente a importância da determinação da presença de anticorpos anti-TPO como dado preditor da evolução para hipotiroidismo (4,6). Este fato coloca o teste como indicado em algumas circunstâncias clínicas, onde uma predisposição para o desenvolvimento de doença tiroideana autoimune pode alterar uma conduta terapêutica ou indicar um seguimento mais cuidadoso. Isto ocorre, por exemplo, em pacientes que iniciarão terapêutica com amiodarona, lítio, interleucina-2 e interferon alfa, ou em grávidas, condições que sabidamente trazem como risco o desenvolvimento de hipotiroidismo. Um outro aspecto de interesse prático, e que fica evidente analisando-se a figura 2, é o aumento da incidência de casos positivos com a idade. Esta observação coincide com a maior incidência de doenças tiroideanas autoimunes com a idade (4-6).
ANTICORPOS ANTI-RECEPTOR DE TSH (TR)
O receptor de TSH é uma glicoproteína localizada na membrana celular dos tirócitos e pertencente à família dos receptores transmembrana acoplados à proteina G. É muito semelhante aos receptores de LH e de FSH, diferindo pela presença de inserções na porção extra-celular que o tornam maior e com algumas características peculiares. Ele é composto de uma sub-unidade B, que se extende do intracelular e faz sete alças transmembrana, uma sub-unidade A, extracelular onde o TSH se acopla, e um peptídeo de conexão, que possui um sítio de clivagem. A ligação entre a presença de anticorpos anti-receptor de TSH (TRAb) e doenças autoimunes tiroidianas, em especial de doença de Graves, é hoje muito bem estabelecida (47). Ela foi estabelecida pela primeira vez no trabalho pioneiro de Adams e Purves (3), e o estudo do fenômeno teve um avanço significativo após a clonagem do receptor e sua localização no cromossoma 14q (48,49). Trabalhos recentes, demonstrando a liberação em circulação da porção extracelular (sub-unidade A) do receptor após clivagem, têm trazido novos conceitos e aumentado a compreensão do fenômeno (50,51).
As metodologias disponíveis para a detecção de anticorpos circulantes contra o receptor de TSH são limitadas por dois fatores técnicos importantes: a pouca disponibilidade de preparações de receptores de TSH e a baixa concentração de anticorpos nos pacientes que os apresentam. Quanto ao primeiro fator limitante, receptores de TSH obtidos de tiróide porcina têm sido utilizados com êxito em alguns modelos de ensaio, o que tem contornado em parte o problema (52). Quanto à baixa concentração dos anticorpos, esta é uma limitação que deve ser vencida com a utilização de ensaios cada vez mais sensíveis, desde que a concentração de anticorpos anti-TR se situa na faixa de ng/mL, enquanto as de anticorpos anti-TPO são, em geral, de 100 a 1000 vezes superiores (53). Do ponto de vista técnico, as metodologias empregadas podem ser divididas em três tipos principais:
métodos baseados em inibição da ligação de TSH marcado a receptor isolado, em fase líqüida ou sólida, ou em células que expressam o receptor naturalmente ou por transfecção (52,54-56);
métodos baseados na medida do efeito biológico observado em células expressando receptor de TSH naturalmente ou por transfecção (17,57-59);
métodos baseados em citometria de fluxo (60).
Cada uma destas variantes metodológicas tem vantagens e desvantagens, e aplicações específicas. Assim, os métodos do primeiro grupo são os mais simples e de utilização mais abrangente, podendo empregar receptores extraídos de tiróide porcina ou humana, receptores humanos completos ou apenas a sub-unidade A. Associa-se a estas características níveis de sensibilidade, se não ideais, bastante aceitáveis. Os receptores podem ser empregados em solução, ancorados à fase sólida, ou expressos na superfície de células, e o TSH marcado pode o ser com Iodo 125 ou acridínio. Trabalhos recentes comprovam que o emprego de fase sólida e marcação com acridínio proporcionam a obtenção de maior sensibilidade, além do detalhe de que receptores humanos recombinantes auxiliam na obtenção dessa maior sensibilidade (55,61). O grande problema que limita os ensaios do primeiro tipo é o fato de que eles não são capazes de distingüir anticorpos estimuladores dos inibidores, desde que o fenômeno observado é apenas a competição com TSH marcado. Daí o uso da nomenclatura TBII ou thyrotropin-binding inhibitor immunoglobulin, nome pelo qual os ensaios que não distingüem entre a atividade estimuladora e bloqueadora são conhecidos na literatura internacional. Apesar dos anticorpos inibidores serem significativamente mais raros que os estimuladores, eles podem ter importância na definição etiológica de casos de hipotiroidismo, e na evolução natural de doença de Graves. Já os métodos do segundo tipo permitem, pelo estudo do fenômeno biológico induzido, classificar os anticorpos em predominantemente estimuladores ou inibidores, sendo os primeiros conhecidos na literatura internacional como TSAb ou thyroid stimulating antibodies, e os segundos como TBAb ou TSH receptor blocking antibodies. Os ensaios empregam células que expressam, naturalmente ou após transfecção, o receptor de TSH; o estudo do efeito biológico induzido, bem como o efeito das imunoglobulinas na estimulação induzida por TSH, servem de base para os ensaios. O sinal detectado pode ser a geração de AMP cíclico, a incorporação de timidina triciada ou mesmo a captação de iodo radioativo. São ensaios mais complexos e sua aplicação se dá apenas em laboratórios de referência, sendo que publicação recente nos "Arquivos" mostrou a excelente experiência de grupo de referência em nosso meio utilizando o bioensaio com células CHO transfectadas (62).
Já os métodos baseados em citometria de fluxo são comparáveis aos do primeiro grupo, porém mais complexos, com a exigência de equipamento especial mas com a vantagem potencial de poder distingüir o subtipo de imunoglobulina (60).
Quanto à utilidade prática da pesquisa de anticorpos anti-receptor de TSH, desde que os ensaios mais sensíveis chegam a detectar a presença de anticorpos em mais de 95% dos pacientes com doença de Graves não tratada (55,62), sua utilidade diagnóstico-potencial é grande. No entanto, do ponto de vista prático, diagnóstico clínico e laboratorial de um caso típico de doença de Graves prescinde deste recurso diagnóstico. Sua indicação é indubitável em algumas condições clínicas bem definidas, como, por exemplo, tirotoxicose na gravidez, tirotoxicose neonatal, tirotoxicose subclínica com bócio difuso e oftalmopatia com eutiroidismo. Seu valor como preditor de remissão ou recidiva de doença de Graves tem uma lógica irretorquível, no entanto é bastante discutido e discutível, não havendo ainda um consenso formal sobre o assunto (63-65). Evidentemente, todas estas consideração são válidas tendo como base os métodos atualmente disponíveis. O desenvolvimento de métodos mais sensíveis e práticos, com potencial de discriminação entre anticorpos estimuladores e bloqueadores, pode abrir novas perspectivas para a utilização prática da pesquisa de anticorpos anti-TR. Esta possibilidade parece mais próxima com a recente descrição de anticorpos monoclonais com atividade estimuladora e/ou inibidora, que podem vir a ser empregados no desenvolvimento de ensaios mais sensíveis e específicos (66-68).
ANTICORPOS ANTI-COTRANSPORTADOR DE SÓDIO E IODO (Na-I Symporter, NIS)
A recente descrição e clonagem da proteína responsável pelo transporte de iodo para dentro da célula tiroideana (69), além de melhorar nosso conhecimento sobre a fisiologia do tirócito, introduziu mais um potencial antígeno tiroideano. Trata-se de uma glicoproteína, de peso molecular aproximado de 80kDa, que se arranja numa estrutura com 13 domínios transmembrana, e cataliza o transporte ativo de iodo para dentro das células foliculares tiroideanas (70). Como este transporte está acoplado ao do sódio, a proteína foi denominada de cotransportador de sódio e iodo (Na-I symporter, ou NIS). O papel da nova proteína como antígeno alvo de anticorpos anti-tiroideanos foi recentemente estudado numa série de trabalhos bastante abrangentes (71-73), e a conclusão é a de que se existe importância prática na detecção destes anticorpos, ela se limita a casos muito selecionados. Os métodos empregados foram de vários tipos, desde bioensaios baseados em captura de iodo (71,74), até imunoprecipitação (72,74), mas a conclusão é que a incidência de casos positivos é baixa. Pode-se conjeturar que o desenvolvimento de ensaios mais sensíveis pode levar a uma maior utilidade do ensaio para anticorpos anti-NIS, mas esta não é a realidade do momento.
CONSIDERAÇÕES GERAIS E CONCLUSÕES
Nesta revisão, procuramos abordar aspectos metodológicos e relacionados ao uso prático da pesquisa de anticorpos contra antígenos tiroideanos. Alguns aspectos são marcantes e merecem considerações. Em primeiro lugar, o fato de que, mesmo depois de quase 50 anos da descrição pioneira de Roitt e cols. (1), o assunto permanece em evolução e ainda não completamente definido. Métodos moleculares permitiram a melhor definição dos antígenos conhecidos, bem como a descrição de novos como o NIS já comentado e a Pendrina, recém descrita (75). Quanto ao uso prático dos testes de pesquisa de anticorpos contra os principais antígenos, hoje em dia são indiscutíveis algumas conclusões: o principal teste, ou seja, o que apresenta maior sensibilidade diagnóstica para doenças autoimunes tiroideanas, é a pesquisa de anticorpos anti-TPO. A pesquisa de anticorpos anti-Tg e anti-TR tem aplicações específicas bem definidas onde são de grande interesse prático. A pesquisa de anticorpos contra outros antígenos tiroideanos como o NIS e Pendrina não tem utilidade ainda conprovada. Outro aspecto importante que emerge da enorme quantidade de estudos feitos sobre o assunto é o limitado valor dos anticorpos no estudo da progressão das doenças autoimunes tiroideanas. Com raras exceções, a pesquisa de anticorpos anti-antígenos tiroideanos tem muito mais valor diagnóstico do que prognóstico. Estas observações não tiram da pesquisa de anticorpos anti-tiroideanos, em especial anti-TPO, o papel de teste de linha de frente para a maior parte das doenças tiroideanas.
Recebido em 13/03/03
Revisado em 04/06/03
Aceito em 06/06/03
- 1. Roitt IM, Doniach D, Campbell PN, Hudson RV. Autoantibodies in Hashimotos disease (lymphadenoid goitre). Lancet 1956;2:820-1.
- 2. Rose NR, Witebsky E. Studies on organ specificity. V. Changes in the thyroid gland of rabbits following active immunization with rabbit thyroid extracts. J Immunol 1956;76:417-22.
- 3. Adams DD, Purves HD. Abnormal responses in the assay of thyrotropin. Proc Univ Otago Med School 1956;34:11-5.
- 4. Vanderpump MPJ, Tunbridge WMG, French JM, Appleton D, Bates D, Clark F, et al. The incidence of thyroid disorders in the community: a twenty-year follow-up of the Whickham Survey. Clin Endocrinol 1995;43:55-68.
- 5. Cooper DS. Subclinical hypothyroidism. N Engl J Med 2001;345:260-5.
- 6. Hollowell JG, Staehling NW, Flanders WD, Hannon WH, Gunter EW, Spencer CA, et al. Serum TSH, T4 and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). J Clin Endocrinol Metab 2002;87:489-99.
- 7. Huber G, Staut J-J, Meier C, Mitrache C, Guglielmetti M, Huber P, et al. Prospective study of the spontaneous course of subclinical hypothyroidism: prognostic value of thyrotropin, thyroid reserve, and thyroid antibodies. J Clin Endocrinol Metab 2002;87:3221-6.
- 8. Roti E, Gardini E, Minelli R, Bianconi L, Braverman LE. Prevalence of anti-thyroid peroxidase antibodies en serum in the elderly: comparison with other tests for anti-thyroid antibodies. Clin Chem 1992;38:88-92.
- 9. Henry M, Malthiery Y, Zanelli E, Charvet B. Epitope mapping of human thyroglobulin. Heterogeneous recognition by thyroid pathologic sera. J Immunol 1990;145:3692-8.
- 10. Maastricht J, Koenig RJ, Kaplan MM, Arscott P, Thompson N, Baker JR Jr. Identification of localized autoantibody epitopes in thyroid peroxidase. J Clin Endocrinol Metab 1992;75:121-6.
- 11. Tonacchera M, Cetani F, Costagliola S, Alcalde L, Uibo R, Vassart G, et al. Mapping thyroid peroxidase epitopes using recombinant protein fragments. Eur J Endocrinol 1995;132:53-61.
- 12. Kohno Y, Naito N, Hiyama Y, Shimojo N, Suzuki N, Tarutani O, et al. Thyroglobulin and thyroid peroxidase share common epitopes recognized in patients with chronic autoimmune thyroiditis. J Clin Endocrinol Metab 1988;67:899-907.
- 13. Estienne V, Duthooit C, Di Costanzo V, Lejeune P-J, Rotondi M, Kornfeld S, et al. Multicenter study on TGPO autoantibody prevalence in various thyroid and non-thyroid diseases; relationships with thyroglobulin and thyroperoxidase autoantibody parameters. Eur J Endocrinol 1999;141:563-9.
- 14. Feldt-Rasmussen U. Analytical and clinical performance goals for testing autoantibodies to thyroperoxidase, thyroglobulin, and thyroidtropin receptor. Clin Chem 1996;42:160-3.
- 15. Fujita K, Yamada N, Sanbe T. Haemagglutination test utilizing the microsomal antigen from the thyroid epithelial cells. Clin Pathol (Japan) 1970;18:213-7.
- 16. Bidey SP, Ekins RP. Comparative evaluation of cyclic AMP and iodide accumulation responses to thyroid-stimulating immunoglobulins in cultured FRTL-5 cells. Clin Endocrinol (Oxf) 1986;24:447-58.
- 17. Vitti P, Elisei R, Tonacchera M. Detection of thyroid-stimulating antibody using Chinese hamster ovary cells transfected with cloned human thyrotropin receptor. J Clin Endocrinol Metab 1993;76:499-503.
- 18. Doble ND, Banga JP, Pope R, Lalor E, Kilduff P, McGregor AM. Autoantibodies to the thyroid microsomal/thyroid peroxidase antigen are polyclonal and directed to several distinct antigenic sites. Immunology 1988;64:23-9.
- 19. Vieira JGH, Tachibana TT, Fonseca RMG, Nishida SK, Maciel RMB. Desenvolvimento de um método immunofluorométrico para a medida de anticorpos séricos contra tiroglobulina. Arq Bras Endocrinol Metab 1996;40:232-7.
- 20. Kasamatsu TS, Maciel RMB, Vieira JGH. Desenvolvimento e validação de um método imunofluorométrico para a pesquisa de anticorpos anti-peroxidase tiroideana no soro. Arq Bras Endocrinol Metab 2002;46:167-72.
- 21. Zweig MH, Campbell G. Receiver-operating characteristic (ROC) plots: a fundamental evaluation tool in clinical medicine. Clin Chem 1993;39:561-77.
- 22. Hanley JA, McNeil BJ. The meaning and use of the area under a receiver operating characteristic (ROC) curve. Diagnostic Radiology 1982;143:29-36.
- 23. Malthiery Y, Lissitzky S. Primary structure of human thyroglobulin deduced from the sequence of its 8448-base complementary DNA. Eur J Biochem 1987;165:491-8.
- 24. Erregragui K, Prato S, Miquelis R, Barrande C, Daniel C, Fert V. Antigenic mapping of human thyroglobulin-topographic relationship between antigenic regions and functional domains. Eur J Biochem 1997;244:801-9.
- 25. Fulthorpe AJ, Roitt IM, Doniach D, Couchman K. A stable sheep cell preparation for detecting thyroglobulin auto-antibodies and its clinical applications. J Clin Path 1961;14:654-60.
- 26. Medeiros-Neto GA, Martits AM, Cintra ABU. Anticorpos anti-tiroglobulina: resultados obtidos em soros de pacientes com tiropatias diversas. Rev Ass Med Brasil 1971;17:387-8.
- 27. Roman SH, Korn F, Davies TF. Enzyme-linked immunosorbent microassay and hemagglutination compared for detection of thyroglobulin and thyroid microsomal antibodies. Clin Chem 1984;30:246-51.
- 28. Zabel KM, Rawitch AB. Thyroglobulin structure-function: the effect of iodination on the structure of human thyroglobulin. Biochem Biophys Res Commun 1984;121:310-6.
- 29. Jorge PT, Carneiro COM, Matsumura LK, Bretas S, Maciel RMB. Importância da determinação simultânea de anticorpos anti-tiroglobulina e antimicrossomal no diagnóstico de doenças auto-imunes da tiróide. Arq Bras Endocrinol Metab 1988;32:69-71.
- 30. Nordyke RA, Gilbert FI, Miyamoto LA, Fleury KA. The superiority of antimicrosomal over antithyroglobulin antibodies for detecting Hashimotos thyroiditis. Arch Intern Med 1993;157:862-5.
- 31. Kasamatsu TS. Desenvolvimento de um ensaio imunofluorométrico para a pesquisa de anticorpos anti-peroxidase tiroidiana. Tese de Mestrado. Curso de Pós-Graduação em Ciências Endocrinológicas, UNIFESP, Escola Paulista de Medicina, 2001
- 32. Maciel RMB Vieira JGH, Russo EMK, Fonseca RMG, Oliveira MAD, Rocca A. Desenvolvimento de um método radioimunológico para a dosagem de tiroglobulina sérica. Arq Bras Endocrinol Metab 1986;30:31-9.
- 33. Spencer CA, Takeuchi M, Kasarosyan M, Wang CC, Guttler RB, Singer PA, et al. Serum thyroglobulin autoantibodies: prevalence, influence on serum thyroglobulin measurement, and prognostic significance in patients with differentiated thyroid carcinoma. J Clin Endocrinol Metab 1998;83:1121-7.
- 34. Li Calzi L, Benvenga S, Battiato S, Santini F, Trimarchi F. Autoantibodies to thyroxine and triiodothyronine in the immunoglobulin G fraction of serum. Cin Chem 1988;34:2561-2.
- 35. Després N, Grant AM. Antibody interference in thyroid assays: a potential for clinical misinformation. Clin Chem 1998;44:440-54.
- 36. Roitt IM, Ling NR, Doniach D. The cytoplasmic autoantigen of the human thyroid. I. Immunological and biochemical characteristics. Immunology 1964;7:375-9.
- 37. Portmann L, Hamada N, Heinrich G, DeGroot LJ. Anti-thyroid peroxidase antibody in patients with autoimmune thyroid disease: possible identity with anti-microsomal antibody. J Clin Endocrinol Metab 1985;61:1001-3.
- 38. Mariotti S, Anelli S, Ruf J, Bechi R, Czarnocka B, Lombardi A, et al. Comparison of serum thyroid microsomal and thyroid peroxidase autoantibodies in thyroid diseases. J Clin Endocrinol Metab 1987;65:987-93.
- 39. Czarnocka B, Ruf J, Ferrand M, Carayon P, Lissitzky S. Purification of the human peroxidase and its identification as the microsomal antigen involved in autoimmune thyroid disease. FEBS Lett 1985;190:147-52.
- 40. Portmann L, Fitch FW, Havran W, Hamada N, Franklin WA, DeGroot LJ. Characterization of the thyroid microsomal antigen, and its relationship to thyroid peroxidase, using monoclonal antibodies. J Clin Invest 1988;81:1217-24.
- 41. Baker JR, Arscott P, Johnson J. An analysis of the structure and antigenicity of different forms of thyroid peroxidase. Thyroid 1994;4:173-8.
- 42. Hobby P, Gardas A, Radomski R, MacGregor AM, Banga JP, Sutton BJ. Identification of an immunodominant region recognized by human autoantibodies in a three-dimensional model of thyroid peroxidase. Endocrinology 2000;141:2018-26.
- 43. Amino N, Hagen SR, Yamada N, Refetoff S. Measurement of circulating thyroid microsomal antibodies by the tanned red cell haemagglutination technique: its usefulness in the diagnosis of autoimmune thyroid diseases. Clin Endocrinol (Oxf) 1976;5:115-25.
- 44. Ruf J, Czarnocka B, Ferrand M, Doullais F, Carayon P. Novel routine assay of thyroperoxidase autoantibodies. Clin Chem 1988;34:2231-4.
- 45. Laurberg P, Pedersen KM, Vittinghus E, Ekelund S. Sensitive enzyme-linked immunosorbent assay for measurement of autoantibodies to human thyroid peroxidase. Scand J Clin Lab Invest 1992;52:663-9.
- 46. Gardas A, Sutton BJ, Piotrowska U, Pasieka Z, Barnett PS, Huang G, et al. Distinct immunological and biochemical properties of thyroid peroxidase purified from human thyroid glands and recombinant protein produced in insect cells. Biochem Biophys Acta 1999;1433:229-39.
- 47. Weetman AP, McGregor AM. Autoimmune thyroid disease: further developments in our understanding. Endocr Rev 1994;15:788-830.
- 48. Parmentier M, Libert F, Maenhaut C, Lefort Gerard C, Perret J, Van Sande J, et al. Molecular cloning of the thyrotropin receptor. Science 1989;246:1620-2.
- 49. Libert F, Lefort A, Gerard C, Parmentier M, Perret J, Ludgade M, et al. Cloning, sequencing and expression of the human thyrotropin (TSH) receptor: evidence for binding of autoantibodies. Biochem Biophys Res Commun 1989;165:1250-5.
- 50. Chazenbalk GD, Pichurin P, Chen C-R, Latrofa F, Johnstone AP, McLachlan SM, et al. Thyroid-stimulating autoantibodies in Graves disease preferentially recognize the free A subunit, not the thyrotropin holoreceptor. J Clin Invest 2002;110:209-16.
- 51. Davies T, Marians R, Latif R. The TSH receptor reveals itself. J Clin Invest 2002;110:161-4.
- 52. Shewring G, Smith BR. An improved radioreceptor assay for TSH receptor antibodies. Clin Endocrinol 1982;17:409-17.
- 53. Jaume JC, Kakinuma A, Chazenbalk GD, Rapoport B, McLachlan SM. Thyrotropin receptor autoantibodies in serum are present at much lower levels than thyroid peroxidase antibodies: analysis by flow cytometry. J Clin Endocrinol Metab 1997;82:500-7.
- 54. Evans C, Morgenthaler NG, Lee S, Llewellyn DH, Clifton-Bligh R, John R, et al. Development of a luminescent bioassay for thyroid stimulating antibodies. J Clin Endocrinol Metab 1999;84:374-7.
- 55. Costagliola S, Morgenthaler NG, Hoermann R, Badenhoop K, Struck J, Freitag D, et al. Second generation assay for thyrotropin receptor antibodies has superior diagnostic sensitivity for Graves disease. J Clin Endocrinol Metab 1999;84:90-7.
- 56. Kakinuma A, Cazenbalk GD, Jaume JC, Rappaport B, McLachlan SM. The human thyrotropin (TSH) receptor in a TSH binding inhibition assay for TSH receptor autoantibodies. J Clin Endocrinol Metab 1997;82:2129-34.
- 57. Bidey SP, Emmerson JM, Marshall NJ, Ekins RP. Characterization of thyroid-stimulating immunoglobulin-induced cyclic AMP accumulation in the rat thyroid cell strain FRTL-5: potentiation by forskolin and calibration against reference preparations of thyrotropin. J Endocrinol 1985;105:7-15.
- 58. Hidaka A, Kasagi K, Takeuchi R, Iida Y, Misaki T, Grollman EF, et al. Stimulated iodide uptake in FRTL-5 cells pre-incubated with Graves disease immunoglobulins in NaCl-free medium: a sensitive assay for thyroid-stimulating antibodies. Thyroid 1994;4:31-6.
- 59. Chiovato L, Vitti P, Bendinelli G, Santini F, Fiore E, Capaccioli A, et al. Detection of antibodies blocking thyrotropin effect using Chinese hamster ovary cells transfected with the cloned human TSH receptor. J Endocrinol Invest 1994;17:809-16.
- 60. Metcalfe R, Jordan N, Watson P, Gullu S, Witshire M, Crisp M, et al. Demonstration of immunoglobulin G, A, and E autoantibodies to the human thyrotropin receptor using flow cytometry. J Clin Endocrinol Metab 2002;87:1754-61.
- 61. Morgenthaler NG, Nagata A, Katayama S, Bergmann A, Iitaka M. Detection of low titre TBII in patients with Graves disease using recombinant human TSH receptor. Clin Endocrinol 2002;57:193-8.
- 62. Cardia MS, Knobel M, Lima N, Gianella-Netto MLCC, Cavaliere H, Medeiros-Neto G. Comparação entre diferentes métodos para avaliar a presença de auto-anticorpos dirigidos ao receptor de TSH em pacientes com moléstia de Graves-Basedow. Arq Bras Endocrinol Metab 2001;45:563-9.
- 63. Feldt-Rasmussen U, Schleusener H, Carayon P. Meta-analysis evaluation of the impact of thyrotropin receptor antibodies on the long term remission after medical therapy of Graves disease. J Clin Endocrinol Metab 1994;78:98-102.
- 64. Michelangeli V, Poon C, Taft J, Newnham H, Topliss D, Colman P. The prognostic value of thyrotropin receptor antibody measurement in the early stages of treatment of Graves disease with antithyroid drugs. Thyroid 1998;8:119-24.
- 65. Nedrebo BG, Holm PI, Uhlving S, Sorheim JI, Eide GE, Husebye ES, et al. Predictors of outcome and comparison of different drug regimens for the prevention of relapse in patients with Graves disease. Eur J Endocrinol 2002;147:583-9.
- 66. Costagliola S, Vassart G. Monoclonal antibodies with thyroid stimulating activity, at last. Thyroid 2002;12:1039-41.
- 67. Sanders J, Jeffreys J, Depraetere H, Richards T, Evans M, Kiddie A, et al. Thyroid stimulating monoclonal antibodies. Thyroid 2002;12:1043-50.
- 68. Costagliola S, Franssen JD, Bonomi M, Urizar E, Willnich M, Bergmann A, et al. Generation of a mouse monoclonal TSH receptor antibody with stimulating activity. Biochem Biophys Res Commun 2002;299:891-6.
- 69. Dai G, Levy O, Carrasco N. Cloning and characterization of the thyroid iodide transporter. Nature 1996;379:458-60.
- 70. Levy O, De la Vieja A, Ginter CS, Riedel C, Dai G, Carrasco N. N-linked glycosilation of the thyroid Na+/I- symporter (NIS). Implications for the secondary structure model. J Biol Chem 1998;273:22657-63.
- 71. Chin HS, Chin DKH, Morgenthaler NG, Vassart G, Costagliola S. Rarity of anti-Na+/I- symporter (NIS) antibody with iodide uptake inhibiting activity in autoimmune thyroid diseases (AITD). J Clin Endocrinol Metab 2000;85:3937-40.
- 72. Seissler J, Wagner S, Schott M, Lettmann M, Feldkamp J, Scherbaum WA, et al. Low frequency of autoantibodies to the human Na+/I- symporter in patients with autoimune thyroid disease. J Clin Endocrinol Metab 2000;85:4630-4.
- 73. Heufelder AE, Joba W, Morgenthaler NG. Autoimmunity involving the human sodium/iodide symporter: fact or fiction? Exp Clin Endocrinol Diabetes 2001;109:35-40.
- 74. Ajjan RA, Kemp EH, Waterman EA, Watson PF, Endo T, Onaya T, et al. Detection of binding and blocking autoantibodies to the human sodium-iodide symporter in patients with autoimmune thyroid disease. J Clin Endocrinol Metab 2000;85:2020-7.
- 75. Royaux IE, Suzuki K, Mori A, Katoh R, Everett LA, Kohn LD, et al. Pendrin, the protein encoded by the Pendred syndrome gene (PDS), is an apical porter of iodide in the thyroid and is regulated by thyroglobulin in FRTL-5 cells. Endocrinology 2000;141:839-45.
Datas de Publicação
-
Publicação nesta coleção
21 Jan 2004 -
Data do Fascículo
Out 2003
Histórico
-
Aceito
06 Jun 2003 -
Revisado
04 Jun 2003 -
Recebido
13 Mar 2003