Resumos
Este artigo descreve o isolamento dos triterpenos lupeol, taraxerol, lupen-3-ona e esqualeno obtido do extrato diclorometânico das folhas da espécie Minquartia guianensis Aubl., pertencente à família Olacaceae. Estes terpenóides foram isolados através de técnicas cromatográficas e identificados utilizando Ressonância Magnética Nuclear (RMN) de ¹H e de 13C. Na literatura disponível, este é o primeiro relato destes triterpenos em M. guianensis.
Triterpenos; Minquartia guianensis; Olacaceae
This article describes the isolation of the triterpenes lupeol, taraxerol, lupen-3-one and squalene from the dichloromethane extract of the leaves of Minquartia guianensis Aubl. belonging to the Olacaceae family. These terpenoids were isolated through chromatographic techniques and identified using ¹H and 13C Nuclear Magnetic Resonance (NMR). At the best of our knowledge, this is the first report of these triterpenes in M. guianensis.
Triterpenes; Minquartia guianensis; Olacaceae
QUÍMICA
Triterpenos das folhas de Minquartia guianensis Aubl. (Olacaceae)
Triterpenes from the leaves of Minquartia guianensis Aubl. (Olacaceae)
Lorena Mayara de Carvalho CursinoI; Adriana Spirotto Stein MesquitaI; Denny William de Oliveira MesquitaI; Carromberth Carioca FernandesII; Orlando Libório Pereira JuniorI; Ieda Leão do AmaralIII; Cecilia Veronica NunezI
IInstituto Nacional de Pesquisas da Amazônia, Coordenação de Pesquisas em Produtos Naturais - CPPN, Av. André Araújo, 2936, Aleixo, Manaus, AM, Brasil. CEP 69060-001. e-mail: cecilia@inpa.gov.br, lorena.cursino@gmail.com
IIUniversidade Federal do Acre
IIIInstituto Nacional de Pesquisas da Amazônia, Coordenação de Pesquisas em Botânica - CPBO
RESUMO
Este artigo descreve o isolamento dos triterpenos lupeol, taraxerol, lupen-3-ona e esqualeno obtido do extrato diclorometânico das folhas da espécie Minquartia guianensis Aubl., pertencente à família Olacaceae. Estes terpenóides foram isolados através de técnicas cromatográficas e identificados utilizando Ressonância Magnética Nuclear (RMN) de 1H e de 13C. Na literatura disponível, este é o primeiro relato destes triterpenos em M. guianensis.
Palavras-chave: Triterpenos, Minquartia guianensis, Olacaceae.
ABSTRACT
This article describes the isolation of the triterpenes lupeol, taraxerol, lupen-3-one and squalene from the dichloromethane extract of the leaves of Minquartia guianensis Aubl. belonging to the Olacaceae family. These terpenoids were isolated through chromatographic techniques and identified using 1H and 13C Nuclear Magnetic Resonance (NMR). At the best of our knowledge, this is the first report of these triterpenes in M. guianensis.
Keywords: Triterpenes, Minquartia guianensis, Olacaceae.
INTRODUÇÃO
A espécie Minquartia guianensis Aubl. pertencente à família Olacaceae está dispersa na América Central e na Bacia Amazônica. No Brasil, esta espécie é encontrada nos Estados do Acre, Amazonas, Roraima, Pará e Amapá. Popularmente é conhecida como acariquara, acariquara-roxa, acari, acapú, acaximba, arariúba, dentre outras denominações (Camargo et al., 2005). Um estudo prévio realizado com as cascas do caule de M. guianensis coletadas no Equador forneceu o ácido minquartinóico, um poliacetileno citotóxico, que mostrou atividade moderada em ensaio in vitro com Plasmodium falciparum e Leishmania major (Rasmussen et al., 2000). Algumas populações indígenas do Equador usam a infusão das cascas no tratamento de infecções intestinais causadas por parasitas, contra dores musculares e irritações cutâneas (Marles et al., 1989). Outro importante estudo realizado com cascas de M. guianensis, também coletadas no Equador, revelou a presença dos triterpenos eritrodiol, betulina, o ácido minquartinóico e a lichexantona (El-Seedi et al., 1994).
Os triterpenos apresentam diversas atividades biológicas, entre as quais destacam-se: cardioprotetora (Sudhahar, et al. 2007), gastroprotetora (Pertino, et al. 2007), antiinflamatória (Medeiros, et al. 2007), antitumoral (Braga, et al. (2007), leishmanicida (Delgado-Mendez, et al. 2008) e anti-hiperglicêmica (Sato, et al. 2007).
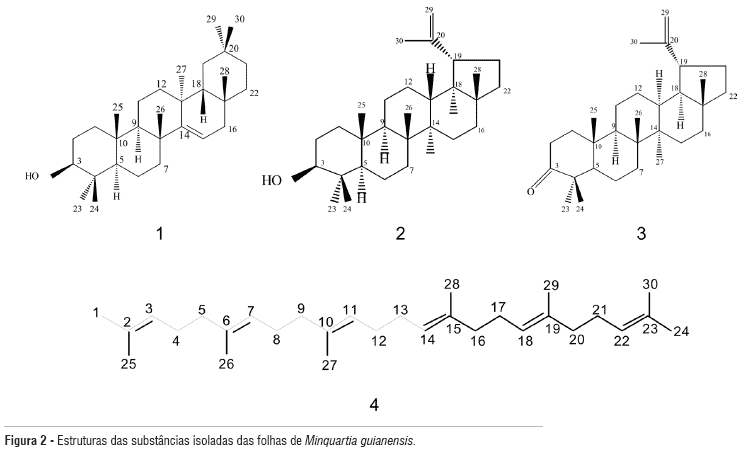
O presente artigo trata do isolamento dos triterpenos taraxerol (1), lupeol (2), lupen-3-ona (3) e esqualeno (4) das folhas de M. guianensis.
MATERIAL E MÉTODOS
MATERIAL VEGETAL
As folhas de Minquartia guinensis Aubl. foram coletadas na Reserva Ducke, INPA, região de Manaus, em abril de 2005 e identificadas pela MSc. Ieda Leão do Amaral. O material vegetal estava estéril no momento da coleta, razão pela qual não pôde ser depositado no Herbário, mas foi comparado com uma excicata previamente depositada no Herbário do INPA, sob o número 179.806. O material vegetal foi seco à temperatura ambiente e moído.
EXTRAÇÃO E FRACIONAMENTO
A extração das folhas (289 g) de M. guianensis foi realizada com diclorometano, metanol e água, cada extração foi realizada em triplicata e usando ultra-som por 20 minutos. Após filtração, os extratos diclorometânico e metanólico foram concentrados utilizando-se rota-evaporador e o aquoso usando liofilizador (Figura 1).
Uma vez que o extrato diclorometânico apresentava indícios da presença de terpenóides quando analisado em cromatografia em camada delgada comparativa (CCDC) e revelado com Ce(SO4)2, apresentando manchas com colorações alaranjadas e avermelhadas, o mesmo foi fracionado e os outros dois extratos (metanólico e aquoso) foram guardados para estudos posteriores. O fracionamento do extrato diclorometânico (3,5 g) foi realizado através de cromatografias em coluna aberta e de recristalizações, conforme mostrado na figura 1. As frações que continham triterpenos foram escolhidas por revelarem colorações entre o lilás, laranja e vermelho, quando reveladas em CCDC com Ce(SO4)2 e Rf de ~ 0,6 quando eluídas com hexano/acetato de etila 8:2.
RESULTADOS E DISCUSSÃO
A identificação dos triterpenos inicia-se pela análise dos espectros de RMN de 1H, seguida pela de 13C. Assim, os primeiros indícios da presença de triterpenos são a presença de ligação dupla isolada entre 5 e 6 ppm e a presença de 8 metilas entre 0,8 e 1,7 ppm, nos espectros de RMN de 1H. Na seqüência, os espectros de RMN de 13C [Broad Band Decoupling (BBD) e Distortionless Enhancement by Polarization Transfer (DEPT) 135º] foram analisados, de maneira que a identificação estrutural iniciou-se pelas análises de ligação dupla, comparando paralelamente com dados de RMN de 13C de triterpenos pentacíclicos publicado por Mahato e Kundu (1994). Desta forma, foi possível identificar os triterpenos taraxerol (1) e lupeol (2) (Figura 2). Podemos destacar a ligação dupla, pela presença de um dd em δ 5,46 (J=8,5 e 3,5 Hz) no espectro de RMN de 1H e no espectro de RMN de 13C, sinais correspondentes ao carbono quaternário em 158,33 ppm e CH em 117,11 ppm, que permitiram a identificação do taraxerol, os demais sinais foram compatíveis com a estrutura proposta. Para o triterpeno 2, nos espectros de RMN de 1H, destacam-se os sinais: em δ 4,62 s e 4,49 s referentes aos 2 hidrogênios da ligação dupla terminal (H29); outro sinal característico é o dd em δ 3,12 (J=11,5 e 5 Hz) referente ao H3. A substância 2 apresentou deslocamentos químicos em 150,9 ppm e 109,3 ppm, nos espectros de RMN de 13C, característicos do grupo olefínico (C-20 e C-29) dos triterpenos Lupanos. A comparação dos demais sinais com os da literatura (Mahato e Kundu, 1994) confirmaram a estrutura proposta.
No espectro de RMN de
1H da lupen-3-ona (
3), observam-se a presença de sinais de hidrogênios da ligação dupla entre 4,49 e 4,61 ppm. No espectro de RMN de
13C (BBD e DEPT 135º), verifica-se o sinal em 150,72 ppm referente ao carbono quaternário, em δ 109,71 sinal de CH
2 da ligação dupla e 217,71 ppm a presença de carbonila que confirma ser a lupen-3-ona. Os outros sinais de 2 e 3 (
Figura 2) foram comparados com outros espectros das mesmas moléculas previamente isoladas de
Wunderlichia crulsiana (Nunez,
et al., 2004), além da comparação com a revisão de Mahato e Kundu (1994).
A identificação do esqualeno (4) foi baseada nas análises dos dados dos espectros de Ressonância Magnética Nuclear (RMN) de 1H e de 13C unidimensionais, com os sinais na Tabela 2. No espectro de RMN de 1H, os sinais em aproximadamente 5 ppm correspondem aos hidrogênios das ligações duplas. Em aproximadamente 2 ppm observam-se os hidrogênios dos metilenos vizinhos às ligações duplas. Em 1,7 e 1,8 ppm observam-se os sinais referentes aos deslocamentos químicos dos hidrogênios das metilas. Através da análise dos dados de 13C (BBD e DEPT 135º) foi possível observar que os sinais entre 131 e 135 ppm são referentes aos carbonos quaternários. A comparação dos dados de RMN da susbstância 4 com os dados da literatura (Saitoa et al., 2007) (Tabela 1), possibilitou propor a mesma como sendo o esqualeno (Figura 2).
CONCLUSÃO
De acordo com a literatura consultada, este é o primeiro relato do isolamento dos triterpenos esqualeno, lupen-3-ona, taraxerol e lupeol em Minquartia guianensis.
AGRADECIMENTOS
Os autores agradecem à FAPEAM e ao PPBio/INPA/CNPq/MCT pelos auxílios concedidos e pelas bolsas de estudo concedidas: LMCC (FAPEAM), ASSM e DWOM (CNPq), CCF (SUFRAMA).
BIBLIOGRAFIA CITADA
Recebido em 14/03/2008
Aceito em 15/06/2008
- Braga, F.; Ayres-Saraiva, D.; Gattass, C.R.; Capella, M. A. M. 2007. Oleanolic acid inhibits the activity of the multidrug resistance protein ABCC1 (MRP1) but not of the ABCB1 (P-glycoprotein): Possible use in cancer chemotherapy. Cancer Letters, 248(1): 147-152.
- Camargo, J. L. C.; Ferraz, I. D. K. 2005. Acariquara-roxa, Minquartia guianensis Aubl., Informativo Técnico Rede de Sementes da Amazônia 10.
- Delgado-Mendez, P.; Herrera, N.; Chavez, H.; Estevez-Braun, A.; Ravelo, A. G.; Cortes, F.; Castanys, S.; Gamarro, F. 2008. New terpenoids from Maytenus apurimacensis as MDR reversal agents in the parasite Leishmania. Bioorganic and Medicinal Chemistry, 16(3): 1425-1430.
- El-Seedi, H. R.; Hazell, A. C.; Torssell, K. B. G. 1994. Triterpenes, lichexanthone and acetylenic acid from Minquartia guianensis. Phytochemistry, 35(5): 1297-1299.
- Mahato, S. B.; Kundu, A. P. 1994. 13C NMR Spectra of Pentacyclic Triterpenoids - A compilation and some salient features". Phytochemistry, 37(6): 1517-1575.
- Marles, R. J.; Farnsworth, N. R; Neill, D. A. 1989. Isolation of a novel cytotoxic polyacetylene from a traditional anthelmintic medicinal plant, Minquartia guianensis. Journal of Natural Products, 52(2): 261-266.
- Medeiros, R.; Otuki, M. F.; Avellar, M. C. W.; Calixto, J. B. 2007. Mechanisms underlying the inhibitory actions of the pentacyclic triterpene [alpha]-amyrin in the mouse skin inflammation induced by phorbol ester 12-O-tetradecanoylphorbol-13-acetate. European Journal of Pharmacology, 559(2-3): 227-235.
- Nunez, C. V.; Pinto, E.; Colepicolo, P., Roque, N. F. 2004. An improved High Performance Liquid Chromatography Method for Separation of Lipophilic Triterpenos from Wunderlichia crulsiana Followed by Gas Chromatography Analysis. Arkivoc, (vi): 80-88.
- Pertino, M.; Schmeda-Hirschmann, G.; Rodriguez, J. A.; Theoduloz, C. 2007. Gastroprotective effect and cytotoxicity of terpenes from the Paraguayan crude drug "yagua rova" (Jatropha isabelli). Journal of Ethnopharmacology, 111(3): 553-559.
- Rasmussen, H. B.; Christesen, S. B.; Kvist, l. P.; Kharazmi, A.; Huansi, A. G. 2000. Absolute Configuration and Antiprotozoal Activiy of Minquartynoic Acid. Journal of Natural Products, 63: 1295-1296.
- Saitoa, T.; Klinklaib, W.; Kawahara, S. 2007. Characterization of epoxidized natural rubber by 2D NMR. Spectroscopy Polymer, 48(3): 750-757.
- Sato, H.; Genet, C.; Strehle, A.; Thomas, C.; Lobstein, A.; Wagner, A.; Mioskowski, C.; Auwerx, J.; Saladin, R. 2007. Anti-hyperglycemic activity of a TGR5 agonist isolated from Olea europaea. Biochemical and Biophysical Research Communications, 362(4): 793-798.
- Sudhahar, V.; Kumar, S. A.; Sudharsan, P. T.; Varalakshmi, P. 2007. Protective effect of lupeol and its ester on cardiac abnormalities in experimental hypercholesterolemia. Vascular Pharmacology, 46(6): 412-418.
Datas de Publicação
-
Publicação nesta coleção
27 Maio 2009 -
Data do Fascículo
Mar 2009
Histórico
-
Aceito
15 Jun 2008 -
Recebido
14 Mar 2008