ARTIGO DE REVISÃO
O sistema endocanabinóide: nova perspectiva no controle de fatores de risco cardiometabólico
Emilio Antonio Francischetti; Virginia Genelhu de Abreu
Universidade do Estado do Rio de Janeiro UERJ - Rio de Janeiro, RJ
Correspondência Correspondência: Emilio Antonio Francischetti Rua Paulo César de Andrade, 106/602 22221-090 Rio de Janeiro, RJ E-mail: eafranc@uerj.br
Os últimos quarenta anos registraram um importante declínio na prevalência de muitos fatores de risco cardiovascular1. Os avanços terapêuticos conquistados graças aos agentes hipolipemiantes, anti-hipertensivos e antidiabéticos orais representaram valiosos instrumentos para reduzir o pesado gravame, em termos de saúde pública, imposto pelos fatores de risco cardiovascular e metabólico.
A doença cardiovascular ainda permanece como principal causa de morte em vários países do mundo ocidental, seja pelo inadequado controle de doenças como o diabetes mellitus, hipertensão arterial e o hábito de fumar1 e/ou pela emergência de novos fatores de risco tais como, aumento da circunferência abdominal2, níveis reduzidos de HDL-C, hipertrigliceridemia e maior proporção de partículas de LDL pequenas e densas3, que reconhecidamente contribuem para o risco cardiovascular global.
Ensaios clínicos mostraram que, embora se tenha alcançado redução significativa no número de eventos pela utilização de esquemas terapêuticos considerados altamente efetivos, um importante risco residual ainda permanece, deixando uma proporção não desprezível de pacientes tratados vulneráveis à morbidade cardiovascular e metabólica4-6. Este aspecto é particularmente alarmante em indivíduos que agregam múltiplos fatores de risco.
A obesidade, principalmente a adiposidade visceral, é uma pandemia que acomete tanto populações de países hegemônicos como daqueles em desenvolvimento, inclusive o Brasil7,8. Atualmente, o tecido adiposo visceral é considerado um órgão endócrino e potencialmente diabetogênico e pro-inflamatório9. Alterações na expressão e secreção de adipocitocinas e mediadores inflamatórios explicam por que a obesidade abdominal se associa à resistência à insulina, dislipidemia aterogênica e hipertensão10. As múltiplas definições de Síndrome Metabólica [da] ATP III11, World Health Organization12 e International Diabetes Federation (IDF)13 incluem esses fatores como componentes da síndrome.
Estudos recentes identificaram as bases moleculares, os circuitos neuronais e as vias metabólicas envolvidas na regulação do consumo de alimentos. Numerosos neuropeptídeos já foram caracterizados em distintos núcleos hipotalâmicos, interagindo com sinais originados de órgãos periféricos, o que sugere existir uma complexa rede que participa não só no controle do apetite e saciedade, como na modulação do balanço energético e composição corporal14.
O sistema endocanabinóide é um sistema de sinalização endógena que atua fisiologicamente na regulação da homeostase energética e no metabolismo de lípides e hidratos de carbono15. A hiper-ativação do sistema endocanabinóide não só causa aumento de peso15 como pode induzir fenótipos dislipidêmicos e disglicêmicos16. Numerosos estudos clínicos e experimentais demonstraram que a intervenção farmacológica no sistema representa promissora perspectiva terapêutica no controle da obesidade, dislipidemia, resistência à insulina e aterosclerose17,18.
O sistema endocanabinóide
Aspectos históricos
A Cannabis sativa (maconha ou marijuana) é a droga ilícita mais consumida no mundo a partir de 196019. Cultivada há mais de cinco mil anos para a obtenção de fibras utilizadas na manufatura de tecidos, a Cannabis era prescrita pelos chineses, desde 2600 A.C., para tratar câimbras, dores reumáticas e menstruais20. Porém, só em 1964 o seu princípio ativo D9-tetra-hidrocanabinol (THC) foi isolado e sua estrutura química caracterizada21. Atualmente, inúmeros análogos sintéticos da Cannabis sativa vêm sendo prescritos como antieméticos e estimulantes do apetite aos pacientes com doenças oncológicas, em uso de quimioterápicos. O dronabinol, um composto sintético derivado do THC foi aprovado pelo FDA, há mais de 15 anos, como tratamento auxiliar de fases avançadas de portadores de SIDA e câncer que cursam com anorexia e caquexia22-24.
Em 1988, o primeiro receptor canabinóide foi identificado25. Em 1993, esse receptor foi cognominado CB1 pois, nesse mesmo ano, um segundo receptor foi caracterizado e designado CB226. Ambos os receptores estão acoplados às proteínas Gi/o e pertencem a uma grande e diversificada família de proteínas acopladas à membrana celular. A distribuição tecidual dessas estruturas explica a maior parte dos efeitos psicotrópicos do THC e atribuídos aos receptores CB127. Os efeitos dos receptores periféricos CB2 estão mais associados à resposta imune28.
Os primeiros ligantes endógenos dos receptores canabinóides os endocanabinóides foram isolados em 199229. Nos dias atuais, a anandamida (N-araquidonoil etanolamina) e o 2-araquidonoil glicerol (2-AG) são, entre os canabinóides endógenos, os mais exaustivamente estudados. O termo "ananda" oriundo do Sânscrito significa felicidade serena ou bem-aventurança20. Ambos os endocanabinóides são agonistas dos receptores CB1 e CB2. Os níveis celulares e teciduais do 2-AG são mais elevados que os da anandamida por conta de seu maior envolvimento em várias vias metabólicas. Os receptores canabinóides, os endocanabinóides e as enzimas que catalisam sua biossíntese e degradação constituem o sistema endocanabinóide.
Receptores CB1 e CB2
Os receptores canabinóides caracterizados até o momento regulam a atividade das adenilato-ciclases (as quais inibem) e das MAPK (do inglês - mitogen-activated protein kinases) as quais estimulam. No caso específico dos receptores CB1, a modulação se faz sobre canais de Ca2+ ativados por voltagem (os quais inibem) e canais de K+ (os quais estimulam)30. A função primária desses receptores é a transdução de estímulos extra-celulares em sinais intracelulares.
Os receptores CB1 são entre os GPCRs (do inglês G protein-coupled membrane receptor), os mais abundantes até agora identificados no sistema nervoso central, embora estejam também presentes no sistema nervoso periférico31. Os canabinóides endógenos exercem, através de seus receptores, importantes ações sobre o sistema nervoso central, que incluem a regulação da função cognitiva e das emoções em circuitos neuronais do córtex, hipocampo e amídala e no reforço dos efeitos de substâncias que levam à dependência química no sistema mesolímbico incluindo a cocaína32, a heroína33, a anfetamina34 e o álcool35.
Alguns estudos têm mostrado um importante papel do sistema endocanabinóide na modulação da dependência de nicotina. Em animais CB1-/- os efeitos de recompensa da nicotina estão abolidos36 e a administração de um antagonista seletivo CB1, o rimonabanto, diminui o comportamento de procura pelo alcalóide37.
Os receptores CB2 localizam-se em estruturas associadas à modulação do sistema imune e da hematopoiese. O estímulo dessas estruturas pelo D9-tetra-hidrocanabinol resulta em um fenótipo imunossupressor38.
Formação e inativação dos endocanabinóides. O processo de neurotransmissão retrógrada
A maior parte dos endocanabinóides identificados até o momento é derivada de ácidos graxos poliinsaturados de cadeia longa (PUFAs), especificamente o ácido araquidônico (fig. 1). Assim, a anandamida e o 2-AG são formados por vias dependentes de fosfolipídios e cujas enzimas de síntese são a N-acilfosfatidiletanolamida-fosfolipase D seletiva (NAPE-PLD) e a sn-1-diacilglicerol lípase seletiva (DAG Lipase), respectivamente39,40.
Ainda que a maior parte dos endocanabinóides atue sob "demanda ou necessidade", em resposta tanto aos estímulos fisiológicos (despolarização neuronal) quanto patológicos15, existem evidências de que estariam primariamente ativados em algumas áreas do cérebro que controlam o balanço energético, sugerindo um tônus contínuo que favorece a ingestão de energia e seu armazenamento41.
Tanto a anandamida quanto o 2-AG têm sua ação interrompida por processo de recaptação pelos neurônios, seguida de seu metabolismo. Essa etapa parece ocorrer por simples difusão e/ou através de processo facilitado por uma proteína transportadora. Ambos os endocanabinóides são rapidamente metabolizados e hidrolizados pela FAAH (do inglês - fatty acid amide hydrolase) e pela MAG lipase (do inglês - monoacyl glicerol), respectivamente, em compostos inativos16,42.
As múltiplas funções do sistema endocanabinóide
Estudos clínicos e experimentais têm demonstrado que os canabinóides endógenos e a ativação concomitante de seus receptores CB1 causam uma pletora de efeitos, entre os quais: 1) envolvimento na antinociceptividade (diminuição da sensibilidade aos estímulos dolorosos), controle do movimento e inibição da memória de curto prazo43; 2) inibição da secreção de prolactina e do hormônio do crescimento e aumento na secreção do ACTH44; 3) efeitos ansiolíticos, através de ações sobre o eixo hipotálamo-hipófise-adrenal45 ; 4) modulação da resposta imune e inflamatória46; 5) aumento da freqüência cardíaca, vasodilatação e broncodilatação47,48; 6) inibição da secreção de testosterona, anovulação e relaxamento uterino49; 7) atividade antitumoral50; 8) neuroproteção diante de situações de trauma e hipóxia51; 9) modulação da ingestão de alimentos graças aos seus efeitos sobre a liberação de peptídeos e hormônios hipotalâmicos e à regulação dos mesmos pelos esteróides31. Todos esses efeitos pleiotrópicos foram concisamente resumidos por Di Marzo e colaboradores52 em uma única frase: "O sistema endocanabinóide reduz a sensação de dor, controla o movimento, a memória, o sono, o apetite e protege".
A ativação tônica dos receptores CB1 cardíacos e vasculares parece limitar a elevação da pressão arterial. Recentemente, Kunos e cols.53 observaram que ratos espontaneamente hipertensos (SHR), quando tratados com um inibidor da degradação da anandamida, tiveram sua hipertensão controlada, efeito esse revertido pela administração de antagonistas CB1. O bloqueio da inativação dos endocanabinóides além de reduzir a pressão dos SHR diminuiu simultaneamente a performance contrátil do ventrículo esquerdo, embora não afetasse esses mesmos parâmetros em animais normais53.
Outra observação extremamente intrigante, agora em relação à função dos receptores CB2, é a de que as propriedades imunossupressoras dos mesmos teriam um efeito benéfico e protetor no milieu inflamatório de lesões ateroscleróticas. Stefens e cols.54, trabalhando com camundongos nocauteados para receptores da apolipoproteína E e alimentados com dieta rica em colesterol observaram regressão significativa das extensas placas aterogênicas peculiares a esse modelo, quando esses animais foram tratados com pequenas doses de THC administradas por via oral. Uma explicação plausível para isso seria a de que receptores CB2 expressos em lesões ateroscleróticas, mas ausentes nas artérias normais, seriam ativados pela THC.
Regulação da ingesta de alimentos pelos endocanabinóides
Os efeitos centrais da ativação dos receptores CB1 se refletem fundamentalmente na modulação do balanço energético e controle do apetite. Numerosas evidências, obtidas de estudos experimentais em murídeos obesos (camundongos ob/ob e db/db e ratos obesos Zuker) e normais mostraram que: 1) a ativação de receptores CB1 por canabinóides endógenos ou THC e a injeção de endocanabinóide diretamente no hipotálamo ou região mesolímbica estimulam o consumo de alimentos55,56; 2) contrariamente, animais cujos genes dos receptores CB1 haviam sido suprimidos (CB1-/-) consomem menos comida e mostram fenótipo magro, resistente ao aumento de peso induzido por dieta57; 3) em condições normais, a ingestão de nutrientes reduz os níveis de endocanabinóides no hipotálamo e no pró-encéfalo límbico, enquanto o jejum tem efeito oposto, elevando-os de forma expressiva55.
A figura 2 mostra que ratos privados de alimentos têm níveis teciduais de 2-AG consistentemente elevados, tanto no pró-encéfalo límbico quanto no hipotálamo, áreas do encéfalo fortemente associadas à motivação e prazer de comer55. Já, no momento em que esses animais estão se alimentando, os níveis de 2-AG, diminuem.
Em outro experimento em que se administrou anandamida a camundongos, a ingestão de alimentos aumentou em 44% e se associou, significativamente, com a elevação das concentrações hipotalâmicas de norepinefrina, dopamina e serotonina58.
Em 2003, Cota e cols.38 demonstraram que esses animais CB1-/-, em que pese serem mais magros, não apresentavam nenhuma mudança na sua atividade locomotora, temperatura corporal ou dispêndio de energia, quando comparados aos congêneres selvagens. Isso indica que a diminuição do estímulo orexígeno ao nível central decorrente da ausência do receptor CB1 teria contribuído para explicar as diferenças entres esses animais, muito mais que as alterações de sua atividade locomotora ou dispêndio de energia.
A administração de rimonabanto o primeiro antagonista seletivo CB1, descrito em 1994 por Rinaldi-Carmona e cols.59 a camundongos que se tornaram obesos pelo consumo de dieta rica em gordura, embora reduzisse significativa e transitoriamente a ingestão de alimentos, levou a sustentada redução ponderal, quando se comparou aos animais de controle. Os efeitos persistentes sobre a redução de peso pelo bloqueador CB1, contrastando com a diminuição transitória do consumo de alimentos, sugerem que outros mecanismos além da ingestão calórica, contribuiriam para os efeitos duradouros do rimonabanto60 (fig. 3).
Esses dados, quando avaliados em conjunto, sugerem que o sistema endocanabinóide encefálico controla a ingestão de energia em dois níveis. Primeiramente, reforça tonicamente e incentiva a motivação de busca e consumo de comida, possivelmente por interagir com vias mesolímbicas (núcleo acúmbens) envolvidas em mecanismos de recompensa. Segundo, o sistema é ativado "sob demanda", no hipotálamo, após um curto período de privação de comida para então, transitoriamente, modular os níveis e ou a ação de outros mediadores obesígenos e anorexígenos, com vistas a indução do apetite. A hipótese de uma ação dual das regiões mesolímbicas e hipotalâmicas foi comprovada pela demonstração de que a injeção de endocanabinóides nessas áreas encefálicas estimula o consumo de alimentos em roedores42.
No hipotálamo, as mudanças nos níveis de endocanabinóides correlacionam-se inversamente com as concentrações plasmáticas de leptina, hormônio secretado pelo adipócito e que exerce um papel central na regulação do consumo de nutrientes e dispêndio de energia. A leptina diminui os níveis de endocanabinóides no hipotálamo, à semelhança do que faz com outros mediadores obesígenos. Ademais, camundongos obesos, geneticamente deficientes nas vias de sinalização da leptina, exibem elevadas concentrações de endocanabinóides no hipotálamo57.
Co-expressão de receptores CB1 com mediadores anorexígenos e obesígenos
O sistema endocanabinóide é um importante modulador da ingestão de energia graças à regulação que exerce sobre a expressão ou ação de vários mediadores anorexígenos ou obesígenos em várias áreas do hipotálamo. Inúmeros trabalhos experimentais têm apontado que os receptores CB1 são co-expressos: 1) no núcleo paraventricular com o mediador anorexígeno CRH (do inglês - corticotropin release hormone)61, aqui, os endocanabinóides atuam retrogradamente na redução da transmissão glutamatérgica de neurônios pré-sinápticos, atenuando a liberação de CRH pela corticosterona, em condições de jejum62; 2) no núcleo lateral do hipotálamo com o mediador orexígeno MCH (do inglês - melanin-concentrating hormone)61; 3) no núcleo arqueado com as células que expressam os CART (do inglês - cocaine amphetamine regulated transcript)61 e 4) no hipotálamo ventromedial com a pré-pró-orexina61. A deleção genética dos receptores CB1 aumenta a expressão de CRH refletindo a inibição tônica deste mediador pelos endocanabinóides63.
Observa-se correlação positiva e direta entre o tônus do sistema endocanabinóide e os níveis circulantes de grelina, após privação de alimentos. Esse peptídeo secretado pelo trato digestivo atua localmente e em terminações vagais aferentes, interage com os endocanabinóides, aumentando o consumo de comida. Esses efeitos são bloqueados pelo rimonabanto64.
Quanto ao sistema mesolímbico, existem evidências de que os endocanabinóides aumentariam o desejo de comer por induzir maior liberação de dopamina no núcleo acúmbens ou por atuar de modo sinérgico com opióides através de mecanismos ainda desconhecidos65.
Um outro ponto igualmente importante no controle da saciedade emerge quando se analisa a relação entre o sistema endocanabinóide e as terminações vagais que conectam o trato gastrointestinal com a medula e núcleos do tronco cerebral. Os endocanabinóides diminuem a saciedade através de suas ações sobre o vago. Tais efeitos podem ser revertidos pela destruição das terminações vagais capsaicíno-sensíveis, que modulam os efeitos da colecistocinina sobre a saciedade66. Por outro lado, a colecistocinina inibe a expressão de receptores CB1 pelos neurônios vagais aferentes67.
Em conjunto, esses dados sugerem que a diminuição da atividade dos endocanabinóides induz sensação de saciedade modulada pela colecistocinina. Em contrapartida, o jejum supera essa sensação por estimular a secreção de endocanabinóides do intestino delgado, liberando os receptores CB1 do vago da inibição pela colecistocinina.
Efeitos periféricos da ativação de receptores CB1
O sistema endocanabinóide tem participação efetiva na modulação da lipogênese. Isso se substancia pelo achado de receptores CB1 no tecido adiposo branco que, quando estimulados, aumentam a expressão da lipase lipoprotéica e diminuem a da adiponectina44. Em contrapartida, o bloqueio do receptor CB1 causou aumento na expressão tanto in vitro quanto in vivo da adiponectina, sabidamente um hormônio crucial na redução da expressão de enzimas envolvidas na lipogênese69,70, e que potencialmente exibe importantes propriedades no controle da dislipidemia aterogênica e da disglicemia. Ademais, a ativação dos receptores CB1 de hepatócitos traduziu-se em aumento da síntese de novo de ácidos graxos pelos hepatócitos, graças à maior expressão gênica do fator de transcrição lipogênico SREBP-1c (do inglês - sterol regulatory element-bynding/binding protein 1c) e das enzimas a ele associadas: a F-AS (do inglês - fatty-acid synthase) e a Acyl-CoA C1 (do inglês - acetyl-CoA Carboxilase-1). Contrariamente, camundongos CB1-/- são resistentes a essas alterações e ao desenvolvimento de esteatose hepática71.
Quanto a homeostase glicêmica, camundongos CB1-/- ingerindo dieta rica em gordura mostraram menores níveis de glicemia após administração intraperitoneal de insulina, quando comparados aos animais selvagens72. Esses animais exibiram, também, redução das concentrações plasmáticas de insulina e leptina, apontando para uma melhor sensibilidade aos dois hormônios.
Recentemente, demonstrou-se que o rimonabanto aumenta o consumo de oxigênio e captação de glicose pelo músculo solear de camundongos ob/ob73, evidenciando os efeitos favoráveis do fármaco sobre a termogênese e sensibilidade à insulina.
A hiperatividade do sistema endocanabinóide e suas conseqüências fisiopatológicas
Estudos realizados em animais sugerem que o sistema endocanabinóide estaria transitoriamente ativado após jejum de curto prazo e/ou exposição a alimentos palatáveis, o que estimularia o apetite e atenuaria a saciedade, além de aumentar a lipogênese e reduzir o dispêndio de energia42. Isso é consistente com o conceito de que níveis elevados de endocanabinóides, inevitáveis na vigência de estímulos associados a situações de estresse, atuariam como estratégia de auxílio aos organismos superiores, com vistas ao restabelecimento de sua homeostase.
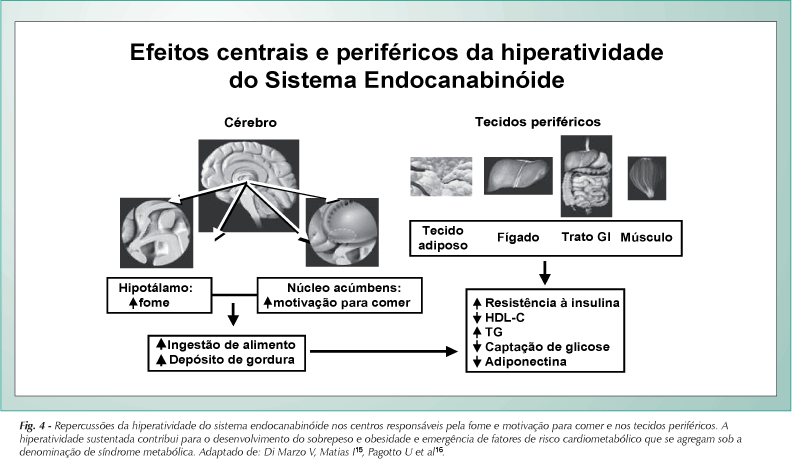
Em contrapartida, resultados de ensaios pré-clínicos e clínicos claramente indicam que o sistema também contribui para a modulação de situações que cursam com hiperfagia e acúmulo de massa adiposa e que seu bloqueio farmacológico reverteria a situação. A hiperatividade sustentada do sistema em tecidos que controlam o balanço energético teria, então, um papel central não só no desenvolvimento da obesidade como na emergência de fatores de risco cardiometabólico que a ela se agregam sob o rótulo de síndrome metabólica15 (fig. 4).
A pergunta que se impõe é: que fatores causais estariam envolvidos em eventuais mudanças de um sistema que atua "sob demanda" para um outro de hiperatividade sustentada? Ao que tudo indica, essa hiperatividade estaria associada a dietas de alto conteúdo de gordura que disponibilizariam ácidos graxos poliinsaturados para a biossíntese dos endocanabinóides42. Ademais, o adipócito de ratos obesos expressa mais receptor CB1 que o adipócito de ratos magros ou adipócitos imaturos70. Uma dieta rica em gordura resulta, também, em maior síntese de anandamida pelos hepatócitos que se acompanha de maior expressão de receptores CB171. Nesse panorama, francamente pró-obesígeno, estaria presente uma importante resistência às ações anoréxicas da leptina57.
Recentemente, identificou-se em indivíduos com sobrepeso e obesos um polimorfismo missense no genótipo homozigoto FAAH 385 A/A, revelando funcionamento potencialmente inadequado de umas das enzimas-chave das vias de degradação dos endocanabinóides74, o que seria uma justificativa adicional para explicar a hiperatividade do sistema.
Em verdade, a hipótese de hiperatividade sustentada do sistema endocanabinóide foi o leitmotiv que propiciou a indicação de antagonistas seletivos CB1 no tratamento da obesidade e suas conseqüências.
Os efeitos do bloqueio seletivo de receptores CB1 sobre os fatores de risco cardiovascular. Alguns resultados de ensaios clínicos do Programa RIO (Rimonabant In Obesity)
O bloqueio de receptores CB1 com antagonistas seletivos como o rimonabanto parece ser perspectiva promissora na redução do risco de doença cardiovascular que persiste mesmo após a instituição de esquemas terapêuticos considerados altamente efetivos.
Os estudos de farmacocinética do rimonabanto revelaram que a droga é rapidamente absorvida por via oral, tem uma meia-vida terminal de nove dias em indivíduos eutróficos e de dezesseis dias em obesos, é metabolisada pelo CYP3A e amidohidrolase, sendo eliminada pelas vias biliares, e tendo desprezível excreção renal. Ajustes nas doses do rimonabanto em pacientes com insuficiência renal e hepática leve a moderada e em idosos não são necessários. A co-administração de rimonabanto com alimentos ou orlistat teve impacto mínimo sobre a farmacocinética da droga75.
Os dados da fase pré-clínica foram confirmados por ensaios clínicos fase III RIO-Europe76, RIO-Lipids17, RIO-North America18, RIO-Diabetes77 conduzidos em pacientes com sobrepeso ou obesos, portadores ou não de comorbidades associadas. Os ensaios foram multicêntricos, randomizados duplo-cegos e controlados com placebo e incluíram 6.627 pacientes de ambos os sexos, com as seguintes características: idade média 45-56 anos, média de índice de massa corporal entre 33-38 kg/m2, e cintura abdominal > 88 cm para as mulheres e > 102 cm para os homens.
Dentre os pacientes randomizados nesses ensaios clínicos, 53% a 66% completaram 12 meses de estudo, o que representa uma limitação para a análise de dados e sua interpretação. Contudo, há que ressaltar que o abandono do tratamento teve percentuais semelhantes naqueles que receberam placebo (49,1%) e rimonabanto 5 mg (49%) e 20 mg (44,9%)18. Além disso, a baixa retenção de pacientes em estudos de intervenção farmacológica com vistas ao controle do sobrepeso e da obesidade, tem sido registrada em outros ensaios clínicos randomizados78.
O percentual de dislipidemia variou de 55,7% no RIO-Diabetes para 100% no RIO-Lipids; o de síndrome metabólica de 34,7% no RIO-North America para 79,3% no RIO-Diabetes. O percentual de hipertensão arterial variou de 61,2% no RIO-Diabetes para 27,2% no RIO-Lipids. Esses ensaios foram realizados nos Estados Unidos, Canadá e Europa.
A casuística do RIO-Lipids foi de 1.033 pacientes com sobrepeso ou obesidade e dislipidemia não tratada, tendo sido excluídos os diabéticos; o estudo durou um ano17. O RIO-Europe teve 1.507 indivíduos com sobrepeso ou obesidade, com ou sem comorbidades, excluindo diabetes e durou dois anos76. O RIO-North America mostrou casuística de 3.040 pacientes com obesidade ou sobrepeso, com ou sem comorbidades associadas, também excluindo diabetes e teve duas fases: a primeira, de 12 meses e uma segunda, correspondendo aos pacientes que já vinham tomando rimonabanto e foram re-randomizados para um braço que usou placebo e um outro que continuou com a mesma dose de rimonabanto18. O RIO-Diabetes randomizou 1.047 pacientes, todos com sobrepeso, obesidade e diabetes tipo 2. Teve duração de um ano e seus resultados foram apresentados em anais de congresso77.
Após um ano de estudo houve redução significativa na circunferência da cintura (-8,5 cm) e do peso (-8,6 kg) nos três estudos publicados, com o uso de 20 mg/dia do fármaco (fig.5). Houve prevenção do reganho de peso e da circunferência abdominal naqueles pacientes do RIO-North America que foram re-randomizados para o braço rimonabanto 20 mg/20 mg.
Quanto aos efeitos do rimonabanto sobre os fatores de risco cardiometabólico, os seguintes resultados foram observados:
1) Níveis de HDL-C, triglicerídeos, LDL pequenas e densas e LDL-C:
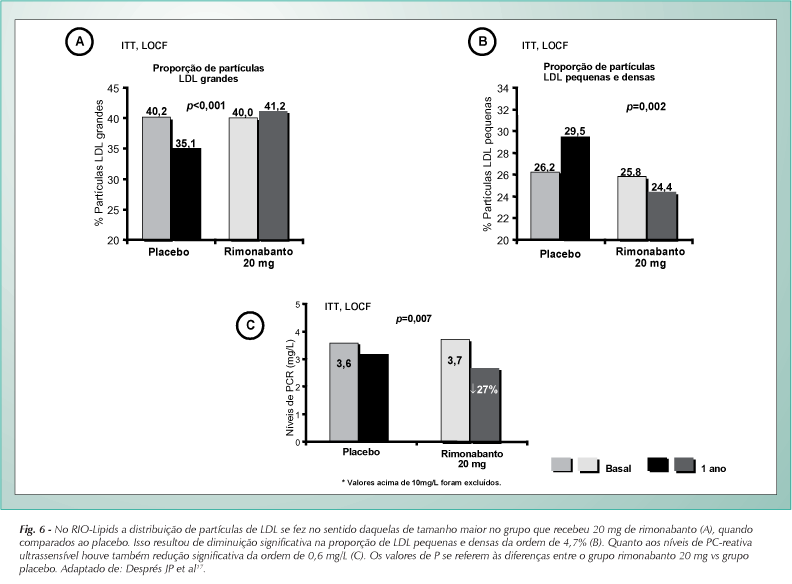
O Rio-Europe mostrou, após um ano de tratamento, mudanças significativas (vs placebo) nas concentrações de triglicerídeos (-6,8%) e do HDL-C (22,3%) no grupo que tomou 20 mg de rimonabanto. As mudanças desses dois parâmetros foram muito semelhantes no RIO-Lipids e persistiram após dois anos de uso do fármaco no RIO-North America. Em nenhum dos três estudos o rimonabanto teve um efeito apreciável sobre os níveis de colesterol e LDL-C. No RIO-Lipids a distribuição de partículas de LDL se fez no sentido daquelas de tamanho maior no grupo que recebeu 20 mg de rimonabanto; ao mesmo tempo observou-se diminuição significativa na proporção [partículas de] de LDL pequenas e densas da ordem de 4,6% (fig. 6), quando comparado ao placebo. Modelos de regressão logística e/ou ANCOVA usando a perda de peso como co-variável mostraram que após 20 mg de rimonabanto, tanto o HDL-C como os triglicerídeos sofreram mudanças, parcialmente independentes da perda de peso (fig. 7).
2) Mudanças nos parâmetros glicêmicos:
A análise conjunta dos três ensaios publicados caracterizou um subgrupo de pacientes pré-diabéticos (n = 1.290) cujos níveis de glicose em jejum variaram entre iguais ou superiores a 100 mg/dl e inferiores a 126 mg/dl. Os resultados mostraram que em 46,5% dos pacientes pré-diabéticos que receberam 20 mg/dia de rimonabanto durante um ano, os valores da glicemia em jejum retornaram ao normal (abaixo de 100 mg/dl).
Quanto aos efeitos da medicação sobre os valores da hemoglobina glicosilada, o estudo RIO-Diabetes mostrou que 43% dos pacientes em uso de 20 mg de rimonabanto, tiveram seus níveis de hemoglobina glicosilada revertidos a valores normais (menos de 6,5%, após um ano de tratamento, quando se comparou com o grupo placebo, onde esta mudança aconteceu em 21% dos pacientes).
Registrou-se, também, uma melhora significativa nas concentrações da insulina em jejum e da resistência à insulina calculada pelo HOMA, quando comparadas com os resultados do grupo placebo. Após um ano de tratamento com placebo, 5 mg e 20 mg/dia de rimonabanto, a prevalência de síndrome metabólica nesses grupos foi 48,1%, 46,4% e 32,3% (p = 0,30 e p < 0,001 vs placebo, respectivamente).
3) O RIO-Lipids mostrou que os níveis de adiponectina aumentaram em 57,7% com o emprego de 20 mg de rimonabanto, diferença essa que foi significativa quando comparada à observada no grupo placebo (fig. 8). É importante mencionar que mais de 50% desse aumento ocorreu independentemente da perda de peso. Ademais, os níveis de adiponectina correlacionaram-se positiva e significativamente com as mudanças do HDL-C e Apo-I. Nesse mesmo ensaio os níveis de leptina diminuíram significativamente tanto com 5 mg quanto com 20 mg de rimonabanto. As concentrações plasmáticas de proteína C-reativa reduziram-se significativamente no grupo que recebeu rimonabanto, mostrando que o fármaco interfere favoravelmente nesse marcador inflamatório (fig. 6).
As pressões sistólica e diastólica diminuíram significativamente (-2,1 mmHg e -1,7 mmHg, respectivamente) e a queda foi maior nos pacientes hipertensos.
4) A análise de eficácia primária do medicamento foi aplicada à população ITT (do inglês - intention to treat) e com a LOCF (do inglês - last observation carried forward). Doses de 20 mg de rimonabanto foram geralmente bem toleradas e os efeitos adversos, de intensidade leve a moderada, restringiram-se, na sua maior parte, a episódios depressivos [2,9% vs 0,6% (placebo)], ansiedade [1,7% vs 0,6% (placebo)] e náusea [1,2% vs 0% (placebo)]. Efeitos adversos considerados sérios e que levaram a interrupção do estudo foram registrados em 5,2%, 4,0% e 2,3% nos pacientes que fizeram uso, durante um ano, de 20 mg, 5 mg e placebo, respectivamente17. Nos pacientes que receberam o mesmo tratamento durante dois anos, a taxa de descontinuidade por efeitos adversos se tornou comparável (4% placebo, 6,3% 5 mg, 4,2% 20 mg), sugerindo que os mesmos ocorrem precocemente e que 5 mg e 20 mg de rimonabanto têm um perfil de tolerabilidade e segurança semelhante ao placebo18.
5) De acordo com os dados até o momento disponíveis do PROGRAMA-RIO, não se registraram interações relevantes entre anti-hipertensivos, vastatinas, anti-diabéticos orais e fibratos com o rimonabanto17,18,76,77.
Além dos ensaios clínicos incluídos no Programa RIO outros estudos estão em andamento para apreciar se a melhora do perfil de risco cardiometabólico pelo rimonabanto se traduz não só em mudanças no volume da placa aterosclerótica de coronárias mensurado por ultrassom intravascular (Estudo STRADIVARIUS)79. Os possíveis benefícios do rimonabanto sobre desfechos fatais e não fatais atribuídos a episódios de infarto agudo do miocárdio e acidente vásculo-encefálico estão sendo avaliados por meio de um ensaio clínico prospectivo, randomizado e controlado (Estudo CRESCENDO), atualmente em fase de recrutamento de pacientes80.
Considerando-se, também, que a interrupção do tabagismo se associa ao rápido declínio no risco de eventos cardiovasculares, o rimonabanto está sendo testado, tanto nos Estados Unidos quanto na Europa (Estudos STRATUS)81, com vista a avaliar possíveis efeitos do medicamento sobre as taxas de abstinência de cigarro. Resultados parciais do STRATUS-US mostraram que essa taxa foi significativamente maior em indivíduos que usaram 20 mg de rimonabanto quando comparados àqueles que utilizaram placebo.
A avaliação dos dados desses ensaios clínicos mostra que a intervenção farmacológica sobre o sistema endocanabinóide é alternativa não só inovadora como bastante promissora no tratamento dos fatores de risco cardiometabólico que acompanham a obesidade abdominal e, possivelmente, um instrumento de real potencialidade na prevenção da aterosclerose e suas conseqüências. Apontam, também, para a extensão desses efeitos por período de até 2 anos ressaltando que a melhora do perfil metabólico aconteceu, em parte, independentemente da perda de peso.
A farmacoterapia no combate a obesidade com fármacos que antagonizam os receptores CB1 do sistema endocanabinóide deve ir além da perda de peso e de seus propósitos meramente estéticos. É preciso dirigi-la aos pacientes de elevado risco, a maioria exibindo excesso de gordura intra-abdominal, à qual se agregam inúmeros fatores de risco cardiovascular e metabólico. Porém, isoladamente é insuficiente e medidas que visam mudanças no estilo de vida devem ser sempre implementadas. Ademais, identificar o fenótipo acima mencionado pela simples mensuração da cintura abdominal, poderá mudar o persistente panorama de risco residual que ainda se registra em percentual significativo de pacientes.
Recebido em 18/04/06
Aceito em 14/07/06
- 1. Gregg EW, Cheng YJ, Cadwell BL, et al. Secular trends in cardiovascular disease risk factors according to body mass index in US adults. JAMA 2005;293:1868-1874.
- 2. Ford ES, Mokdad AH, Giles WH. Trends in waist circumference among US adults. Obes Res 2003;11:1223-1231.
- 3. Carmena R, Duriez P, Fruchart JC. Atherogenic lipoprotein particles in atherosclerosis. Circulation 2004;109:III2-III7.
- 4. Heart Protection Study Collaborative Group. MRC; BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomized placebo controlled trial. Lancet 2002;360:7-22.
- 5. Yusuf S, Sleight P, Pogue J, Bosch J, Davies R, Dagenais G. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. The Heart Outcomes Prevention Evaluation Study Investigators. N Engl J Med 2000;342:145-153.
- 6. Gaede P, Vedel P, Larsen N, Jensen GV, Parving HH, Pedersen O. Multifatorial intervention and cardiovascular disease in patients with type 2 diabetes. N Engl J Med 2003;348:383-393.
- 7. Instituto Brasileiro de Geografia e Estatística IBGE. Pesquisa de orçamentos familiares 2002-2003. Rio de Janeiro 2004, 80p.
- 8. WHO MONICA. Project Geographical variation in the major risk factors of coronary heart disease in men and women aged 35-64years. World Health Statistics Quaterly 1988;41:115-140.
- 9. Barroso SG; Abreu VGA, Francischetti EA. A participação do tecido adiposo visceral na gênese da hipertensão e doença cardiovascular aterogênica. Um conceito emergente. Arq Bras Cardiol 2002;78:618-630.
- 10. Kershaw EE, Flier JS. Adipose tissue as an endocrine organ. J Clin Endocrinol Metab 2004;89:2548-2556.
- 11. National Cholesterol Education Program. Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III): Final Report. National Cholesterol Education Program, National Heart, Lung, and Blood Institute, National Institutes of Health. NIH Publication No. 02-5215. September 2002.
- 12. World Health Organization. Definition, diagnosis and classification of diabetes mellitus and its complications, 1999. WHO/NCD/NCS/99.2.
-
13International Diabetes Federation, http://www.idf.org
- 14. Schwartz MW, Woods SC, Porte Jr D, Seeley RJ, Baskin DG. Central nervous system control of food intake. Nature 2000;404:661-671.
- 15. Pagotto U, Marsicano G, Cota D, Lutz B, Pasquali R. The emerging role of the endocannabinoid system in endocrine regulation and energy balance. Endocr Rev 2006;27:73-100.
- 16. Di Marzo V, Matias I. Endocannabinoid control of food intake and energy balance. Nat Neurosc 2005;8:585-589.
- 17. Després JP, Golay A, Sjöström L. Effects of rimonabant on metabolic risk factors in overweight patients with dyslipidemia. N Engl J Med 2005;353:2121-2134.
- 18. Pi-Sunyer FX, Aronne LJ, Heshmati HM, Devin J, Rosenstock J. Effect of rimonabant, a cannabinoid-1 receptor blocker, on weight and cardiometabolic risk factors in overweight or obese patients. JAMA 2006;295:761-775.
- 19. Adams IB, Martin BR. Cannabis: pharmacology and toxicology in animals and humans. Addiction 1996;91:1585-1614.
- 20. Mechoulam R. in Cannabis as Therapeutic Agent (ed. Mechoulam, R.) 1-19 (CRC Press Roca Ranton, 1986).
- 21. Gaoni Y, Mechoulam R. Isolation, structure, and partial synthesis of an active constituent of hashish. J Am Chem Soc 1964; 86:16461647.
- 22. Plasse TE, Gorter RW, Krasnow SH, Lane M, Shepard KV, Wadleigh RG. Recent clinical experience with dronabinol. Pharmacol Biochem Behav 1991;40:695-700.
- 23. Beal JE, Olson R, Laubenstein I, et al. Dronabinol as a treatment for anorexia associated with weight loss in patients with AIDS. J Pain Sympton Manage 1995;10:89-97.
- 24. Volicer I, Stelly M, Morris J, McLaughlin J, Volicer BJ. Effects of dronabinol on anorexia and disturbed behavior in patients with Alzheimer's disease. Int J Geriatr Psychiatry 1997;12:913-919.
- 25. Devane WA, Dysarz FA, Johnson MR, Melvin LS, Howlett AC. Determination and characterization of a cannabinoid receptor in rat brain. Mol Pharmacol 1988:34:605613.
- 26. Munro S, Thomas KL, Abu-Shaar M. Molecular characterization of a peripheral receptor for cannabinoids. Nature 1993;365,61-65.
- 27. Ameri A. The effects of cannabinoids on the brain. Prog Neurobiol 1999;58:315-348.
- 28. Porter AC, Felder CC. The endocannabinoid nervous system: unique opportunities for therapeutic intervention. Pharmacol Ther 2001;90:45-60.
- 29. Devane WA, Hanus L, Breuer A, et al. Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Science 1992;258:1946-1949.
- 30. McAllister SD, Glass M. CB1 and CB2 receptor mediated signalling: a focus on endocannabinoids. Prostaglandins Leukot. Essent. Fatty Acids 2002;66:161-171.
- 31. Di Marzo V, Bifulco M, De Petrocellis L. The endocannabinoid system and its therapeutic exploration. Nature Rev 2004;3:771-784.
- 32. De Vries TJ, Shaham Y, Homberg JR, et al. A cannabinoid mechanisms in relapse to cocaine seeking. Nat Med 2001;7:1099-1100.
- 33. Fattore L, Spano MS, Cossu G, Deiana S, Fratta W. Cannabinoid mechanism in reinstatement of heroin-seeking after a long period of abstinence in rats. Eur J Neurosci 2003;17:1723-1726.
- 34. Anggadiredja K, Nakamichi M, Hiranita T, et al. Endocannabinoid system modulates relapse to methamphetamine seeking: possible mediation by the arachidonic acid cascade. Neuropsychopharmacology 2004;29:1470-1478.
- 35. Gallate JE, Saharov T, Mallet PE, McGregor IS. Increased motivation for beer in rats, following administration of a cannabinoid CB1 receptor agonist. Eur J Pharmacol 1999;370:233-240.
- 36. Castane A, Valjent E, Ledent C, Parmentier M, Maldonado R, Valverde O. Lack of CB1 cannabinoid receptors modifies nicotine behavioural responses, but not nicotine abstinence. Neuropharmacology 2002;43:857-867.
- 37. LeFoll B, Goldberg SR. Rimonabant, a CB1 antagonist, blocks nicotine-conditioned place preferences. Neuroreport 2004;15:2139-2143.
- 38. Cota D, Marsicano G, Tschop M, et al. The endogenous cannabinoid system affects energy balance via central orexigenic drive and peripheral lipogenesis. J Clin Invest 2003;112:423-431.
- 39. Okamoto Y, Morishita J, Tsuboi K, Tonai T, Ueda N. Molecular characterization of a phospholipase D generating anandamine and its congeners. J Biol Chem 2004;279:5298-5305.
- 40. Bisogno T, Howell F, Williams G, et al. Cloning of the first sn1-DAG lipases points to the spatial and temporal regulation of endocannabinoid signaling in the brain. J Cell Biol 2003;163:463-468.
- 41. De Petrocellis L, Cascio MG, Di Marzo V. The endocannabinoid system: a general view and latest additions. British J Pharmacol 2004;141:765-774.
- 42. Bisogno T, De Petrocellis L, Di Marzo V. Fatty acid amide hydrolase, an enzyme with many bioactive substrates. Possible therapeutic implications. Curr Pharm Des. 2002;8:533-547.
- 43. Lutz B. Molecular biology of cannabinoid receptors. Prostaglandins Leukot Essent Fatty Acids 2002;66:123-142.
- 44. Pagotto U, Marsicano G, Fezza E, et al. Normal human pituitary adenomas express cannabinoid receptor type 1 and synthesize endogenous cannabinoid: first evidence for a direct role of cannabinoids on hormone modulation at the human pituitary level. J Clin Endocrinol Metab 2001;86:2687-2696.
- 45. Navarro M, Hernandez E, Munoz RM, et al. Acute administration of the CB1 cannabinoid receptor antagonist SR141716A induces anxiety-like responses in the rat. Neuroreport 1997;8:491-496.
- 46. De Petrocelli L, Melck D, Bisogno T, Di Marzo V. Endocannabinoids and fatty acid amides in cancer, inflammation and related disorders. Chem Phys Lipids 2000;108:191-209.
- 47. Calignano A, Katona I, Desarnaud F, et al. Bidirectional control of airway responsiveness by endogenous cannabinoids. Nature 2000;408:96-101.
- 48. Wagner JA, Jarai Z, Batkai S, Kunos G. Hemodynamic effects of cannabinoids: coronary and cerebral vasodilation mediated by cannabinoid CB1 receptors. Eur J Pharmacol 2001;423:203-210.
- 49. Wenger T, Ledent C, Csernus V, Gerendal I. The central cannabinoid receptor inactivation suppresses endocrine reproductive functions. Biochem Biophys Res Commun 2001;284:363-368.
- 50. Bifulco M, Di Marzo V. Targetting the endocannabinoid system in cancer therapy: a call for further research. Nat Med 2002;8:547-550.
- 51. Panikashvili D, Simeonidou C, Ben Shabat S, Hanus I, et al. An endogenous cannabinoid (2-AG) is neuroprotective after brain injury. Nature 2001;413:527-531.
- 52. Di Marzo V, Melck D, Bisogno T, De Petrocellis L. Endocannabinoid: endogenous cannabinoid receptor ligands with neuromodulatory action. Trends Neurosci 1998;21:521-528.
- 53. Bátkai S, Pacher P, Osei-Hyiaman D, et al. Endocannabinoids acting at cannabinoid-1 receptors regulate cardiovascular function in hypertension. Circulation 2004;110:1996-2002.
- 54. Steffens S, Veillard NR, Arnaud C, et al. Low dose oral cannabinoid therapy reduces progression of atherosclerosis in mice. Nature 2005;434:782-786.
- 55. Kirkham TC, Williams CM, Fezza F, Di Marzo V. Endocannabinoid levels in rat limbic forebrain and hypothalamus in relation to fasting, feedind and satiation: stimulation of eating by 2-arachidonoyl glycerol. Br J Pharmacol 2002;136:550-557.
- 56. Jamshidi N, Taylor DA. Anandamide administration into the ventromedial hypothalamus stimulates appetite in rats. Br J Pharmacol 2001;134:1151-1154.
- 57. Di Marzo V, Goparaju SK, Wang L, et al. Leptin-regulated endocannabinoids are involved in maintaining food intake. Nature 2001;410:822-825.
- 58. Hao S, Avraham Y, Mechoulam R, Berry EM. Low dose anandamide affects food intake, cognitive function, neurotransmitter and corticosterone levels in diet-restricted mice. Eur J Pharmacol 2000;392:147-156.
- 59. Rinaldi-Carmona M, Barth F, Heauline M, et al. SR141716A, a potent and selective antagonist of the brain cannabinoid receptor. FEBS Lett 1994;350:240-244.
- 60. Ravinet Trillou C, Arnone M, Delgorge C, et al. Anti-obesity effect of SR141716, a CB1 receptor antagonist, in diet-induced obese mice. Am J Physiol Regul Comp Physiol 2003;284:R345-R353.
- 61. Pagotto U, Cervino C, Vicennati V, Marsicano G, Lutz B, Pasquali R. How many sites of action for endocannabinoids to control energy metabolism? Int J Obes 2006;30:S39-S43.
- 62. Di S, Malcher-Lopes R, Halmos KC, Tasker JG. Nongenomic glucocorticoid inhibition via endocannabinoid release in the hypothalamus: a fast feedback mechanism. J Neurosc 2003;23:4850-4857.
- 63. Horvath TL. Endocannabinoids and the regulation of body fat: the smoke is clearing. J Clin Invest 2003;112:323-326.
- 64. Tucci SA, Rogers EK, Korbonits M, Kirkham TC. The cannabinoid CB1 receptor antagonist SR141716 blocks the orexigenic effects of intrahypothalamic ghrelin. Br J Pharmacol 2004;143:520-533.
- 65. Kirkham TC, Williams CM. Synergistic effects of opioid and cannabinoid antagonists on food intake. Psychopharmacology 2001;153:267-270.
- 66. Gomez R, Navarro M, Ferrer B, et al. A peripheral mechanism for CB1 cannabinoid receptor-dependent modulation of feeding. J Neurosc 2002;22:9612-9617.
- 67. Burdyga G, Lal S, Varro A, Dimaline R, Thompson DG, Dockray GJ. Expression of cannabinoid CB1 receptors by vagal afferent neurons is inhibited by cholecystokinin. J Neurosci 2004;24:2708-2715.
- 68. Cota D, Marsicano G, Lutz B, et al. Endogenous cannabinoid system as a modulator of food intake. Int J Obes 2003;27:289-301.
- 69. Poirier B, Bidouard JP, Cadrouvele C, et al. The anti-obesity effect of rimonabant is associated with an improved serum lipid profile. Diabetes Obes Metab 2005;7:65-72.
- 70. Bensaid M, Gary-Bobo M, Esclangon A, et al. The cannabinoid CB1 receptor antagonist SR141716 increases Acrp30 mRNA expression in adipose tissue of obese fa/fa rats and in culture adipocyte cells. Mol Pharmacol 2003;63:908-914.
- 71. Osei-Hyiaman D, DePetrillo M, Pacher P, et al. Endocannabinoid activation at hepatic CB1 receptors stimulates fatty acid synthesis and contributes to diet-induced obesity. J Clin Invest 2005;115:1298-1305.
- 72. Ravinet Trillou C, Delgorge C, Menet C, Arnone M, Soubrie P. CB1 cannabinoid receptor knockout in mice leads to leanness, resistanse to diet-induced obesity and enhanced leptin sensitivity. Int J Obes Relat Metab Disord 2004;28:640-648.
- 73. Liu YL, Connoley IP, Wilson CA, Stock MJ. Effects of the cannabinoid CB1 receptor antagonist SR141716 on oxygen consumption and soleus muscle glucose uptake in Lep(ob)/Lep(ob) mice. Int J Obes Relat Metab Disord 2005;29:183-187.
- 74. Sipe JC, Waalen J, Gerber A, Beutler E. Overweight and obesity associated with a missense polymorphism in fatty acid amide hydrolase (FAAH). Int J Obes 2005;29:755-759.
-
75Clinical Investigator Brochure. Sanofi-Synthelabo Recherche SR141716, Rimonabant. 2004; pp. 35-38.
- 76. Van Gaal LF, Rissanen AM, Scheen AJ, Ziegler O, Rössner S. Effects of the cannabinoid-1 receptor blocker rimonabant on weight reduction and cardiovascular risk factors in overweight patients: 1-year experience from the RIO-Europe study. Lancet 2005;365:1389-1387.
- 77. Scheen AJ, et al. Oral presentation: American Diabetes Association 65th Annual Scientific Sessions, San Diego, CA, June 12, 2005.
- 78. Padwal R, Li S, Lau D. Long-term pharmacotherapy for overweight and obesity: a systematic review and meta-analysis of randomised controlled trials. Int J Obes Relat Metab Disord 2003;27:1437-1446.
-
79STRADIVARIUS (Strategy to Reduce Atherosclerosis Development Involving Administration of Rimonabant - the intravascular ultrasound study). http://www. clinicaltrials.gov / ct/gui/show/ NCT00 124332 Accessed in 5/06/2006.
-
80CRESCENDO Comprehensive Rimonabant Evaluation Study of Cardiovascular. ENDpoints and Outcomes. http://www.clinicaltrials.gov/ct/gui/show/NCT00263042 Accessed em 15/06/2006.
- 81. Anthenelli RM. Effects of rimonabant in the reduction of major cardiovascular risk factors. Results from the STRATUS-US trial (Smoking Cessation in Smokers Motivated to Quit). Presented at: American College of Cardiology Scientific Sessions; New Orleans, LA: 2004.
Correspondência:
Datas de Publicação
-
Publicação nesta coleção
21 Nov 2006 -
Data do Fascículo
Out 2006
Histórico
-
Recebido
18 Abr 2006 -
Aceito
14 Jul 2006