Resumos
O efeito dos diferentes níveis de preservação ambiental de córregos de 1ª a 4ª ordens sobre a riqueza, abundância, similaridade na composição de Baetidae (Ephemeroptera) e o potencial das espécies como bioindicadoras foram investigados em uma região de cerrado matogrossense. Um total de vinte espécies/morfoespécies foi catalogado dentre as 1752 ninfas amostradas, sendo reportado dois novos registros de espécies para o país. Os valores do Índice de Integridade de Hábitat (HII) obtidos foram categorizados para ambientes degradados, alterados e conservados. A riqueza de espécies foi diferente entre os locais, sendo maior em ambientes alterados. A abundância foi maior entre ambientes conservados e alterados, sendo significantemente diferente dos locais degradados. A análise NMDS indicou que locais conservados e alterados apresentam similaridade de composição de espécies, diferindo dos locais degradados. Quatro espécies demonstraram relação positiva com o aumento dos valores do HII. Baetidae apresentou espécies indicadoras de ambientes com diferentes níveis de preservação, sendo Zelusia principalis Lugo-Ortiz & McCafferty, 1998 e Baetodes sp. indicadoras de ambientes conservados e Aturbina nigra Salles, Boldrini & Shimano, 2011, Callibaetis sp. 2, Camelobaetidius aff. janae Dominique & Thomas, 2000, Paracloeodes binodulus Lugo-Ortiz & McCafferty, 1996, Waltzoyphius roberti Thomas & Peru, 2002 como indicadoras de ambientes alterados. O conhecimento da ecologia das espécies avança no sentido de fornecer subsídios ao biomonitoramento da bacia e uso de espécies indicadoras.
Abundância; riqueza; similaridade; Índice de Integridade de Hábitat; espécies indicadoras
The effect of different stream environmental preservation levels, in 1st to 4th orders, over the richness, abundance, similarity in the composition and the potential of Baetidae (Ephemeroptera) species as bioindicators were investigated in a Cerrado region located in the state of Mato Grosso, Brazil. A total of twenty species/morphospecies were catalogued from the 1752 samples of nymphs, resulting in a new record for two species in Brazil. Values of Habitat Integrity Index (HII) were categorized among damaged, modified, and preserved environments. Species richness was different between sites, being greater in disturbed habitats. Total abundance was higher among preserved and altered environments, and differed significantly from the degraded areas. The NMDS analysis indicates that, in preserved and modified sites, the similarity in the composition of species differs from degraded areas. Four species showed a positive relationship with increasing values of HII. Baetidae showed environmental indicator species with different levels of preservation, with Zelusia principalis Lugo-Ortiz & McCafferty, 1998 and Baetodes sp. being indicators of preserved environments and Aturbina nigra Salles, Boldrini & Shimano, 2011, Callibaetis sp. 2, Camelobaetidius aff. janae, Paracloeodes binodulus Lugo-Ortiz & McCafferty, 1996 and Waltzoyphius roberti Thomas & Peru, 2002 as indicators of modified environments. The knowledge on the ecology of species advances in terms of providing subsidies for the biomonitoring of basins and the use of indicator species.
Abundance; richness; similarity; Index of Habitat Integrity; indicator species
Baetidae (Insecta, Ephemeroptera) em córregos do cerrado matogrossense sob diferentes níveis de preservação ambiental
Baetidae (Insecta, Ephemeroptera) of Cerrado streams in the state of Mato Grosso, Brazil, under different levels of environmental preservation
Hilton M. de L. SouzaI; Helena S. R. CabetteII; Leandro JuenIII
IPrograma de Pós-Graduação em Ciências Ambientais, Universidade do Estado de Mato Grosso, Av. Santos Dumont, Bairro Santos Dumont, Cidade Universitária, 78200-000, Cáceres MT, Brasil (hilton_marcelo@hotmail.com)
IIDepartamento de Ciências Biológicas, Universidade do Estado de Mato Grosso, BR 158, Km 148, Caixa Postal 08, 78690-000, Nova Xavantina MT, Brasil (hcabette@uol.com.br)
IIIInstituto de Ciências Biológicas, Universidade Federal do Pará, Rua Augusto Correia, no1, Bairro Guama, 66075-110, Belém, Pará, Brasil (leandrojuen@yahoo.com.br)
RESUMO
O efeito dos diferentes níveis de preservação ambiental de córregos de 1ª a 4ª ordens sobre a riqueza, abundância, similaridade na composição de Baetidae (Ephemeroptera) e o potencial das espécies como bioindicadoras foram investigados em uma região de cerrado matogrossense. Um total de vinte espécies/morfoespécies foi catalogado dentre as 1752 ninfas amostradas, sendo reportado dois novos registros de espécies para o país. Os valores do Índice de Integridade de Hábitat (HII) obtidos foram categorizados para ambientes degradados, alterados e conservados. A riqueza de espécies foi diferente entre os locais, sendo maior em ambientes alterados. A abundância foi maior entre ambientes conservados e alterados, sendo significantemente diferente dos locais degradados. A análise NMDS indicou que locais conservados e alterados apresentam similaridade de composição de espécies, diferindo dos locais degradados. Quatro espécies demonstraram relação positiva com o aumento dos valores do HII. Baetidae apresentou espécies indicadoras de ambientes com diferentes níveis de preservação, sendo Zelusia principalis Lugo-Ortiz & McCafferty, 1998 e Baetodes sp. indicadoras de ambientes conservados e Aturbina nigra Salles, Boldrini & Shimano, 2011, Callibaetis sp. 2, Camelobaetidius aff. janae Dominique & Thomas, 2000, Paracloeodes binodulus Lugo-Ortiz & McCafferty, 1996, Waltzoyphius roberti Thomas & Peru, 2002 como indicadoras de ambientes alterados. O conhecimento da ecologia das espécies avança no sentido de fornecer subsídios ao biomonitoramento da bacia e uso de espécies indicadoras.
Palavras-chave: Abundância, riqueza, similaridade, Índice de Integridade de Hábitat, espécies indicadoras.
ABSTRACT
The effect of different stream environmental preservation levels, in 1st to 4th orders, over the richness, abundance, similarity in the composition and the potential of Baetidae (Ephemeroptera) species as bioindicators were investigated in a Cerrado region located in the state of Mato Grosso, Brazil. A total of twenty species/morphospecies were catalogued from the 1752 samples of nymphs, resulting in a new record for two species in Brazil. Values of Habitat Integrity Index (HII) were categorized among damaged, modified, and preserved environments. Species richness was different between sites, being greater in disturbed habitats. Total abundance was higher among preserved and altered environments, and differed significantly from the degraded areas. The NMDS analysis indicates that, in preserved and modified sites, the similarity in the composition of species differs from degraded areas. Four species showed a positive relationship with increasing values of HII. Baetidae showed environmental indicator species with different levels of preservation, with Zelusia principalis Lugo-Ortiz & McCafferty, 1998 and Baetodes sp. being indicators of preserved environments and Aturbina nigra Salles, Boldrini & Shimano, 2011, Callibaetis sp. 2, Camelobaetidius aff. janae, Paracloeodes binodulus Lugo-Ortiz & McCafferty, 1996 and Waltzoyphius roberti Thomas & Peru, 2002 as indicators of modified environments. The knowledge on the ecology of species advances in terms of providing subsidies for the biomonitoring of basins and the use of indicator species.
Keywords: Abundance, richness, similarity, Index of Habitat Integrity, indicator species.
Alterações provocadas pelas ações antrópicas nos ecossistemas aquáticos geralmente levam a uma diminuição ou completa perda das características ambientais do sistema (BAUERNFEIND & MOOG, 2000). Tem-se observado expressiva queda da qualidade da água e redução da integridade ambiental em corpos d'água no Brasil, levando a modificações na dinâmica natural das comunidades biológicas, culminando na perda de biodiversidade aquática (GALDEAN et al., 2000; CALLISTO et al., 2001; DODDS, 2002).
As principais modificações estruturais em ambientes lóticos são consequência da retirada da vegetação ciliar que deixam as margens expostas facilitando o processo de assoreamento, resultando na homogeneização do leito e na diminuição da diversidade de habitats (microhabitats) (DELONG & BRUSVEN, 1998). Em consequência disso, os organismos que dependem de condições ambientais específicas para sua coexistência são os primeiros a serem afetados (CORTEZZI et al., 2009) e sua distribuição reflete diretamente os impactos provocados no ecossistema (RIOS & BAILEY, 2006; CRISCI-BISPO et al., 2007).
Macroinvertebrados aquáticos são o grupo de organismos mais utilizado em programas de biomonitoramento, especialmente insetos (ROSEMBERG & RESH, 1993). Dentre esses, Ephemeroptera se destaca, compreendendo um dos grupos dominantes em ecossistemas lóticos; são importantes nas cadeias tróficas, no processamento da matéria orgânica, bem como na transferência de energia (GALDEAN et al., 2000; SALLES et al., 2004b). Possuem curto período de vida adulta (efêmera), longa duração de seu período ninfal, alta abundância e capacidade de ocupar todos os habitats aquáticos disponíveis (BISPO & CRISCI-BISPO, 2006).
Segundo BAUERNFEIND & MOOG (2000), a estrutura da comunidade de efemerópteros reflete eficientemente a situação ambiental dos corpos d'água, em virtude da intrínseca relação com a disponibilidade de habitats, podendo ser usada como ferramenta na avaliação da integridade ecológica e monitoramento ambiental. Sob condições naturais, sua diversidade é diretamente correlacionada com a variedade de habitat e, portanto, uma modificação na estrutura física dos córregos deve refletir efetivamente o estado da integridade ecológica da área de amostragem (KOTHE, 1962; DINAKARAM & ANBALAGAN, 2007).
Dentre as famílias de Ephemeroptera registradas no Brasil, Baetidae é a mais abundante (ROMERO & FERNÁNDEZ, 2001; FRANCISCHETTI et al., 2004; GOULART & CALLISTO, 2005; BUSS & SALLES, 2007) e a que possui maior número de espécies registradas (69), além de ser o grupo mais amplamente distribuído entre as diversas regiões geográficas do mundo (LUGO-ORTIZ & MCCAFFERTY, 1999; BARBER-JAMES et al., 2008; SALLES, 2011).
Baetidae apresenta algumas vantagens como indicadores da integridade de riachos; (1) a taxonomia é baseada na forma imatura, não sendo necessária a associação com a forma adulta; (2) são facilmente encontrados em diversos tipos de substratos, tais como seixos, folhiços, entre outros (BUSS et al., 2004); (3) a evolução na taxonomia deste grupo é evidente nos últimos 10 anos na região neotropical (BUSS & SALLES, 2007), com descrição de novos gêneros e espécies (GILLIES, 2001; LUGO-ORTIZ et al., 2002; SALLES & LUGO-ORTIZ, 2003; SALLES et al., 2003, 2004a,c, 2005; FRANCISCHETTI et al., 2004; SALLES & FRANCISCHETTI, 2004; SALLES & SERRÃO, 2005; DOMÍNGUEZ et al., 2006; NIETO & SALLES, 2006; SALLES, 2007; SALLES & POLEGATTO, 2008).
Estudos ecológicos com esta família ainda são restritos, entretanto, BUSS et al. (2002) indicam os baetídeos como pouco sensíveis às alterações ambientais, encontrados em locais com níveis intermediários de degradação. Outras contribuições relatam variação nas espécies quanto às exigências por locais com integridades ambientais mais elevadas e tipos de substratos específicos associados a esses ambientes (DOMÍNGUEZ et al., 2006; BUSS & SALLES, 2007).
Diante deste cenário, este trabalho tem como objetivo avaliar o efeito da integridade ambiental sobre a abundância, riqueza e similaridade na composição das espécies de Baetidae em córregos do cerrado matogrossense, procurando indicar se existem espécies com especificidade/fidelidade a determinado nível de conservação. Para tanto, foi testada a seguinte hipótese: Baetidae apresenta maior riqueza e abundância de espécies em locais com níveis mais elevados de integridade e ambientes com menor integridade apresentarão redução na riqueza e composição de espécies mais homogêneas do que nos locais mais íntegros. Assim, se de fato a integridade ambiental é importante para a distribuição, as espécies apresentarão baixa tolerância às variações de integridade e poderão ser usadas como espécies indicadoras.
MATERIAL E MÉTODOS
A bacia do Rio Pindaíba, com área de 10.029 km2, localiza-se em região de cerrado ao leste do Estado de Mato Grosso (14°59' - 15°39'S / 52°03' - 52°28'O), onde a atividade econômica predominante é a agropecuária extensiva. O clima regional é do tipo Cwa conforme Köppen, com duas estações climáticas bem definidas: um período seco de cinco meses (de maio a setembro) e outro período chuvoso (dezembro a março), com temperaturas médias em torno de 20ºC a 25ºC, sendo o período de agosto a outubro o mais quente. As médias de precipitação anual variam de 1.200 a 1.600mm (BRASIL, 1981).
As áreas de estudo correspondem a pontos da rede de drenagem da sub-bacia do rio Corrente nos córregos Taquaral (CRT) e Papagaio (CRP) e, porção superior e média da sub-bacia do rio Pindaíba nos córregos Cachoeirinha (CRC), da Mata (CRM) e Caveira (CRCV). Foram selecionados 20 locais de estudo em afluentes de 1ª a 4ª ordens (STRAHLER, 1957) (Fig. 1).
No total foram realizadas 64 coletas, sendo três etapas nos córregos CRC, CRM, CRP e CRT (período chuvoso, seca e início das chuvas de 2005) e quatro etapas no CRCV (estação seca, início das chuvas, auge da estação chuvosa e na vazante em 2007/2008); cada etapa em cada córrego foi tratada como uma réplica diferente, exceto na ordenação.
A amostragem das ninfas foi feita pelo método de varredura, com áreas fixas em transectos de 100 m e subdivisões a cada 5 m, perfazendo 20 segmentos amostrais por local de estudo (adaptado de DE MARCO JR., 1998; FERREIRA-PERUQUETTI & DE MARCO JR., 2002; FERREIRA-PERUQUETTI & FONSECA-GESSNER, 2003), com auxílio de uma peneira de 18 cm de diâmetro e malha de 0,50 mm. Em cada local foram anotados os aspectos físico-químicos da água. Este método vem sendo usado com eficiência em outros estudos em Mato Grosso (CABETTE et al., 2010).
As espécies/morfoespécies foram identificadas através de chaves taxonômicas (SALLES et al., 2004c; DOMÍNGUEZ et al., 2006) e por comparação com as descrições de WALTZ & MCCAFFERTY (1987), LUGO-ORTIZ & MCCAFFERTY (1996a,b), GILLIES (2001), FRANCISCHETTI et al. (2003), SALLES & SERRÃO (2005), SALLES & POLEGATTO (2008). O material foi preservado em álcool a 85% e está depositado na Coleção Zoobotânica "James A. Ratter", Universidade do Estado de Mato Grosso, campus de Nova Xavantina (CZNX).
A integridade ambiental dos locais foi avaliada através do Índice de Integridade de Habitat (Habitat Integrity Index - HII) (NESSIMIAN et al., 2008), que analisa diversos aspectos ambientais, tais como padrão do uso da terra, largura da vegetação ripária, estado de preservação da mata ciliar, dispositivos de retenção, sedimentos no canal, estrutura do barranco, leito do rio, corredeiras, vegetação aquática e detritos. O índice é expresso numericamente de 0 a 1 - valores mais próximos de 1 representam ambientes com os níveis mais elevados de integridade. Os dados obtidos a partir do HII foram categorizados de acordo com o critério de SCOTT (1979) para a formação dos grupos, estabelecendo três categorias de conservação: ambientes degradados, alterados e conservados. Os ambientes considerados como degradados apresentaram valores de HII=0,52 a ┤0,67, alterados com HII=├ 0,68 a ┤ 0,82 e conservados com HII=├ 0,83 a 0,97.
Análise de dados. Para testar se houve diferenças na abundância e na riqueza de espécies entre as categorias de integridade ambiental, foi aplicada a análise de variância (ANOVA unifatorial) (ZAR, 1999). Os pressupostos de normalidade e de homocedasticidade (teste de Levene) foram calculados e testados. O teste a posteriori de Tukey foi aplicado quando a ANOVA foi significativa, para identificar quais categorias de integridade ambiental apresentaram médias diferentes.
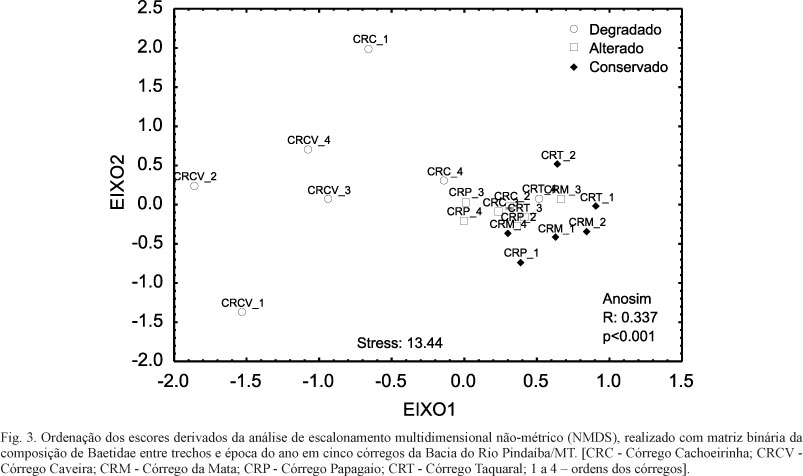
Para sumarizar os dados da estrutura e composição da assembleia, utilizamos a análise de escalonamento multidimensional não-métrico (non-metric multidimentional scaling - NMDS) (DELANEY et al., 2000) ordenando os 20 locais estudados com base na similaridade de composição a partir da presença e ausência das espécies. Para testar a diferença na composição de espécies entre as áreas degradadas, alteradas e conservadas, aplicou-se a Análise de Similaridade Bi-fatorial (ANOSIN), método usado para detectar diferenças na estrutura da composição (MELO & HEPP, 2008).
Para indicar a relação de cada espécie aos níveis de integridade, foi utilizada regressão linear simples (ZAR, 1999) entre os valores do HII e abundância das espécies que apresentaram ocorrência mínima de 1,5 indivíduos por local amostrado. A escolha desse valor foi devido às espécies com valores inferiores apresentarem grande heterogeneidade de variância. O potencial de bioindicação das espécies foi avaliado através do Teste de Espécies Indicadoras (INDVAL) (DUFRÊNE & LEGENDRE, 1997), submetidos ao teste de Monte Carlo aplicando 10.000 permutações, para os três níveis de integridade (conservado, alterado e degradado). Todas as análises foram realizadas no programa R (R DEVELOPMENT CORE TEAM, 2009).
RESULTADOS
Foram coletados 1.752 indivíduos da família Baetidae, distribuídos em 11 gêneros e 20 espécies/morfoespécies (Tab. I), o que representa aproximadamente 50% dos gêneros e 40% das espécies registradas para o Brasil. Os gêneros mais abundandes foram Zelusia (641 exemplares), Waltzoyphius (213), Aturbina (210) e Americabaetis (207), ocorrendo em todos os córregos, exceto Zelusia que não ocorreu no CRCV.
As espécies mais abundantes foram Zelusia principalis Lugo-Ortiz & McCafferty, 1998 (n=641), Americabaetis alphus Lugo-Ortiz & McCafferty, 1996 (n=207), Aturbina georgei Lugo-Ortiz & McCafferty, 1996 (n=170), Paracloeodes sp. (n=143) e Cloeodes redactus Nieto & Richard, 2008 (n=126).
No CRT houve maior frequência de C. redactus (69,8%), Z. principalis (39%) e Paracloeodes sp. (37%), no CRM foram Z. principalis (32,8%) e A. georgei (29,4%). Americabaetis alphus apresentou maior frequência para o CRP (39,6%) e A. georgei para o CRC (35%). Americabaetis alphus, A. georgei e Callibaetis sp., com ampla distribuição, ocorreram em todos os locais de coleta.
O HII apresentou valores que variaram de 0,52 a 0,96. Seguindo as categorias estabelecidas, oito locais foram classificados como degradados (CRC 1ª e 4ª ordens; CRCV 1ª a 4ª ordens; CRP 2ª ordem; CRT 4ª ordem), seis como alterados (CRC 2ª e 3ª ordens; CRM 3ª ordem; CRP 3ª e 4ª ordens; CRT 3ª ordem) e seis como conservados (CRM 1ª, 2ª e 4ª ordens; CRP 1ª ordem; CRT 1ª e 2ª ordens) (Tab. II).
Houve alteração do valor desse índice entre locais (ordens) de um mesmo córrego; assim, o CRC variou entre 0,61 a 0,73 (nascente intermitente e outros locais com agricultura e pecuária), o CRCV entre 0,52 a 0,65 (barragens no curso e locais de agricultura e pastagem), CRM entre 0,82 a 0,96 (locais com alguma influência de pastagens a outros com vegetação ciliar preservada), CRP entre 0,65 a 0,84 (mata ciliar circundada por pastagens a locais com mata ciliar preservada) e o CRT com HII de 0,62 a 0,96 (locais com influência de pastagem a locais com vegetação ciliar preservada).
A riqueza de espécies foi diferente entre os locais com distintos níveis de integridade (F(2,17)=8,486; p=0,003). Em média, locais alterados apresentaram oito espécies a mais do que degradados (p=0,003) e sete a mais que ambientes conservados (p=0,015); os ambientes conservados tiveram riqueza de espécies similares aos degradados (Fig. 2A). A abundância das espécies também diferiu entre locais (F(2,17)=5,418; p=0,015). Ambientes conservados apresentaram, em média, 75 indivíduos a mais do que os degradados (Tukey p=0,022), enquanto que locais alterados, 65 indivíduos a mais do que os locais degradados (Tukey p=0,050) (Fig. 2B).
Ao analisar a ordenação (NMDS) dos locais estudados, foi possível observar um gradiente no agrupamento indicando que os locais conservados apresentaram composição similar aos de ambientes alterados e ambos diferiram dos locais degradados (Fig. 3). Os resultados da ANOSIN também indicam diferenças na composição de espécies entre os dois grupos de ordenação; conservados/alterados e degradados (R=0,337, p=0,001).
A integridade ambiental não mostrou efeito sobre a riqueza de espécies (r2=0,034; p=0,437). Porém, quando avaliamos esse efeito sobre a abundância de espécimes, houve um efeito positivo; neste sentido, a redução da integridade reflete na abundância, e essa relação não pode ser explicada pelo acaso (r2=0,428; p=0,001). A integridade ambiental também apresentou efeito positivo sobre a abundância de A. alphus (r2=0,229; p=0,032), C. redactus (r2=0,243; p=0,026), Z. principalis (r2=0,364; p=0,004) e Baetodes sp. (r2=0,276; p=0,017), sendo mais abundantes em locais com maior nível de conservação (Fig. 4).
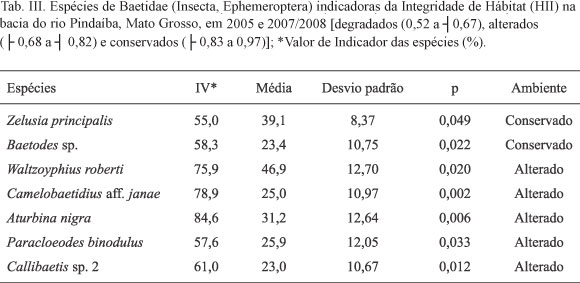
Ao avaliar o potencial de indicação das espécies, de acordo com os critérios de fidelidade e especificidade estabelecidos pela análise de INDVALL, Z. principalis e Baetodes sp. indicaram preferência por locais conservados; por outro lado, W. roberti, Camelobaetidius aff. jane, Aturbina nigra, Paracloeodes binodulus Lugo-Ortiz & McCafferty, 1996 e Callibaetis sp. 2 podem ser usadas para indicar ambientes que sofreram alterações em sua integridade (Tab. III). Nenhuma espécie apresentou especificidade e fidelidade ambiental suficiente para serem usadas como indicadoras de ambientes degradados.
DISCUSSÃO
O número de espécies de Baetidae na bacia do rio Pindaíba (n=20), pode ser considerado elevado se comparado com outros estudos no Brasil, fato que pode estar associado à diversidade deste grupo, ainda pouco conhecida na região Centro-Oeste. SALLES et al. (2003) reportou dez gêneros e 13 espécies em córregos de baixa ordem no Estado de São Paulo e BUSS & SALLES (2007) registraram nove espécies de Baetidae para o Estado do Rio de Janeiro. As várias morfoespécies identificadas, tais como Aturbina sp. nov., Baetodes sp., Callibaetis sp., Callibaetis sp. 1, Callibaetis sp. 2, Camelobaetidius sp. e Paracloeodes sp. reforça a necessidade de intensificar estudos com focos taxonômicos e ecológicos, visando conhecer e descrever as espécies da região, bem como verificar suas exigências ecológicas. Waltzoyphius roberti e C. redactus foram registradas pela primeira vez para o Brasil.
A riqueza foi alta em ambientes alterados, refutando nossa hipótese de que ambientes mais íntegros apresentariam maior número de espécies. Em outras pesquisas abordando comunidades de macroinvertebrados, vários autores têm verificado uma relação entre a riqueza de espécies com locais íntegros. Para RIOS & BAILEY (2006) há uma forte relação entre a vegetação ciliar, uso do solo e estrutura de macroinvertebrados. Desta forma, riqueza e diversidade de táxons - principalmente de EPT (Ephemeroptera, Plecoptera e Trichoptera) - aumentam com maior quantidade de cobertura vegetal da zona ripária. COUCEIRO et al. (2007) observaram redução na riqueza de insetos aquáticos com a retirada da vegetação ciliar resultante do desmatamento, sendo este um dos principais fatores que afetam a composição das comunidades.
O fato da maior riqueza de Baetidae ter ocorrido em trechos alterados pode ser explicado com base na hipótese do distúrbio intermediário de origem antrópica, que estes locais vêm sofrendo pela retirada parcial da vegetação ciliar para implantação de áreas de pastagens. SIEGLOCH et al. (2008) também relataram a influência do distúrbio intermediário sobre a riqueza de ninfas de efemerópteros no Sudeste do Brasil. Para CONNELL (1978), a composição das espécies de uma comunidade raramente está em um estado de equilíbrio, sendo alta a riqueza quando os distúrbios são intermediários em escala de frequência e intensidade. Isso ocorre por haver coexistência de diferentes grupos de macroinvertebrados, levando a uma colonização favorável destes organismos, que por sua vez, aumentam, assim, a riqueza de espécies do local. Outro aspecto a ser considerado é a existência de uma maior variedade de guildas alimentares em Baetidae. As comunidades estudadas apresentam alguns representantes da guilda dos raspadores (e.g. Baetodes sp., Camelobaetidius sp. e C. aff. janae), que encontram mais alimento, especialmente o perifíton, em locais que tem maior abertura de dossel, como ocorre em ambientes alterados pela retirada de vegetação ciliar (SVITOK, 2006).
Os locais conservados apresentaram baixa riqueza. De acordo com CONNELL (1978), locais sem distúrbio tendem a apresentar maior exclusão competitiva de espécies, uma vez que poderá haver predominância daquelas mais hábeis na colonização. Segundo RESH et al. (1988), quando há ausência de distúrbio em uma comunidade, o resultado é a competição, onde competidores superiores eliminaram os inferiores, reduzindo a riqueza de espécies do sistema e dando espaço a dominância de algumas espécies. Assim, faz-se necessário a compreensão de outros aspectos ecológicos do sistema, tais como a preferência das espécies a determinados tipos de substratos.
Os córregos classificados como degradados apresentaram baixa riqueza de Baetidae, devido à maior intensidade das pressões antrópicas (retilinização e atividades agropastoris) sobre os locais. Segundo TOWNSEND et al. (1997), locais que apresentam maior intensidade de distúrbio mostram baixa riqueza porque poucas espécies são hábeis para colonizar ambientes que apresentam homogeneização do sistema devido à perda de microhábitat.
A abundância de Baetidae foi alta em ambientes conservados e alterados, refutando parcialmente a hipótese de que o grupo apresentaria maior abundância em locais com níveis elevados de integridade, corroborando com BUSS et al. (2002) que observaram alta abundância do grupo em locais com níveis intermediários de impacto. Segundo MERRIT & CUMMINS (1996), essa família é formada basicamente por organismos coletores (representados aqui por Z. principalis, W. roberti, A. georgei, Paracloeodes sp., dentre os mais abundantes) e raspadores (e.g., C. aff. janae). BAPTISTA et al. (2006) indicaram que espécies de Americabaetis, Baetodes, Cloeodes e Camelobaetidius podem ser pastadoras ("grazers"), manipuladoras de detritos vegetais e raspadoras de substratos rochosos. GALDEAN et al. (2000) anotaram espécies raspadoras em locais com maior entrada de luz e, consequentemente, aumento da produtividade primária no sistema, fato que pode explicar a alta abundância de baetídeos em ambientes com algum grau de impacto.
BAUERNFEIND & MOOG (2000) e CHAKONA et al. (2008) relataram que a distribuição e abundância da comunidade de efemerópteros é fortemente dependente da composição do habitat, estrutura de micro e mesohabitats. Ambientes alterados podem apresentar menor disponibilidade de habitats, com menos entrada de material alóctone no sistema e predomínio de matéria orgânica particulada fina, favorecendo a prevalência de organismos coletores. Para DELONG & BRUSVEN (1998), os impactos na bacia de drenagem, como erosão e remoção da vegetação ripária, resultam no aumento da sedimentação, entrada de luz e diminuição de matéria orgânica, levando a uma diminuição de macroinvertebrados que tem sua distribuição fortemente associada a tipos específicos de microhabitats.
WANTZEN & PINTO-SILVA (2006) relataram que os desmatamentos, construção de estradas e agricultura não-sustentável são as principais causas de erosões em riachos no Mato Grosso. Aliados a isso, apontaram que locais assoreados tendem a ter menor abundância de macroinvertebrados, possivelmente devido à baixa colonização e falta de substratos. A baixa abundância de baetídeos em locais categorizados como degradados pode estar diretamente associada a estes aspectos. Segundo BRITTAIN (1982), outros fatores devem ser considerados, tais como inundações, alimentação e competição e que também podem influenciar a abundância e distribuição.
Os agrupamentos dos locais de coleta demonstram diferenças na composição de Baetidae entre ambientes degradados com os conservados/alterados. Locais degradados apresentaram maior similaridade de fauna, corroborando nossa hipótese. Esse resultado já era esperado, uma vez que a uniformidade ambiental dos locais degradados afeta significantemente a diversidade e abundância de efemerópteros (BAUERNFEIND & MOOG, 2000). Em diversas pesquisas com macroinvertebrados, as análises de agrupamentos têm mostrado a separação dos indivíduos quanto à preferência a um determinado tipo ambiental. BUSS & SALLES (2007) e BARBOSA et al. (2001) relataram que baetídeos foram predominantes em locais sob níveis intermediários de impacto, onde as populações são capazes de se adaptar às novas condições, refletindo na resiliência do ecossistema. Assim, pode-se verificar que Baetidae vem sendo citado como um grupo que apresenta preferência por trechos de integridade intermediária, o que corrobora em parte com os dados ecológicos para esta família até então registrados.
Algumas espécies apresentaram relação com o aumento da integridade. Entre as onze espécies analisadas, A. alphus, Baetodes sp., C. redactus e Z. principalis revalaram relação positiva da abundância com os valores de HII. Entretanto, A. alphus e C. redactus não demonstraram fidelidade aos ambientes conservados.
Segundo SIEGLOCH et al. (2008), Americabaetis tem ampla distribuição, ocorrendo em vários tipos de habitats, incluindo locais com algum grau de impacto. BUSS & SALLES (2007) descreveram que A. alphus é tolerante à variação das condições ambientais, vivendo em áreas com baixo fluxo de água, frequentemente associada a folhiços de origem alóctone. Para GOULART & CALLISTO (2005), Cloeodes foi registrado associado com o biofilme de algas (perifíton) ou substratos rochosos, enquanto que DOMÍNGUEZ et al. (2006) observaram que ninfas habitam ampla diversidade de habitats, encontradas tanto em riachos bem oxigenados quanto em locais pobremente oxigenados. Os aspectos ecológicos citados demonstram que estes gêneros em questão podem estar em ambientes conservados, mas não demonstram preferência por este tipo de categoria ambiental.
Já a especificidade e fidelidade de Z. principalis para ambientes conservados (INDVAL) corrobora com BUSS & SALLES (2007), que a classificaram como muito sensível a alterações ambientais e LUGO-ORTIZ et al. (2002) que a consideraram intolerante a tais modificações. Esta espécie foi cerca de três a quatro vezes mais abundante que A. alphus e A. georgei, respectivamente; a distribuição foi mais restrita, devido sua ausência no CRCV, reforçando sua preferência ecológica. Baetodes sp., ao apresentar-se como indicadora ecológica de ambientes com elevada integridade, diverge do conjunto do gênero, que foi classificado como pouco sensível por BUSS & SALLES (2007), mesmo que DOMÍNGUEZ et al. (2006) tenham registrado espécies em locais bem oxigenados e associados ao substrato rochoso.
Waltzoyphius roberti, C. aff. janae, Aturbina nigra, P. binodulus, Callibaetis sp. 2, não responderam significantemente em relação ao aumento dos valores do HII, sendo mais abundantes em locais alterados e indicadoras de ambientes com algum grau de alteração na integridade (INDVAL). Estas espécies demonstraram preferência a ambientes que possam apresentar perda de microhabitat, menor sombreamento, pedregosos, com maior entrada de luz no sistema e assoreamento, ocorridos principalmente pela devastação de mata ciliar. Ambientes com estas características são habitados por organismos generalistas ou que se privilegiam por terem estratégias alimentares diferentes daqueles organismos encontrados em ambientes conservados (DOMÍNGUEZ et al., 2006; BAPTISTA et al. 2006).
A hipótese de que baetídeos podem ser usados como organismos bioindicadores de alterações ambientais não foi corroborada; no entanto, os resultados apresentam espécies sensíveis (Baetodes sp. e Z. principalis) e outras cinco que se beneficiam com pequenas alterações ambientais (W. roberti; C. aff. janae, Aturbina nigra, P. binodulus e Calibaetis sp. 2), indicadoras do início de alterações antrópicas no sistemas aquáticos da região. Assim, os resultados revelam que a comunidade de Baetidae apresenta ampla resposta em meio a diferentes níveis de integridade ambiental.
Agradecimentos. À Fundação de Amparo a Pesquisa de Mato Grosso (FAPEMAT, Processo n°098/04), pelo apoio financeiro para execução do projeto. A Universidade do Estado de Mato Grosso (UNEMAT), Departamento de Ciências Biológicas e aos membros do Laboratório de Entomologia pelo suporte logístico e de parcerias no trabalho. Ao Dr. Frederico Falcão Salles (UFES) e Yulie Shimano Feitosa (UNEMAT), pela orientação taxonômica e revisão da identificação das espécies. L. Juen é bolsista da Capes.
Recebido em 11 de julho de 2010.
Aceito em 15 de setembro de 2011.
- BAPTISTA, D. F.; BUSS, D. F.; DIAS, L. G.; NESSIMIAN, J. L.; DA SILVA, E. R.; DE MORAIS NETO, A. H. A.; DE CARVALHO, S. N.; DE OLIVEIRA, M. A. & ANDRADE, L. R. 2006. Functional feeding groups of Brazilian Ephemeroptera nymphs: ultrastructure mouthparts. Annales de Limnologie - Internacional Journal of Limnology 42(2):87-96.
- BARBER-JAMES, H. M.; GATTOLLIAT, J-L.; SARTORI, M. & HUBBARD, M. D. 2008. Global diversity of mayflies (Ephemeroptera, Insecta) in freshwater. Hydrobiologia 595:339-350.
- BARBOSA, F. A. R.; CALLISTO, M. & GALDEAN, N. 2001. Diversity macroinvertebrates as an indicator of water quality and ecosystem health: a case study for Brazil. Aquatic Ecosystem Health and Management Society 4:51-59.
- BAUERNFEIND, E. & MOOG, O. 2000. Mayflies (Insecta: Ephemeroptera) and the assessment of ecological integrity: a methodological approach. Hydrobiologia 422:71-83.
- BISPO, P. DA C. & CRISCI-BISPO, V. L. 2006. Ephemeroptera. In: COSTA, C.; IDE S. & SIMONKA, E. org. Insetos imaturos: metamorfose e identificação Ribeirão Preto, Holos. p. 55-59.
- BRASIL. 1981. Projeto RADAMBRASIL, Folha SD 22 Goiás: geologia, geomorfologia, pedologia, vegetação, uso potencial da terra. Ministério das Minas e Energia/ Divisão de Publicação. 636p.
- BRITTAIN, J. E. 1982. Biology of mayflies. Annual Review of Entomology 27:119-147.
- BUSS, D. F. & SALLES, F. F. 2007. Using Baetidae species as biological indicators of environmental degradation in a Brazilian River Basin. Environmental Monitoring Assessment 130:365-372.
- BUSS, D. F.; BAPTISTA, D. F.; NESSIMIAN, J. L. & EGLER, M. 2004. Substrate specificity, environmental degradation and disturbance structuring macroinvertebrate assemblages in neotropical streams. Hydrobiologia 518:179-188.
- BUSS, D. F.; BAPTISTA, D. F.; SILVEIRA, M. P.; NESSIMIAN, J. L. & DORVILLÉ, L. F. M. 2002. Influence of water chemistry and environmental degradation on macroinvertebrate assemblages in a river basin in south-east Brazil. Hydrobiologia 481:125-136.
- CABETTE, H. S. R.; GIEHL, N. F. S.; DIAS-SILVA, K; JUEN, L. & BATISTA, J. B. 2010. Distribuição de Nepomorpha e Gerromorpha (Insecta: Heteroptera) da Bacia Hidrográfica do Rio Suiá-Miçu, MT: riqueza relacionada à qualidade da água e do hábitat. In: SANTOS, J. E.; GALBIATI, C. & MOSCHINI, L. E. orgs. Gestão e educação ambiental: água, biodiversidade e cultura São Carlos, RiMa. v. 2, p.113-137.
- CALLISTO, M.; MORETTI, M. & GOULART, M. 2001. Macroinvertebrados bentônicos como ferramenta para avaliar a saúde de riachos. Revista Brasileira de Recursos Hídricos 6(1):71-82.
- CONNELL, J. H. 1978. Diversity in tropical rain forest and coral reefs. Science California 199(4335):1302-1310.
- CORTEZZI, S. S.; BISPO, P. DA C.; PACIÊNCIA, G. DE P. & LEITE, R. C. 2009. Influência da ação antrópica sobre a fauna de macroinvertebrados aquáticos em riachos de uma região do cerrado do sudoeste do Estado de São Paulo. Iheringia, Série Zoologia, 99(1):36-43.
- CHAKONA, A.; PHIRI, C.; MAGAGADZA, C. H. D. & BRENDONCK, L. 2008. The influence of habitat structure and flow permanence on macroinvertebrate assemblages in temporary rivers in northwestern Ziwbabwe. Hydrobiologia 607:199-209.
- COUCEIRO, S. R. M.; HAMADA, N.; LUZ, S. L. B.; FORSBERG, B. R. & PIMENTEL, T. P. 2007. Deforestation and sewage effects on aquatic macroinvertebrates in urban stream in Manaus, Amazonas, Brazil. Hydrobiologia 575:271-284.
- CRISCI-BISPO, V. L.; BISPO, P. C. & FROEHLICH, C. G. 2007. Ephemeroptera, Plecoptera e Trichoptera assemblages in two Atlantic rainforest streams, Southeastern Brazil. Revista Brasileira de Zoologia 24(2):312-318.
- DELANEY, C.; REED, D. & CLARKE, M. 2000. Describing patient problems & nursing treatment patterns using nursing Minimum data sets (NMDS & NMMDS) & UHDDS repositories. Procedings of the American Medical Informatics Association Symposium p.176-179.
- DELONG, M. D. & BRUSVEN, M. A. 1998. Macroinvertebrate community structure along the longitudinal gradient of an agriculturally impacted stream. Environmental Management 22(3):445-457.
- DE MARCO JR., P. 1998. The Amazonian Campina dragonfly assemblage: patterns in microhabitat use and behavior in a foraging habitat. Odonatologica 27:239-248.
- DINAKARAN, S. & ANBALAGAN, S. 2007. Anthropogenic impacts on aquatic insects in six streams of South Western Ghats. Journal of Insect Science 7(37):1-9.
- DODDS, W. K. 2002. Freshwater ecology: concepts and environmental applications San Diego, London, Academic Press. 569p.
- DOMÍNGUEZ, E.; MOLINERI, C.; PESCADOR, M. L.; HUBBARD, M. D. & NIETO, C. 2006. Ephemeroptera of South America. In: ADIS, J.; ARIAS, J. R.; RUEDA-DELGADO, G. & WANTZEN, K. M. eds. Aquatic Biodiversity in Latin America (ABLA). Sofia-Moscow, Pensoft. v. 2, 644p.
- DUFRÈNE, M. & LEGENDRE, P. 1997. Species assemblages and indicator species: the need for a flexible asymmetrical approach. Ecological Monographs 67:345-366.
- FERREIRA-PERUQUETTI, P. & DE MARCO JR., P. 2002. Efeito da alteração ambiental sobre comunidades de Odonata em riachos de Mata Atlântica de Minas Gerais, Brasil. Revista Brasileira de Zoologia 19(2):317-327.
- FERREIRA-PERUQUETTI, P. S. & FONSECA-GESSNER, A. A. 2003. Comunidade de Odonata (Insecta) em áreas naturais de Cerrado e monocultura no nordeste do Estado de São Paulo, Brasil: relação entre o uso do solo e a riqueza faunística. Revista Brasileira de Zoologia 20(2):219-224.
- FRANCISCHETTI, C. N.; SALLES, F. F.; LUGO-ORTIZ, C. R. & DA-SILVA, E. R. 2003. First report of Americabaetis Kluge (Ephemeroptera: Baetidae) from Rio de Janeiro, Brazil. Entomotropica 18(1):69-71.
- FRANCISCHETTI, C. N.; DA SILVA, E. R.; SALLES, F. F. & NESSIMIAN, J. L. 2004. A efemeropterofauna (Insecta: Ephemeroptera) do trecho ritral inferior do Rio Campo Belo, Itatiaia, RJ: composição e mesodistribuição. Lundiana 5(1):33-39.
- GALDEAN, N.; CALLISTO, M. & BARBOSA, F. A. R. 2000. Lotic ecosystems of Serra do Cipó, southeast Brazil: water quality and a tentative classification based on the benthic macroinvertebrate community. Aquatic Ecosystem Health & Management 3(4):545-552.
- GOULART, M. & CALLISTO, M. 2005. Mayfly diversity in the Brazilian tropical headwaters of Serra do Cipó. Brazilian Archives of Biology and Technology 48(6):983-996.
- GILLIES, M. T. 2001. A new species of Aturbina (Ephemeroptera: Baetidae) Lugo-Ortiz and McCafferty from Uruguay. In: DOMÍNGUEZ, E. ed. Trends in Research in Ephemeroptera & Plecoptera New York, Kluwer Academic, Plenum Publishers. p. 331-335.
- KOTHE, P. 1962. Der Artenfehlbetrag, ein einfaches Güterkriterium und seine Anwenung bei biologischen Vorflutersuntersuchungen. Deutsche Gewässerkundliche Mitteilungen 6:60-65.
- LUGO-ORTIZ, C. R. & MCCAFFERTY, W. P. 1996a. Taxonomy of the Neotropical Genus Americabaetis, new status (Insecta: Ephemeroptera: Baetidae). Studies on Neotropical Fauna and Environment 31:156-169.
- _____. 1996b. The genus Paracloeodes (Insecta: Ephemeroptera: Baetidae) and its presence in South America. Annales Limnologie 32(3):161-169.
- _____. 1999. Global biodiversity of the family Baetidae (Ephemeroptera): a generic perspective. Trends in Entomology 2(1):45-54.
- LUGO-ORTIZ, C. R.; SALLES, F. F. & FURIERI, K. S. 2002. First record of small minnow mayflies (Ephemeroptera: Baetidae) from the state of Espírito Santo southeastern Brazil. Lundiana 3(1):79-80.
- MELO, A. S. & HEPP, L. U. 2008. Ferramentas estatísticas para análises de dados provenientes de biomonitoramento. Oecologia Brasiliensis 12(3):463-486.
- MERRIT, R. W. & CUMMIS, K. W. 1996. An introduction to the aquatic insects of North America 3 ed. Dubuque, Kendall/Hunt Publishing Company. 862p.
- NESSIMIAN, J. L.; VENTICINQUE, E. M.; ZUANON, J.; DE-MARCO-JR., P.; GORDO, M.; FIDELIS, L.; BATISTA, J. D. & JUEN, L. 2008. Land use, habitat integrity and aquatic insect assemblages in Central Amazonian streams. Hydrobiologia 614(1):117-131.
- NIETO, C. & SALLES, F. F. 2006. Revision of the Genus Paracloeodes (Ephemeroptera: Baetidae) in South America. Zootaxa 1303:1-33.
- R DEVELOPMENT CORE TEAM. 2009. R: a language and environment for statistical computing R Foundation for Statistical Computing, Vienna, Austria. Disponível em: <http://www.rproject.org>. Acesso em: 23.06.2009.
- RESH, V. H.; BROWN, A.; COVICH, A. P.; GURTZ, M. E.; LI, H. W.; MINSHALL, G. W.; REICE, S. R.; SHELDON, A. L.; WALLACE, J. B. & WISMAR, R. C. 1988. The role of the disturbance in stream ecology. Journal of the North American Benthological Society 7(4):433-455.
- RIOS, S. L. & BAILEY, R. C. 2006. Relationship between riparian vegetation and stream benthic communities at three spatial scales. Hydrobiologia 553:153-160.
- ROMERO, R. & FERNÁNDEZ, H. R. 2001. Abundance and diversity of a mayfly taxocenose in a South America Subtropical mountain stream. In: DOMÍNGUEZ, E. ed. Trends in Research in Ephemeroptera & Plecoptera New York, Kluwer Academic, Plenum Publishers. p.173-178.
- ROSEMBERG, D. M. & RESH, V. H. 1993. Introduction to freshwater biomonitoring and benthic macroinvertebrates. In: ROSEMBERG, D. M. & RESH, V. H. eds. Freshwater biomonitoring and benthic macroinvertebrates New York, Chapmam and Hall. p.1-9.
- SALLES, F. F. 2007. The presence of Chane Nieto and Guajirolus Flowers (Ephemeroptera: Baetidae) in Brazil with the description of a new species. Revista Brasileira de Entomologia 51(4):404-409.
- SALLES, F. F. 2011. Lista de espécies de Ephemeroptera (Insecta) registradas para o Brasil. Disponível em: <http://sites.google.com/site/listaephemeropteradobrasil/home>. Acesso em 09.05.2011.
- SALLES, F. F. & FRANCISCHETTI, C. N. 2004. Cryptonympha dasilvai sp. nov. (Ephemeroptera: Baetidae ) do Brasil. Neotropical Entomology 33(2):213-216.
- SALLES, F. F. & LUGO-ORTIZ, C. R. 2003. Nova espécie de Cloeodes Traver (Ephemeroptera: Baetidae) do Estado do Rio de Janeiro. Neotropical Entomology 32(3):449-452.
- SALLES, F. F. & POLEGATTO, C. M. 2008. Two new species of Baetodes Needham & Murphy (Ephemeroptera: Baetidae) from Brazil. Zootaxa 1851:43-50.
- SALLES, F. F. & SERRÃO, J. E. 2005. The nymphs of the genus Camelobaetidius Demoulin (Ephemeroptera: Baetidae) in Brazil: new species, new records, and key of the identification of the species. Annales de Limnologie - Internacional Journal of Limnology 41(4):267-279.
- SALLES, F. F.; ANDRADE, M. B. & DA-SILVA, E. R. 2005. Camelobaetidius francischetti: a new species of Baetidae (Ephemeroptera) from Brazil. Zootaxa 1027:47-53.
- SALLES, F. F.; BATISTA, J. D. & CABETTE, H. R. S. 2004a. Baetidae (Insecta: Ephemeroptera) de Nova Xavantina, Mato Grosso, Brasil: novos registros e descrição de uma nova espécie de Cloeodes Traver. Biota Neotropica 4(2):1-8.
- SALLES, F. F.; DA-SILVA, E. R.; HUBBARD, M. D.; SERRÃO, J. E. 2004b. As espécies de Ephemeroptera (Insecta) registradas para o Brasil. Biota Neotropica 4(2):1-34.
- SALLES, F. F.; DA-SILVA, E. R.; SERRÃO, J. E. & FRANCISCHETTI, C. N. 2004c. Baetidae (Ephemeroptera) na região Sudoeste do Brasil: novos registros e chaves para os gêneros no estágio ninfal. Neotropical Entomology 33(5):725-735.
- SALLES, F. F.; FRANCISCHETTI, C. N.; ROQUE, F. DE O.; PEPINELLI, M. & TRIVINHO-STRIXINO, S. 2003. Levantamento preliminar dos gêneros e espécies de Baetidae (Insecta: Ephemeroptera) do Estado de São Paulo, com ênfase em coletas realizadas em córregos florestados de baixa ordem. Biota Neotropica 3(2):1-7.
- SCOTT, D. W. 1979. On optimal and data based histograms. Biometrika 66(3):605-610.
- SIEGLOCH, A. E.; FROEHLICH, C. G. & KOTZIAN, C. B. 2008. Composition and diversity of Ephemeroptera (Insecta) nymph communities in the middle section of the Jacuí River and some tributaries, southern Brazil. Iheringia, Série Zoologia 98(4):425-432.
- STRAHLER, H. N. 1957. Quantitative analysis of watershed geomorphology. American Geophysical Union Transactions 33(1):913-920.
- SVITOK, M. 2006. Structure and spatial variability of mayfly (Ephemeroptera) communities in the upper Hron River basin. Biologia Bratislava 61(5):547-554.
- TOWNSEND, C. R.; SCARSBROOK, M. R. & DOLÉDEC, S. 1997. The intermediate disturbance hyphotesis, refugia, and biodiversity in streams. Limnology and Oceanography 42(5):928-949.
- WALTZ, R. D. & MCCAFFERTY, W. P. 1987. Revision of the genus Cloeodes Traver (Ephemeroptera: Baetidae). Annals of the Entomological Society of America 80(2):191-207.
- WANTZEN, K. M. & PINTO-SILVA, V. 2006. Uso de substratos artificiais para a avaliação do impacto do assoreamento sobre macroinvertebrados bentônicos em um córrego de cabeceira no Pantanal do Mato Grosso, Brasil. Revista Brasileira de Recursos Hídricos 11(1):99-107.
- ZAR, J. H. 1999. Biostatistical analysis New York, Prentice-Hall, Englewood Cliffs. 663p.1
Datas de Publicação
-
Publicação nesta coleção
13 Dez 2011 -
Data do Fascículo
Set 2011
Histórico
-
Recebido
11 Jul 2010 -
Aceito
15 Set 2011