RESUMO
É apresentada uma lista de espécies do estado de Mato Grosso do Sul. Existem 65 espécies registradas, representado 17% de todas as espécies de Muscidae conhecidas no Brasil.
PALAVRAS-CHAVE
Biodiversidade; mosca doméstica; mosca de estábulo; muscídeos; Programa Biota-MS
ABSTRACT
A checklist of Muscidae species in the state of Mato Grosso do Sul, Brazil is provided. There are 65 species recorded, which represent 17% of all Brazilian species of Muscidae known.
KEYWORDS
Biodiversity; house fly; muscid; stable fly; Biota-MS Program
Muscidae é uma família de espécies bem comuns no Brasil. São moscas de tamanho pequeno a médio, com o comprimento do corpo variando de 2 a 8 mm, de coloração geralmente escura, mas com algumas espécies amarelas, azuis ou verde-metálicas. São facilmente reconhecidos pelas calípteras desenvolvidas e ausência de cerdas desenvolvidas no mero. A cerda dorsal pré-apical na tíbia posterior está ausente e a veia A1+CuA2 é incompleta, estendendo-se até a metade da distância da base ao bordo da asa ( Carvalho, 2002Carvalho, C. J. B. de, ed. 2002. Muscidae (Diptera) of the Neotropical Region: Taxonomy. Curitiba, Editora Universidade Federal do Paraná. 289p. ). Esses caracteres separam Muscidae das famílias mais próximas, como Anthomyiidae e Fanniidae ( Carvalho & Melo-Patiu, 2008Carvalho, C. J. B. de & Mello-Patiu, C. A. 2008. Key to the adults of the most common forensic species of Diptera in South America. Revista Brasileira de Entomologia52(3):390-406. ).
Os muscídeos são conhecidos normalmente como mosca doméstica, mosca de estábulos ou mosca do chifre, pela presença de Musca domestica Linnaeus, Stomoxys calcitrans (Linnaeus) e Haematobia irritans (Linnaeus), respectivamente, espécies sinantrópicas, ocorrendo junto ao homem e seus animais. A biologia da maioria das espécies da família, entretanto, é pouco conhecida. Os adultos normalmente frequentam matéria orgânica em decomposição, como lixo, fezes e outros dejetos orgânicos, utilizando esses substratos para alimentação, oviposição, larviposição ou local para encontro com o sexo oposto. Normalmente as larvas são de hábitos terrestres, mas algumas são consideradas aquáticas ou subaquáticas, encontradas em locais úmidos, poças d’água, lagos e córregos, predando outros organismos que vivem nesses ambientes ( Skidmore, 1985Skidmore, P. 1985. The biology of the Muscidae of the world. Series Entomologica 29:1-550. ; Ferrar, 1987Ferrar, P. 1987. Family Muscidae. In: Lyneborg, L. ed. Guide to the breeding habits and immature stages of Diptera Cyclorrapha. Copenhague, E. J. Brill/Scandinavian Science Press. (Entomograph vol. 8), p. 228-249.).
MATERIAL E MÉTODOS
Para a preparação da lista de espécies foram consultados publicações com registros de espécies de Muscidae para o estado de Mato Grosso do Sul: Boff et al. (2008Boff, S.; Graciolli, G.; Boaretto, A. G. & Marques, M. R. 2008. Insetos visitantes de gomas exsudadas por Terminalia argentea Mart & Zurcc (Combretaceae). Revista Brasileira de Entomologia 52(3):477-479. ); Campos & Barros (1995Campos, C. F. M. & Barros, A. T. M. 1995. Dípteros muscóides da área urbana de Corumbá, Mato Grosso do Sul, Brasil. Revista Brasileira de Biologia 55:351-354. ); Carvalho et al. (2002aCarvalho, C. J. B. de; Moura, M. O. & Ribeiro, P. B. 2002a. Chave para adultos de dípteros (Muscidae, Fanniidae, Anthomyiidae) associados ao ambiente humano no Brasil. Revista Brasileira de Entomologia46(2):107-114. , 2005Carvalho, C. J. B. de; Couri, M. S.; Pont, A. C.; Pamplona, D. M. & Lopes, S. M. 2005. A Catalogue of the Muscidae (Diptera) of the Neotropical Region. Zootaxa 860:1-282. ) e Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ). Foi também consultada a Coleção Entomológica Pe. Jesus Santiago Moure, da Universidade Federal do Paraná (DZUP) ( Carvalho et al., 2002bCarvalho, C. J. B. de; Couri, M. S. Toma, R.; Rafael, J. A.; Harada, A. Y.; Bonatto, S. R.; Loureiro A. L. & Gastal, H. A. de O. 2002b. Principais coleções brasileiras de Diptera: Histórico e Situação atual, p. 37-52. In: Costa, C.; Vanin, S. A.; Lobo, J. M. & Melic, A. Proyecto de Red Iberoamericano de Biogeografia Y Entomologia Sistemática PRIBES 2002. Zaragoza, Sociedad (SEA) & Cited. 329p. (m3m-Monografias, Tercer Milenio, vol. 2.).) na procura de exemplares coletados no estado. Foi incluída, quando disponíveis, a latitude e longitude (em decimais) para a maioria das localidades.
RESULTADOS E DISCUSSÃO
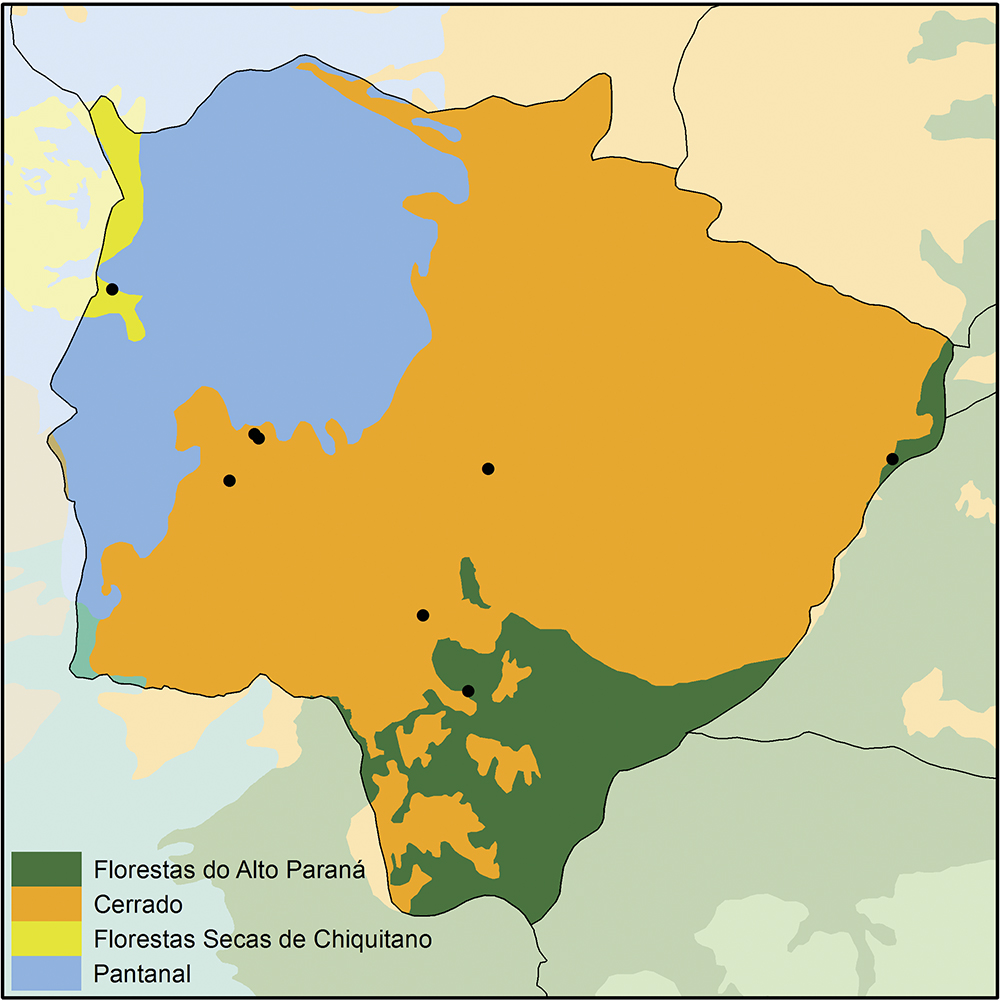
Foram encontradas 65 espécies de Muscidae que ocorrem em oito localidades do Mato Grosso do Sul: Bodoquena, Campo Grande, Corumbá, Dourados, Maracaju, Miranda, Salobra, Selvíria ( Fig. 1). São elas:
Localidades de coleta de espécies de Muscidae (Bodoquena, Campo Grande, Corumbá, Dourados, Maracaju, Salobra) e ecorregiões (Olson et al., 2001) no estado de Mato Grosso do Sul, Brasil.
Atherigona orientalis Schiner, 1868. Localidades de coleta: Campo Grande, Corumbá. Ref.: Campos & Barros (1995Campos, C. F. M. & Barros, A. T. M. 1995. Dípteros muscóides da área urbana de Corumbá, Mato Grosso do Sul, Brasil. Revista Brasileira de Biologia 55:351-354. ), DZUP.
Biopyrellia bipuncta (Wiedemann, 1830). Localidades de coleta: Bodoquena, -20.5386, -56.7150; Dourados, -22.2167, -54.8000; Maracaju, -21.6144, -55.1683. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Brontaea debilis (Williston, 1896). Localidades de coleta: Miranda, Salobra.
Ref.: Carvalho et al. (2005Carvalho, C. J. B. de; Couri, M. S.; Pont, A. C.; Pamplona, D. M. & Lopes, S. M. 2005. A Catalogue of the Muscidae (Diptera) of the Neotropical Region. Zootaxa 860:1-282. ), DZUP.
Brontaea normata (Bigot, 1885). Localidade de coleta: Campo Grande. Ref.: Carvalho et al. (2005Carvalho, C. J. B. de; Couri, M. S.; Pont, A. C.; Pamplona, D. M. & Lopes, S. M. 2005. A Catalogue of the Muscidae (Diptera) of the Neotropical Region. Zootaxa 860:1-282. ), DZUP.
Cariocamyia maculosa Snyder, 1951. Localidade de coleta: Salobra, -20.2000, -56.4833. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Coenosia plumiseta Stein, 1911. Localidade de coleta: Maracaju, -21.6144, -55.1683. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Cyrtoneurina uber Giglio-Tos, 1893. Localidade de coleta: Salobra, -20.1667, -56.5167. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Cyrtoneuropsis brunnea (Hough, 1900). Localidades de coleta: Corumbá, -19.0092, -57.6533; Salobra, -20.1667, -56.5167. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Cyrtoneuropsis mimica (Snyder, 1954). Localidades de coleta: Dourados, -22.2211, -54.8056; Maracaju, -21.6144, -55.1683. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Cyrtoneuropsis pararescita (Couri, 1995). Localidade de coleta: Selvíria, -20.3672, -51.4189. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Cyrtoneuropsis polystigma (Wulp, 1896). Localidades de coleta: Dourados, -22.2211, -54.8056; Maracaju, -21.6144, -55.1683; Salobra, -20.1667, -56.5167.
Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Cyrtoneuropsis rescita (Walker, 1861). Localidade de coleta: Salobra, -20.2000, -56.4833. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Cyrtoneuropsis walkeri (Pont, 1972). Localidade de coleta: Salobra, -20.2000, -56.4833. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Dolichophaonia brasiliensis (Albuquerque, 1958). Localidade de coleta: Salobra, -20.2000, -56.4833. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Dolichophaonia paranaensis Carvalho, 1993. Localidade de coleta: Campo Grande, -20.4500, -54.0500. Ref.: Boff et al. (2008)Boff, S.; Graciolli, G.; Boaretto, A. G. & Marques, M. R. 2008. Insetos visitantes de gomas exsudadas por Terminalia argentea Mart & Zurcc (Combretaceae). Revista Brasileira de Entomologia 52(3):477-479. .
Graphomya amazonensis Couri & Marques, 2005. Localidade de coleta: Maracaju, -21.6144, -55.1683. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Graphomya analis (Macquart, 1851). Localidade de coleta: Maracaju, -21.6144, -55.1683. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Graphomya maculata (Scopoli, 1763). Localidade de coleta: Salobra, -20.2000, -56.4833. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Graphomya mexicana Giglio-Tos, 1893. Localidade de coleta: Salobra, -20.2000, -56.4833. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Haematobia irritans (Linnaeus, 1758). Localidade de coleta: Campo Grande.
Ref.: Carvalho et al. (2005Carvalho, C. J. B. de; Couri, M. S.; Pont, A. C.; Pamplona, D. M. & Lopes, S. M. 2005. A Catalogue of the Muscidae (Diptera) of the Neotropical Region. Zootaxa 860:1-282. ), DZUP.
Helina refiguttata (Macquart, 1851). Localidades de coleta: Maracaju, -21.6144, -55.1683; Salobra, -20.1667, -56.5167. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Helina rubripalpis (Wulp, 1896). Localidades de coleta: Dourados, -22.2211, -54.8056; Maracaju, -21.6144, -55.1683; Salobra, -21.2333, -57.1333. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Hemichlora scordalus (Walker, 1861). Localidade de coleta: Maracaju, -21.6144, -55.1683. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Limnophora piliseta Stein, 1919. Localidades de coleta: Salobra, -20.2000, -56.4833. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Limnophora saeva (Wiedemann, 1830). Localidade de coleta: Salobra, -20.2000, -56.4833. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Micropotamia cilitibia (Albuquerque, 1955). Localidade de coleta: Salobra, -20.2000, -56.4800. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Morellia dalcyi Pamplona, 1986. Localidade de coleta: Dourados, -22.2167, -54.8000. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Morellia lopesae Pamplona, 1986. Localidade de coleta: Dourados, -22.2167, -54.8000. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Morellia nigricosta Hough, 1900. Localidades de coleta: Dourados, -22.2167, -54.8000; Maracaju, -21.6144, -55.1683. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Morellia obscuripes (Bigot, 1887). Localidade de coleta: Maracaju, -21.6144, -55.1683. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Morellia violacea (Robineau-Desvoidy, 1830). Localidades de coleta: Bodoquena, -20.5386, -56.7150; Maracaju, -21.6144, -55.1683. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Morellia xanthoptera Pamplona, 1986. Localidade de coleta: Dourados, -22.2211, -54.8056. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Morellia ( Parapyrellia) maculipennis (Macquart, 1846). Localidade de coleta: Bodoquena, -20.5386, -56.7150. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Musca domestica Linnaeus, 1758. Localidade de coleta: Campo Grande, Corumbá. Ref.: Campos & Barros (1995Campos, C. F. M. & Barros, A. T. M. 1995. Dípteros muscóides da área urbana de Corumbá, Mato Grosso do Sul, Brasil. Revista Brasileira de Biologia 55:351-354. ), DZUP.
Neomuscina atincticosta Snyder, 1949. Localidade de coleta: Dourados, -22.2211, -54.8056. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Neomuscina currani Snyder, 1949. Localidade de coleta: Dourados, -22.2211, -54.8056. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Neomuscina dorsipuncta (Stein, 1918). Localidade de coleta: Dourados, -22.2211, -54.8056. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Neomuscina douradensis Lopes & Khouri, 1996. Localidade de coleta: Dourados, -22.2211, -54.8056. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Neomuscina instabilis Snyder, 1949. Localidade de coleta: Dourados, -22.2211, -54.8056. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Neomuscina neosimilis Snyder, 1949. Localidades de coleta: Dourados, -22.2211, -54.8056; Maracaju, -21.6144, -55.1683. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Neomuscina paramediana Lopes & Khouri, 1996. Localidade de coleta: Salobra, -21.2333, -57.1333. Ref.: Löwenberg-Neto & Carvalho (2012Carvalho, C. J. B. de, ed. 2002. Muscidae (Diptera) of the Neotropical Region: Taxonomy. Curitiba, Editora Universidade Federal do Paraná. 289p. ).
Neomuscina pictipennis (Bigot, 1878). Localidades de coleta: Dourados, -22.2211, -54.8056 (MNRJ); Maracaju, -21.6144, -55.1683. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Neomuscina schadei Snyder, 1949. Localidade de coleta: Maracaju, -21.6144, -55.1683. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Neomuscina similata Snyder, 1949. Localidades de coleta: Dourados, -22.2211, -54.8056 (MNRJ); Maracaju, -21.6144, -55.1683. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Phaonia grajauensis (Albuquerque, 1957). Localidade de coleta: Dourados, -22.2211, -54.8056. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Phaonia nigriventris (Albuquerque, 1954). Localidade de coleta: Dourados, -22.2211, -54.8056. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Philornis angustifrons (Loew, 1861). Localidade de coleta: Salobra, -21.2333, -57.1333. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Philornis deceptivus Dodge & Aitken, 1968. Localidade de coleta: Dourados, -22.2211, -54.8056. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Philornis falsificus Dodge & Aitken, 1968. Localidade de coleta: Salobra, -21.2333, -57.1333. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Philornis fumicosta Dodge, 1968. Localidade de coleta: Dourados, -22.2211, -54.8056. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Philornis mimicola Dodge, 1968. Localidade de coleta: Dourados, -22.2211, -54.8056. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Philornis obscurus (Wulp, 1896). Localidades de coleta: Dourados, -22.2211, -54.8056; Salobra, -21.2333, -57.1333. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Philornis pici (Macquart, 1854). Localidade de coleta: Salobra, -21.2333, -57.1333. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Philornis rufoscutellaris (Couri, 1983). Localidade de coleta: Dourados, -22.1500, -54.8700. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Philornis setinervis Dodge, 1963. Localidade de coleta: Dourados, -22.2211, -54.8056. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Philornis univittatus Dodge, 1968. Localidade de coleta: Salobra, -21.2333, -57.1333. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Polietina flavithorax (Stein, 1904). Localidade de coleta: Miranda, -20.1666, -56.5166. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Polietina major Albuquerque, 1956. Localidades de coleta: Miranda, -20.1666, -56.5166; Salobra, -21.2333, -57.1333. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Polietina minor (Albuquerque, 1956). Localidade de coleta: Maracaju, -21.6333, -55.1500. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Polietina orbitalis (Stein, 1904). Localidades de coleta: Campo Grande, -20.4428, -54.6464; Maracaju, -21.6333, -55.1500; Miranda, -20.1666, -56.5166.
Ref.: Boff et al. (2008)Boff, S.; Graciolli, G.; Boaretto, A. G. & Marques, M. R. 2008. Insetos visitantes de gomas exsudadas por Terminalia argentea Mart & Zurcc (Combretaceae). Revista Brasileira de Entomologia 52(3):477-479. ; Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Pseudoptilolepis nigripoda Snyder, 1949. Localidade de coleta: Maracaju, -21.6333, -55.1500. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Pseudoptilolepis nudapleura Snyder, 1949. Localidade de coleta: Maracaju, -21.6144, -55.1683. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Sarcopromusca pruna (Shannon & Del Ponte, 1926). Localidades de coleta: Campo Grande, -20.4500, -54.6166; Corumbá, -19.0166, -57.6500. Ref.: Löwenberg-Neto & Carvalho (2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
Stomoxys calcitrans (Linnaeus, 1758). Localidades de coleta: Campo Grande, Dourados. Ref.: Carvalho et al. (2005Carvalho, C. J. B. de; Couri, M. S.; Pont, A. C.; Pamplona, D. M. & Lopes, S. M. 2005. A Catalogue of the Muscidae (Diptera) of the Neotropical Region. Zootaxa 860:1-282. ), DZUP.
Synthesiomyia nudiseta (Wulp, 1883). Localidades de coleta: Corumbá.
Ref.: Campos & Barros (1995Campos, C. F. M. & Barros, A. T. M. 1995. Dípteros muscóides da área urbana de Corumbá, Mato Grosso do Sul, Brasil. Revista Brasileira de Biologia 55:351-354. ).
Comentários sobre a lista, riqueza de espécies no estado e comparação com outras regiões. No Brasil, os estados com maior número de espécies conhecidas são Rio de Janeiro (221 spp.), Paraná (155 spp.) e São Paulo (140 spp.). São estados que apresentam grupo de pesquisa consolidado de Muscidae, incentivo governamental para o conhecimento da biota e acervos reconhecidos internacionalmente. O atual número de espécies conhecidas no Mato Grosso do Sul (65 spp.) é semelhante ao de estados com baixo esforço amostral, como Mato Grosso (54 spp.), Santa Catarina (66 spp.) e Rio Grande do Sul (73 spp.) ( Löwenberg-Neto & Carvalho, 2013Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147. ).
As lacunas espaciais de amostragem das espécies de Muscidae no Mato Grosso do Sul são extensas. Sob o ponto de vista das ecorregiões ( Olson et al., 2001Olson, D. M.; Dinerstein, E.; Wikramanayake, E. D.; Burgess, N. D.; Powell, G. V. N.; Underwood, E. C.; d’Amico, J. A.; Itoua, I.; Strand, H. E.; Morrison, J. C.; Loucks, C. J.; Allnut, T. F.; Ricketts, T. H.; Kura, Y.; Lamoreaux, J. F.; Wettengel, W. W.; Hedão, P. & Kassem, K. R. 2001. Terrestrial ecoregions of the World: a new map of life on Earth. BioScience 11:933-938. ), o Cerrado é a mais amostrada e o Pantanal não apresenta registros de coleta ( Fig. 1). Apesar de poucas localidades de amostras, o estado apresenta registro de 17% das espécies brasileiras.
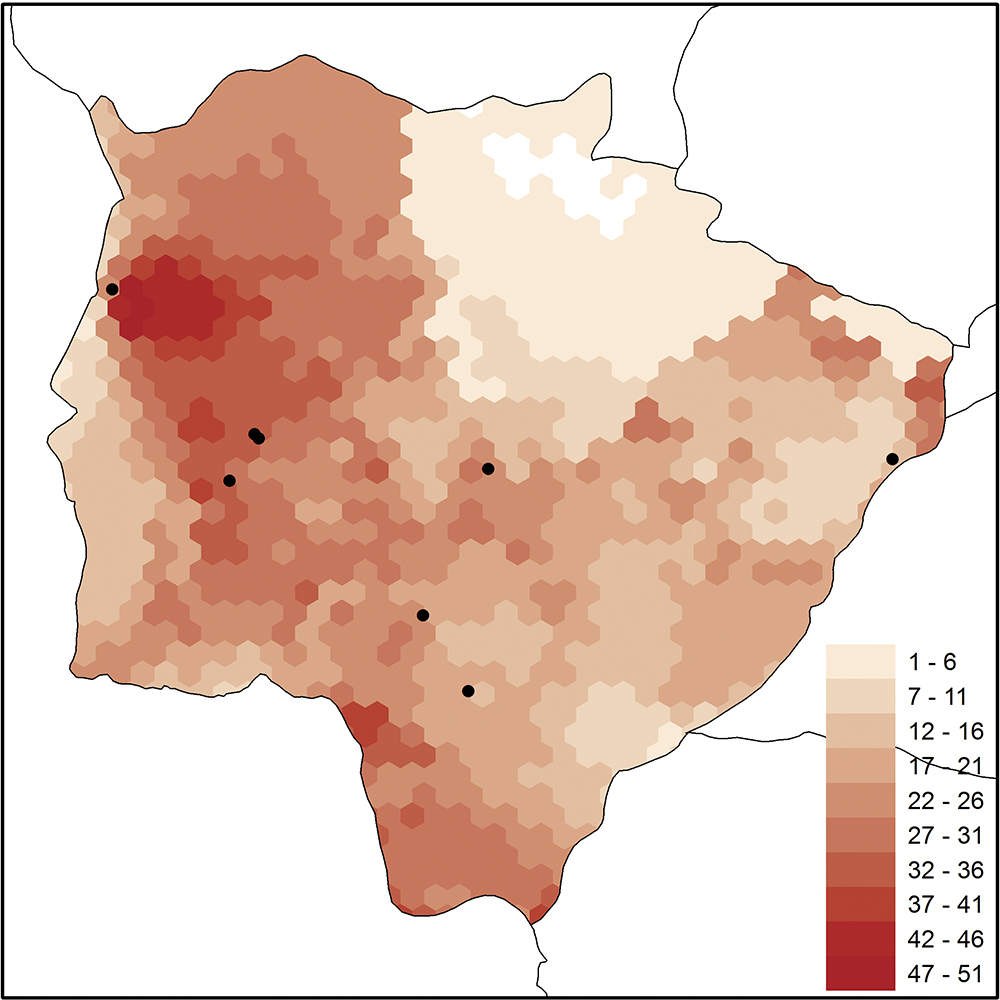
Um estudo de biogeografia de Muscidae estimou por modelagem de distribuição geográfica a riqueza de espécies na América do Sul e Central ( Löwenberg-Neto et al., 2011Löwenberg-Neto, P.; Carvalho, C. J. B. de& Hawkins, B. A. 2011. Tropical niche conservatism as a historical narrative hypothesis for the Neotropics: a case study using the fly family Muscidae. Journal of Biogeography 38:1936-1947.). O padrão de riqueza estimado para o Mato Grosso do Sul mostra elevado número de espécies na região Sudoeste, Oeste e Noroeste do estado ( Fig. 2). Estas são áreas que devem ser amostradas para ampliar a representação espacial no estado, com especial atenção ao Pantanal.
Riqueza de espécies de Muscidae estimada por modelagem de distribuição geográfica (Löwenberg-Neto et al., 2011) para o estado do Mato Grosso do Sul, Brasil.
Em relação ao perfil das espécies de Muscidae encontradas no estado do Mato Grosso do Sul, a maioria das espécies pertence à subfamília Dichaetomyiinae (30 spp.), seguida por Muscinae (16 spp.), Mydaeinae (7 spp.), Phaoniinae (6 spp.), Coenosiinae (3 spp.), Atherigoninae (1 sp.), Azeliinae (1 sp.) e Reinwardtiinae (1 sp.). Para os limites do estado, a métrica filogenética computada no estudo de riqueza de Muscidae varia de 6 a 12 ( Löwenberg-Neto et al., 2011Löwenberg-Neto, P.; Carvalho, C. J. B. de& Hawkins, B. A. 2011. Tropical niche conservatism as a historical narrative hypothesis for the Neotropics: a case study using the fly family Muscidae. Journal of Biogeography 38:1936-1947.). Este intervalo sugere que, com futuras amostras no estado, as subfamílias acima sejam amplamente reamostradas, exceto Coenosiinae, que apresentam valores superiores da métrica e tendem a ocupar regiões mais frias e altas.
Principais grupos de pesquisa e acervos. Duas instituições, Museu Nacional do Rio de Janeiro (MNRJ) e Departamento de Zoologia da Universidade Federal do Paraná (DZUP) possuem grupos de pesquisa consolidados trabalhando na taxonomia, filogenia e biogeografia de Muscidae. Esses grupos são coordenados, respectivamente, pela Profa. Márcia Souto Couri e Prof. Claudio J. B. de Carvalho. Três instituições no Brasil possuem as coleções mais representativas de Muscidae no Brasil (Carvalho et al., 2002b) (entre parênteses, o número de exemplares adultos): MNRJ (29.313), Museu de Zoologia da Universidade de São Paulo (MZSP) (26.382) e DZUP (25.770). Neste levantamento, mesmo que fosse reunido todos os exemplares de Muscidae de todas as coleções no país, o número não ultrapassaria os 100.000 exemplares coletados. Posteriormente ao levantamento realizado por Carvalho et al. (2002bCarvalho, C. J. B. de; Couri, M. S. Toma, R.; Rafael, J. A.; Harada, A. Y.; Bonatto, S. R.; Loureiro A. L. & Gastal, H. A. de O. 2002b. Principais coleções brasileiras de Diptera: Histórico e Situação atual, p. 37-52. In: Costa, C.; Vanin, S. A.; Lobo, J. M. & Melic, A. Proyecto de Red Iberoamericano de Biogeografia Y Entomologia Sistemática PRIBES 2002. Zaragoza, Sociedad (SEA) & Cited. 329p. (m3m-Monografias, Tercer Milenio, vol. 2.).), algumas instituições, como o INPA e MZSP, incrementaram fortemente suas coleções entomológicas, utilizando diversos tipos de armadilhas. Com isto, os Muscidae foram bem coletados. Entretanto, até o momento, não existe nenhuma coleção, mesmo regional, de Muscidae para o estado de Mato Grosso do Sul.
Principais lacunas de conhecimento. O desconhecimento quase absoluto da biologia e formas imaturas de Muscidae é, talvez, o maior impedimento do conhecimento pleno da família. No Brasil, é conhecido menos do que 10% das formas imaturas de Muscidae. Entretanto, o melhor e mais adequado conhecimento de qualquer grupo taxonômico, passa necessariamente pelo conhecimento apropriado das áreas e dos padrões de distribuição das espécies ( Haseyama & Carvalho, 2011Haseyama, K. L. F. &.Carvalho, C. J. B. de 2011. Padrões de distribuição da biodiversidade Amazônica: um ponto de vista evolutivo. Revista da Biologia, volume especial de Biogeografia:35-40. ). No Mato Grosso do Sul existem amplas áreas sem amostragem de Muscidae (déficit Wallaceano) e deve haver um grande número de espécies ainda não registradas (déficit Linneano), incluindo sinantrópicas como de Ophyra e Muscina.
Perspectivas de pesquisa em Muscidae para os próximos 10 anos. As perspectivas de pesquisa em Muscidae para os próximos 10 anos passa pelo desenvolvimento de projetos envolvendo coleta e amostragem da fauna, com o projeto SISBIOTA, realizado nas regiões de Cerrado, Pantanal e regiões de transição com a região amazônica.
Agradecimentos.
A Fundação de Apoio ao Desenvolvimento do Ensino, Ciências e Tecnologia do Estado de Mato Grosso do Sul (Fundect) e a Superintendência de Ciências e Tecnologia do Estado de Mato Grosso do Sul (Sucitec/MS) pelo convite de participação neste fascículo especial da Iheringia, Série Zoologia e o suporte financeiro para sua publicação. Ao CNPq pela bolsa de produtividade em pesquisa (CJBC - processo número 304713/2011-2).
Referências Bibliográficas
- Boff, S.; Graciolli, G.; Boaretto, A. G. & Marques, M. R. 2008. Insetos visitantes de gomas exsudadas por Terminalia argentea Mart & Zurcc (Combretaceae). Revista Brasileira de Entomologia 52(3):477-479.
- Campos, C. F. M. & Barros, A. T. M. 1995. Dípteros muscóides da área urbana de Corumbá, Mato Grosso do Sul, Brasil. Revista Brasileira de Biologia 55:351-354.
- Carvalho, C. J. B. de, ed. 2002. Muscidae (Diptera) of the Neotropical Region: Taxonomy. Curitiba, Editora Universidade Federal do Paraná. 289p.
- Carvalho, C. J. B. de; Couri, M. S.; Pont, A. C.; Pamplona, D. M. & Lopes, S. M. 2005. A Catalogue of the Muscidae (Diptera) of the Neotropical Region. Zootaxa 860:1-282.
- Carvalho, C. J. B. de; Couri, M. S. Toma, R.; Rafael, J. A.; Harada, A. Y.; Bonatto, S. R.; Loureiro A. L. & Gastal, H. A. de O. 2002b. Principais coleções brasileiras de Diptera: Histórico e Situação atual, p. 37-52. In: Costa, C.; Vanin, S. A.; Lobo, J. M. & Melic, A. Proyecto de Red Iberoamericano de Biogeografia Y Entomologia Sistemática PRIBES 2002. Zaragoza, Sociedad (SEA) & Cited. 329p. (m3m-Monografias, Tercer Milenio, vol. 2.).
- Carvalho, C. J. B. de & Mello-Patiu, C. A. 2008. Key to the adults of the most common forensic species of Diptera in South America. Revista Brasileira de Entomologia52(3):390-406.
- Carvalho, C. J. B. de; Moura, M. O. & Ribeiro, P. B. 2002a. Chave para adultos de dípteros (Muscidae, Fanniidae, Anthomyiidae) associados ao ambiente humano no Brasil. Revista Brasileira de Entomologia46(2):107-114.
- Ferrar, P. 1987. Family Muscidae. In: Lyneborg, L. ed. Guide to the breeding habits and immature stages of Diptera Cyclorrapha. Copenhague, E. J. Brill/Scandinavian Science Press. (Entomograph vol. 8), p. 228-249.
- Haseyama, K. L. F. &.Carvalho, C. J. B. de 2011. Padrões de distribuição da biodiversidade Amazônica: um ponto de vista evolutivo. Revista da Biologia, volume especial de Biogeografia:35-40.
- Löwenberg-Neto, P. &.Carvalho, C. J. B. de 2013. Muscidae (Insecta: Diptera) of Latin America and the Caribbean: geographic distribution and checklist by country. Zootaxa 3650:1-147.
- Löwenberg-Neto, P.; Carvalho, C. J. B. de& Hawkins, B. A. 2011. Tropical niche conservatism as a historical narrative hypothesis for the Neotropics: a case study using the fly family Muscidae. Journal of Biogeography 38:1936-1947.
- Olson, D. M.; Dinerstein, E.; Wikramanayake, E. D.; Burgess, N. D.; Powell, G. V. N.; Underwood, E. C.; d’Amico, J. A.; Itoua, I.; Strand, H. E.; Morrison, J. C.; Loucks, C. J.; Allnut, T. F.; Ricketts, T. H.; Kura, Y.; Lamoreaux, J. F.; Wettengel, W. W.; Hedão, P. & Kassem, K. R. 2001. Terrestrial ecoregions of the World: a new map of life on Earth. BioScience 11:933-938.
- Skidmore, P. 1985. The biology of the Muscidae of the world. Series Entomologica 29:1-550.
Datas de Publicação
-
Publicação nesta coleção
2017
Histórico
-
Recebido
23 Nov 2016 -
Aceito
06 Fev 2017