Abstract
Lipid oxidation is certainly one of the most important alterations that affect both oils or fats and foods that contain them. It is responsible for the development of unpleasant taste and smell in foods, making them unsuitable for consuming. The use of antioxidants permits a longer useful life of these products. This work presents a bibliographic review of research carried out in order to evaluate the antioxidant activity of natural or synthetic substances used in the conservation of food lipid. Among such substances, the following antioxidants are highlighted: butylated hydroxyanisole (BHA), butylated hydroxytoluene (BHT), tertiary butylhydroquinone (TBHQ), propyl gallate (PG), tocopherols, phenolic acids and isolated compounds from rosemary and oregano.
lipid oxidation; natural antioxidants; synthetic antioxidants
REVISÃO
Antioxidantes utilizados em óleos, gorduras e alimentos gordurosos
Antioxidants used in oils, fats and fatty foods
Valéria Cristina Ramalho* * e-mail: valeria_ramalho@yahoo.com.br ; Neuza Jorge
Departamento de Engenharia e Tecnologia de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista, Rua Cristóvão Colombo, 2265, 15054-000 São José do Rio Preto - SP, Brasil
ABSTRACT
Lipid oxidation is certainly one of the most important alterations that affect both oils or fats and foods that contain them. It is responsible for the development of unpleasant taste and smell in foods, making them unsuitable for consuming. The use of antioxidants permits a longer useful life of these products. This work presents a bibliographic review of research carried out in order to evaluate the antioxidant activity of natural or synthetic substances used in the conservation of food lipid. Among such substances, the following antioxidants are highlighted: butylated hydroxyanisole (BHA), butylated hydroxytoluene (BHT), tertiary butylhydroquinone (TBHQ), propyl gallate (PG), tocopherols, phenolic acids and isolated compounds from rosemary and oregano.
Keywords: lipid oxidation; natural antioxidants; synthetic antioxidants.
INTRODUÇÃO
Com a finalidade de inibir ou retardar a oxidação lipídica de óleos, gorduras e alimentos gordurosos, são empregados compostos químicos conhecidos como antioxidantes.
Os lipídios são constituídos por uma mistura de tri, di e monoacilgliceróis, ácidos graxos livres, glicolipídios, fosfolipídios, esteróis e outras substâncias. A maior parte destes constituintes é oxidável em diferentes graus1, sendo que os ácidos graxos insaturados são as estruturas mais susceptíveis ao processo oxidativo2.
A oxidação lipídica é responsável pelo desenvolvimento de sabores e odores desagradáveis tornando os alimentos impróprios para consumo, além de também provocar outras alterações que irão afetar não só a qualidade nutricional, devido à degradação de vitaminas lipossolúveis e de ácidos graxos essenciais, mas também a integridade e segurança dos alimentos, através da formação de compostos poliméricos potencialmente tóxicos3-5.
Os lipídios podem ser oxidados por diferentes caminhos:
Reações hidrolíticas
As reações hidrolíticas são catalisadas pelas enzimas lipase ou pela ação de calor e umidade, com formação de ácidos graxos livres6.
Oxidação enzimática
A oxidação por via enzimática ocorre pela ação das enzimas lipoxigenases que atuam sobre os ácidos graxos poliinsaturados, catalisando a adição de oxigênio à cadeia hidrocarbonada poliinsaturada. O resultado é a formação de peróxidos e hidroperóxidos com duplas ligações conjugadas que podem envolver-se em diferentes reações degradativas5,7.
Fotoxidacão
O mecanismo de fotoxidacão de gorduras insaturadas é promovido essencialmente pela radiação UV em presença de fotossensibilizadores (clorofila, mioglobina, riboflavina e outros) que absorvem a energia luminosa de comprimento de onda na faixa do visível e a transferem para o oxigênio triplete (3O2), gerando o estado singlete (1O2)8.
O oxigênio singlete reage diretamente com as ligações duplas por adição formando hidroperóxidos diferentes dos que se observam na ausência de luz e de sensibilizadores, e que por degradação posterior originam aldeídos, álcoois e hidrocarbonetos5,9.
Autoxidacão
É o principal mecanismo de oxidação dos óleos e gorduras8.
Farmer et al.10 propuseram uma seqüência de reações inter relacionadas para explicar o processo de autoxidacão dos lipídios demonstrada na Figura 1.
Como pode ser observado, a autoxidacão dos lipídios está associada à reação do oxigênio com ácidos graxos insaturados e ocorre em três etapas:
-
Iniciação ocorre a formação dos radicais livres do ácido graxo devido à retirada de um hidrogênio do carbono alílico na molécula do ácido graxo, em condições favorecidas por luz e calor
11.
-
Propagação os radicais livres que são prontamente susceptíveis ao ataque do oxigênio atmosférico, são convertidos em outros radicais, aparecendo os produtos primários de oxidação (peróxidos e hidroperóxidos) cuja estrutura depende da natureza dos ácidos graxos presentes. Os radicais livres formados atuam como propagadores da reação, resultando em um processo autocatalítico
11.
-
Término dois radicais combinam-se, com a formação de produtos estáveis (produtos secundários de oxidação) obtidos por cisão e rearranjo dos peróxidos (epóxidos, compostos voláteis e não voláteis)
5,8.
Para evitar a autoxidação de óleos e gorduras há a necessidade de diminuir a incidência de todos os fatores que a favorecem, mantendo ao mínimo os níveis de energia (temperatura e luz) que são responsáveis pelo desencadeamento do processo de formação de radicais livres, evitando a presença de traços de metais no óleo, evitando ao máximo o contato com oxigênio e bloqueando a formação de radicais livres por meio de antioxidantes, os quais, em pequenas quantidades, atuam interferindo nos processos de oxidação de lipídios12.
HISTÓRICO SOBRE O USO DE ANTIOXIDANTES
O uso de antioxidantes na indústria de alimentos e seus mecanismos funcionais têm sido amplamente estudados13.
O retardamento das reações oxidativas por certos compostos foi primeiramente registrado por Berthollet, em 1797, e depois esclarecido por Davy14, em 1817.
O curso da rancificação de gorduras permaneceu desconhecido até Duclaux demonstrar que o oxigênio atmosférico era o maior agente causador de oxidação do ácido graxo livre. Vários anos mais tarde, Tsujimoto descobriu que a oxidação de triglicerídios altamente insaturados poderia provocar odor de ranço em óleo de peixe14.
Wright, em 1852, observou que índios americanos do Vale de Ohio preservavam gordura de urso usando casca de omeiro. Esse produto foi patenteado como antioxidante 30 anos mais tarde14.
O conhecimento atual das propriedades de vários produtos químicos para prevenir a oxidação de gorduras e alimentos gordurosos começou com estudos clássicos de Moureu e Dufraise. Durante a I Guerra Mundial e pouco depois, estes pesquisadores testaram a atividade antioxidante de mais de 500 compostos. Esta pesquisa básica, combinada com a vasta importância da oxidação em praticamente todas as operações de manufatura, desencadeou uma busca por aditivos químicos para controlar a oxidação, que ainda hoje está em curso14.
Das centenas de compostos que têm sido propostos para inibir a deterioração oxidativa das substâncias oxidáveis, somente alguns podem ser usados em produtos para consumo humano.
Na seleção de antioxidantes, são desejáveis as seguintes propriedades: eficácia em baixas concentrações (0,001 a 0,01%); ausência de efeitos indesejáveis na cor, no odor, no sabor e em outras características do alimento; compatibilidade com o alimento e fácil aplicação; estabilidade nas condições de processo e armazenamento e o composto e seus produtos de oxidação não podem ser tóxicos, mesmo em doses muitos maiores das que normalmente seriam ingeridas no alimento14.
Além disso, na escolha de um antioxidante deve-se considerar também outros fatores, incluindo legislação, custo e preferência do consumidor por antioxidantes naturais15.
CLASSIFICAÇÃO E MECANISMO DE AÇÃO
Segundo Bailey14, os antioxidantes podem ser classificados em primários, sinergistas, removedores de oxigênio, biológicos, agentes quelantes e antioxidantes mistos.
Os antioxidantes primários são compostos fenólicos que promovem a remoção ou inativação dos radicais livres formados durante a iniciação ou propagação da reação, através da doação de átomos de hidrogênio a estas moléculas, interrompendo a reação em cadeia16. Frankel17 apresentou o mecanismo de ação representado pela Figura 2.
O átomo de hidrogênio ativo do antioxidante é abstraído pelos radicais livres R e ROO com maior facilidade que os hidrogênios alílicos das moléculas insaturadas. Assim formam-se espécies inativas para a reação em cadeia e um radical inerte (A) procedente do antioxidante. Este radical, estabilizado por ressonância, não tem a capacidade de iniciar ou propagar as reações oxidativas.
Os antioxidantes principais e mais conhecidos deste grupo são os polifenóis, como butil-hidroxi-anisol (BHA), butil-hidroxi-tolueno (BHT), terc-butil-hidroquinona (TBHQ) e propil galato (PG), que são sintéticos, e tocoferóis, que são naturais18. Estes últimos também podem ser classificados como antioxidantes biológicos14,18.
Os sinergistas são substâncias com pouca ou nenhuma atividade antioxidante, que podem aumentar a atividade dos antioxidantes primários quando usados em combinação adequada com eles. Alguns antioxidantes primários quando usados em combinação podem atuar sinergisticamente14.
Os removedores de oxigênio são compostos que atuam capturando o oxigênio presente no meio, através de reações químicas estáveis tornando-os, conseqüentemente, indisponíveis para atuarem como propagadores da autoxidação. Ácido ascórbico, seus isômeros e seus derivados são os melhores exemplos deste grupo. O ácido ascórbico pode atuar também como sinergista na regeneração de antioxidantes primários14,19.
Os antioxidantes biológicos incluem várias enzimas, como glucose oxidase, superóxido dismurtase e catalases. Estas substâncias podem remover oxigênio ou compostos altamente reativos de um sistema alimentício14,20.
Os agentes quelantes/seqüestrantes complexam íons metálicos, principalmente cobre e ferro, que catalisam a oxidação lipídica. Um par de elétrons não compartilhado na sua estrutura molecular promove a ação de complexação. Os mais comuns são ácido cítrico e seus sais, fosfatos e sais de ácido etileno diamino tetra acético (EDTA)14,21.
Os antioxidantes mistos incluem compostos de plantas e animais que têm sido amplamente estudados como antioxidantes em alimentos. Entre eles estão várias proteínas hidrolisadas, flavonóides e derivados de ácido cinâmico (ácido caféico)14.
ANTIOXIDANTES MAIS UTILIZADOS EM ALIMENTOS
Antioxidantes sintéticos
BHA, BHT, PG e TBHQ são os antioxidantes sintéticos mais utilizados na indústria de alimentos.
A estrutura fenólica destes compostos (Figura 3) permite a doação de um próton a um radical livre, regenerando, assim, a molécula do acilglicerol e interrompendo o mecanismo de oxidação por radicais livres. Dessa maneira, os derivados fenólicos transformam-se em radicais livres. Entretanto, estes radicais podem se estabilizar sem promover ou propagar reações de oxidação22.
BHA é um antioxidante mais efetivo na supressão da oxidação em gorduras animais que em óleos vegetais. Como a maior parte dos antioxidantes fenólicos, sua eficiência é limitada em óleos insaturados de vegetais ou sementes. Apresenta pouca estabilidade frente a elevadas temperaturas, mas é particularmente efetivo no controle de oxidação de ácidos graxos de cadeia curta, como aqueles contidos em óleo de coco e palma14.
BHT tem propriedades similares ao BHA, porém, enquanto o BHA é um sinergista para propilgalatos, o BHT não é. BHA e BHT podem conferir odor em alimentos quando aplicados em altas temperaturas em condição de fritura, por longo período14.
O BHA e o BHT são sinergistas entre si. O BHA age como seqüestrante de radicais peróxidos, enquanto o BHT age como sinergista, ou regenerador de radicais BHA23.
PG é um éster do 3,4,5 ácido triidroxibenzóico; tem uma concentração ótima de atividade como antioxidante e quando usado em níveis elevados pode atuar como pró-oxidante. Seu poder para estabilizar alimentos fritos, massas assadas e biscoitos preparados com gorduras é baixo14.
TBHQ é um pó cristalino branco e brilhoso, moderadamente solúvel em óleos e gorduras e não se complexa com íons de cobre e ferro, como o galato24. É considerado, em geral, mais eficaz em óleos vegetais que BHA ou BHT; em relação à gordura animal, é tão efetivo quanto o BHA e mais efetivo que o BHT ou o PG25. O TBHQ é considerado também o melhor antioxidante para óleos de fritura, pois resiste ao calor e proporciona uma excelente estabilidade para os produtos acabados26. Ácido cítrico e TBHQ apresentam excelente sinergia em óleos vegetais.
Estudos toxicológicos têm demonstrado a possibilidade destes antioxidantes apresentarem efeito carcinogênico em experimentos com animais27. Em outros estudos, o BHA mostrou induzir hiperplasia gastrointestinal em roedores por um mecanismo desconhecido; em humanos, a relevância dessa observação não está clara28.
A redução do nível de hemoglobina e a hiperplasia de células basais24 foram atribuídas ao uso de TBHQ, .
Por estes motivos, o uso destes antioxidantes em alimentos é limitado; TBHQ não é permitido no Canadá e na Comunidade Econômica Européia29. No Brasil, o uso destes antioxidantes é controlado pelo Ministério da Saúde que limita 200 mg/kg para BHA e TBHQ e 100 mg/g para BHT como concentrações máximas permitidas30.
Tendo em vista os indícios de problemas que podem ser provocados pelo consumo de antioxidantes sintéticos, pesquisas têm sido dirigidas no sentido de encontrar produtos naturais com atividade antioxidante, os quais permitirão substituir os sintéticos ou fazer associações entre eles, com intuito de diminuir sua quantidade nos alimentos31.
Antioxidantes naturais
Entre os antioxidantes naturais mais utilizados podem ser citados tocoferóis, ácidos fenólicos e extratos de plantas como alecrim e sálvia.
O tocoferol, por ser um dos melhores antioxidantes naturais é amplamente aplicado como meio para inibir a oxidação dos óleos e gorduras comestíveis, prevenindo a oxidação dos ácidos graxos insaturados12.
A legislação brasileira permite a adição de 300 mg/kg de tocoferóis em óleos e gorduras, como aditivos intencionais, com função de antioxidante32.
Os tocoferóis estão presentes de forma natural na maioria dos óleos vegetais, em alguns tipos de pescado e atualmente são fabricados por síntese. Existem quatro tipos segundo a localização dos grupos metila no anel: a, b, g, d (Figura 4). A atividade antioxidante dos tocoferóis é principalmente devida à capacidade de doar seus hidrogênios fenólicos aos radicais livres lipídicos interrompendo a propagação em cadeia.
Muitas pesquisas têm sido realizadas nos últimos 40 anos sobre o efeito de tocoferóis durante a autoxidação de óleos33.
Yoshida et al.34, afirmaram que a potência biológica dos tocoferóis como vitamina E decresce conforme a seqüência a, b, g, d e segundo Jorge e Gonçalves12, sua atividade como antioxidante aumenta nessa mesma seqüência.
Por outro lado, Lea e Ward citados por Warner et al.33 sugerem que a atividade antioxidante relativa dos tocoferóis depende de vários parâmetros, incluindo temperatura, composição e forma da gordura (líquida, emulsão) e concentração de tocoferóis.
Com relação à temperatura, pesquisas revelam que essa variável pode ter um efeito significativo no resultado de estudos de oxidação usando esses compostos. Segundo Gottstein e Grosch35, a atividade antioxidante relativa dos tocoferóis é d > g > b > a em gordura de porco acima de 60 ºC, mas essa ordem é alterada para a > g > b > d entre 20 e 40 ºC. Verifica-se também, que a atividade antioxidante relativa dos tocoferóis em diferentes gorduras armazenadas a 37 ºC é g = d > a33, o que mostra o efeito do tipo de substrato.
O a-tocoferol pode atuar como antioxidante ou pró-oxidante dependendo do sistema testado, da concentração, do tempo de oxidação e do método usado para acompanhar a oxidação; a concentração de tocoferol para otimizar a estabilidade oxidativa de óleo de soja é entre 400 e 600 mg/kg36.
Tendo como base a formação de hidroperóxidos, em óleo de milho a-tocoferol exibiu ótima atividade antioxidante em concentrações menores (100 mg/kg) que na correspondente emulsão óleo/água (250500 mg/kg). Entretanto, baseando-se na decomposição de hidroperóxidos, medida pela formação de hexanal, a atividade do a-tocoferol aumentou com a concentração, tanto no óleo quanto na emulsão37.
Por outro lado, Jung e Min38 definiram concentrações ótimas de 100 mg/kg para a, 250 mg/kg para g e 500 mg/kg para d tocoferóis para aumentar a estabilidade oxidativa de óleos de soja purificados e armazenados no escuro, à temperatura de 55 ºC. Os tocoferóis apresentaram significantes efeitos pró-oxidantes em concentrações acima destes níveis.
Os tocoferóis são lábeis na presença de oxigênio, luz e calor. A velocidade relativa de decomposição de tocoferol em aquecimento de óleo de soja e girassol simulando fritura (180 ºC por 12 h) foi a > b > g > d12.
Em estudo da ação antioxidante dos tocoferóis em gorduras vegetais parcialmente hidrogenadas de soja e algodão com variação no índice de iodo, Stell39 notou uma destruição mais rápida de a e g tocoferóis que de b e d tocoferóis durante a termoxidação a 180 ºC por 10 h. A destruição dos tocoferóis originais, naturalmente presentes nos óleos e gorduras, foi maior nas gorduras mais saturadas, enquanto que a dos tocoferóis adicionados, em geral, foi maior nas gorduras mais insaturadas, demonstrando haver uma relação da resistência dos tocoferóis não só com o substrato mas também com o fato de serem naturais ou adicionados.
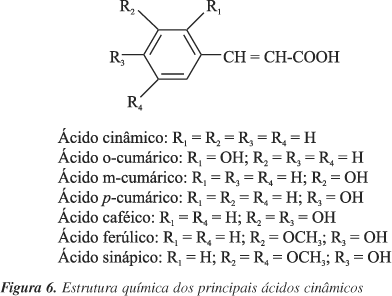
Os ácidos fenólicos caracterizam-se pela presença de um anel benzênico, um grupamento carboxílico e um ou mais grupamentos de hidroxila e/ou metoxila na molécula, que conferem propriedades antioxidantes40. São divididos em três grupos; o primeiro é composto pelos ácidos benzóicos, que possuem sete átomos de carbono (C6 C1), suas fórmulas gerais e denominações estão representadas na Figura 5. O segundo grupo é formado pelos ácidos cinâmicos, que possuem nove átomos de carbono (C6 C3), sendo sete os mais comumente encontrados no reino vegetal (Figura 6). As cumarinas são derivadas do ácido cinâmico por ciclização da cadeia lateral do ácido o-cumárico (Figura 7)31.
Os antioxidantes fenólicos funcionam como seqüestradores de radicais e, algumas vezes, como quelantes de metais41, agindo tanto na etapa de iniciação como na propagação do processo oxidativo. Os produtos intermediários formados pela ação destes antioxidantes são relativamente estáveis, devido à ressonância do anel aromático apresentada por estas substâncias4.
Diversos autores realizaram estudos visando verificar o potencial antioxidante dos ácidos fenólicos, com o objetivo de substituir os antioxidantes sintéticos, largamente utilizados na conservação de alimentos lipídicos por aumentarem a vida útil de muitos produtos42.
Em um estudo para avaliação do potencial dos ácidos caféico, protocatequínico, p-hidroxibenzóico, ferúlico e p-cumárico em banha, na concentração de 200 mg/kg, utilizando o método Rancimat à temperatura de 90 ºC, os ácidos caféico e protocatequínico apresentaram atividade antioxidante maior que o a-tocoferol e o BHT na mesma concentração43.
A atividade antioxidante da fração polar contida em óleo de oliva refinado foi testada nele mesmo através do método de Shall (estufa a 60 ºC, na ausência de luz), determinando-se o índice de peróxido como indicador do processo oxidativo. O extrato contendo a fração polar era constituído praticamente por compostos fenólicos, em particular por ácidos fenólicos. Os resultados mostraram uma certa ação por parte da fração polar do óleo de oliva, mas esta foi inferior à do BHT, ambos utilizados na dosagem de 200 mg/kg. Foi testada também a atividade antioxidante de cada ácido fenólico contido na fração polar, individualmente, utilizando a mesma metodologia. O ácido caféico mostrou uma atuação maior que a do BHT, enquanto os ácidos protocatequínico e siríngico, apesar de terem apresentado atividade, foram inferiores ao BHT. Por outro lado, os ácidos o-cumárico, p-cumárico, p-hidroxibenzóico e vanílico demonstraram pouca ou nenhuma propriedade antioxidante44.
Em estudos realizados com extratos de casca de batata, através do método de Shall, observou-se que os compostos ácidos clorogênico, gálico, protocatequínico e caféico apresentaram atividade antioxidante similar ao BHA quando o extrato e o antioxidante sintético foram aplicados em óleo de girassol na dosagem de 200 mg/kg45.
Na tentativa de elucidar as diferenças de potencial existentes entre os ácidos fenólicos, foi realizada uma comparação quantitativa do comportamento cinético da inibição da oxidação de alguns ácidos benzóicos (ácidos p-hidroxibenzóico, vanílico, siríngico, e 3,4diidroxibenzóico) e cinâmicos (ácidos p-cumárico, ferúlico, sinápco e caféico) quando aplicados em banha aquecida a 100 ºC, com retirada de amostras em intervalos de tempo definidos para análise46. Concluiu-se que, no caso dos ácidos benzóicos, a hidroxila presente na molécula do ácido p-hidroxibenzóico não conferiu a este nenhuma propriedade antioxidante. Já a metoxila presente com a hidroxila no ácido vanílico conferiu a ele uma pequena atividade antioxidante. No caso do ácido siríngico, que possui dois grupamentos de metoxila, a ação foi ainda maior. Com referência aos ácidos cinâmicos, a presença de metoxila adjacente à hidroxila, como ocorre no ácido ferúlico, aumentou o período de indução da oxidação duas vezes em relação ao controle. O período de indução foi ainda maior com a presença de duas metoxilas, como ocorre no ácido sinápico. Entretanto, o maior potencial antioxidante foi encontrado quando havia duas hidroxilas nas posições 3 e 4, estrutura apresentada pelos ácidos caféico e 3,4-diidroxibenzóico. Portanto, a atividade antioxidante dos compostos estudados apresentou a seguinte ordem: ácido caféico > 3,4-diidroxibenzóico > sinápico > siríngico > ferúlico > p-cumárico > vanílico.
Em estudos cinéticos mais recentes, utilizando-se triacilgliceróis e metil ésteres de óleo de girassol, verificou-se que os ácidos fenólicos participaram mais efetivamente na fase de iniciação da oxidação e os ácidos ferúlico, caféico e sinápico atuaram também nas reações de propagação. Isso leva ao melhor esclarecimento da ação destes antioxidantes no processo oxidativo47.
Em investigações de ácidos fenólicos presentes em grãos de soja, quatro ácidos apresentaram atividade oxidante significativa quando aplicados em óleo de soja: ácidos clorogênico, caféico, p-cumárico e ferúlico, tendo este último a maior atividade antioxidante. A oxidação foi acompanhada através da determinação do índice de peróxido48.
No número crescente de pesquisas que têm sido realizadas visando a utilização de antioxidantes naturais, muitas especiarias têm sido estudadas e tem-se observado que o alecrim e o orégano possuem forte atividade antioxidante49. Vários compostos fenólicos têm sido isolados do alecrim (carnosol, rosmanol, rosmaridifenol e rosmariquinona)49 e do orégano (glucosídeos, ácidos fenólicos e derivados terpenos)50.
Wu et al.51 confirmaram a eficiência antioxidante do extrato metanólico de alecrim (0,02%) em banha armazenada no escuro por 6, 14, 21, 28 e 36 dias através da determinação do índice de peróxido. A eficiência do extrato de alecrim foi comparável ao BHT e superior ao BHA nas mesmas concentrações.
Vekiari et al.50 fracionaram extrato de orégano com vários solventes (éter de petróleo, éter etílico, acetato de etila e butanol). A fração solúvel em éter etílico foi mais efetiva na proteção de banha (no escuro, a 65 ºC) contra a oxidação e sua atividade foi equivalente ao BHT. O mesmo foi observado em óleo de milho e soja refinados armazenados no escuro, a 35 e 65 ºC e sob operação de fritura. Os antioxidantes foram utilizados na dosagem de 0,01 e 0,02% e a oxidação foi acompanhada pela determinação do índice de peróxido.
Em estudo realizado por Almeida-Doria e Regitano-D'Arce49, sobre a ação antioxidante de extratos etanólicos de alecrim e orégano em óleo de soja submetidos à termoxidação, foram realizados ensaios para verificação de atividade antioxidante de extratos etanólicos dessas especiarias comparados com os antioxidantes sintéticos TBHQ e BHA + BHT. Verificou-se que os compostos empregados retardaram a oxidação do óleo, entretanto, os extratos naturais não atingiram a eficiência do TBHQ, mas foram tão efetivos quanto a mistura BHA + BHT.
Gordon e Kourimská52 observaram que o extrato de alecrim promoveu ação protetora contra formação de dímeros e degradação de tocoferóis em óleo de canola usado na fritura de batata.
Ainda sobre a estabilidade oxidativa da batata frita, Lolos et al.53 observaram que o extrato de orégano adicionado em batata chips após a fritura, como antioxidante, retardou significativamente a oxidação do óleo absorvido pela batata, com resultados comparáveis ao TBHQ durante armazenamento a 63 ºC por 7 dias, entretanto, o TBHQ foi mais efetivo após este tempo.
O extrato de alecrim também retardou a perda de a-tocoferol em óleo extraído de sardinha e armazenado a 30 ºC54.
OUTROS ANTIOXIDANTES
Suja et al.55 avaliaram a atividade antioxidante de extrato metanólico de gergelim em óleo de soja e girassol, usando o método de estufa a 60 ºC. Os resultados mostraram que o extrato de gergelim, em concentrações de 5, 10, 50 e 100 mg/kg nos óleos testados reduziu significativamente o índice de peróxido, dienos conjugados e o valor de p-anisidina. O estudo também indicou um melhor efeito antioxidante do extrato de gergelim que do BHT a 200 mg/kg. Menores concentrações de extrato de gergelim foram efetivas na proteção de óleos vegetais, independentemente de insaturação e conteúdo de vitamina E.
Zainol et al.56 avaliaram a atividade antioxidante dos extratos de quatro espécies de centela asiática (Centella asiática (L.) Urban) através de medidas usando os métodos de tiocianeto férrico (FTC) e ácido tiobarbitúrico (TBA), comparando a atividade antioxidante com a do a-tocoferol (natural) e BHT (sintético). Os resultados mostraram que a folha e a raiz da centela apresentaram alta atividade antioxidante, tão boa quanto a do a-tocoferol. Os resultados também sugeriram que os compostos fenólicos (3,23 a 11,7 g/100g amostra seca) são os principais contribuintes para a atividade antioxidante da centela asiática.
ESTUDOS COMPARATIVOS ENTRE A EFICIÊNCIA DE DIVERSOS ANTIOXIDANTES
O ascorbil palmitato atua como antioxidante absorvendo o oxigênio por reação direta ou reagindo com os hidroperóxidos já formados. Em estudo comparativo envolvendo esse antioxidante, BHA, BHT, PG na dosagem de 0,01% e TBHQ na dosagem de 0,02% em óleo de soja com diferentes índices de peróxido (1,73 e 4,57 meq/kg), observou-se que a ordem decrescente do efeito protetor foi: TBHQ, PG, AP, BHT, BHA, para o óleo com menor índice de peróxido e TBHQ, BHT, AP, PG, BHA para o óleo com maior índice de peróxido. A eficiência dos antioxidantes foi comparada em termos de índice de peróxido após 10 dias de estufa, a 60 ºC11.
Estudando o efeito de vários antioxidantes, incluindo fosfolipídios, ascorbil palmitato, alecrim, tocoferol e catequina sobre a estabilidade do óleo de amendoim, Chu e Hsu57, observaram que entre estes antioxidantes, catequina sozinha e mistura de catequina com outros antioxidantes aumentaram significativamente a estabilidade do óleo quando comparado com um controle, sendo seguida por fosfolipídio, alecrim e tocoferol. O ascorbil palmitato não apresentou resultado significativo.
Em outro estudo, o efeito da adição de antioxidante ao óleo de canola foi avaliado sob aquecimento do óleo a 80 ºC e fritura de batatas a 162 ºC. Segundo os resultados da estabilidade oxidativa pelo Rancimat a 100 ºC do óleo submetido à fritura, o TBHQ foi considerado o antioxidante mais potente, seguido do ascorbil palmitato e extrato de alecrim, BHA e BHT, d-tocoferol e lecitina. No entanto, a ordem de atividade antioxidante do óleo aquecido a 80 ºC mostrou-se diferente, sendo: TBHQ > lecitina > ascorbil palmitato > extrato de alecrim > BHT, BHA e d-tocoferol58.
Estudo comparativo envolvendo BHA, BHT, TBHQ, a-tocoferol e ácido caféico em emulsão óleo/água através da medida de formação de peróxidos durante oxidação a 37 ºC mostrou que BHA e BHT foram mais efetivos em baixos níveis de adição. O a-tocoferol teve uma atividade intermediária. A ação pró ou antioxidante do ácido caféico dependeu da concentração59.
ANTIOXIDANTES POTENCIAIS
Lima et al.60 avaliaram a atividade antioxidante do extrato aquoso do broto de feijão-mungo (Vigna radiata L.) em sistema modelo b-caroteno/ácido linoléico. O extrato apresentou atividade oxidante (48,07% de inibição da oxidação) embora tenha sido inferior ao BHT usado como referência. Os autores evidenciaram que a ação antioxidante desse vegetal está relacionada ao teor de compostos fenólicos, assim como aconteceu com o extrato aquoso de canela com 60%61, germe de trigo e gensing com 64,9 e 69,1% de inibição da oxidação, respectivamente62.
Também utilizando o sistema modelo b-caroteno/ácido linoléico, Melo et al.63 avaliaram a atividade antioxidante de extratos de coentro (Coriandrum sativum L.). O extrato aquoso exibiu 69,83% e o extrato etéreo 51,89% de proteção contra a oxidação, sendo essa habilidade atribuída, respectivamente, aos seus constituintes fenólicos e carotenóides.
CONCLUSÃO
O desenvolvimento de compostos indesejáveis oriundos da oxidação lipídica é um importante problema a ser resolvido a fim de se obter um prolongamento da vida útil de óleos, gorduras e alimentos gordurosos.
Como conseqüência, tem surgido uma série de estudos para avaliar o potencial antioxidante de vários compostos para se conhecer a concentração adequada, a influência do sistema lipídico e da temperatura, existindo também forte tendência de substituição dos antioxidantes sintéticos por antioxidantes naturais, visto que as pesquisas têm demonstrado a possibilidade dos sintéticos apresentarem algum efeito tóxico.
Para gordura animal, o ácido caféico e o extrato metanólico de alecrim mostraram ser os antioxidantes mais adequados apresentando inclusive efeito superior ao BHT e BHA, respectivamente.
Para os óleos vegetais, as pesquisas indicaram o TBHQ como o mais efetivo inclusive sob altas temperaturas, mas os antioxidantes naturais demonstraram ter melhor efetividade que BHA e BHT, como os extratos de orégano, alecrim e gergelim para óleo de soja, extrato de gergelim, ácidos clorogênico, gálico, protocatequínico e caféico para óleo de girassol, ascorbil palmitato e extrato de alecrim para óleo de canola e ácido caféico para óleo de oliva.
Recebido em 8/6/04; aceito em 6/5/05; publicado na web em 01/12/05
- 1. Berset, C.; Cuvelier, M. E.; Sciences des aliments 1996, 16, 219.
- 2. Cosgrove, J. P.; Church, D. F.; Pryor, W. A.; Lipids 1987, 22, 299.
- 3. Kubow, S.; Nutritions Reviews 1993, 51, 33.
- 4. Nawar, W. W. Em Lipids; Fennema, O. R., ed.; Marcel Dekker: New York, 1985, p. 139.
- 5. Silva, F. A. M.; Borges, M. F. M.; Ferreira, M. A.; Quim. Nova 1999, 22, 94.
- 6. Barrera-Arellano, D.; Óleos e Grãos 1993, 6, 10.
- 7. Halliwell, B.; Murcia, M. A.; Chirico, S.; Aruoma, O. I.; Crit. Rev. Food Sci. Nutr 1995, 35, 7.
- 8. Berger, K. G.; Hamilton, R. J. Em Developments in Oils and Fats; Hamilton, R. J., ed.; Chapman & Hall: London, 1995, cap. 7.
- 9. Jadhav, S. J.; Nimbalkar, S. S.; Kulkarni, A. D.; Madhavi, D. L.; Rajalakshmi, D.; Narasimhan, S. Em Food Antioxidants: Technological, Toxicological, and Health Perspectives; Madhavi, D. L.; Deshpande, S. S.; Salunkhe, D. K., eds.; Marcel Dekker Inc.: New York, 1996, p. 5.
- 10. Farmer, E. H.; Bloomfield, G. G.; Sundralingam, S.; Sutton, D. A.; Trans. Faraday Soc 1942, 38, 348.
- 11. Toledo, M. C. F.; Esteves, W.; Hartmann, E. M.; Ciênc. Tecnol. Aliment 1985, 5, 1.
- 12. Jorge, N.; Gonçalves, L. A. G.; Boletim SBCTA 1998, 32, 40.
- 13. Mukai, K.; Morimoto, H.; Okauchi, Y.; Nagaoka, S.; Lipids 1993, 28, 753.
- 14. Bailey, A. E.; Bailey's Industrial Oil and Fat Products, 5th ed., John Wiley: New York, 1996, vol. 3.
- 15. Rafecas, M.; Guardiola, F.; Illera, M.; Codony, R.; Boatella, J.; J. Chromatogr 1998, 822, 305.
- 16. Simic, M. G.; Javanovic, S. V. Em Inactivation of oxygen radicals by dietary phenolic compounds in anticarcinogenesis; Ho, C. T.; Osawa, T.; Huang, T. M.; Rosen, R. T., eds.; Food Phytochemicals for Cancer Prevention: Washington, 1994, p. 20.
- 17. Frankel, E. N.; Prog. Lip. Res1980, 19, 1.
- 18. Namiki, M.; Crit. Rev. Food Sci. Nutr 1990, 29, 273.
- 19. Belitz, H. D.; Grosch, W.; Quimica de los Alimentos, Acribia: Zaragoza, 1988.
- 20. Kehrer, J. P.; Smith, C. V. Em Natural antioxidants in human health and disease; Frei, B., ed.; Academic Press: San Diego, 1992, p. 25.
- 21. Labuza, T. P.; Crit. Rev. Food Technol 1971, 3, 355.
- 22. Buck, D. F.; J. Am. Oil Chem. Soc 1981, 58, 275.
- 23. Omura, K.; J. Am Oil Chem. Soc 1995, 72, 1565.
- 24. Madhavi, D. L.; Salunkhe, D. K. Em Antioxidants; Maga, J.; Tu, A. T., eds.; Marcel Dekker: New York, 1995, p. 89.
- 25. Chahine, M. H.; Macneill, R. F.; J. Am. Oil Chem. Soc 1974, 51, 37.
- 26. Dziezac, J. D.; Food Technol 1986, 43, 66.
- 27. Botterweck, A. A. M.; Verhagen, H.; Goldbohm, R. A.; Kleinjans, J.; Food Chem. Toxicol 2000, 38, 599.
- 28. Cruces-Blanco, C.; Carretero, A. S.; Boyle, E. M.; Gutiérrez, A. F.; Talanta 1999, 50, 1099.
- 29. Reishe, D. W.; Lilliard, D. A.; Eitenmiller, R. R. Em Antioxidants; Akoh, C. C.; Min, D. B., eds.; Marcel Dekker: New York, 1997, p. 423.
-
30http://www.anvisa.gov.br/legis, acessada em Maio 2004.
- 31. Soares, S. E.; Rev. Nutr 2002, 15, 01.
- 32. ABIA Associação Brasileira das Indústrias da Alimentação; Compêndio da Legislação de Alimentos: Consolidação das Normas e Padrões de Alimentos, 7Ş ver., São Paulo, 1999, vol. 1.
- 33. Warner, K.; Neff, W. E.; Eller, F. J.; J. Agric. Food Chem 2003, 51, 623.
- 34. Yoshida, H.; Tatsumi, M.; Kajimoto, G.; J. Am. Oil Chem. Soc 1991, 68, 566.
- 35. Gottstein, T.; Grosch, W.; Fat Sci Technol 1990, 92, 139.
- 36. Frankel, E. N.; Food Chem 1996, 57, 51.
- 37. Huang, S. W.; Frankel, E. N.; German, J. B.; J. Agric. Food Chem. 1994, 42, 2108.
- 38. Jung, M. Y.; Min, D. B.; J. Food Sci 1990, 55, 1464.
- 39. Stell, C. J.; Tese de Doutorado, Universidade Estadual de Campinas, Brasil, 2002.
- 40. Ferguson, L. R.; Harris, P. J.; Eur. J. Cancer Prev. 1999, 8, 17.
- 41. Shahidi, F.; Janitha, P. K.; Wanasundara, P. D.; Crit. Rev. Food Sci. Nutr 1992, 32, 67.
- 42. Durán, R. M.; Padilla, B.; Grasas y Aceites 1993, 44, 101.
- 43. Gadow, V. A.; Joubert, E.; Hansmann, C. F.; J. Agric. Food Chem 1997, 45, 632.
- 44. Papadopoulos, G.; Boskou, D.; J. Am. Oil Chem. Soc. 1991, 68, 669.
- 45. Sotillo, D. R.; Hadley, M.; Holm, E. T.; J. Food Sci 1994, 59, 1031.
- 46. Marinova, E. M.; Yanishlieva, N. V.; Fett-Wissenschaft Technol 1992, 94, 428.
- 47. Yanishlieva, N. V.; Marinova, E. M.; Food Chem. 1995, 54, 377.
- 48. Nagen, T. J.; Albuquerque, T. T.; Miranda, L. C. G.; Arquivos de Biologia e Tecnologia 1992, 35, 129.
- 49. Almeida-Doria, R. F.; Regitano-D'Arce, M. A. B.; Ciênc. Tecnol. Aliment. 2000, 20, 01.
- 50. Vekiari, S. A.; Tzia, C.; Oreopoulo, V.; Thomopoulos, C. D.; Riv. Ital. Sostanze Grasse 1993, 70, 25.
- 51. Wu, J. W.; Lee, M-N.; Ho, C-T.; Chang, S. S.; J. Am. Oil Chem. Soc. 1982, 59, 339.
- 52. Gordon, M. H.; Kourimská, L.;. Food Chem. 1995, 52, 175.
- 53. Lolos, M.; Oreopoulo, V.; Tzia, C.; J. Sci. Food Agric. 1999, 79, 1524.
- 54. Fang, X.; Wada, S.; Food Research Int 1993, 26, 405.
- 55. Suja, K.; Abraham, J. T.; Thamizh, S. N.; Jayalekshmy, A.; Arumughan, C.; Food Chem. 2004, 84, 393.
- 56. Zainol, M. K.; Abd-Hamid, A.; Yusof, S.; Muse, R.; Food Chem 2003, 81, 575.
- 57. Chu, Y.; Hsu, H.; Food Chem. 1999, 66, 29.
- 58. Antoniassi, R.; BCEPPA 2001, 19, 353.
- 59. Nenadis, N.; Zafiropoulou, I.; Tsimidou, M.; Food Chem. 2003, 82, 403.
- 60. Lima, V. L. A. G.; Melo, E. A.; Maciel, I. S.; Silva, G. S. B.; Rev. Nutr 2004, 17, 53.
- 61. Mancini-Filho, J.; Van-Koiij, A.; Mancini, D. A. P.; Cozzolino, F. F.; Torres, R. P.; Boll. Chim. Farma 1998, 137, 443.
- 62. Velioglu, Y. S.; Mazza, G.; Gao, L.; Oomah, B. D.; J. Agric. Food Chem 1998, 46, 4113.
- 63. Melo, E. A.; Mancini-Filho, J.; Guerra, N. B.; Maciel, G. R.; Ciênc. Tecnol. Aliment 2003, 23, 195.
Publication Dates
-
Publication in this collection
02 Aug 2006 -
Date of issue
July 2006
History
-
Accepted
06 May 2005 -
Received
08 June 2004