Resumos
Em experimentos conduzidos no campo, quantificaram-se a dispersão vertical e horizontal dos conídios de Stenocarpella maydis e S. macrospora liberados de palha de milho (Zea mays) naturalmente infetada. Verificou-se que 93% do número total de conídios de S. maydis e 88% de S. macrospora foram capturados durante o dia, diferindo estatisticamente do período noturno. O número de conídios de S. maydis e S. macrospora capturados no ar foi inversamente proporcional à distância da posição vertical e horizontal das armadilhas da fonte de inóculo. Os conídios foram capturados até uma altura de 2 m acima e distantes 120 m da fonte de inóculo. No entanto, em ambos experimentos, a freqüência e o número de esporos coletados foram maiores até 25 cm acima e 20 m distante da fonte de inóculo. Além disto, a dispersão dos conídios isolados ou agrupados no cirro, ocorreu livremente no ar, não necessitando estarem veiculados a gotículas d'água.
disseminação; milho; plantio direto; Diplodia; propágulos
Experiments were carried out in the field to quantify airborne dispersal of Stenocarpella maydis and S. macrospora conidia from naturally infected corn (Zea mays) straw. The data indicated that 93% and 88% of the total number of sampled conidia of S. maydis and S. macrospora, respectively, were trapped during the day, differing statistically from the night period. The number of sampled conidia of both fungi, was inversely proportional to the vertical and horizontal distance of spore traps from the inoculum source. Conidia were collected up to a height of 2.0 m and up to 120.0 m from the inoculum source. In both experiments, the frequency and the number of collected spores were the highest at a height of 25.0 cm and at a distance of 20.0 m from the inoculum source. Conidia was dispersed in the air as individual spores and/or grouped in cirri and not essentially associated to rain splashes.
ARTIGOS ARTICLES
Dispersão vertical e horizontal de conídios de Stenocarpella macrospora e Stenocarpella maydis* * Parte da Tese de Doutorado do primeiro autor. Universidade Federal de Viçosa (2000)
Vertical and horizontal dispersion of conidia of Stenocarpella macrospora and Stenocarpella maydis
Ricardo T. CasaI, ** ** Bolsista do CNPq ; Erlei M. ReisII; Laércio ZambolimIII
ICentro de Ciências Agroveterinárias - CAV/UDESC, Cx. Postal 281, Lages, SC, CEP 88520-000, e-mail: a2rtc@cav.udesc.br
IIFaculdade de Agronomia e Medicina Veterinária - FAMV/UPF, Cx. Postal 611, Passo Fundo, RS, CEP 99001-970
IIIDepartamento de Fitopatologia - DFP/UFV, Viçosa, MG, CEP 36570-000
RESUMO
Em experimentos conduzidos no campo, quantificaram-se a dispersão vertical e horizontal dos conídios de Stenocarpella maydis e S. macrospora liberados de palha de milho (Zea mays) naturalmente infetada. Verificou-se que 93% do número total de conídios de S. maydis e 88% de S. macrospora foram capturados durante o dia, diferindo estatisticamente do período noturno. O número de conídios de S. maydis e S. macrospora capturados no ar foi inversamente proporcional à distância da posição vertical e horizontal das armadilhas da fonte de inóculo. Os conídios foram capturados até uma altura de 2 m acima e distantes 120 m da fonte de inóculo. No entanto, em ambos experimentos, a freqüência e o número de esporos coletados foram maiores até 25 cm acima e 20 m distante da fonte de inóculo. Além disto, a dispersão dos conídios isolados ou agrupados no cirro, ocorreu livremente no ar, não necessitando estarem veiculados a gotículas d'água.
Palavras-chave adicionais: disseminação, milho, plantio direto, Diplodia, propágulos.
ABSTRACT
Experiments were carried out in the field to quantify airborne dispersal of Stenocarpella maydis and S. macrospora conidia from naturally infected corn (Zea mays) straw. The data indicated that 93% and 88% of the total number of sampled conidia of S. maydis and S. macrospora, respectively, were trapped during the day, differing statistically from the night period. The number of sampled conidia of both fungi, was inversely proportional to the vertical and horizontal distance of spore traps from the inoculum source. Conidia were collected up to a height of 2.0 m and up to 120.0 m from the inoculum source. In both experiments, the frequency and the number of collected spores were the highest at a height of 25.0 cm and at a distance of 20.0 m from the inoculum source. Conidia was dispersed in the air as individual spores and/or grouped in cirri and not essentially associated to rain splashes.
INTRODUÇÃO
As podridões do colmo e da espiga de plantas de milho (Zeae mays L.) podem ser causadas pelos fungos Stenocarpella maydis (Berk.) Sutton [Sin. Diplodia maydis (Berk.) Sacc.; D. zeae (Schw.) Lev.] e S. macrospora (Earle) Sutton [Sin. D. macrospora Earle in Bull.] (White, 1999). O fungo S. macrospora também pode causar sintoma de mancha foliar (Marasas & Van Der Westhuizen, 1979). Os fungos sobrevivem em sementes e nos restos culturais infetados (McGee, 1988; Casa, 1997).
A intensidade das podridões de diplodia é maior nas lavouras de monocultura onde estão presentes os restos culturais (Flett & Wehner, 1991). Na Região Sul do Brasil, os danos à produção de grãos têm sido maiores em lavouras conduzidas no sistema de plantio direto em monocultura (Reis & Casa, 1996). Nos restos culturais, constituídos em sua maioria por colmos, os fungos sobrevivem saprofiticamente na forma de picnídios (Flett et al., 1992), produzindo e liberando conídios em cirros, os quais se constituem na principal fonte de inóculo primário.
Alguns fungos que produzem corpos frutíferos, como por exemplo, os picnídios, comumente liberam os esporos na presença de água, com sua posterior dispersão veiculados em respingos de gotas d'água da chuva ou de irrigação (Fitt et al., 1989). No caso de S. maydis e S. macrospora, existe pouco estudo sobre os mecanismos que envolvem a maturação dos picnídios, extrusão do cirro de conídios do picnídio e a posterior dispersão dos esporos. Poucas são as informações disponíveis tratando sobre a distância e a altura que o inóculo pode ser transportado, sendo relatado apenas que as maiores intensidades das podridões do colmo e da espiga ocorrem próximas da fonte de inóculo (Ullstrup, 1964; Del Río & Melara, 1991).
O objetivo do presente trabalho foi determinar o período do dia em que ocorre a liberação e a dispersão dos conídios de S. maydis e S. macrospora, bem como quantificar a distância de transporte vertical e horizontal dos esporos pelo vento a partir da fonte de inóculo constituída por palha de milho naturalmente infetada.
MATERIAL E MÉTODOS
Os ensaios de dispersão vertical e horizontal dos conídios de S. macrospora e S. maydis foram instalados em área de lavoura conduzida em semeadura direta, sem a presença de lavoura de milho ou restos culturais da gramínea a menos de 500 m de distância. A determinação da ausência do inóculo foi monitorada pela presença de armadilhas de esporos colocadas 15 dias antes da implantação do experimento.
A fonte de inóculo constituiu-se de colmos de milho naturalmente infetados com S. maydis e S. macrospora, distribuídos na superfície do solo, sobre a resteva de soja (Glycine max (L.) Merril), aveia (Avena sativa L.) e/ou azevém (Lolium multiflorum L.), simulando a mesma quantidade de resíduo de milho após a colheita (g de palha/m2). Nessa palha determinou-se a densidade de inóculo dos fungos S. maydis e S. macrospora, quantificando-se o número de conídios/g de palha.
Em todos experimentos as armadilhas de esporos utilizadas foram do tipo cata-vento (Reis & Santos, 1985). A coleta de esporos no ar ocorreu pelo impacto dos propágulos numa lâmina de microscópio, inclinada num ângulo de 45o e protegida da chuva. A lâmina foi untada com uma mistura de vaselina, parafina, fenol e hexano (Frederickson et al., 1989).
Dispersão vertical
O ensaio foi conduzido de janeiro a março de 1996, em uma área de 400 m2 (20 m x 20 m) constituída da fonte de inóculo, no campo experimental da Faculdade de Agronomia e Medicina Veterinária/FAMV-UPF.
As armadilhas de esporos foram colocadas dispostas no centro da área da fonte de inóculo, posicionadas nas seguintes alturas acima da superfície do solo: 12,5, 25, 50, 100 e 200 cm.
O delineamento experimental foi de blocos ao acaso com cinco tratamentos e três repetições. A distância entre armadilhas dentro do bloco foi de 1 m e entre os blocos de 2 m.
As avaliações do número de conídios em uma área de 768 mm2 de lâmina microscópica foram feitas diariamente em microscópio ótico, removendo-se as lâminas dos coletores às 8:00 h e às 20:00 h durante 62 dias consecutivos, iniciando no dia 20 de janeiro e terminando no dia 21 de março.
Os dados obtidos foram expressos em número acumulado de conídios de S. maydis e de S. macrospora durante os 62 dias de avaliação para cada altura e para cada período diário de avaliação. A comparação de média foi feita com o auxílio do teste "t". A análise de regressão foi usada para determinar a relação entre a variável dependente (número de conídios) e a variável independente (altura das armadilhas). A análise de gradiente de inóculo foi comparada pelos modelos propostos por Gregory (Potencial: y = a.d-b; onde: y = quantidade de inóculo estimada, a = quantidade de inóculo na fonte, d = distância, b = coeficiente ou taxa na qual y diminui em função de d) e Kiyosawa & Shiyomi (Exponencial: y = a.e-bd; onde: e = exponencial) (Campbell & Madden, 1990).
Também foram monitoradas as condições climáticas durante esse período, como a temperatura mínima, média e máxima, a umidade relativa do ar e a precipitação pluvial.
Dispersão horizontal
Os experimentos foram conduzidos nos meses de maio e junho na Granja Santa Cecília, localizada no município de Coxília, RS, em 1996, e na área experimental da FAMV-UPF, em 2000.
A distância de transporte horizontal dos conídios foi determinada com armadilhas de esporos posicionadas a uma distância de 10, 20, 40, 80 e 120 m da fonte de inóculo em 1996 e a 10, 20, 40, 60 e 80 m em 2000, em ambos os anos dispostas na direção norte e sul. Para cada distância foram instaladas duas armadilhas, posicionadas 35 cm de altura acima do solo e espaçadas um metro cada, ambas lado a lado.
As lâminas das armadilhas foram substituídas entre sete e quinze dias em 1996 e com um intervalo de dois a três dias em 2000. No laboratório, sobre microscópio ótico, procedeu-se a quantificação do número de conídios de S. maydis e S. macrospora numa área de lâmina microscópica de 768 mm2.
Os dados obtidos foram expressos em número médio de conídios de S. maydis e S. macrospora capturados para cada distância da fonte de inóculo. Os resultados foram submetidos à análise de regressão. O gradiente de inóculo também foi comparado pelos modelos propostos por Gregory e Kiyosawa & Shiyomi (Campbell & Madden, 1990).
RESULTADOS E DISCUSSÃO
O monitoramento prévio da presença de S. maydis e S. macrospora nas áreas experimentais indicou a ausência do inóculo antes da distribuição da palha de milho naturalmente infetada. Confirmou-se assim, que a principal fonte de inóculo para S. maydis e S. macrospora são os restos culturais infetados e que os esporos desses fungos são disseminados pelo vento a curta distância. Com isso, numa lavoura sem resteva infetada, provavelmente não deve haver inóculo suficiente para causar epidemia de mancha foliar e de podridões do colmo e da espiga causadas por Stenocarpella sp. Flett & Wehner (1991) verificaram que a intensidade da podridão da espiga, causada por S. maydis, apresentou resposta linear à presença da palha sobre a superfície do solo, apresentando em plantio direto maior intensidade de espigas e de grãos infetados quando comparado com a aração do solo.
Quanto ao tipo de armadilha de esporos utilizada, segundo Ingold (1971), o método de determinação de esporos no ar pelo impacto dos propágulos na lâmina tem mérito quanto a sua praticidade, porém, possui pouco valor quantitativo, principalmente, porque as condições de turbulência da atmosfera devem favorecer o impacto de esporos grandes. Como os esporos de S. maydis e S. macrospora são considerados grandes (maiores que 30 µm de comprimento), a armadilha tipo cata-vento permitiu quantificar eficientemente a dispersão vertical e horizontal dos esporos. Além da captura dos conídios de S. maydis e S. macrospora, foram detectados esporos de outras espécies de fungos e grãos de pólen. Os esporos mais frequentemente detectados pertenciam aos gêneros Alternaria, Bipolaris, Drechslera, Erysiphe, Fusarium e Puccinia, possivelmente pela grande disponibilidade de restos culturais e plantas voluntárias de cereais de inverno.
Dispersão vertical
A quantidade de palha de milho na área experimental correspondente à fonte de inóculo foi de 256 g de palha/m2, com uma densidade de inóculo de 1.233.408 conídios de S. maydis e 88.832 conídios de S. macrospora por metro quadrado.
Em relação ao período diário de coleta dos conídios, verificou-se nas lâminas removidas às 20:00 h uma captura de 93% dos conídios de S. maydis e 88% de S. macrospora (Tabelas 1 e 2), indicando diferença significativa entre os dois períodos de coleta em relação ao número total de esporos capturados, considerando as cinco alturas dos coletores. No entanto, considerando somente o número de conídios capturados na altura de 200 cm, para ambos fungos, não se detectou diferença estatística comparando os períodos de coleta (Tabelas 1 e 2). Mesmo assim, nessa altura capturou-se 78,5% e 95,4% dos conídios de S. maydis e S. macrospora, respectivamente, às 20:00 h.
A alta proporção de conídios de S. maydis e S. macrospora capturados durante o dia possivelmente refletiu as condições climáticas ocorrentes no período noturno, onde a umidade do solo e a umidade relativa do ar foram maiores, acarretando no aumento do conteúdo de água nos restos culturais. Nessa situação, os picnídios dos fungos presentes sob a epiderme dos tecidos do colmo do milho hidratam-se, determinando, assim, sua maturação, com a produção e liberação de conídios. Segundo Sutton (1980), os conidióforos de Stenocarpella sp. são usualmente ausentes, com conídios produzidos em células conidiogênicas enteroblásticas e fialídicas, formada a partir de células internas da parede do picnídio. No caso de Stagonospora nodorum (Berk.) Castellani & E.G. Germano, os conídios são produzidos numa massa mucilaginosa dentro do picnídio. A mucilagem, composta de proteínas e açúcares (Fournet, 1969), absorve água e intumesce quando a umidade relativa atmosférica é alta. No picnídio o intumescimento resulta na extrusão do cirro de conídios através do ostíolo (Fitt et al. 1989). Possivelmente, noites com formação de orvalho prolongado, com deposição d'água sobre os restos culturais do milho, favoreceram o aumento do conteúdo de água na palha.
Fitt et al. (1989) relataram que alguns fungos formadores de picnídios comumente liberam os conídios na presença de água, com sua posterior dispersão veiculados em respingos de chuva formados pelo impacto de uma gota numa determinada superfície. Os conídios atingidos pela gota são liberados e dispersados a curtas distâncias. No entanto, nesse experimento conduzido com Stenocarpella sp., verificaram-se cinco situações onde ocorreram três dias consecutivos sem haver precipitação pluvial, mesmo assim capturaram-se conídios de S. maydis e S. macrospora. Portanto, demonstrou-se que nesse patossistema não há necessidade de ocorrer precipitações pluviais para induzir a liberação do cirro e posterior dispersão dos conídios. Fitt et al. (1989) descreveram que os fungos dispersos por respingos de gotas de chuva freqüentemente apresentam esporos com parede fina, hialinos, protegidos por mucilagem, sendo produzidos em picnídios, acérvulos e estromas. Ingold (1971) menciona que a dispersão por respingos parece ser essencial para espécies de fungos como Fusarium spp. e Colletotrichum spp. A produção de esporos pegajosos em regiões secas ocorre após um umedecimento do estroma, quando a mucilagem associada aos esporos tem tempo para absorver água e intumecer estando em uma condição efetiva para a dispersão pelo respingo d'água. No caso das duas espécies de Stenocarpella sp., seus conídios apresentam parede espessa e são escuros, além do que, na bibliografia consultada não se encontrou relato da presença de mucilagem associada aos esporos. Segundo Alexopoulos & Mims (1979), cirro é uma massa cilíndrica de esporos mantida unida à medida que é liberada do ostíolo. É nessa forma que os fungos S. maydis e S. macrospora produzem cirros. Dessa maneira, os fungos S. maydis e S. macrospora podem ser comparados com alguns fungos da Ordem Sphaeropsidales descritos por Ingold (1971) e Fitt et al. (1989) quanto à necessidade de água para o intumescimento e extrusão do cirro, porém, para a dispersão dos esporos não há necessidade de respingos de chuva, comportando-se como esporos secos.
A extrusão do cirro do corpo frutífero também é favorecida pela presença de luz e pelo aumento da temperatura. Como durante a noite as temperaturas do ar são mais baixas, possivelmente, as temperaturas mais elevadas ocorrentes de dia favorecem a extrusão dos cirros. Nos 62 dias de condução do experimento verificou-se que a temperatura média do ar às 16:00 h foi 5,34 e 5,49 oC mais elevada quando comparada com as obtidas às 10:00 e às 22:00 h, respectivamente.
Além do efeito da radiação solar e da temperatura, a predominância dos ventos também contribui para dispersar o inóculo dos fungos. Segundo De Fina & Ravello (1972), a velocidade do vento sofre uma variação diária, apresentando grande analogia com a variação diária da temperatura. A velocidade do vento é muito menor durante a noite, aumentando desde a saída do sol até pouco depois do meio dia, momento em que alcança o valor máximo. De acordo com Fitt et al. (1989), muitos patógenos podem ser detectados no ar na ausência de chuvas. A liberação dos esporos dispersados no ar seco mostra uma periodicidade diurna; freqüentemente os esporos são coletados próximo ao meio dia quando a velocidade do vento é maior, a temperatura é mais elevada e a umidade relativa é menor. Deste modo, no caso das espécies de Stenocarpella sp., assume-se que existe necessidade de água no estado líquido para hidratar o picnídio e exsudar o cirro de conídios, porém os fatores climáticos que governam sua dispersão são semelhantes aos de patógenos que produzem conídios sobre conidióforos livremente, ou seja, fora de corpos frutíferos. Aylor (1990), relata que muitos fungos, como por exemplo, Puccinia spp., Ustilago spp., Erysiphe spp. e Drechslera spp., são passivamente liberados pelo vento com esporos encontrados em alta concentração na atmosfera durante o dia, freqüentemente alcançando uma máxima concentração próximo ao meio dia quando a velocidade do vento e o nível de turbulência próximo ao solo normalmente é maior.
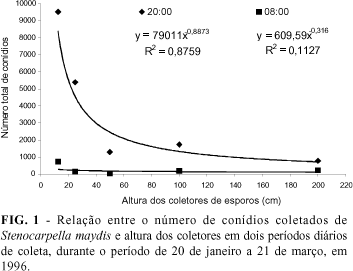
Em relação às alturas de coleta, o número acumulado de conídios de S. maydis com lâmina removida às 20:00 h diminuiu à medida que a altura dos coletores de esporos aumentou (Figura 1). Nesta situação, o melhor ajuste do gradiente de inóculo foi obtido pelo modelo proposto por Gregory (y = 79.011x-0,9973, R2 = 0,88), onde a quantidade de conídios capturados foi inversalmente proporcional a distância da fonte de inóculo. Durante a noite não foi observada essa tendência (Figura 1), sendo que o modelo proposto por Gregory não obteve bom ajuste (y = 609,59x-0,316, R2 = 0,11). Para S. macrospora o número de conídios coletados diminuiu à medida que aumentou a altura dos coletores, tanto de dia (y = 4.108,4x-0,4701, R2 = 0,96) como de noite (y = 2.333,5x-0,9182, R2 = 0,88) (Figura 2), sendo que o modelo de Gregory se ajustou muito bem para explicar a análise de dispersão do inóculo (Campbell & Madden, 1990).
Os dados obtidos demonstraram que mais de 60% dos conídios de S. maydis e S. macrospora foram coletados até altura de 25 cm (Tabelas 1 e 2). Esses valores ajudam a compreender porque as podridões causadas por Stenocarpella sp. em milho apresentam sintomas freqüentes e típicos na base do colmo, normalmente no primeiro e segundo entre-nó. Cabe salientar que esses sintomas também podem ser evidentes no final do ciclo da cultura caso ocorra a transmissão dos fungos da semente para a planta (McGee, 1988; Casa et al., 1998). Com altura superior a 50 cm verificou-se uma coleta de 20 a 30% dos conídios para ambos os fungos, indicando redução de mais de 50% comparando com a altura de até 25 cm. Possivelmente, o tamanho e o peso dos conídios e/ou do cirro inteiro liberado do picnídio ou a altura do respingo do impacto da gotícula d'água sobre o corpo frutífero contendo o inóculo, não permitam que sejam capturados abundantemente a alturas superiores a 25 cm da fonte de inóculo.
Brennan et al. (1985), estudando as características de dispersão por respingos de gotas d'água do fungo S. nodorum, demonstraram que gotas de 5 mm de diâmetro contendo esporos do fungo não são transportadas pelo vento a mais de 40 a 50 cm de altura. Por outro lado, em ensaios de campo, durante período de chuva, os conídios de Pseudocercosporella herpotrichoides (Fron) Deighton (Fitt & Bainbridge, 1983) e S. nodorum (Faulkner & Colhoun, 1976) foram coletados 0,7 e 1,0 m, respectivamente, acima de palha infetada. Tais esporos são liberados pelas gotas da chuva e então transportados pelo vento.
Os conídios de Stenocarpella sp. capturados acima de 50 cm de altura possivelmente são responsáveis por uma das vias de inoculação dos fungos nas espigas, causando a podridão da base da espiga. Nessa situação, na lavoura, os conídios dispersos pelo vento são depositados pela força gravitacional na bainha foliar. Mário et al. (1998) determinaram que os esporos produzidos nos restos culturais foram responsáveis pela infecção de grãos de milho no campo. Na presença de água os esporos germinam e iniciam o processo de penetração direta do tecido vegetal que envolve a palha da espiga em formação (Bensch, 1995). Os conídios de S. macrospora coletados 50 cm acima da fonte de inóculo provavelmente são responsáveis pela infecção das folhas do milho, causando sintoma de mancha foliar.
A viabilidade dos conídios de S. maydis e S. macrospora não foi determinada nesse ensaio. Entretanto, como seus conídios são ricos em melanina, são mais difíceis de perderem a viabilidade, além disso, a freqüência de dias em que os esporos S. maydis e S. macrospora foram capturados (Tabelas 1 e 2) possibilita prever que as unidades de dispersão podem alcançar com maior facilidade os sítios de infecção da planta hospedeira. Outro detalhe fundamental é o processo de produção de conídios e extrusão dos cirros, que ocorre várias vezes na natureza, quando as condições ambientais forem favoráveis. Os picnídios de Stenocarpella sp. podem ser recarregados produzindo inóculo constantemente em grande quantidade, e pode manter, também, o inóculo viável durante longo período de tempo.
Apesar dos conídios de S. macrospora serem duas a três vezes maiores (41-89 x 6-12,5 µm) do que os de S. maydis (15-34 x 4-8 µm) (Sutton & Waterston, 1966a,b; Casa, 1997), os esporos de S. macrospora foram capturados em porcentagem superior nas alturas acima de 50 cm (Tabelas 1 e 2). A presença de conídios isolados (não agrupados em cirro) tanto de S. maydis como S. macrospora capturados nas alturas mais elevadas das armadilhas, tem demonstrado que a dispersão anemófila dos conídios pode ocorrer livremente no ar, não necessitando estar veiculado a gotículas d'água. Em algumas situações tem-se observado em lupa estereoscópica, com aumento de 40 a 50 vezes, conídios de S. maydis e S. macrospora isolados aderidos à palha de milho, mais precisamente próximo ao local onde o picnídio emergiu. Provavelmente, isso decorra após um período de molhamento, quando os conídios no cirro se dissolvem, permitindo que os esporos formem uma fina camada sobre a superfície do hospedeiro (Fitt et al., 1989). A presença desses conídios após um período de secamento da superfície da palha pode constituir-se em unidade de dispersão do inóculo.
Analisando-se o número total de conídios acumulados para ambas espécies de Stenocarpella sp. (Tabelas 1 e 2), verificou-se que 82,7% dos conídios capturados foram de S. maydis. Convém lembrar que os conídios de S. maydis são duas a três vezes menores do que os de S. macrospora e que a densidade de inóculo de S. maydis nos restos culturais correspondeu a 93,3%. Além disso, deve-se considerar a maior freqüência do número de dias de coleta de S. maydis (Tabelas 1 e 2).
Dispersão horizontal
Em 1996 a área correspondente à fonte de inóculo foi de 36 m2 (6 x 6 m), apresentando 257 g de palha/m2 e uma densidade de inóculo de 801 e 284 conídios de S. maydis e S. macrospora respectivamente/ g de palha. No ano de 2000 a área da fonte de inóculo foi de 6,25 m2 (2,5 x 2,5 m), apresentando 208 g de palha/m2, com 601 e 332 conídios de S. maydis e S. macrospora/g de palha, respectivamente.
O número de conídios de S. maydis e S. macrospora coletados no ano de 1996 em função da distância das armadilhas da fonte de inóculo demonstrou que os esporos dos fungos foram capturados nas armadilhas até uma distância de 120 m da fonte de inóculo. O modelo de dispersão de inóculo proposto por Kiyosawa & Shiyomi foi o que melhor se ajustou tanto para S. maydis (y = 30,757e-0,025x, R2 = 0,70) como para S. macrospora (y = 8,6301e-0,0244x, R2 = 0,88), assumindo uma diminuição exponencial da captura de conídios a partir da fonte de inóculo (Figura 3).
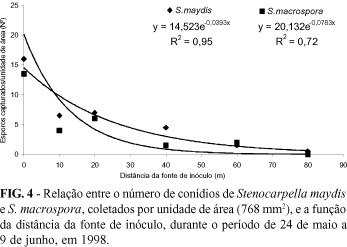
No ano de 2000 os esporos de S. maydis foram capturados até uma distância de 80 m, sendo que S. macrospora foi detectado somente até 60 m da fonte de inóculo. A maior quantidade de esporos foi capturada nas armadilhas localizadas sobre fonte de inóculo, sendo que nas distâncias de 10 a 40 m capturou-se um número semelhante de esporos de S. maydis e de 10 a 20 m de S. macrospora. Nenhum esporo de S. macrospora foi coletado a 80 m de distância da fonte de inóculo (Figura 4). Novamente, o modelo de Kiyosawa & Shiyomi se ajustou melhor para expressar o gradiente de dispersão de S. maydis (y =14,523e-0,0393x, R2 = 0,95) e de S macrospora (y = 20,132e-0,0783x, R2 = 0,72) (Figura 4).
De modo geral, os dois experimentos demonstraram que a concentração de esporos coletados diminuiu exponencialmente com a distância horizontal da fonte de inóculo. Apesar de ter-se capturado esporos distantes 80 e 120 m da palha infetada, presume-se que, considerando a freqüência e o pequeno número de esporos coletados, dificilmente seriam suficientes para causar uma epidemia da doença em lavouras posicionadas a mais de 80 m da fonte de inóculo.
A captura dos conídios de Stenocarpella spp. nos dois anos coincidiu com períodos de dias chuvosos e com dias sem haver precipitação pluvial. Naqueles dias onde a chuva perdurou durante horas, pode ter havido dispersão horizontal por respingos principalmente para as armadilhas posicionadas sobre a fonte de inóculo. Segundo Madden (1997), a distância de transporte de conídios por respingo é muito curta, geralmente menor que 15 cm, e, portanto, a deposição dos esporos num sítio de infecção é o resultado de uma seqüência contínua de respingos sobre a superfície do solo ou cobertura do solo e através do dossel. Distâncias de 5 a 10 m foram relatadas para a dispersão de conídios por respingos de chuva dos fungos Ascochyta pisi Lib. (Hewet, 1973) e S. nodorum (Griffiths & Hann, 1976). Nesses exemplos, o inóculo dos fungos estava veiculado a gotículas d'água e, possivelmente, a turbulência e as rajadas de vento forte facilitaram sua dispersão.
Madden (1997), salienta que a dispersão dos esporos por respingos de chuva tem sido pouco estudada se comparada com a dispersão pelo vento. No entanto, neste trabalho de dispersão horizontal de S. maydis e S. macrospora, devido ao tipo de armadilha utilizada e distâncias monitoradas, tornou-se mais evidente que os esporos foram transportados livremente pelo vento até serem capturados pelo impacto nas lâminas das armadilhas. Além disso, houve seqüências de dias sem chuva e mesmo assim os esporos dos fungos foram capturados, prova que não necessita do veículo água. Tal fato também foi demonstrado na dispersão vertical, quando os esporos de S. maydis e S. macrospora foram capturados no ar, não veiculados a gotículas d'água, individualmente ou agrupados em cirro, até uma altura de 2 m acima da fonte de inóculo.
Os resultados obtidos em 1996 sugerem que lavouras conduzidas em rotação de culturas, distantes acima de 120 m dos restos culturais infetados, podem apresentar menor incidência das podridões do colmo e da espiga causada por Stenocarpella sp. A mancha foliar causada por S. macrospora possivelmente apresentará a mesma resposta em relação a sua ocorrência e intensidade. Como os esporos de S. macrospora são duas a três vezes maiores do que os de S. maydis, a distância de transporte dos conídios de S. macrospora pelo vento, provavelmente será menor. Logicamente, o efeito barreira das plantas de milho ou de outras espécies vegetais pode contribuir ainda mais para reduzir a distância de transporte do inóculo. Ullstrup (1964) e Del Río & Melara (1991), demonstraram que a intensidade da podridão da espiga causada por S. maydis relaciona-se inversamente à distância da fonte de inóculo. Ullstrup (1964) relatou incidência da podridão de 49 a 61% em lavoura localizada ao lado da fonte de inóculo, com redução da incidência para 1% em plantas localizadas até 16 m da fonte de inóculo. Del Río & Melara (1991) relataram redução de 80% na podridão da espiga em plantas distantes 20 m da palha infetada.
Aceito para publicação em 19/11/2003
Autor para correspondência: Ricardo Trezzi Casa
- ALEXOPOULOS, C.J. & MIMS, C.W. Introductory mycology. 3rd ed. New York: John Wiley & Sons. 1979.
- AYLOR, D.E. The role of intermittent wind in the dispersal of fungal pathogens. Annual Review of Phytopathology 28:73-92. 1990.
- BENSCH, M.J. Stenocarphella maydis (Berk.) Sutton colonization of maize ears. Journal of Phytopathology 143:597-599. 1995.
- BRENNAN, R.M., FITT, B.D.L., TAYLOR, G.S. & COLHOUN, J. Dispersal of Septoria nodorum pycnidiospores by simulated rain in still air. Phytopathologische Zeitschrift 112:281-290. 1985.
- CAMPBELL, C.L. & MADDEN, L.V. Spatial as pects of plant disease epidemics I: dispersal gradients and long-range transport. In: Cambell, C.L. & Madden, L.V. (Eds.). Introduction to plant disease epidemiology. A Wiley-Interscience Publication. John Wiley & Sons, Inc. 1990. pp.253-287.
- CASA, R.T. Diplodia maydis e Diplodia macrospora associados à semente de milho. Dissertação de Mestrado. UFV, Viçosa, MG. 1997.
- CASA, R.T., ZAMBOLIM, L. & REIS, E.M. Transmissão e controle de diplodia em sementes de milho. Fitopatologia Brasileira 23:436-441. 1998.
- DE FINA, A.L. & RAVELLO, A.C. Climatología y fenología agrícolas. Eudeba, Editorial Universitária de Buenos Aires. 1972.
- DEL RÍO, L. & MELARA, W. Dispersion de Stenocarpella maydis (Berk.) Sutton en un cultivo de maíz. Ceiba 32:133-140. 1991.
- FAULKNER, M.J. & COLHOUN, J. Aerial dispersal of picnidiospores of Leptosphaeria nodorum Phytopathologische Zeitschrift 86:357-360. 1976.
- FITT, B.D.L. & BAINBRIDGE, A. Dispersal of Pseudocercosporella herpotrichoides spores from infected wheat straw. Phytopathologische Zeitschrift 106:177-182. 1983.
- FITT, B.DL., McCARTNEY, H.A. & WALKATE, P.J. The role of rain in dispersal pathogen inoculum. Annual Review of Phytopathology 27:241-270. 1989.
- FLETT, B.C. & WEHNER, F.C. Incidence of Stenocarpella and Fusarium cob rots in monoculture maize under different tillage systems. Journal of Phytopathology 133:327-333. 1991.
- FLETT, B.C., WEHNER, F.C. & SMITH, M.F. Relationship between maize stuble placement in soil and survival of Stenocarpella maydis (Diplodia maydis). Journal of Phytopathology 134:33-38. 1992.
- FOURNET, J. Propriétés et rôle du cirrhe du Septoria nodorum Berk. Annual Phytopathology 1:87-94. 1969.
- FREDERICKSON, D.E., MANTLE, P.G. & DE MILLIANO, W.A.J. Secondary conidiation of Sphacelia sorghi on sorghum, a movel factor in the epidemiology of ergot disease. Mycological Research 93:497-502. 1989.
- GRIFFITHS, D.C. & HANN, C.A.O. Dispersal of Septoria nodorum spores and spread of glume blocth of wheat in the field. Transactions of the British Mycological Society 67:413-418. 1976.
- HEWETT, P.D. The field behaviour of seedborne Ascochyta fabae and disease control in field beans. Annals of Applied Biology 74:287-295. 1973.
- INGOLD, C.T. Fungal spores: Their liberation and dispersal. Clarendon Press. Oxford University Press, Ely House. London. 1971.
- MADDEN, L.V. Effects of rain splash dispersal of fungal pathogens. Canadian Journal of Plant Pathology 19:225-230. 1997.
- MARASAS, W.F.O. & VAN DER WESTHUIZEN, G.C.A. Diplodia macrospora: the cause of leaf blight and cob rot of maize (Zea mays) in South Africa. Phytophyllactica 11:61-64. 1979.
- MÁRIO, J.L., REIS, E.M. & SEVERO, R. Quantificação do inóculo de Diplodia macrospora e de D. maydis em restos culturais, no ar e sua relação com a infecção em grãos de milho. Fitopatologia Brasileira 23:301. 1998. (Resumo)
- McGEE, D.C. Maize diseases: A reference source for seed technologists. St. Paul: The American Phytophathological Society. 1988.
- REIS, E.M. & CASA, R.T. Manual de identificação e controle de doenças de milho. Passo Fundo. Aldeia Norte Editora, 1996.
- REIS, E.M. & SANTOS, H.P. dos. População de Helminthosporium sativum no ar através de uma armadilha tipo cata-vento. Fitopatologia Brasileira 10:515-519. 1985.
- SUTTON, B.C. The coelomycetes. Commonwealth Mycological Institute, Kew, Surrey, England. 1980.
- SUTTON, B.C. & WATERSTON, J.M. Diplodia maydis London: C.M.I. (Descriptions of pathogenic fungi and bacteria, 84) 1966a. .
- SUTTON, B.C. & WATERSTON, J.M. Diplodia macrospora London: C.M.I. (Descriptions of pathogenic fungi and bacteria, 83).1966b.
- ULLSTRUP, A.J. Observations on two ephiphytotics of Diplodia ear rot of corn in Indiana. Plant Disease 48:414-415. 1964.
- WHITE, D.G. Compendium of corn diseases. Third Edition. Americam Phytopathological Society. APS Press. St. Paul, Minnesota, USA. 1999.
Datas de Publicação
-
Publicação nesta coleção
27 Abr 2004 -
Data do Fascículo
Abr 2004