Resumos
Os padrões fenológicos da vegetação arbórea do cerrado, savanas e demais formações florestais periodicamente secas ainda são pouco conhecidos, assim como são ainda obscuras as causas da periodicidade observada, ora atribuída a fatores abióticos, ora a fatores bióticos, ou a ambos, ou ainda determinada por restrição filogenética. Em uma área de cerrado marginal no extremo nordeste do Maranhão foram estudadas, durante vinte e dois meses, as dez espécies de leguminosas arbóreas mais freqüentes. As observações foram mensais em uma amostra de dez indivíduos por espécie. Nestas leguminosas, tanto o crescimento vegetativo quanto o reprodutivo são eventos periódicos e sazonais e, na maioria das espécies, a floração ocorre durante a estação seca sendo simultânea à renovação das folhas. Três padrões fenológicos podem ser distinguidos: espécies que renovam suas folhas e florescem precocemente na seca, frutificam e dispersam seus propágulos ainda nesta estação (1), espécies que renovam suas folhas tardiamente na seca e florescem nesta ocasião (2) ou florescem na estação chuvosa (3), frutificando na estação chuvosa e dispersando seus propágulos na seca subseqüente. Períodos de atividade de crescimento vegetativo e dormência alternam-se, aparentemente mais sincronizados com as variações no fotoperíodo, termoperíodo e irradiância do que com as variações sazonais na disponibilidade hídrica. Os padrões fenológicos assim como os períodos de floração e de frutificação variam entre as famílias consideradas como monofiléticas, sendo a única convergência neste nível taxonômico a sincronização da dispersão de propágulos com a estação seca. A reprodução vegetativa parece não ser um evento comum nas leguminosas estudadas.
The phenological patterns of trees from cerrado, savannah and others seasonally dry forest are not well known and causes for observed periodicity are still obscure; it is said to be caused either by abiotic factors like precipitation or to biotic ones or even both, or also enforced by phylogenetic restriction. In an area of cerrado in the far northeast of Maranhão, the ten most frequent leguminous trees were monitored during twenty-two months. The phenological records were made montly in a sample of ten individuals of each species. Either vegetative or reproductive growth are periodical and seasonal events and in the most species flowering occur during the dry season simultaneous to leaves renewal. Most species produce fruits during the wet period and the propagules are dispersed almost exclusively during the dry one. Tree phenological patterns are discernible: species that renew their leaves and bloom early during the dry season, fruiting and dispersing their propagules at the same season (1), species that renew their leaves late in the dry season, flowering at this time (2) or flowering during the wet season (3), fruiting in the wet period and dispersing their propagules during the following dry one. Periods of vegetative growth and dormancy seem to occur alternately more synchronised with variation of the photoperiod, thermoperiod, and irradiance, than seasonal variations of water availability. Phenological patterns, flowering and fruting periods vary inter and intra families considered as monophyletic, being the only convergence, at this taxonomic level, the synchronisation of thepropagules dispersal in the dry season. The vegetative reproduction does not seem to be a common event in the leguminous species studied.
Phenology; leguminous; cerrado; Maranhão
Fenologia de leguminosas arbóreas em uma área de cerrado marginal no nordeste do Maranhão
CLARISSA F. BULHÃO 1 1 . Universidade de Brasília,Departamento de Botânica, Caixa Postal 04457, 70919-970 Brasília, DF, Brasil. e PAULO S. FIGUEIREDO 2 1 . Universidade de Brasília,Departamento de Botânica, Caixa Postal 04457, 70919-970 Brasília, DF, Brasil. ,3 1 . Universidade de Brasília,Departamento de Botânica, Caixa Postal 04457, 70919-970 Brasília, DF, Brasil.
(recebido: 30 de maio de 2001; aceito: 5 de junho de 2002)
ABSTRACT (Phenology of leguminous trees in an area of cerrado in the northeast of Maranhão). The phenological patterns of trees from cerrado, savannah and others seasonally dry forest are not well known and causes for observed periodicity are still obscure; it is said to be caused either by abiotic factors like precipitation or to biotic ones or even both, or also enforced by phylogenetic restriction. In an area of cerrado in the far northeast of Maranhão, the ten most frequent leguminous trees were monitored during twenty-two months. The phenological records were made montly in a sample of ten individuals of each species. Either vegetative or reproductive growth are periodical and seasonal events and in the most species flowering occur during the dry season simultaneous to leaves renewal. Most species produce fruits during the wet period and the propagules are dispersed almost exclusively during the dry one. Tree phenological patterns are discernible: species that renew their leaves and bloom early during the dry season, fruiting and dispersing their propagules at the same season (1), species that renew their leaves late in the dry season, flowering at this time (2) or flowering during the wet season (3), fruiting in the wet period and dispersing their propagules during the following dry one. Periods of vegetative growth and dormancy seem to occur alternately more synchronised with variation of the photoperiod, thermoperiod, and irradiance, than seasonal variations of water availability. Phenological patterns, flowering and fruting periods vary inter and intra families considered as monophyletic, being the only convergence, at this taxonomic level, the synchronisation of thepropagules dispersal in the dry season. The vegetative reproduction does not seem to be a common event in the leguminous species studied.
RESUMO (Fenologia de leguminosas arbóreas em uma área de cerrado marginal no nordeste do Maranhão). Os padrões fenológicos da vegetação arbórea do cerrado, savanas e demais formações florestais periodicamente secas ainda são pouco conhecidos, assim como são ainda obscuras as causas da periodicidade observada, ora atribuída a fatores abióticos, ora a fatores bióticos, ou a ambos, ou ainda determinada por restrição filogenética. Em uma área de cerrado marginal no extremo nordeste do Maranhão foram estudadas, durante vinte e dois meses, as dez espécies de leguminosas arbóreas mais freqüentes. As observações foram mensais em uma amostra de dez indivíduos por espécie. Nestas leguminosas, tanto o crescimento vegetativo quanto o reprodutivo são eventos periódicos e sazonais e, na maioria das espécies, a floração ocorre durante a estação seca sendo simultânea à renovação das folhas. Três padrões fenológicos podem ser distinguidos: espécies que renovam suas folhas e florescem precocemente na seca, frutificam e dispersam seus propágulos ainda nesta estação (1), espécies que renovam suas folhas tardiamente na seca e florescem nesta ocasião (2) ou florescem na estação chuvosa (3), frutificando na estação chuvosa e dispersando seus propágulos na seca subseqüente. Períodos de atividade de crescimento vegetativo e dormência alternam-se, aparentemente mais sincronizados com as variações no fotoperíodo, termoperíodo e irradiância do que com as variações sazonais na disponibilidade hídrica. Os padrões fenológicos assim como os períodos de floração e de frutificação variam entre as famílias consideradas como monofiléticas, sendo a única convergência neste nível taxonômico a sincronização da dispersão de propágulos com a estação seca. A reprodução vegetativa parece não ser um evento comum nas leguminosas estudadas.
Key words - Phenology, leguminous, cerrado, Maranhão
Introdução
A fenologia da vegetação arbórea, do cerrado e de savanas, tem sido abordada por vários autores, sob diferentes enfoques e em diferentes localidades (Hopkins 1970, Sarmiento & Monasterio 1983, Sarmiento 1984, Sarmiento et al. 1985, Mantovani & Martins 1988, Miranda 1995, Penhalber & Mantovani 1997, Oliveira 1998, Batalha & Mantovani 2000).
Na maioria das espécies o crescimento é periódico e sazonal e, embora predomine o hábito sempre verde (Sarmiento et al. 1985), hábito decíduo ou semidecíduo é freqüente, com a renovação das folhas ocorrendo na estação seca (Hopkins 1970, Mantovani & Martins 1988, Seghieri et al. 1995, Miranda 1995, Oliveira 1998, Batalha & Mantovani 2000). Espécies em flor podem ser encontradas durante todo o ano, sendo que a maioria floresce na estação seca de acordo com Frankie et al. (1974), Monasterio & Sarmiento (1976) e Miranda (1995), ou no início da estação chuvosa, como indicam os resultados de Oliveira (1998) e Batalha & Mantovani (2000). A frutificação é sazonal, sendo os frutos carnosos zoocóricos geralmente produzidos durante a estação chuvosa e os secos, anemo ou autocóricos, durante a seca (Oliveira 1998, Batalha & Mantovani 2000), o que deve impor uma sazonalidade correspondente no período de dispersão de tipos de diásporos. A germinação e o estabelecimento das plantas são sazonais, restritos à estação chuvosa (Oliveira 1998).
A aparente correlação entre atividade e disponibilidade de água sugere que a seca sazonal, atuando como um fator limitante para o crescimento, seja um dos principais fatores ambientais determinantes dos padrões fenológicos. Além disto, como ressaltado por Mooney & Dunn (1970), sua periodicidade e as variações anuais em intensidade e duração, devem exercer um profundo efeito na evolução de respostas adaptativas.
Em espécies arbóreas de florestas tropicais periodicamente secas, a restrição hídrica durante a seca sazonal parece ser, de fato, o principal fator determinante da sazonalidade da fenodinâmica foliar (Njoku 1963, Lord Medway 1972, Daubenmire 1972, Frankie et al. 1974, Lieberman 1982, Borchert 1983, Reich & Borchert 1984, Bullok & Sollis-Magallanes 1990, Borchert 1992, 1994, Reich 1995, Penhalber & Mantovani 1997). No entanto, a floração e o brotamento durante a seca, em algumas espécies, têm sido considerados como aparentes paradoxos (Sarmiento 1984, Borchert 1994). Se a reprodução e o crescimento vegetativo não são limitados pela disponibilidade de água na seca, sua periodicidade pode ser modulada por outros fatores ambientais como o foto, o termoperíodo ou o fogo, que também variam sazonalmente (Huxley & Van Eck 1974, Coutinho 1976, Seghieri et al. 1995). O fato de que as espécies variam com relação à sua sensibilidade a estes fatores ambientais poderia explicar a ocorrência de padrões fenológicos divergentes, como o de espécies sempre-verdes com crescimento quase contínuo, ou diferentes períodos de floração.
Do ponto de vista evolutivo, tem sido argumentado, ainda, que a periodicidade em espécies arbóreas de florestas tropicais sazonais constitui uma estratégia adaptativa, selecionada tanto por pressões abióticas quanto bióticas (Lieberman & Lieberman 1984, Rathcke & Lacey 1985, Van Schaik et al. 1993, Reich 1995). Assim, menor pressão de herbivoria selecionaria para rebrota sincronizada na estação seca (Aide 1992, 1993), enquanto condições mais favoráveis para transferência de pólen e maior disponibilidade de polinizadores podem selecionar para floração sazonal e sincronizada nesta estação (Janzen 1967).
Alguns autores têm postulado que a limitação sazonal do período de floração e possivelmente os padrões fenológicos são determinados filogeneticamente (restrição filogenética) e fortemente influenciados pela forma de vida, sendo relativamente independentes de fatores bióticos (Kochmer & Handel 1986, Johnson 1992), ou mesmo dos abióticos como precipitação (Wright & Calderon 1995). Desta maneira, dentro de uma determinada forma de vida, espécies mais relacionadas filogeneticamente tenderiam a convergir com relação a essas características.
O objetivo deste trabalho foi descrever os padrões fenológicos em espécies filogeneticamente mais relacionadas, na tentativa de diagnosticar as causas da periodicidade dos eventos fenológicos nas espécies arbóreas de regiões sazonalmente secas.
Material e métodos
Área de estudo - Este trabalho foi realizado entre abril de 1998 e fevereiro de 2000, numa reserva particular de cerrado (3º20'41" S e 42º52'07" W), pertencente à Comercial e Agrícola Paineras Ltda. A área total da reserva é de aproximadamente 15.000 ha e compreende vários fragmentos de vegetação em diferentes níveis de conservação devido à influência antrópica. A área escolhida corresponde a um fragmento de 1.255,07 ha, localizado na altitude de 91 m no município de Santa Quitéria (MA), e consiste de uma chapada entrecortada por vales que abriga um cerrado sensu stricto com algumas manchas de cerradão.
O clima da região é do tipo AWI (classificação de Köppen) ou tropical quente e úmido, com precipitação média anual de 1.500 mm e uma estação chuvosa de janeiro a junho e de estiagem de julho a dezembro (IBGE 1984, Eiten 1994). Os dados de precipitação foram obtidos através de pluviômetros instalados na área de estudo. A temperatura diária foi obtida através de termômetros instalados no município de Urbano Santos, a aproximadamente 80 km da área de estudo (3º13'02" S e 43º23'56" W), sendo plotados os valores médios mensais considerando os anos de 1997, 1998 e 1999. Os dados de fotoperíodo e irradiância para as coordenadas da área de estudo foram fornecidos pelo Instituto Astronômico e Geofísico de São Paulo.
Material botânico - Foram estudadas as dez espécies de leguminosas arbóreas mais freqüentes na área, listadas a seguir. Família Caesalpiniaceae: Dimorphandra gardneriana Tul. (fava d'anta), Hymenaea stigonocarpa Mart. var. pubescens Benth. (jatobá), Sclerolobium aureum (Tul.) Benth. (paupombo). Família Mimosaceae: Parkia platycephala Benth. (fava de bolota), Plathymenia foliolosa Benth. (candeia), Stryphnodendron coriaceum Benth. (barbatimão). Família Fabaceae: Bowdichia virgilioides Kunth (sucupira), Dalbergia sp. (violeta), Dipteryx alata Vogel (garampara), Vatairea macrocarpa (Benth.) Ducke (amargoso). As exsicatas correspondentes às espécies estudadas foram depositadas na coleção botânica do Departamento de Biologia da UFMA, respectivamente sob os números de registro de 1.040 a 1.049, sendo que Dalbergia sp. foi coletada por E.C. Girnos, s.n.
Fenologia - Os dados fenológicos foram obtidos numa amostra de dez indivíduos por espécie, os quais foram marcados e numerados seqüencialmente determinando-se, mensalmente, a proporção da copa com folhas, flores e frutos no período de abril de 1998 a fevereiro de 2000. Para Vatairea macrocarpa, Dalbergia sp. e Bowdichia virgilioides, os dados fenológicos da reprodução foram obtidos em dois ou três indivíduos por espécie, já que a maioria dos indivíduos na área de estudo, incluindo os indivíduos marcados, não floresceram durante o período de observação. Os dados foram agrupados em classes de intervalo de acordo com o método de Fournier (1974, apud Ribeiro & Castro 1986).
A estimativa da Intensidade da Fenofase (IF) foi expressa como uma média dos valores da proporção de indivíduos nas diferentes classes, de acordo com a expressão a seguir:
IF =
WiPi, N =
ni
Pi = ni / N
Onde:
IF = Intensidade da fenofase
i = classes de intervalo
Wi = proporção da copa na fenofase
Pi = proporção de indivíduos na classe i
N = número de plantas amostradas
ni = número de plantas em cada classe i
Dessa forma, atribui-se o valor máximo (IF = 1) quando todos os indivíduos amostrados da espécie apresentam a totalidade da copa na fenofase.
Para definição do hábito, considerou-se como sempre-verdes aquelas espécies em que o IF referente a folhas foi sempre superior a 0,5 durante os dois anos consecutivos. Como semidecíduas aquelas em que o IF atingiu ocasionalmente valores entre 0,3 e 0,5 e cuja maioria dos indivíduos manteve parte das folhas neste período. Como decíduas, aquelas em que o IF atingiu ocasionalmente valores iguais ou inferiores a 0,2, sendo que a maioria dos indivíduos perdeu a totalidade das folhas neste período. Em todos os casos não foi levada em consideração a redução do IF como conseqüência do fogo.
A dispersão das sementes foi estimada indiretamente, computando-se a variação mensal de frutos maduros ou do total de frutos produzidos por planta. Durante a fase inicial da frutificação, quando o número de frutos aumenta com o tempo, estimou-se a dispersão como a variação mensal do total de frutos maduros. Posteriormente, quando o número de frutos diminui com o tempo, estimou-se a dispersão como a variação mensal do total de frutos produzidos. Em ambos os casos a dispersão foi estimada considerando-se:
IFD = Ft1 Ft2 , desde que Ft1 > Ft2
Onde:
IFD = Intensidade da fenofase dispersão
F = frutos maduros ou frutos totais
t1 ¾ t2= intervalo de temposucessivo
Reprodução vegetativa - A reprodução vegetativa foi verificada expondo as raízes superficiais das árvores para evidenciar conexões de órgãos subterrâneos entre indivíduos e/ou brotamentos posteriores. De um a três indivíduos por espécie foram escavados na base até a profundidade de 0,5 a 1 m. Na ocorrência de ramificações superficiais, estas foram seguidas, expostas e observadas mensalmente.
Resultados
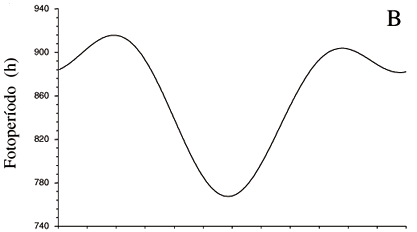
A precipitação na região pode sofrer grandes variações interanuais seguindo-se anos relativamente mais secos como os de 1997 e 1998, com 899 e 968 mm de precipitação respectivamente, e atingindo valores próximos à média da região no ano de 1999, com 1.530 mm de precipitação anual. Durante os três anos de observação, o período de maior precipitação, que caracteriza a estação chuvosa, ocorreu de dezembro a maio. O período de menor precipitação, com uma precipitação mensal inferior a 50 mm de chuva que caracteriza a estação seca, ocorreu de junho a novembro (figura 1a). O fotoperíodo, o termoperíodo e a irradiância também variam sazonalmente, embora exibam uma pequena amplitude de variação. Tanto o comprimento do dia quanto a irradiância aumentam durante a estação seca, período em que se verificam também aumentos nas temperaturas mínimas e máximas mensais assim como na amplitude térmica. O oposto se verifica durante a estação chuvosa (figuras 1b, 1c, 1d).
Quanto à renovação das folhas, as leguminosas estudadas exibem um padrão semidecíduo e sazonal. Na maioria das espécies, a interrupção da produção de novas folhas tem início ainda na estação chuvosa, nos meses de abril e maio. A abscisão, que na maioria das espécies coincide com os primeiros meses da seca em julho, atinge um máximo no meio da estação nos meses de agosto, setembro e outubro. Em geral, a rebrota e expansão inicial das folhas ocorrem ainda nesta estação, entre os meses de outubro e novembro, antes das primeiras chuvas (figura 2a).
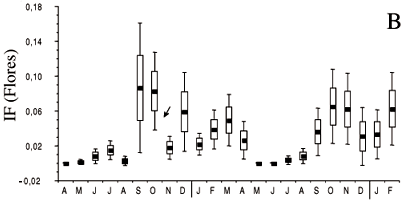
Na figura 2b observa-se que a floração foi um evento discreto podendo ser distinguidos dois períodos de máxima floração. O principal período, quanto ao número de espécies em flor e de flores na comunidade, ocorre sincronizado com a estação seca de agosto a dezembro, com um pico aparente no meio da estação entre os meses de setembro e novembro. Um outro período de floração de menor intensidade ocorre durante a estação chuvosa, de janeiro a abril, com um pico aparente no meio da estação, em março. Na maioria das espécies que floresce na seca, a floração se manifesta em plantas sem folhas, ou com um número mais reduzido delas. A abscisão das folhas antecede a floração a qual precede ou é simultânea à rebrota. Nas espécies que florescem na estação chuvosa, a renovação das folhas ocorre também na estação seca e a floração se manifesta em plantas com a totalidade ou quase totalidade das folhas (figuras 2a, 2b).
Na figura 2c observa-se que, em geral, a frutificação se inicia na estação chuvosa, em janeiro, estendendo-se até os primeiros meses da seca em agosto e setembro. Um pico aparente ocorre no final da estação chuvosa e início da seca, entre os meses de maio a agosto.
Os diásporos são dispersos quase que exclusivamente durante a seca, entre os meses de maio e novembro, com um pico aparente no meio desta estação, em setembro (figura 2d).
O fogo, em outubro de 1998, ocorreu no final da estação seca coincidindo com o início do brotamento na maioria das espécies. Seu efeito na comunidade foi o de reduzir significativamente o número de folhas e retardar o brotamento e a renovação da biomassa foliar. Essa se renovou gradativamente durante as chuvas e só se recompôs totalmente no meio da estação chuvosa em abril de 1999 (figura 2a).
O fogo, ocorrendo no período de maior floração, reduz significativamente o número de flores (figura 2b) afetando a reprodução na estação subseqüente. Na própria estação sucedeu o principal período de frutificação (figura 2c) e o de dispersão dos diásporos (figura 2d), não manifestando um efeito direto perceptível nestes eventos fenológicos.
Na figura 3 observa-se que três padrões fenológicos (grupos) podem ser distinguidos de acordo com a distribuição temporal dos eventos fenológicos como a renovação das folhas, a floração, a frutificação e a dispersão dos diásporos. No grupo I estão as espécies como Bowdichia virgilioides, Vatairea macrocarpa e Dalbergia sp., cuja reprodução não ocorre anualmente. Nessas espécies, a abscisão das folhas precede a floração precoce na seca com os indivíduos frutificando e dispersando seus diásporos no meio desta estação. No grupo II (Sclerolobium aureum, Plathymenia foliolosa e Stryphnodendron coriaceum) a abscisão das folhas precede a floraçãotardia na seca, com os indivíduos frutificando na estação chuvosa e dispersando seus diásporos na estação seca subseqüente. No grupo III (Hymenaea stigonocarpa, Dimorphandra gardneriana e Dipteryx alata ),a renovação das folhas é tardia na seca e a floração e a frutificação ocorrem durante a estação chuvosa, seguidas pela dispersão dos diásporos na estação seca subseqüente.
Parkia platycephala apresenta uma variação. Sua reprodução é aparentemente anual e a abscisão das folhas ocorre tardiamente na seca, após a reprodução, contrastando com as demais espécies. A distribuição temporal dos eventos reprodutivos na seca, como o período de floração, frutificação e dispersão dos diásporos permite, entretanto, enquadrá-la no grupo I.
O hábito, o período de floração e o de frutificação variam entre espécies de uma mesma família e entre as famílias. O mesmo não ocorre com o período de dispersão de diásporos que ocorre predominantemente durante a seca. Padrões fenológicos também variam dentro das famílias, cujas espécies exibem ao menos dois padrões distintos. Embora espécies de famílias diferentes possam compartilhar padrões fenológicos, estes divergem consideravelmente entre as famílias.
As observações sobre a ocorrência de reprodução vegetativa mostraram que poucas espécies exibem raízes diagravitrópicas que crescem paralelamente à superfície do solo. São elas: P. foliolosa, D. gardneriana, H. stigonocarpa e S. aureum Dessas, somente H. stigonocarpa apresentou brotamento nas raízes nos meses subseqüentes à exposição e à injúria provocada, evidenciando reprodução vegetativa.
Discussão
Segundo Reich & Borchert (1984) e Borchert (1994), hábito sempre-verde ou decíduo em ambientes sazonalmente secos representam extremos de um gradiente determinado pelo teor de água das plantas durante a estação seca. Nas espécies decíduas, as árvores com maior densidade no lenho e folhas menos coriáceas teriam menor capacidade de retenção de água, ou seja: seriam mais sensíveis à deficiência hídrica. Holbrook et al. (1995) acrescentam que nas espécies sempre-verdes desses ambientes, maior tolerância à deficiência hídrica seria conseqüência de uma combinação de raízes mais profundas, maior massa foliar por área, escleromorfismo e maior capacidade de transporte de água no xilema.
Nas leguminosas estudadas, as espécies sempreverdes aparentam maior tolerância à deficiência hídrica renovando parcialmente as folhas tardiamente na seca, enquanto a maioria das semidecíduas renovaas precocemente. As espécies caracterizadas como decíduas ou semidecíduas com renovação tardia das folhas na seca, como Parkia platycephala, Plathymenia foliolosa e Dimorphandra gardneriana, podem tratar-se de sempre-verdes facultativas. De acordo com Borchert (1994), deciduidade em espécies sempreverdes pode ser provocada pela maior desidratação das árvores em anos rigorosamente secos, ou pela ocorrência em microsítios mais secos. Deciduidade pode, também, ser causada pelo fogo, fato que foi observado em espécies sempre-verdes, como Sclerolobium aureum e Dipterix alata no ano de 1998. Assim, correlações envolvendo o hábito devem ser tomadas com cautela, já que o grau de deciduidade entre indivíduos numa população e entre populações de uma espécie pode variar temporal e espacialmente. Essa variação talvez possa explicar os resultados aparentemente conflitantes, como os de Franco (2000) que indicam uma tendência de espécies sempre-verdes no cerrado possuírem sistema radicular mais superficial.
Tanto nas espécies sempre-verdes quanto nas decíduas ou semidecíduas, a retomada do crescimento ainda na seca indica que a restrição de água durante a estação não é severa, aspecto já ressaltado por vários autores referindo-se às espécies arbóreas em geral no cerrado (Ferri 1944, Rawistcher 1948, Rizzini 1976, Oliveira 1998). A redução da transpiração, ocasionada pela abscisão das folhas, e a utilização de água residual podem permitir reidratação e retomada do crescimento na estação, fato que assegura uma relativa independência da precipitação desse período (Reich & Borchert 1984, Borchert 1994, Reich 1995).
Embora a restrição hídrica possa induzir abscisão das folhas e a rebrota na seca possa depender da reidratação dos tecidos, déficit hídrico não deve ser considerado como o fator indutor da sazonalidade observada. A abscisão e queda das folhas no início da seca é precedida da redução da atividade de crescimento nos meristemas apicais da parte aérea, manifestada pela interrupção da produção de novas folhas, ainda na estação chuvosa. Se a água não constitui um fator limitante, essas gemas manifestam dormência, e não quiescência como tem sido sugerido para espécies arbóreas de florestas tropicais periodicamente secas (Borchert 1994); um estado fisiológico de repouso freqüentemente acompanhado da desidratação dos tecidos que, todavia, não é interrompido pela mera reidratação, embora possa coincidir com ela.
A floração foi um evento discreto durante os dois anos de observação, um reflexo tanto do pequeno número de indivíduos em flor quanto do reduzido número de flores por indivíduo. A limitação da produção de flores pode ser conseqüência de uma possível deficiência hídrica nos solos submetidos à seca mais rigorosa, como sugerido por Seghieri et al. (1995) para espécies arbóreas de savanas africanas no nordeste da República de Camarões. O mesmo fator pode, também, ser responsável pela ausência de floração nas espécies que não se reproduzem anualmente, como Vatairea macrocarpa, Bowdichia virgilioides e Dalbergia sp.
A floração nas leguminosas segue um padrão que pode ser considerado bi ou trimodal. A maioria das espécies floresce durante o final do inverno/início da primavera formando um contínuo, porém com espécies de floração precoce ou tardia na seca, enquanto algumas poucas espécies florescem no verão/outono, durante a estação chuvosa. Em geral, a floração na seca ocorre após a abscisão das folhas e quebra da dormência nos meristemas apicais da parte aérea das plantas, precedendo ou coincidindo com a retomada do crescimento vegetativo. Essa seqüência de eventos fenológicos durante a seca, um padrão típico de espécies arbóreas decíduas de florestas menos secas, savanas e cerrados (Opler et al. 1980, Lieberman 1982, Sarmiento & Monasterio 1983, Miranda 1995, Bullock 1995), tem sido tomada como evidência de que a floração, ou a antese, seja induzida por reidratação ocasionada pela redução da transpiração e utilização de água residual (Borchert 1994).
A floração na primavera, no auge da seca, parece ser o padrão majoritário da vegetação arbórea do cerrado e de savanas de latitudes próximas ao equador (Sarmiento & Monasterio 1983, Miranda 1995, P.S. Figueiredo, dados não publicados). Em latitudes mais ao sul, como nos cerrados do planalto central (Oliveira 1998) e áreas disjuntas no sudeste (Batalha & Mantovani 2000), a floração na primavera coincide com o início das chuvas. Esse fato sugere que a floração na primavera independe do regime pluviométrico da região e que a indução floral é decorrente deoutros fatores que não a reidratação dos tecidos. Ofato de que, em Parkia platycephala, a floração na seca anteceda a abscisão das folhas, corrobora esta hipótese.
Nas leguminosas estudadas, crescimento vegetativo e dormência alternam-se, aparentemente mais sincronizados com as variações no fotoperíodo, irradiância e temperatura da região do que com o regime hídrico. A dormência e abscisão das folhas ocorrem sob dias progressivamente mais curtos, com menor irradiância e temperaturas mais baixas do outono/inverno, ainda na estação chuvosa; enquanto maior atividade de crescimento e reprodução ocorrem, em geral, sob as condições opostas durante a seca. Na maioria das espécies arbóreas de regiões temperadas que manifestam um fenoritmo semelhante, dormência durante o inverno frio e seco seguida de floração na primavera, o fotoperíodo e a temperatura têm sido considerados os principais fatores indutores desta periodicidade. A predominância desse fenoritmo nas leguminosas arbóreas do cerrado argumenta a favor da hipótese de que as plantas de regiões tropicais ou equatoriais sejam sensíveis às pequenas variações nesses fatores, devendo ser melhor investigado o efeito dos mesmos tanto na indução quanto na quebra da dormência e na floração.
Sazonalidade em relação à floração também não pode ser atribuída ao fogo, como ocorre em várias espécies herbáceas e subarbustivas (Coutinho 1976). O fogo só antecedeu a floração nas espécies que floresceram na estação chuvosa e, nestas, a floração ocorreu mesmo quando não houve queimadas. Seu efeito é o de acentuar a sazonalidade da fenodinâmica foliar e, ocorrendo geralmente no final da seca no auge da floração, diminuir significativamente o número de flores e consequentemente a produção de frutos e sementes.
De acordo com a distribuição temporal dos eventos fenológicos, como a renovação das folhas, floração, frutificação e dispersão dos diásporos, três padrões fenológicos podem ser distinguidos nas leguminosas. Como a maioria das espécies floresce durante a seca, julgou-se mais conveniente definir os padrões (precoce ou tardio) em relação à esta estação e não em relação à chuvosa como fizeram Sarmiento & Monasterio (1983). Os três grupos aqui descritos (floração na estação chuvosa, precoce ou tardia na seca) correspondem, portanto, aos mesmos definidos por aqueles autores para espécies arbóreas de savanas venezuelanas, respectivamente como precoce, retardada ou tardia em relação à estação chuvosa.
O hábito, o período de floração e o de frutificação variam entre espécies de uma mesma família e entre as famílias, sendo o único padrão constante o da dispersão dos diásporos na estação seca. Os padrões fenológicos observados, também diferem dentro e entre as famílias. De acordo com Kochmer & Handel (1986), Johnson (1992) e Wrigth & Calderon (1995), restrição filogenética aplica-se àquelas propriedades compartilhadas com um ancestral comum por membros de grupos monofiléticos e que limitam a resposta destes táxons à seleção direcional. Segundo os autores, restrição filogenética pode explicar a maioria da variação nos períodos de florescimento e possivelmente nos padrões fenológicos na comunidade. Nas leguminosas estudadas, tanto o período de floração quanto os padrões fenológicos não aparentam ser restritos filogeneticamente no nível de família. Mesmo nos grupos considerados monofiléticos, como nas famílias Fabaceae e Mimosaceae (Doyle 1994), os períodos de floração assim como os padrões fenológicos são distintos, sugerindo divergência e adaptação às condições abióticas e/ou bióticas do cerrado.
A sincronização da dispersão com a seca não aparenta ser conseqüência de restrição filogenética. A produção de frutos secos, anemo ou barocóricos, é uma das principais características dessas leguminosas, sendo a dispersão na seca correlacionada com esse tipo de fruto nas espécies do cerrado (Miranda, 1995, Oliveira 1998, Batalha & Mantovani 2000).
Areprodução vegetativa parece não ser um evento comum nas leguminosas estudadas, sendo unicamente observada em Hymenaea stigonocarpa. Assim, a sobrevivência da maioria das espécies parece depender da produção regular de sementes, germinação e estabelecimento de plântulas.
Agradecimentos - Ao Prof. Dr. Miguel Petrere Jr. pela formulação matemática no cálculo da intensidade da fenofase. Aos profissionais do Museu Emílio Goeldi pela identificação taxonômica das espécies. À Comercial e Agrícola Paineiras Ltda. pelo apoio logístico sem o qual não teria sido possível a realização do trabalho.
2 . Universidade Federal do Maranhão, Departamento de Biologia, Av. dos Portugueses, s/n, Campus do Bacanga, 65068-240 São Luís, MA, Brasil.
3. Autor para correspondência: paulosfigueiredo@uol.com.br
- AIDE, T.M. 1992. Dry season leaf production: a escape from herbivory. Biotropica 24:532-537.
- AIDE, T.M. 1993. Patterns of leaf development and herbivory in a tropical understory community. Ecology 74:455-466.
- BATALHA, M.A. & MANTOVANI, W. 2000. Reproductive phenological patterns of cerrado plant species at the Pé-de-Gigante Reserve (Santa Rita do Passa Quatro, SP, Brazil): a comparison between the herbaceous and woody floras. Revista Brasileira de Biologia. 60:129-145.
- BORCHERT,R. 1983. Phenology and control of flowering in tropical trees. Biotropica 15:81-89.
- BORCHERT,R. 1992. Computer simulation of tree growth periodicity and climatic hydroperiodicity in tropical forest. Biotropica 24:385-395.
- BORCHERT,R. 1994. Soil and stem water storage determine phenology and distribuition of tropical dry forest trees. Ecology 75:1437-1449.
- BULLOK, S.H. 1995. Plant reproduction in neotropical dry forest trees. In Seasonally dry tropical forests. (S.H. Bullock, H.A. Mooney & E. Medina, eds.). Cambridge University Press, Cambridge, p.277-296.
- BULLOK, S.H. & SOLLIS-MAGALLANES, J.A. 1990. Phenology of canopy trees of a tropical forest in Mexico. Biotropica 22:22-35.
- COUTINHO, L.M. 1976. Contribuiçăo ao conhecimento do papel ecológico das queimadas na floraçăo de espécies do cerrado. Tese de livre docęncia, Instituto de Biocięncias, Universidade de Săo Paulo, Săo Paulo.
- DAUBENMIRE, R. 1972. Phenology and other characteristics of tropical semi-deciduous forest in North-western Costa-Rica. Journal of Ecology 60:147-160.
- DOYLE, J.J. 1994. Phylogeny of legume family: an approach to understanding the origins of nodulation. Annual Review of Ecology and Systematics 25:325-349.
- EITEN, G. 1994. Duas travessias na vegetaçăo do Maranhăo. Editora Sucesso, Brasília.
- FERRI, M.G. 1944. Transpiraçăo das plantas permanentes do cerrado. Boletim da Faculdade de Filosofia, Cięncias e Letras. Universidade de Săo Paulo. Botânica 4:159-224.
- FRANCO, A.C. 2000. Water and light use strategies by Cerrado woody plants. In Tópicos atuais em Botânica: palestras convidadas do 51o Congresso Nacional de Botânica. (T.B. Cavalcanti & B.M.T. Walter, orgs.). Embrapa Recursos Genéticos e Biotecnologia/Sociedade Botânica do Brasil, Brasília. p.292-298.
- FRANKIE, G.W., BAKER, H.G. & OPLER, P.A. 1974. Comparative phenological studies of trees in tropical wet and dry forests in the lowlands of Costa Rica. Journal of Ecology 62:881-919.
- HOLBROOK, N.M., WHITBECK, J.L. & MOONEY, H.A. 1995. Drought responses of neotropical dry forest trees. In Seasonality dry tropical forests (S.H. Bullock, H.A. Mooney & E. Medina, eds.). Cambridge University Press, Cambridge, p.243-270.
- HOPKINS, B. 1970. Vegetation of Olokemeji forest Reserve Nigeria. VII. The plants on the savanna site with special reference to their seasonal growth. Journal of Ecology 58:895-825.
- HUXLEY, P.A. & VAN ECK, W.A. 1974. Seasonal changes in growth and development of some woody near Kampala, Uganda. Journal of Ecology 62:579-592.
- IBGE. 1984. Atlas do Maranhão. Instituto Brasileiro de Geografia e Estatística, Rio de Janeiro.
- JANZEN, D.H. 1967. Synchronization of sexual reproduction of trees within the dry season in Central America. Evolution 21:620-637.
- JOHNSON, S.D. 1992. Climatic and phylogenetic determinants of flowering seasonality in the Cape flora. Journal of Ecology 81:567-572.
- KOCHMER, J.P. & HANDEL, S.N. 1986. Constrains and competition in the evolution of flowering phenology. Ecological Monographs 56:303-325.
- LIEBERMAN, D. 1982. Seasonality and phenology in a dry tropical forest in Ghana. Journal of Ecology 70:791-806.
- LIEBERMAN, D. & LIEBERMAN, M. 1984. The causes and consequences of syncronous flushing in a dry tropical forest. Biotropica 16:193-201.
- LORD MEDWAY, F.L.S. 1972. Phenology of a tropical rain forest in Malaya. Biological Journal of the Linnean Society 4:117-146.
- MANTOVANI, W. & MARTINS, F.R. 1988. Variaçőes fenológicas das espécies do cerrado da Reserva Biológica de Moji Guaçu, Estado de Săo Paulo. Revista Brasileira de Botânica 11:101-112.
- MIRANDA, I.S. 1995. Fenologia do estrato arbóreo de uma comunidade de cerrado em Alter-do-Chăo, Pará. Revista Brasileira de Botânica 18:235-240.
- MONASTERIO, M. & SARMIENTO, G. 1976. Phenological strategies em species of seasonal savana and semideciduous forest in the Venezuelan Llanos. Journal of Biogeography 3:325-355.
- MOONEY, H.S. & DUNN, E.L. 1970. Convergent evolution of mediterraneum climate evergreen sclerophyl shrubs. Evolution 24:292-303.
- NJOKU, E. 1963. Seasonal periodicity in the growth and development of some forest trees in Nigeria. I. Observations on mature trees. Journal of Ecology 51:617-624.
- OLIVEIRA, P.O. 1998. Fenologia e biologia reprodutiva das espécies de cerrado. In Cerrado: ambiente e flora (S.M. Sano & S.P. Almeida, eds.). Embrapa-CPAC, Planaltina, p.169-192.
- OPLER, A.P., FRANKIE, G.W. & BAKER, H.G. 1980. Comparative phenological studies of treelet and shrub species in a tropical wet and dry forest in the lowlands of Costa Rica. Journal of Ecology 68:167-188.
- PENHALBER, E.F & MANTOVANI, W. 1997. Floraçăo e chuva de sementes em mata secundária em Săo Paulo, SP. Revista Brasileira de Botânica 20:205-220.
- RATHCKE, B. & LACEY, E.P. 1985. Phenological patterns of terrestrial plants. Annual Review of Ecology and Systematics 16:179-214.
- RAWITSCHER, F. 1948. The water economy of the vegetation of the ¨campos cerrados¨ in southern Brazil. Journal of Ecology 36:237-268.
- REICH, P.B. 1995. Phenology of tropical forest: patterns, causes and consequences. Canadian Journal of Botany 73:164-174.
- REICH, P.B. & BORCHERT, R. 1984. Water stress and tree phenology in a tropical dry forest in the lowlands of Costa Rica. Journal of Ecology 72:61-74.
- RIBEIRO, J.F. & CASTRO, L.H.R. 1986. Método quantitativo para avaliar características fenológicas em árvores. Revista Brasileira de Botânica 9:7-11.
- RIZZINI, C.T. 1976. Tratado de Fitogeografia do Brasil. Aspectos ecológicos. Hucitec, Universidade de Săo Paulo, Săo Paulo.
- SARMIENTO, G. 1984. The ecology of neotropical savannas. Harvard University Press, Cambridge.
- SARMIENTO, G. & MONASTERIO, M. 1983. Life forms and phenology. In Ecosystems of the word: Tropical savannas (F. Bourličre, ed.). Elsevier Science, Amsterdan, p.79-108.
- SARMIENTO, G., GOLDSTEIN, G. & MEINZER, F. 1985. Adaptative strategies of woody species in neotropical savannas. Biological Review 60:315-356.
- SEGHIERI, J., FLORET, C.H. & PONTANIER, R. 1995. Plant phenology in relation to water availibility: herbaceous and woody species in the savannas of northern Cameroon. Journal of Tropical Ecology 11:237-254.
- VAN SCHAIK, C.P., TERBORGH, J.W. & WRIGH, S.J. 1993. The phenology of tropical forests: adaptative significance and consequences for primary consumers. Annual Review of Ecology and Systematics 24:353-377.
- WRIGH, S.J. & CALDERON, O. 1995. Phylogenetic patterns among tropical flowering phenologies. Journal of Ecology 83:937-948.
Datas de Publicação
-
Publicação nesta coleção
20 Jan 2003 -
Data do Fascículo
Set 2002
Histórico
-
Aceito
05 Jun 2002 -
Recebido
30 Maio 2001