Resumos
Muitas substâncias têm sido utilizadas após hepatectomias parciais a fim de conhecer como elas atuam sobre o processo de regeneração hepática. Adequado fluxo sangüíneo parece ter muita importância neste processo. Autores descreveram, após hepatectomias em ratos, elevação dos níveis plasmáticos de histamina. Substâncias inibidoras da histidina-decarboxilase e da histaminase leva a elevação da histamina endógena com vasodilatação sinusoidal e aceleração da regeneração hepática. No presente estudo busca-se conhecer a influência da histamina exógena administrada à ratos parcialmente hepatectomizados. Utilizaram-se 32 ratos Wistar que sofreram hepatectomia de aproximadamente 67% da víscera. Os animais do grupo experimento receberam por via subcutânea 0,5 mg/Kg/dia de histamina e os do grupo controle igual volume de solução salina isotônica. As aferições foram realizadas com 36 horas e 7 dias. A avaliação do peso da víscera não mostrou diferença entre os grupos. O número de figuras de mitose em 10 campos foi maior no grupo experimento com 36 horas (p=0,010). No sétimo dia o número delas era semelhante nos dois grupos. Concluiu-se que a administração de histamina exógena, talvez pela sua vida média curta, aumenta o número de figuras de mitose no início do processo, não interferindo na regeneração ao final de 7 dias.
Histamina; Fígado; Regeneração hepática
Many substances have been used after partial hepatectomy in order to determine how they act on the process of hepatic regeneration. An adequate blood flow seems to be very important in this process. Increased plasma histamine levels after hepatectomy in rats have been reported by some investigators. Substances that inhibit histidine-decarboxylase and histaminase lead to an elevation in endogenous histamine with sinusoid vasodilation and acceleration of hepatic regeneration. The objective of the present study was to determine the effect of exogenous histamine administered to partially hepatectomized rats. Thirty two Wistar rats were submitted to approximately 67% hepatectomy. The animals in the experimental group received subcutaneously 0.5 mg/kg/day of histamine and the controls received an equal volume of isotonic saline. Determinations were made after 36 hours and after 7 days. Liver weight did not differ between groups. The number of mitotic figures in 10 fields was higher in the experimental group after 36 hours (p=0.010). On the seventh day, the number of mitotic figures was similar for both groups. We conclude that the administration of exogenous histamine, perhaps due to the short half-life of the substance, increases the number of mitotic figures at the beginning of the process but has no effect on regeneration after 7 days.
Histamine; Liver; Hepatic regeneration
EFEITO DA HISTAMINA NA REGENERAÇÃO HEPÁTICA ESTUDO EXPERIMENTAL EM RATOS11.Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina da Pontifícia Universidade Católica do Paraná (PUC-PR)..Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina da Pontifícia Universidade Católica do Paraná (PUC-PR).2.Prof. Adjunta de Técnica Operatória e Cirurgia Experimental da PUC-PR e Prof. Titular de Experimentação em Clínica e Cirurgia da Faculdade Evangélica de Medicina do Paraná. Doutora em Cirurgia Experimental pela Universidade Federal de São Paulo- Escola Paulista de Medicina.3.Prof. Titular de Técnica Operatória e Cirurgia Experimental da PUC-PR. e Prof. Adjunto de Técnica Operatória e Cirurgia Experimental da Universidade Federal do Paraná. Doutor em Cirurgia Experimental pela Universidade Federal de São Paulo- Escola Paulista de Medicina.4.Alunos de Técnica Operatória e Cirurgia Experimental da PUC-PR.
Maria de Lourdes Pessole Biondo-Simões21.Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina da Pontifícia Universidade Católica do Paraná (PUC-PR)..Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina da Pontifícia Universidade Católica do Paraná (PUC-PR).2.Prof. Adjunta de Técnica Operatória e Cirurgia Experimental da PUC-PR e Prof. Titular de Experimentação em Clínica e Cirurgia da Faculdade Evangélica de Medicina do Paraná. Doutora em Cirurgia Experimental pela Universidade Federal de São Paulo- Escola Paulista de Medicina.3.Prof. Titular de Técnica Operatória e Cirurgia Experimental da PUC-PR. e Prof. Adjunto de Técnica Operatória e Cirurgia Experimental da Universidade Federal do Paraná. Doutor em Cirurgia Experimental pela Universidade Federal de São Paulo- Escola Paulista de Medicina.4.Alunos de Técnica Operatória e Cirurgia Experimental da PUC-PR.
Fernando Hintz Greca31.Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina da Pontifícia Universidade Católica do Paraná (PUC-PR)..Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina da Pontifícia Universidade Católica do Paraná (PUC-PR).2.Prof. Adjunta de Técnica Operatória e Cirurgia Experimental da PUC-PR e Prof. Titular de Experimentação em Clínica e Cirurgia da Faculdade Evangélica de Medicina do Paraná. Doutora em Cirurgia Experimental pela Universidade Federal de São Paulo- Escola Paulista de Medicina.3.Prof. Titular de Técnica Operatória e Cirurgia Experimental da PUC-PR. e Prof. Adjunto de Técnica Operatória e Cirurgia Experimental da Universidade Federal do Paraná. Doutor em Cirurgia Experimental pela Universidade Federal de São Paulo- Escola Paulista de Medicina.4.Alunos de Técnica Operatória e Cirurgia Experimental da PUC-PR.
Gustavo Henrique Smaniotto41.Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina da Pontifícia Universidade Católica do Paraná (PUC-PR)..Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina da Pontifícia Universidade Católica do Paraná (PUC-PR).2.Prof. Adjunta de Técnica Operatória e Cirurgia Experimental da PUC-PR e Prof. Titular de Experimentação em Clínica e Cirurgia da Faculdade Evangélica de Medicina do Paraná. Doutora em Cirurgia Experimental pela Universidade Federal de São Paulo- Escola Paulista de Medicina.3.Prof. Titular de Técnica Operatória e Cirurgia Experimental da PUC-PR. e Prof. Adjunto de Técnica Operatória e Cirurgia Experimental da Universidade Federal do Paraná. Doutor em Cirurgia Experimental pela Universidade Federal de São Paulo- Escola Paulista de Medicina.4.Alunos de Técnica Operatória e Cirurgia Experimental da PUC-PR.
Fernando Techy41.Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina da Pontifícia Universidade Católica do Paraná (PUC-PR)..Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina da Pontifícia Universidade Católica do Paraná (PUC-PR).2.Prof. Adjunta de Técnica Operatória e Cirurgia Experimental da PUC-PR e Prof. Titular de Experimentação em Clínica e Cirurgia da Faculdade Evangélica de Medicina do Paraná. Doutora em Cirurgia Experimental pela Universidade Federal de São Paulo- Escola Paulista de Medicina.3.Prof. Titular de Técnica Operatória e Cirurgia Experimental da PUC-PR. e Prof. Adjunto de Técnica Operatória e Cirurgia Experimental da Universidade Federal do Paraná. Doutor em Cirurgia Experimental pela Universidade Federal de São Paulo- Escola Paulista de Medicina.4.Alunos de Técnica Operatória e Cirurgia Experimental da PUC-PR.
Diogo de Paula Soares41.Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina da Pontifícia Universidade Católica do Paraná (PUC-PR)..Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina da Pontifícia Universidade Católica do Paraná (PUC-PR).2.Prof. Adjunta de Técnica Operatória e Cirurgia Experimental da PUC-PR e Prof. Titular de Experimentação em Clínica e Cirurgia da Faculdade Evangélica de Medicina do Paraná. Doutora em Cirurgia Experimental pela Universidade Federal de São Paulo- Escola Paulista de Medicina.3.Prof. Titular de Técnica Operatória e Cirurgia Experimental da PUC-PR. e Prof. Adjunto de Técnica Operatória e Cirurgia Experimental da Universidade Federal do Paraná. Doutor em Cirurgia Experimental pela Universidade Federal de São Paulo- Escola Paulista de Medicina.4.Alunos de Técnica Operatória e Cirurgia Experimental da PUC-PR.
Cassiana Kannenberg41.Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina da Pontifícia Universidade Católica do Paraná (PUC-PR)..Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina da Pontifícia Universidade Católica do Paraná (PUC-PR).2.Prof. Adjunta de Técnica Operatória e Cirurgia Experimental da PUC-PR e Prof. Titular de Experimentação em Clínica e Cirurgia da Faculdade Evangélica de Medicina do Paraná. Doutora em Cirurgia Experimental pela Universidade Federal de São Paulo- Escola Paulista de Medicina.3.Prof. Titular de Técnica Operatória e Cirurgia Experimental da PUC-PR. e Prof. Adjunto de Técnica Operatória e Cirurgia Experimental da Universidade Federal do Paraná. Doutor em Cirurgia Experimental pela Universidade Federal de São Paulo- Escola Paulista de Medicina.4.Alunos de Técnica Operatória e Cirurgia Experimental da PUC-PR.
Cibele Cristina de Lara Castro41.Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina da Pontifícia Universidade Católica do Paraná (PUC-PR)..Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina da Pontifícia Universidade Católica do Paraná (PUC-PR).2.Prof. Adjunta de Técnica Operatória e Cirurgia Experimental da PUC-PR e Prof. Titular de Experimentação em Clínica e Cirurgia da Faculdade Evangélica de Medicina do Paraná. Doutora em Cirurgia Experimental pela Universidade Federal de São Paulo- Escola Paulista de Medicina.3.Prof. Titular de Técnica Operatória e Cirurgia Experimental da PUC-PR. e Prof. Adjunto de Técnica Operatória e Cirurgia Experimental da Universidade Federal do Paraná. Doutor em Cirurgia Experimental pela Universidade Federal de São Paulo- Escola Paulista de Medicina.4.Alunos de Técnica Operatória e Cirurgia Experimental da PUC-PR.
Cynthia Neves de Vasconcelos41.Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina da Pontifícia Universidade Católica do Paraná (PUC-PR)..Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina da Pontifícia Universidade Católica do Paraná (PUC-PR).2.Prof. Adjunta de Técnica Operatória e Cirurgia Experimental da PUC-PR e Prof. Titular de Experimentação em Clínica e Cirurgia da Faculdade Evangélica de Medicina do Paraná. Doutora em Cirurgia Experimental pela Universidade Federal de São Paulo- Escola Paulista de Medicina.3.Prof. Titular de Técnica Operatória e Cirurgia Experimental da PUC-PR. e Prof. Adjunto de Técnica Operatória e Cirurgia Experimental da Universidade Federal do Paraná. Doutor em Cirurgia Experimental pela Universidade Federal de São Paulo- Escola Paulista de Medicina.4.Alunos de Técnica Operatória e Cirurgia Experimental da PUC-PR.
Biondo-Simões MLP, Greca FH, Smaniotto GH, Techy F, Soares DP, Kannenberg C, Castro CCL, Vasconcelos CN. Efeito da histamina na regeneração hepática: estudo experimental em ratos. Acta Cir Bras [serial online] 2000 Jan-Mar;15(1). Available from: URL: http://www.scielo.br/acb.
RESUMO: Muitas substâncias têm sido utilizadas após hepatectomias parciais a fim de conhecer como elas atuam sobre o processo de regeneração hepática. Adequado fluxo sangüíneo parece ter muita importância neste processo. Autores descreveram, após hepatectomias em ratos, elevação dos níveis plasmáticos de histamina. Substâncias inibidoras da histidina-decarboxilase e da histaminase leva a elevação da histamina endógena com vasodilatação sinusoidal e aceleração da regeneração hepática. No presente estudo busca-se conhecer a influência da histamina exógena administrada à ratos parcialmente hepatectomizados. Utilizaram-se 32 ratos Wistar que sofreram hepatectomia de aproximadamente 67% da víscera. Os animais do grupo experimento receberam por via subcutânea 0,5 mg/Kg/dia de histamina e os do grupo controle igual volume de solução salina isotônica. As aferições foram realizadas com 36 horas e 7 dias. A avaliação do peso da víscera não mostrou diferença entre os grupos. O número de figuras de mitose em 10 campos foi maior no grupo experimento com 36 horas (p=0,010). No sétimo dia o número delas era semelhante nos dois grupos. Concluiu-se que a administração de histamina exógena, talvez pela sua vida média curta, aumenta o número de figuras de mitose no início do processo, não interferindo na regeneração ao final de 7 dias.
DESCRITORES: Histamina. Fígado. Regeneração hepática.
INTRODUÇÃO
O hepatócito é uma célula estável, denominação esta devida à sua baixa taxa de replicação celular sob condições de normalidade. Entretanto quando o fígado é submetido à tratamento que reduza seu parênquima, suas células readquirem a capacidade de se multiplicar rapidamente, restaurando a massa hepática.
O termo regeneração, consagradamente utilizado, tem apenas o significado de recuperação do volume da víscera e não de regeneração da parte perdida. Na verdade o que ocorre é a hiperplasia global de todo o parênquima até que se restabeleça a massa hepática primitiva6, 30.
Após resseccões amplas do fígado, uma insuficiência hepática transitória, de algum nível, se instala. O entendimento do processo de regeneração permite interferir, de modo a acelerá-lo e diminuir o tempo de insuficiência. A busca de estimuladores da regeneração tem sido atraente campo de pesquisa. MICHALOPOULOS (1990) classificou estes agentes em 2 grupos: os mitogênicos completos e os incompletos ou co-mitogênicos. Mitogênicos completos são substâncias capazes, em meios de cultura isentos de soro ou de qualquer outro fator, induzir a síntese do DNA e a mitose. Co-mitogênicos são substâncias que estimulam a replicação celular de maneira indireta22.
Entre os agentes mitogênicos citam-se:a) o fator de crescimento epidérmico (EGF)9,19, b) o fator transformador do crescimento alfa (aTGF)21, c) o fator de crescimento do hepatócito (HGF)14,23, d) a substância estimuladora hepática (HSS)16, e) o fator de crescimento de fibroblastos ácido (aFGF)18 e f) o hormônio de crescimento2,8.
Entre os co-mitogênicos citam-se: a) norepinefrina e receptor a adrenérgico7,12, b) vasopressina e angiotensinas26, c) insulina e glucágon29, d) prostaglandinas (ácido aracdônico, PGA1, PGE1, PGE2 e PGE2a1,17 , e) estrógeno e testosterona10,28 e f) fibronectina13,15.
Existem, ainda, fatores que estão parcialmente caracterizados.
Adequado fluxo sangüíneo parece ter muita importância na regeneração hepática. RICHARDSON e WITHRINGTON (1982) demonstraram que a redução do suprimento sangüíneo leva à menor taxa de regeneração24. SATO, TSUKADA, TANAKA e HATAKEYAMA. (1997) afirmam que a pressão portal, a qual reflete o volume sinusoidal, pode representar o controle da regeneração do volume hepático27.
Após hepatectomias em ratos, CHAMBON, MOULINOUX e FONTAINEN (1977) observaram elevação dos níveis de histamina3. Estes mesmos autores descreveram que a injeção de tritoqualine, substância inibidora da histidina-decarboxylase, em ratos parcialmente hepatectomizados, levava a aumento transitório da concentração plasmática de histamina e vasodilatação sinusoidal com aceleração da regeneração hepática4. Em outro trabalho, injetaram sulfato de amino-guanidina, substância inibidora da histaminase e encontraram elevação da histamina endógena e da regeneração hepática5. MASLINSKI, FOGEL e ANDERZEJEJEWSKI (1993) injetaram em ratos parcialmente hepatectomizados uma solução TPP ( tolpa peat preparation) e observaram elevação dos níveis hepáticos de espermidina, histamina, RNA e DNA e da regeneração hepática20.
Nestes trabalhos, observa-se a estimulação para a elevação da histamina endógena. No presente estudo busca-se conhecer a influência da histamina exógena administrada à ratos parcialmente hepatectomizados.
MÉTODO
Utilizaram-se 32 ratos (Rattus norvegicus albinus, Rodentia mammalia), Wistar, fêmeas, com idade de 120 dias e peso entre 162 e 256 gramas, mantidos em biotério com ciclo claro-escuro, temperatura e umidade próprios do ambiente, com livre aceso à água e à ração comercial.
Dividiu-se a amostra em 2 grupos de 16 ratos para constituir os grupos controle ( C ) e experimento ( E ) . Sob anestesia inalatória obtida com éter etílico submeteu-se os animais à depilação digital da parede abdominal ventral e antissepsia com polivinilpirrolidona-iodo. Em seguida realizou-se laparotomia mediana e hepatectomia parcial, ressecando-se os lobos lateral esquerdo e mediano. Esta hepatectomia equivale à ressecção de aproximadamente 67% do volume da víscera (HIGGINS e ANDERSON, 1931). Pesou-se os segmentos ressecados e anotou-se em protocolo. Após a laparorrafia injetou-se na tela subcutânea da região dorsal dos animais do grupo experimento 0,5mg/kg/dia de histamina e nos do grupo controle injetava-se volume equivalente de solução fisiológica 0,9%. Realizou-se as aferições com 36 horas e com 7 dias, quando se sacrificou 8 animais de cada grupo. Desta forma obteve-se os subgrupos C1, C2, E1 e E2. Pesou-se novamente os ratos e realizou-se nova laparotomia com ressecção total do fígado que foi pesado. As medidas foram anotadas em protocolo.
Fixou-se as peças ressecadas em formalina tamponada à 10% e encaminhou-se para estudo histopatológico, corando-se os cortes histológicos pela hematoxilina e eosina.
Avaliou-se a regeneração através de 2 métodos: pela fórmula de KWON e col. (1990) e pela contagem das figuras de mitose existentes em 10 campos. A fórmula de Kwon e col. fornece a taxa de regeneração, baseada no peso.
% = D/E .100 onde E = R/0,7
Onde: D = peso do fígado por 100 g de peso do animal no dia do sacrifício,
E = representa o peso estimado por 100 g de peso do animal, antes da hepatectomia, a qual é calculada pelo peso do fígado ressecado ( R ).
Submeteram-se os resultados à análise estatística através do teste não paramétrico de Mann Whitney para comparação entre dois grupos, nos dois tempos. Adotou-se como nível de significância p £ 0,05 ou 5 %.
RESULTADOS
Registrou-se o óbito de 3 animais, 2 no subgrupo C1 e um no subgrupo C2 por acidente anestésico, tendo-se excluído estes ratos das análises.
A taxa de regeneração baseada no peso, com 36 horas mostrou média de recuperação do peso da víscera para C1 de 81,62 % e para E1 de 74,78 % (p = 0,097). A avaliação com 7 dias revelou recuperação para C2 de 122,00 % e para E2 de 135,50% (p = 0,095).
A contagem das figuras de mitose em 10 campos revelou na avaliação de 36 horas, em C1 12,43 figuras e em E1 23,62 figuras (p = 0,010). Na avaliação de 7 dias a média de figuras de mitose foi de 5,71 no subgrupo C2 e de 5,75 no subgrupo E2 (p=0,140).
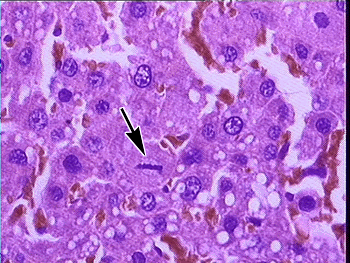
A arquitetura hepática mostrou-se normal nos 2 grupos e os capilares sinusóides no grupo E estavam dilatados. Nas
figuras 1 e 2pode-se ver imagem das figuras de mitose em cortes histológicos dos 2 grupos.
Fotomicrografia de corte histológico de fígado de animal tratado com histamina mostrando 4 figuras de mitose (® )
Fotomicrografia de corte histológico de fígado de animal do grupo controle onde se vê uma figura de mitose (® )
DISCUSSÃO
A busca por agentes que acelerem a regeneração hepática tem importância na medida em que diminui o tempo de insuficiência hepática e desta forma permite ressecções mais ampliadas. Muitas substâncias estão estabelecidas como mitogênicas completas: o EGF, o aTGF, a SSH, o aFGF, o HGF e o GH2,8,9,14,16,18,19,21,23. Outras como co-mitogênicas como: a norepinefrina, a vasopressina, as angiotensinas, a insulina e o glucágon, as prostaglandinas e as fibronectinas1,7,10,12, 13,15,17,26,28,29.
CHAMBON e col. (1977) já haviam relatado elevação da histamina endógena após hepatectomias e testado substâncias que elevavam sua concentração plasmática com aceleração da regeneração hepática3,4,5. Mais recentemente MASLINSKI e col. (1993) observaram que a injeção de TPP elevava os níveis hepáticos de espermidina, histamina, RNA e DNA com aumento da regeneração hepática20. Nestes estudos os autores utilizaram substâncias que levavam a aumento da concentração de histamina endógena, provavelmente porque a histamina exógena é rapidamente metabolizada não mantendo concentração constante.
No presente estudo pode-se verificar que a administração de histamina exógena, embora administrada em doses fracionadas e portanto não mantendo nível constante da concentração, mas se fazendo em picos modificou o curso da regeneração do fígado. O número de figuras de mitose mostrou-se mais elevado nas 36 horas tanto no grupo controle como no grupo experimento, concordando com a descrição da literatura que diz que uma onda de mitoses é observada a partir de 22 horas da hepatectomia atingindo o pico máximo com 34 horas24. Foi possível verificar que, neste tempo, o número de figuras de mitose era maior no grupo experimento do que no grupo controle (p = 0,010). No sétimo dia o número de figuras de mitose em ambos os grupos era menor e equivalente (p = 0,140). A regeneração do peso da víscera com 36 horas era semelhante. Já no terceiro dia pode-se verificar que ambos os grupos haviam recuperado parcialmente a massa hepática e no sétimo dia ambos haviam regenerado mais do que a massa inicial, sem diferença significante entre os grupos. Desta forma o único dado significante observado foi o aumento do número de figuras de mitose. Para melhor entender a interferência da histamina exógena faz-se necessário conhecer a concentração de DNA nos hepatócitos, não estudado neste trabalho.
CONCLUSÃO
A administração de histamina exógena à ratos parcialmente hepatectomizados permite observar um maior número de figuras de mitose após 36 horas.
REFERÊNCIAS
1. Andrei PG, Hitfield JF, Armato U. Stimulation of DNA synthesis and mitosis of hepatocytes in primary cultures of neonatal rat liver by arachidonic acid and prostaglandins. Exp Cell Res 1981;134:265-72.
2. Asakawa K, Hizuka N, Takano K, Horikawa R, Suregawa I, Toyoda C, Shizume K. Human growth hormon stimulates liver regeneration in rats. J Endocrinol Invest 1989;12:343-7.
3. Chambon Y, Moulinoux JP, Fontainen N. Importante augmentation des taux hepatique et sanguin de lhistamine apres hepatectomie partielle chez le rat. C R Seances Soc Biol Fil 1977;171:644-8.
4. Chambon Y, Moulinoux JP, Fontainen N. Action de la tritoqualine sur les taux hepatique et sanguin de lhistamine apress hepatectomie partielle chez le rat. C R Seances Soc Biol Fil 1977;171:1283-7.
5. Chambon Y, Moulinoux JP, Fontainen N. Action du sulfate daminoguanidine sur le taux hepatique et sanguin de lhistamine apres hepatectomie partielle chez le rat. C R Seances Soc Biol Fil 1977;171:1288-92.
6. Cressman DE, Diamond RH, Taub R. Rapid activatin of the start 3 transcription complex in the liver regeneration. Hepatology 1995;21:1443-9.
7. Cruise JL, Cotecchia S, Michalopoulos GK. Norepinephrine decreases EGF binding in primary rat hepatocyte cultures. J Cell Physiol 1986;127:39-44.
8. Ekberg S, Luther M, Nakamura T, Jansson JO. Growth hormone promotes early initiation of hepatocyte growth factor gen expression in the liver of hypophysectomized rats after partial hepatectomy. J Endocrinol 1992;135:59-67.
9. Francavilla A, Ove P, Polimeno L, Sciascia C, Coetzee ML, Starzl TE. Epidermal growth factor and proliferation in rat hepatocytes in primary culture isolated at different times after partial hepatectomy. Cancer Res 1986;46:1318-23.
10. Francavilla A, Polimeno L, Dileo A, Barone M, Ove P, Coetzee M, Eagon P, Makowka L, Ambrosino G, Mazaferro V, Starzl TE. The effect of estrogen and tamoxifen on hepatocyte proliferation in vivo and in vitro. Hepatology 1989;9:614-20.
11. Higgins GM, Anderson RM. Experimental pathology of the liver: I. Restaration of the liver of the white rat folliwing partial surgical removal. Arch Pathol 1931;12:186-202.
12. Houck KA, Michaloupolos GK. Altered responses of regenerating hepatocytes to noeepinephrine and transforming growth factor-b . J Cell Physiol 1989;141:503-9.
13. Imawari M, Hugles RD, Gove CD, Willians R. Fibronectin and Kupffer cell function in fulminant hepatic failure. Dig Dis Sci 1985;30:1028-33.
14. Ishiki Y, Ohnishi H, Muto Y, Matromoto K, Nakamura T. Direct evidence that hepatocyte growth factor is a hepatotrophic factor for liver regeneration and has a potent antihepatitis effect in vivo. Hepatology 1992;16:1227-35.
15. Kwon AH, Uetsuji S, Yamamura M, Hioki K, Yamamoto M. Effect of administration of fibronectin or aprotinin on liver regeneration after experimental hepatectomy. Ann Surg 1990;211:295-300.
16. Lablecque DR. Hepatic stimulator substance: discovery, characteristics and mechanisms of action. Dig Dis Sci 1991;36:669-73.
17. MacManus JP, Braceland BM. A connection between the production of prostaglandins during liver regeneration and the DNA synthetic response. Prostaglandins 1976;11:609-20.
18. Mardsen ER, Hu Z, Fujio K, Nakatsukasa H, Thorgeirsson SS, Evarts RP. Expression of acidic fibroblast growth factor in regenerating liver and during hepatic differentiation. Lab Invest 1992;67:427-33.
19. Marti V, Burwen SJ, Jones AL. Biological effects of epidermal growth factor with emphasis on the gastrointestinal tract and liver. Hepatology 1989;9:126-38.
20. Maslinski C, Fogel WA, Anderzejejewski W. The influence of Tolpa Peat Preparation (TPP) on rat liver regeneration. Acta Pol Pharm 1993;50:413-6.
21 Mead JE, Fausto N. Transformin growth factor aTGF maybe a physiological regulator of liver regeneration by means of means of na autocrine mechanism. Proc Nath Acad Sci 1989;86:1558-62.
22. Michalopoulos G. Liver regeneration: molecular mechanisms of growth control. Faber J 1990;4:176-87.
23. Nakamura T, Nawa K, Ichihara A. Partial purification and characterization of hepatocyte growth factor from serum of hepatectomized rats. Biochem Biophys Res Commun 1984;122:1450-9.
24. Rares HM, Wirshing R, Tuczak HV, Iseler G. Analysis of cell cycle comportments of hepatocytes after partial hepatectomy. Cell Tissue Kinet 1976;6:517-32.
25. Richardson PD, Withrington PG. Physiological regulation of the hepatic circulation. Ann Rev Physiol 1982;44:57-69.
26. Russel WE, Bucker NLR. Vasopressin modulates liver regeneration in yhe Brattlebors rat. Am J Physiol 1983;245:G321-4.
27. Sato Y, Tsukada K, Tanaka K, Hatakeyama K. New aspects in the liver regeneration following partial hepatectomy. Nippon Geka Gakkai Zasshi 1997;98:706-12.
28. Svanas GW, Egon PK, Elm M, Makowka L, Podesta L, ChapChap P, Kaln D, Starzl TE, Van Thiel DH. Effect of antiandrogen flutamide on measures of hepatic regeneration in rats. Dig Dis Sci 1989;34:1916-23.
29. Vintermyr OK, Doskeland SO. Cell cycle parameters of adult rat hepatocytes in a definit medium. S note on the timing of nucleolar DNA replication. J Cell Physiol 1987;132:12-21.
30. Westwick JK, Weitzel C, Lerrert HL, Brenner DA. Activation of jun kinase is a early event in hepatic regeneration. J Clin Invest 1995;95:803-10.
Biondo-Simões MLP, Greca FH, Smaniotto GH, Techy F, Soares DP, Kannenberg C, Castro CCL, Vasconcelos CN. Effect of histamin on liver regeneration: experimental study on rats. . Acta Cir Bras [serial online] 2000 Jan-Mar;15(1). Available from: URL: http://www.scielo.br/acb.
SUMMARY: Many substances have been used after partial hepatectomy in order to determine how they act on the process of hepatic regeneration. An adequate blood flow seems to be very important in this process. Increased plasma histamine levels after hepatectomy in rats have been reported by some investigators. Substances that inhibit histidine-decarboxylase and histaminase lead to an elevation in endogenous histamine with sinusoid vasodilation and acceleration of hepatic regeneration. The objective of the present study was to determine the effect of exogenous histamine administered to partially hepatectomized rats. Thirty two Wistar rats were submitted to approximately 67% hepatectomy. The animals in the experimental group received subcutaneously 0.5 mg/kg/day of histamine and the controls received an equal volume of isotonic saline. Determinations were made after 36 hours and after 7 days. Liver weight did not differ between groups. The number of mitotic figures in 10 fields was higher in the experimental group after 36 hours (p=0.010). On the seventh day, the number of mitotic figures was similar for both groups. We conclude that the administration of exogenous histamine, perhaps due to the short half-life of the substance, increases the number of mitotic figures at the beginning of the process but has no effect on regeneration after 7 days.
SUBJECT HEADINGS: Histamine. Liver. Hepatic regeneration.
Endereço para correspondência:
Maria de Lourdes Pessole Biondo-Simões
Rua Ari José Valle, 1987
Curitiba-PR
82030-000
Tel: (41) 273-5117 ou 9991-5566
Data do recebimento: 25/05/99
Data da revisão: 03/07/99
Data da aprovação: 15/09/99
Datas de Publicação
-
Publicação nesta coleção
02 Maio 2000 -
Data do Fascículo
Mar 2000
Histórico
-
Aceito
15 Set 1999 -
Revisado
03 Jul 1999 -
Recebido
25 Maio 1999