Resumos
OBJETIVO: Investigar a área de necrose focal induzida pela injeção intra-hepática de quatro diferentes substâncias no fígado de ratos. MÉTODOS: Foram utilizados 25 ratos Wistar, com peso variando entre 200 a 250 g, distribuidos em 5 grupos, que receberam 0,1cc das seguintes substâncias: Grupo I (Gr. I) - soro fisiológico a 0,9% (controle). Grupo II (Gr. II) - glicose hipertônica a 50%. Grupo III (Gr. III) - NaCl a 20%. Grupo IV (Gr. IV) - formol a 10%. Grupo V (Gr. V) - etanol. Os animais foram submetidos a laparotomia para que a punção fosse realizada no lobo hepático médio sob visão direta. Todos os animais foram sacrificados após 24 horas da injeção.. Os fígados foram avaliados histologicamente, com o intuito de mensurar a área do tecido necrótico. RESULTADOS: Nos cinco grupos estudados observou-se: Gr. I - 2829mm² (controle); Gr. II - 3805mm² (glicose hipertônica); Gr. III - 3930mm² (NaCl); Gr. IV - 4532mm² (formol) e Gr. V - 6432mm² (etanol). A análise estatística destes valores foi feita pelo método das comparações múltiplas. CONCLUSÃO: 1. O soro fisiológico foi à substância que causou a menor área de necrose (P< 0,05). 2. O NaCl a 20% e a glicose hipertônica a 50% produzem efeitos semelhantes (P > 0,05). 3. O formol a 10% produziu necrose mais extensa que a glicose hipertônica a 50% (P < 0,05) e que o NaCl a 20%, porém não apresentou diferença estatisticamente significativa com esta última (P > 0,05). 4. O etanol foi à substância que, comparada com as outras, mais necrose produziu (P < 0,05).
Fígado; Necrose; Ratos
PURPOSE: To investigate the extent of necrosis after the injection of four substances into the liver of rats. METHODS: Twenty-five male Wistar rats (weighting from 200 - 250g) and divided into five groups were used for this study. All the animals underwent a transverse laparotomy, each receiving 0,1ml of the following substances into the liver parenchyma: Saline solution (1st Group - Gr. I), 50% hypertonic glucose (2nd Group - Gr. II), 20% NaCl (3rd Group - Gr. III), 10% formaline solution (4th Group - Gr. IV) and ethanol (5th Group - Gr. V). All the animals were sacrificated 24 hours after surgical procedures. The livers were examined microscopically to measure the extent of induced necrosis. RESULTS: The results achieved were the following: 2829mm² - Gr. I; 3805mm² - Gr. II; 3930mm² - Gr. III; 4532mm² - Gr. IV; and 6432mm² - Gr. V.. Statistical analysis were made with Kruskal-Wallis test and P less than 0,05 were considered statistically significant. CONCLUSIONS: 1. A saline solution causes hepatic necrosis, although to a lesser extent than the other substances (P < 0,05). 2. 20% NaCl and 50% hypertonic glucose produce necrosis to the same extent (P > 0,05). 3. The necrosis induced by a 10% formaline solution was greater than that induced by 50% hypertonic glucose (P < 0,05) and 20% NaCl (P > 0,05). 4. The hepatic injection of ethanol produced the most intense hepatic necrosis when compared to saline solution, 20% NaCl, 50% hipertonic glucose and 10% formaline solution (P < 0,05).
Liver; Necrosis; Rats
ARTIGO ORIGINAL
Modelo de indução de necrose focal hepática: estudo experimental em ratos1 1 Trabalho realizado no Laboratório de Fisiologia da Faculdade de Medicina da Universidade Federal do Rio de Janeiro (UFRJ).
Experimental induction model of hepatic focal necrosis, in rats
José Manoel da Silva Gomes MartinhoI; Heleno Pinto de MoraesII; Marcelo Enne de OliveiraIII; Lucio Filgueiras Pacheco MoreiraIII; Alexandre Cerqueira da SilvaIII; Leonel dos Santos PereiraIV; Francisco MaiaV
IProfessor Adjunto do Departamento de Cirurgia Geral e Especializada da Universidade Federal Fluminense
IIProfessor Adjunto do Departamento de Patologia da Universidade Federal Fluminense
IIIMédico do Hospital Geral de Bonsucesso do Ministério da Saúde
IVProfessor Adjunto do Departamento de Cirurgia da UFRJ
VProfessor Titular do Departamento de Cirurgia Geral e Especializada da Universidade Federal Fluminense
Endereço para correspondência Endereço para correspondência Prof. José Manoel da Silva Gomes Martinho Av. Amaral Peixoto, 467/512 24020-072 Niterói RJ Tel/Fax: (21) 2620-6272 jmanoel@ar.microlink.com.br
RESUMO
OBJETIVO: Investigar a área de necrose focal induzida pela injeção intra-hepática de quatro diferentes substâncias no fígado de ratos.
MÉTODOS: Foram utilizados 25 ratos Wistar, com peso variando entre 200 a 250 g, distribuidos em 5 grupos, que receberam 0,1cc das seguintes substâncias: Grupo I (Gr. I) - soro fisiológico a 0,9% (controle). Grupo II (Gr. II) - glicose hipertônica a 50%. Grupo III (Gr. III) - NaCl a 20%. Grupo IV (Gr. IV) - formol a 10%. Grupo V (Gr. V) - etanol. Os animais foram submetidos a laparotomia para que a punção fosse realizada no lobo hepático médio sob visão direta. Todos os animais foram sacrificados após 24 horas da injeção.. Os fígados foram avaliados histologicamente, com o intuito de mensurar a área do tecido necrótico.
RESULTADOS: Nos cinco grupos estudados observou-se: Gr. I - 2829mm2 (controle); Gr. II - 3805mm2 (glicose hipertônica); Gr. III - 3930mm2 (NaCl); Gr. IV - 4532mm2 (formol) e Gr. V - 6432mm2 (etanol). A análise estatística destes valores foi feita pelo método das comparações múltiplas.
CONCLUSÃO: 1. O soro fisiológico foi à substância que causou a menor área de necrose (P< 0,05). 2. O NaCl a 20% e a glicose hipertônica a 50% produzem efeitos semelhantes (P > 0,05). 3. O formol a 10% produziu necrose mais extensa que a glicose hipertônica a 50% (P < 0,05) e que o NaCl a 20%, porém não apresentou diferença estatisticamente significativa com esta última (P > 0,05). 4. O etanol foi à substância que, comparada com as outras, mais necrose produziu (P < 0,05).
Descritores: Fígado. Necrose. Ratos.
ABSTRACT
PURPOSE: To investigate the extent of necrosis after the injection of four substances into the liver of rats.
METHODS: Twenty-five male Wistar rats (weighting from 200 - 250g) and divided into five groups were used for this study. All the animals underwent a transverse laparotomy, each receiving 0,1ml of the following substances into the liver parenchyma: Saline solution (1st Group - Gr. I), 50% hypertonic glucose (2nd Group - Gr. II), 20% NaCl (3rd Group - Gr. III), 10% formaline solution (4th Group - Gr. IV) and ethanol (5th Group - Gr. V). All the animals were sacrificated 24 hours after surgical procedures. The livers were examined microscopically to measure the extent of induced necrosis.
RESULTS: The results achieved were the following: 2829mm2 - Gr. I; 3805mm2 - Gr. II; 3930mm2 - Gr. III; 4532mm2 - Gr. IV; and 6432mm2 - Gr. V.. Statistical analysis were made with Kruskal-Wallis test and P less than 0,05 were considered statistically significant.
CONCLUSIONS: 1. A saline solution causes hepatic necrosis, although to a lesser extent than the other substances (P < 0,05). 2. 20% NaCl and 50% hypertonic glucose produce necrosis to the same extent (P > 0,05). 3. The necrosis induced by a 10% formaline solution was greater than that induced by 50% hypertonic glucose (P < 0,05) and 20% NaCl (P > 0,05). 4. The hepatic injection of ethanol produced the most intense hepatic necrosis when compared to saline solution, 20% NaCl, 50% hipertonic glucose and 10% formaline solution (P < 0,05).
Key words: Liver. Necrosis. Rats.
Introdução
O melhor método para o tratamento de lesões malignas primárias ou secundárias do fígado é a ressecção 1_5. Entretanto existem pacientes que, por problemas diversos, como idade avançada, múltiplos nódulos ou risco cirúrgico proibitivo, são inoperáveis 6,7.
Na literatura encontram-se relatos de vários procedimentos, isolados ou associados 8_10 com o intuito de evitar a intervenção cirúrgica, prolongar a sobrevida ou mesmo curar estes pacientes11.
Dentre as alternativas mais usadas destacam-se a coagulação por microondas12,13, a fotocoagulação por laser14, a crioterapia11_15, a quimioembolização arterial e a injeção percutânea do etanol16_18.
Esta última apresenta como vantagens ser um método barato, de fácil execução e que permite a repetição várias vezes no mesmo paciente7, principalmente em tumores com menos de 3 cm16. O etanol age induzindo uma necrose hepática focal. Após 271 injeções, em 23 pacientes, Livraghi19 não encontrou células tumorais viáveis em biópsias ou em ressecções realizadas em pacientes portadores de hepatocarcinoma.
Encontram-se relatos da aplicação experimental de outras substâncias com a mesma finalidade, ou seja, a destruição de tecido tumoral hepático. Honda20 induziu tumores em fígado de ratos e injetou água a 80 graus Celsius, comparando o efeito com o do etanol. Concluiu que a água quente produziu necrose na mesma intensidade que o etanol.
Ohnishi21 injetou ácido acético em fígados de ratos e concluiu que, dependendo da concentração utilizada, este era mais letal para o hepatócito que o etanol.
Na literatura nacional, entretanto, não encontramos estudo clínico ou experimental que abordasse especificamente este assunto.
O propósito desta investigação foi avaliar, experimentalmente, em ratos, a extensão da necrose hepática induzida pela injeção de glicose hipertônica a 50%, NaCl a 20%, formol a 10% e etanol.
Métodos
Foram utilizados 25 ratos Wistar, machos, pesando entre 200 e 250 gramas. Os animais foram anestesiados por inalação de éter, inicialmente em campânula fechada e, posteriormente, mantidos sob máscara. Na mesa de cirurgia foram posicionados em decúbito dorsal, tricotomizados e fixados com elásticos nas patas.
Depois dos cuidados de anti-sepsia, realizou-se uma incisão transversa subcostal direita. O ligamento falciforme foi parcialmente seccionado, liberando o fígado da parede abdominal anterior. Em seguida realizou-se a punção do lobo médio22, 25 com agulha 10 x 4,5mm e injetou-se 0,1ml da substância a ser estudada. A punção e a injeção foram sempre feitas na mesma topografia, guardando a mesma distância da borda inferior do fígado e do ligamento falciforme à esquerda, na mesma profundidade e ângulo de inclinação em relação à cápsula de Glisson.
Cada grupo de cinco animais recebeu as seguintes substâncias: glicose hipertônica a 50%, NaCl a 20%, formol a 10% e etanol. Os cinco animais restantes receberam soro fisiológico (grupo controle).
O abdome dos animais foi fechado com fio inabsorvível em sutura contínua no plano músculo-aponeurótico e pontos separados na pele.
Os animais foram alojados individualmente em gaiolas, permanecendo com ração liberada.
Nenhum animal morreu ou apresentou sinais de doença. Após 24 horas, com a mesma rotina seguida para a cirurgia, o lobo mediano, contendo a lesão foi retirado e processado para estudo morfológico. Em seguida, os animais foram sacrificados por secção da aorta abdominal e medula espinhal, ainda sob anestesia.
Após fixação em formol a 10% por sete dias, as peças foram seccionadas em fatias de espessura constante de 3 mmatravés de uma guia de metal em forma de "U" e uma navalha histológica descartável. À medida que o lobo era seccionado, as peças eram colocadas lado a lado e uma das suas faces marcada com tinta nanquim para, não só orientar a inclusão em parafina como evitar que as faces adjacentes de fatias consecutivas fossem examinadas à microscopia de luz. As fatias, em grupos de duas a quatro por lâmina, eram colocadas em envelopes de papel filtro, identificadas com o número do animal e com o número do bloco (ex: Rato 1 - Bloco 1), perfazendo um total de três lâminas por animal. A numeração do bloco sempre se iniciava pela extremidade mais próxima à área de secção do fígado, portanto, a mais afastada da borda hepática. Todo este processamento foi realizado pela mesma pessoa, com a utilização da mesma guia, obtendo-se fatias de fígado com 0,25cm de espessura.
O processamento histológico teve início com a desidratação do material em banhos consecutivos de álcool. A diafanização foi feita com banhos de xilol e a inclusão realizada em parafina histológica. Utilizou-se uma estufa a 60 graus centígrados.
A inclusão nos blocos de parafina foi feita com o cuidado de se posicionar a face marcada da fatia do fígado voltada para cima. A seguir os blocos foram seccionados utilizando-se um micrótomo rotativo Spencer 820, obtendo-se cortes de 5m que foram corados pelas hematoxilina de Harris e eosina alcoólica (H - E). Por último, as lâminas foram montadas com bálsamo do Canadá e lamínulas de vidro.
A quantificação da necrose foi realizada utilizando-se um Mini-Mop (Carl Zeiss), integrado a um fotomicroscópio Nikon com câmara lúcida. Um ponto de luz de cor vermelha projetado sobre o corte histológico e que desloca-se de acordo com a movimentação do mouse ligado ao Mini-Mop, traça o contorno da necrose em todas as lâminas. O percurso do ponto luminoso foi medido por um programa próprio do sistema que calcula a área delimitada, ou seja, a área de necrose.
Os dados referentes aos cinco grupos estudados foram analisados comparando-se seus valores através do teste não paramétrico de Kruskal - Wallis, com a adoção do nível de significância de 5% de probabilidade, segundo Campos (1983) 26. Quando significante o valor do teste, utilizou-se o método das comparações múltiplas para localizar as diferenças entre pares de tratamentos.
Resultados
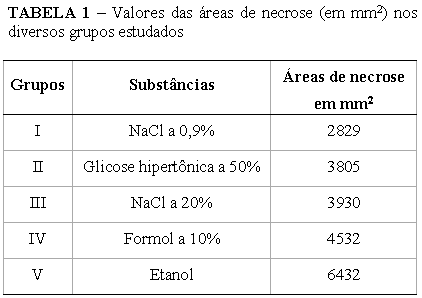
Macroscopicamente todos os fígados examinados apresentaram necrose hepática. Histologicamente, a quantificação das áreas de necrose mostrou diferenças entre os diversos grupos (Tabela 1).
No grupo I (soro fisiológico a 0,9%), a soma dos valores das áreas de necrose foi de 2829mm2.
No grupo II (glicose hipertônica a 50%), o somatório foi de 3805mm2.
No grupo III (NaCl a 20%), o total encontrado foi de 3930mm2.
No grupo IV (formol a 10%), a área total de necrose encontrada foi de 4532mm2.
No grupo V (etanol), encontrou-se a maior área de necrose com 6432mm2.
Aplicado o teste não paramétrico de Kruskal - Wallis, seu valor correspondeu a H = 38,72 (P < 0,01), indicando diferença significante entre os grupos.
Em seguida, utilizou-se o método das comparações múltiplas para localizar as diferenças entre pares de tratamentos.
O grupo controle, representado por ratos que receberam soro fisiológico a 0,9%, foi o que estatisticamente demonstrou menor área de necrose (P< 0,05) em relação aos outros grupos.
O grupo V foi o que apresentou a necrose mais extensa , sendo também esta diferença, quando comparada com todas as outras substâncias, estatisticamente significante (P < 0,05).
Os grupos II e III, representados respectivamente pelos ratos injetados com glicose hipertônica a 50 % e NaCl a 20%, não apresentaram diferença estatística (P > 0,05), quando comparados entre si.
O formol a 10% produziu área de necrose menor que o grupo V (P< 0,05) e maior que todas as outras substâncias testadas, não apresentando porém diferença estatística significante com relação ao grupo III (P > 0,05).
Discussão
Um percentual significativo de pacientes é portador de neoplasias irressecáveis do fígado por vários motivos, tais como, idade avançada, múltiplos nódulos hepáticos, cirrose avançada, dificuldade de acesso à lesão ou mesmo recusa do paciente em submeter-se a uma cirurgia de alto risco6,27,28. Por isso, um grande número de proposições apareceram na literatura como terapias alternativas para esses casos, algumas durante o ato operatório, outras não cirúrgicas11,9,29,30.
A injeção intratumoral de etanol vem sendo proposta por Sugiura31 como procedimento simples e barato32 para o tratamento do carcinoma hepatocelular único ou múltiplo33, de pequeno tamanho e, mais raramente, para hiperplasia adenomatosa34 e tumores secundários35.
O etanol é injetado no tumor ou na artéria que o vasculariza através uma agulha fina e sob controle ultrassonográfico32,36. O mecanismo de ação do álcool dá-se por duas maneiras. A primeira por desidratação imediata do citoplasma pela difusão dentro da célula, com conseqüente necrose por coagulação, seguida por reação fibrótica e a segunda, pela entrada do etanol na circulação sangüínea, induzindo necrose da célula endotelial e agregação plaquetária com conseqüente trombose de pequenos vasos, causando isquemia do tecido neoplásico37,7.
Na maioria dos casos há necessidade de múltiplas aplicações da substância38,39. A complicação decorrente do procedimento mais relatada é a dor, causada pelo derrame na cavidade peritoneal 4. Sua prevenção é feita, porém, pela injeção lenta do etanol e retirada da agulha alguns segundos após o término da injeção32. Com a finalidade de diminuir o inconveniente de uma distribuição irregular do etanol dentro do tumor, Sheu40 utilizou uma agulha multiperfurada na ponta. Outra complicação é a febre baixa que pode cursar com a necrose do tumor.32
Giovannini35 injetou o etanol em 40 pacientes com 55 tumores secundários do fígado, relatando necrose completa em 31 casos (56%). A média de sobrevida nesses pacientes foi de 21 meses, chegando a 39% em três anos.
A avaliação da resposta ao tratamento tem sido acompanhada pela ultrassonografia, tomografia computadorizada41,42, o doppler colorido43 e a ressonância nuclear magnética44,45.
Burgener46 avaliou experimentalmente o efeito da injeção percutânea do etanol em adenocarcinomas implantados na pata posterior de ratos. Concluiu que a injeção intramuscular do etanol produziu uma necrose de coagulação local, seguida de formação de tecido de granulação e subsequente fibrose, sem sintomas colaterais sistêmicos. Em comparação com animais de controle, a injeção intratumoral induziu necrose parcial ou completa do tumor, reduziu a taxa de crescimento e causou a erradicação completa em 25 % dos casos.
Festi e col.47, em trabalho experimental, avaliaram os efeitos locais e sistêmicos da injeção do etanol. Injetaram de 0,1 a 2 ml/kg de peso em fígado de coelhos e os sacrificaram em intervalos variando de 1 a 30 dias. Concluiram que a injeção do etanol era bem tolerada, não produzindo efeitos colaterais, sendo a área de necrose dependente da dose injetada.
O nosso trabalho foi realizado em ratos, injetando-se quantidade padronizada de várias substâncias em fígado sadio. Não nos propusemos a estudar os efeitos locais das substâncias injetadas em longo prazo nem seus efeitos colaterais. Devemos contudo registrar que os animais sacrificados não apresentaram sinais de doença. O espaço de tempo de 24 horas entre a injeção intra-hepática das substâncias e o sacrifício dos animais preencheu nossa expectativa que era a de estudar a área de necrose produzida, sem a interferência das fases subseqüentes.
Os achados de nossa experimentação, utilizando o etanol, foram semelhantes aos de Festi e col.47. Embora o nosso tempo de observação tenha sido de apenas 24 horas, constatamos necrose nos fígados de todos os animais que receberam esta substância.
Outras substâncias são relatadas na literatura, principalmente a japonesa, utilizadas com a mesma finalidade, e apontam uma tendência atual dos pesquisadores em buscar alternativas que não impliquem em cirurgias extensas, de grande risco para os pacientes e cujo resultado em termos de sobrevida sejam iguais ou melhores que as ressecções.
Honda20, em trabalho experimental, injetou água a 80 graus Celsius ou etanol para o tratamento de tumores hepáticos induzidos em ratos. Concluiu que a água quente induzia necrose em tumores hepáticos tanto quanto o etanol. No mesmo ano utilizou clinicamente a água quente48. Em 1994, publicou os resultados de um grupo de 20 pacientes com carcinoma hepatocelular com menos de 3 cm que foram tratados com injeção percutânea de soro fisiológico quente. Não houve complicações e um efeito terapêutico foi obtido em todos os casos49.
Em nosso estudo as substâncias utilizadas foram injetadas na temperatura ambiente. Nesta condição, o efeito do etanol foi muito superior ao do soro fisiológico e ao NaCl a 20%.
Ohnishi21 injetou ácido acético em várias concentrações ou etanol em ratos. Comparou os diâmetros médios das áreas de necrose e concluiu que o ácido acético nas concentrações acima de 40% era mais efetivo que o etanol. Em 1996 o ácido acético foi utilizado clinicamente pelo mesmo autor em carcinoma hepatocelular maior ou menor de 3 cm, mostrando ser mais eficaz que o etanol como indutor de necrose focal50,51,52. Mostrou também que a recidiva era maior em pacientes tratados com etanol do que com o ácido acético53.
Em nosso experimento, o soro fisiológico, utilizado como controle, também produziu necrose. No entanto, a quantidade de necrose foi menor quando comparada com todas as outras substâncias (P < 0,05).
Não encontramos na literatura, mesmo na internacional, referências a estudos com as outras substâncias utilizadas em nossa pesquisa.
Verificamos, conforme pode-se depreender, que tanto a glicose hipertônica a 50% quanto o NaCl a 20% e o formol a 10% foram efetivos na produção de necrose em tecido hepático sadio, provavelmente pela hipertonicidade das duas primeiras e pelo efeito cáustico do formol.
Estas três substâncias carecem portanto de investigação experimental, a fim de testar a sua eficácia no que tange à indução de necrose em tecido tumoral. Um experimento que nos parece atraente para comprovar tal hipótese seria o de primeiro induzir tumor no fígado de ratos e em seguida administrá-las isolada ou em associação, utilizando o mesmo modelo deste estudo, para avaliar a eficiência na destruição de células tumorais.
Conclusões
1. O soro fisiológico causou a menor área de necrose, comparada com as outras;
2 NaCl a 20% e a glicose hipertônica a 50% produzem áreas de necrose semelhantes;
3 O formol a 10% produziu necrose mais extensa comparada ao uso da glicose hipertônica a 50%;
4 O etanol foi à substância que, comparada com as outras, produziu maior área de necrose.
Data do recebimento: 15/12/2003
Data da revisão: 06/01/2004
Data da aprovação: 22/01/2004
Conflito de interesse: nenhum
Fonte de financiamento: nenhuma
- 1. Bismuth H, Adam R, Navarro F, Engerran L, Abascal. Re-resection for colorectal liver metastasis. Surg. Oncol. Clin. North Am1996; 5:353-64.
- 2. Lai E, Fan S T, Chu K M, Wong J. Hepatic resection for hepatocellular carcinoma. Ann. Surg. 1995; 221: 291-8.
- 3. Nakamura S, Suzuki S, Baba S. Resection of liver metastases of colorectal carcinoma. World J. Surg. 1997; 21: 741-7.
- 4. Schwartz IS. Hepatic resection. Ann. Surg. 1990; 211: 1-8.
- 5. Sitzmann J, Greene P S. Perioperative predictors of following hepatic resection for neoplasm. Ann Surg 1994; 219 : 13-7.
- 6. Bismuth H, Adam R, Levi F, Farabos W, Castaing D, Majno P, Engerran L. Resection of nonresectable liver metastases from colorectal cancer after neoadjuvant chemotherapy. Ann. Surg. 1996; 224: 509 -22.
- 7. Livraghi T, Giorgio A, Marin G, Salmi A, Sio I, Bolondi L, Pompili M, Brunello F, Lazzaroni S, Torzilli G, Zucchi A. Hepatocellular Carcinoma and cirrhosis in 746 patients: long-term results of percutaneous ethanol injection. Radiology 1995; 197: 101-8.
- 8. Duskeiko GM, Hobbs KE, Dick R, Burroughs AK. Treatement of small hepatocellular carcinomas. Lancet 1992; 340: 285-8.
- 9. Farmer DG, Rosone MH, Shaked A, Bussutil RW. Current treatment modalities for hepatocellular carcinoma. Ann. Surg 1994; 219 : 236 -47.
- 10. KatsuakiT. . The long term efficacy of combined transcatheter arterial embolization and percutaneous ethanol injection in the treatment of patients with large hepatocellular carcinoma and cirrhosis. Cancer 1998; 82: 78-85.
- 11. Adam R, Akpinar E, Johann M, Kustlinger F, Majno P, Bismuth H. Place of cryosurgery in the treatment of malignant liver tumors. Ann. Surg.1997; 225 (1):39-50.
- 12. Ido K, Isoda N, Kawamoto C, Hozumi M, Suzuki T, Nagamine N, Nakazawa Y, Ono K, Hirota N, Hyodoh H, Kimura K. Laparoscopic microwave coagulation therapy for solitary hepatocellular carcinoma performed under laparoscopic ultrasonography. Gastroentestinalendoscopy 1997; 45: 415-20.
- 13. Sato M, Watanabe Y, Ueda S, Iseki S, Abe Y, Sato n, Kimura S, Okubo K, Onji M.Microwave coagulation therapy for hepatocellular carcinoma. Gastroenterology 1996; 110: 1507-14.
- 14. Amin Z, Bown SG, Lees WR. Local treatment of colorectal liver metastases: a comparison of interstitial laser photocoagulation (ILP) and percutaneous alcohol injection (PAI). Clin. Radiol 1993; 48: 166-71.
- 15. Liu CL, Fan ST. Nonresectional therapies for hepatocellular carcinoma. Am. J. Surg 1997; 173: 358-65.
- 16. Bartolozzi C, Lencioni R, Caramella D, Vignali C, Cioni R, Mazzeo R, Carrai M, Maltinti G, Capria A, Conte PF. Treatement of large HCC: transcatheter arterial chemoembolization combined with percutaneous ethanol injection versus repeated transcatheter arterial chemoembolization. Radiology 1995; 197: 812-18.
- 17. Lee M J, Mueller PR, Dawson SL, Gazelle SL, Hahn PF, Goldberg MA, Boland GW. Percutaneous ethanol injection for the treatment of hepatic tumors: indications, mechanism of action, tecnique, and efficacy. AJR - Am J. Roentgenol. 1995; 164 215-20.
- 18. Ohto M, Yoshikawa M, Saisho H, Ebara M, Sugiura N. Nonsurgical treatment of hepatocellular carcinoma in cirrhotic patients. WorldJ. Surg. 1995; 19:42-6.
- 19. Livraghi T, Salmi A, Bolondi L, Marin G, Arienti V, Monti F, Vettori C. Small hepatocellular carcinoma: percutaneous alcohol injection - resultes in 23 patients. Radiology 1988; 168:313-17.
- 20. Honda N, Yokol H, Hirai T, Ohishi H, Kichikawa K, Uchida K.An experimental study of percutaneous hot water injection therapy (PhoT) for hepatic tumor. Jpn J Med Ultrasonics 1991; 18(1):167- 8.
- 21. Ohnishi K, Ohyama N, Ito S, Fujiwara K. Small hepatocellular carcinoma: treatment with US - guided intratumor injection of acetic acid. Radiology 1994; 193:747-52.
- 22. Higgins GM, Anderson RM. Experimental pathology of the liver. Arch. Patol 1931; 12: 186202.
- 23. Refinetti RA. Efeitos da cimetidina e da ranitidina na histologia do fígado após hepatectomia parcial. Estudo experimental em ratos [ Tese - Doutorado ]. Universidade Federal do Rio de Janeiro Faculdade de Medicina ; 1992.
- 24. Manso J E F. Influência da esplenectomia e hemi esplenectomia na regeneração hepática. Estudo experimental em ratos. [Tese - Doutorado ]. Universidade Federal do Rio de Janeiro Faculdade de Medicina; 1992.
- 25. Palombo A. Influência do fator de crescimento epidérmico na regeneração do fígado após hepatectomia parcial. Estudo experimental em ratos [Tese de Doutorado ]. Universidade Federal do Rio de Janeiro Faculdade de Medicina; 1994.
- 26. Campos H. Estatística Experimental não paramétrica. Piracicaba; ESALQ, 1983.
- 27. Livragni T, Lazzaroni S, Meloni F, Torzilli G, Vettori C. Intralesional ethanol in the treatment of irresectable liver cancer. World J. Surg 1995; 19:801-6.
- 28. Sogni P. Traitements non chirurgicaux du carcinome hepatocellulaire. Ann. Chir1995; 49;16072 .
- 29. Shimamura T, Nakagima Y, Une Y, Namieno T, Ogasawara K, Yamashita K, Haneda T, Nakanishi K, Kimura J, Matsushita M, Sato N, Uchino J.. Efficacy and safety of preoperative percutaneous transhepatic portal embolization with absolute ethanol: A clinical study. Surgery 1997; 121:135-41.
- 30. Watanabe Y, Sato M, Abe Y, Horiuchi S, Kito K, Kimura K, Kimura S. Laparoscopic microwave coagulo - necrotic therapy for hepatocellular carcinoma: a feasible study of an alternative option for poor - risk patients. J. Laparoendosc. Surg. 1995; 5:16975.
- 31. Sugiura N. Treatment of small hepatocellular carcinoma by percutaneous injection of ethanol into tumor with real-time ultrasound monitoring. Acta Hepatolol Jpn, 1983; 24:24-7.
- 32. Bruix J. Treatement of hepatocelular carcinoma. Hepatology 1997; 25:259-62.
- 33. Shiina S, Yasuda H, Muto H, Tagawa, K, Unuma T, Ibukuro K, Inoue Y, Takanashi R. Percutaneous ethanol injection in the treatment of liver neoplasms. A.J.R 1987; 149:949-52.
- 34. Livraghi T, Sangalli G, Vettori C. Adenomatous hiperplastic nodules in cirrhotic liver: a therapeutic approach. Radiology 1989;170:155 -7.
- 35. Giovannini M, Seitz JF. Ultrasound-guided percutaneous alcohol injection of small liver metastases. Cancer 1994 ; 73:294-7.
- 36. Ueno N, Tomiama T, Tano S. Color doppler sonography-guided ethanol injection therapy for hepatocellular carcinoma. A.J.R1998; 170: 515.
- 37. Kawano, M. An experimental study of percutaneous absolute ethanol injection therapy for small hepatocellular carcinoma: effects of absolute ethanol on the healthy canine liver. Gastroenterol. Jpn 1989; 26;663-9.
- 38. Ishii H, Okada S, Nose H, Okusaka T, Yoshimori M, Takayama T, Kosuge T, Yamasaki S, Sakamoto M, Hirohashi S. Local recurrence of hepatocellular carcinoma after percutaneous ethanol injection. Cancer 1996; 77:1792 -6.
- 39. Ishizaka H, Ishijima H, Katsuya T, Koyama Y. Percutaneous ethanol injection therapy: use of a directable needle guide. AJR 1997; 168:1563-4.
- 40. Sheu JC, Sung JL, Huang GT, Chen DS, Yang PM, Lai MY, Wei TC, Su TC, Tsang YM, Lee CZ, Chen JC, Hsu HC. Intratumor injection of absolute ethanol under ultrasound guidance for the treatement of small hepatocellular carcinoma. Hepato-gastroenterol 1987; 34:255-61.
- 41. Ebara M, Kita K, Sugiura N, Yoshikawa M, Fukuda H, Ohto M, Kondo F, Kondo Y. Therapeutic efect of percutaneous ethanol injection on small hepatocellular carcinoma: evaluation with CT. Radiology 1995; 195:371-7.
- 42. Yoshikawa J, Matsui O, Kadoya M, Gabata T, Miyayama S, Takahashi S, Takashima M, Kobayashi K.. Hepatocellular Carcinoma: CT appearance of parenchymal changes after percutaneous ethanol injection therapy. Radiology 1995; 194:107-11.
- 43. Lencione R, Caramella D, Bartolozzi C. Hepatocellular carcinoma: use of color doppler US to evaluate reponse to treatment with percutaneous ethanol injection. Radiology 1995; 194:113-8.
- 44. Pacella C, Papini E, Bizzrri G, Picardi R. Hepatocellular carcinoma: magnetic resonance imaging after ultasonically guided percutaneous alcohol treatment. Preliminary report. Ital. J.Gastroenterol 1990; 22:136-41.
- 45. Usui H, Itai Y.. Percutaneous ethanol injection therapy for hepatocellular carcinoma: validity of MR imaging in the evaluation of treatment effect. Radiat. Med 1995; 13 :103-8.
- 46. Burgerer F A, Steinmetz SD. Treatement of experimental adenocarcinomas by percutaneous intratumoral injection of absolute ethanol.Invest-Radiol 1987; 22:472-8.
- 47. Festi D, Monti F, Casanova S, Livraghi T, Frabboni R, Roversi CA, Bertoli D, Borelli G, Mazella G, Bazzoli F, Aldini R, Barbara L, Roda E. Morfological and biochemical effects of intrahepatic alcool injection in the rabbit. Journal of gastroenterol. and hepatol 1990; 5:404-6.
- 48. Honda N, Yokoi H, Hirai T, Ohishi H, Uchida H.Percutaneous hot water injection therapy (PhoT) for the treatment of hepatic tumor: clinical studies. Jpn J Med Ultrassonics 1991; 18 (suppl II) 171-2.
- 49. Honda N, Guo Q, Uchida H, Ohishi H, Hiasa Y. Percutaneous hot saline injection therapy for hepatic tumors: an alternative to percutaneous ethanol injection therapy. Radiology1994; 190;53-7.
- 50. Ohnishi K, Yoshioka H, Ito S, Fujiwara K. Treatment of nodular hepatocelular carcinoma larger than 3cm with ultrasound-guided percutaneous acetic acid injection. Hepatology 1996; 24:1379-85.
- 51. Ohnishi K, Yoshioka H, Kosoka K, Yoshima K, NishiyamaJ, Kameda C, Ito S, Fujiwara K. Treatment of hypervascular small hepatocellular carcinoma with ultrasound-guided percutaneous acetic acid injection: comparison with segmental transcatheter arterial embolization. AJG1996; 91:2574-79.
- 52. Ohnishi K, Nomura F, Ito S, Fujiwara K. Prognosis of small hepatocellular carcinoma (less than 3 cm) after percutaneous acetic acid injection: study of 91 cases. Hepatology 1996; 23:994-1002.
- 53. Ohnishi K, Yoshioka H, Ito S, Fujiwara K. Prospective randomized controlled trial comparing percutaneous acetic acid injection and percutaneous ethanol injection for small hepatocellular carcinoma. Hepatology 1998; 27 :67-72.
Datas de Publicação
-
Publicação nesta coleção
07 Abr 2004 -
Data do Fascículo
Jan 2004
Histórico
-
Aceito
22 Jan 2004 -
Revisado
06 Jan 2004 -
Recebido
15 Dez 2003