Resumos
Os corretivos da acidez dos solos podem ter dois equivalentes em carbonato de cálcio: um, calculado pelos teores de cálcio e magnésio utilizando a expressão: % CaO x 1,79 + % MgO x 2,48 = %ECaCO3; outro, determinado analiticamente pelo poder ou valor de neutralização. Para uma mesma amostra ambos os valores deveriam coincidir, o que raramente acontece. Diversas hipóteses foram levantadas para justificar essa diferença. Os resultados deste trabalho permitiram inferir que nem todo o cálcio e magnésio dos corretivos devem estar associados às bases quimicamente efetivas mas também a fosfato, sulfato ou outras bases de forças inexpressivas; também os constituintes neutralizantes podem estar aprisionados em cristais de outros componentes dos corretivos, como sílica por exemplo, que só são atingidos por um ataque mais enérgico da amostra. Como conclusão, a avaliação química atual dos corretivos da acidez dos solos pode não estar se compatibilizando com o comportamento agrícola desses produtos.
corretivos de acidez; equivalente em carbonato; poder de neutralização
Agricultural liming materials can have two calcium carbonate equivalents: one calculated in function of calcium and magnesium oxide percentages, by the expression: % CaO x 1,79 + % MgO x 2,48 = %ECaCO3; and the other determined analytically by the neutralization power or value. For one sample, both values should be similar, however, this rarely occurs. Several hypoteses were raised to justify the difference. Results of this research permit to infer that not all calcium and magnesium should be associated to the chemically effective bases, but they are also associated to phosphate, sulphate or other bases of inexpressive strength. It is also possible that, the neutralizing components could be captured inside cristals, like silica for example, which react only after a strong solubilization of the sample. It is concluded that the chemical evaluation of agricultural liming materials at the present time cannot explain the agronomical behaviour of these products.
agricultural liming materials; calcium carbonate equivalent; neutralization power
O EQUIVALENTE EM CARBONATO DE CÁLCIO DOS CORRETIVOS DA ACIDEZ DOS SOLOS
J.C. ALCARDE; A.A. RODELLA
Depto. de Química-ESALQ/USP, C.P. 9, CEP: 13418-900 - Piracicaba, SP.
RESUMO: Os corretivos da acidez dos solos podem ter dois equivalentes em carbonato de cálcio: um, calculado pelos teores de cálcio e magnésio utilizando a expressão: % CaO x 1,79 + % MgO x 2,48 = %ECaCO3; outro, determinado analiticamente pelo poder ou valor de neutralização. Para uma mesma amostra ambos os valores deveriam coincidir, o que raramente acontece. Diversas hipóteses foram levantadas para justificar essa diferença. Os resultados deste trabalho permitiram inferir que nem todo o cálcio e magnésio dos corretivos devem estar associados às bases quimicamente efetivas mas também a fosfato, sulfato ou outras bases de forças inexpressivas; também os constituintes neutralizantes podem estar aprisionados em cristais de outros componentes dos corretivos, como sílica por exemplo, que só são atingidos por um ataque mais enérgico da amostra. Como conclusão, a avaliação química atual dos corretivos da acidez dos solos pode não estar se compatibilizando com o comportamento agrícola desses produtos.
Descritores: corretivos de acidez, equivalente em carbonato, poder de neutralização
THE CALCIUM CARBONATE EQUIVALENT OF AGRICULTURAL LIMING MATERIALS
ABSTRACT: Agricultural liming materials can have two calcium carbonate equivalents: one calculated in function of calcium and magnesium oxide percentages, by the expression: % CaO x 1,79 + % MgO x 2,48 = %ECaCO3; and the other determined analytically by the neutralization power or value. For one sample, both values should be similar, however, this rarely occurs. Several hypoteses were raised to justify the difference. Results of this research permit to infer that not all calcium and magnesium should be associated to the chemically effective bases, but they are also associated to phosphate, sulphate or other bases of inexpressive strength. It is also possible that, the neutralizing components could be captured inside cristals, like silica for example, which react only after a strong solubilization of the sample. It is concluded that the chemical evaluation of agricultural liming materials at the present time cannot explain the agronomical behaviour of these products.
Key Words: agricultural liming materials, calcium carbonate equivalent, neutralization power
INTRODUÇÃO
Os materiais considerados corretivos da acidez dos solos são aqueles que contém como "constituintes neutralizantes" ou "princípios ativos": carbonatos, óxidos, hidróxidos ou silicatos de cálcio e ou de magnésio, isto é, compostos de cálcio e ou de magnésio de caráter alcalino e disponíveis economicamente em diversos materiais (Alcarde, 1983).
Devido diferirem na natureza química, esses constituintes apresentam também diferentes capacidades de neutralização da acidez. Com isso, a comparação da ação neutralizante entre corretivos de natureza química diferente, com base no teor de constituintes neutralizantes que apresentam, é irreal e incorreta. Exemplo: um calcário com 80% de constituintes neutralizantes (CaCO3 e MgCO3) tem potencialmente uma ação neutralizante inferior a de um cal virgem com 60% de constituintes neutralizantes (CaO e MgO).
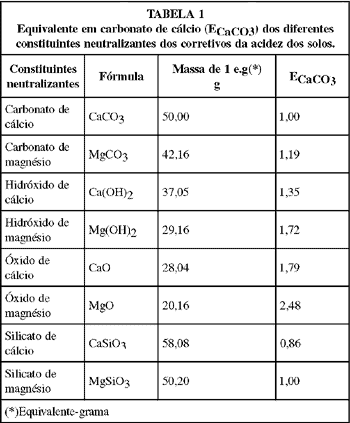
Essa aparente dificuldade é contornada com base no princípio da equivalência química, segundo a qual as reações químicas ocorrem em igualdade de número de equivalentes e não de massa. Assim é possível calcular a capacidade de neutralização relativa de cada constituinte neutralizante, tomando como padrão o carbonato de cálcio (CaCO3), obtendo-se os índices de equivalência em carbonato de cálcio (ECaCO3) de cada constituinte neutralizante, como mostrados na TABELA 1.
Desta forma um calcário com 60% de CaCO3 e 20% de MgCO3 tem uma ação neutralizante de 60 x 1 + 20 x 1,19 = 83,8% ECaCO3, isto é, 100 kg desse produto tem uma ação neutralizante teórica ou calculada equivalente a 83,8 kg de CaCO3; uma cal virgem com 45% de CaO e 15% de MgO tem uma ação neutralizante de 45 x 1,79 + 15 x 2,48 = 117,8% ECaCO3, isto é, 100 kg desse produto tem uma ação neutralizante teórica ou calculada equivalente a 117,8 kg de CaCO3. Essa forma padronizada de expressar a ação neutralizante dos corretivos em ECaCO3 permite a comparação entre produtos de natureza química diferente.
Por tradição, nos corretivos agrícolas não se costuma expressar os teores dos constituintes neutralizantes próprios da espécie do corretivo, mas em CaO e MgO. E esses teores são obtidos através das determinações dos elementos cálcio e magnésio e transformados por cálculo estequiométrico, nos respectivos óxidos. Portanto não são identificadas e nem consideradas as bases químicas a que esses elementos estão associados. Isso pode levar à situações enganosas em relação ao ECaCO3 teórico ou calculado, como no caso de misturas de corretivos de acidez com gesso: numa mistura de um calcário (por exemplo: 28% de CaO e 17% de MgO) com gesso (CaSO4 - 30% de CaO) na proposição de 1:1, ter-se-ia um ECaCO3 calculado de (14+15) x 1,79 + 8,5 x 2,48 = 72,99%. Como o gesso não é corretivo de acidez (Alcarde, 1988), o seu conteúdo de CaO não pode participar do cálculo do ECaCO3, cujo valor teórico então é: 14 x 1,79 + 8,5 x 2,48 = 46,14%.
Na prática, a capacidade de neutralização de um corretivo é obtida através de uma determinação analítica denominada Poder ou Valor de Neutralização (PN ou VN): fundamenta-se em fazer uma amostra de corretivo exercer toda a sua capacidade de neutralização sobre uma quantidade conhecida e em excesso de ácido clorídrico; em seguida determina-se o excesso de ácido e, por diferença, tem-se a quantidade de ácido neutralizada, que é quimicamente equivalente à quantidade de constituintes neutralizantes presente na amostra de corretivo. Para qualquer natureza de corretivo, convencionou-se considerar o constituinte neutralizante como sendo o CaCO3 e o resultado é também expresso em "equivalente em carbonato de cálcio - ECaCO3" (Brasil, 1983; Association of Official Analytical Chemists, 1984).
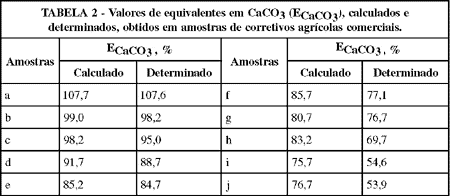
Do exposto observa-se que os corretivos podem ter o valor do seu ECaCO3 obtido de duas maneiras: indiretamente, ou seja, por cálculo através dos teores de cálcio e magnésio, e diretamente, ou seja, através da determinação do poder ou valor de neutralização. Para uma mesma amostra de corretivo, idealmente, esses dois valores deveriam se identificar; mas isso, principalmente no caso dos calcários, só ocorre raramente, sendo o ECaCO3 calculado normalmente maior do que o determinado, conforme mostra a TABELA 2.
A identificação do fator ou fatores responsáveis por essa diferença constituiu-se no objetivo deste trabalho.
Uma das hipóteses recai sobre os processos de solubilização da amostra, que são diferentes para as determinações do cálcio e magnésio e para o poder de neutralização. No primeiro caso o processo é mais enérgico, isto é, 0,5 g da amostra é fervida com 20 ml de solução de HCl 6 N durante 10 minutos; no segundo caso o processo é mais brando, isto é, 1 g da amostra (0,5 g no caso de produtos calcinados) é fervida com 50 ml de solução de HCl 0,5 N, durante 5 minutos. Portanto, para as determinações do cálcio e do magnésio utiliza-se uma solução de HCl muito mais concentrada e contendo mais HCl, além de um tempo maior de fervura, para metade da quantidade da amostra. Como as amostras são analisadas tal qual são comercializadas, a granulometria, assim como a natureza geológica (sedimentar ou metamórfica) e teores de outros componentes como sílica e sexqui-óxidos presentes nos corretivos, poderiam ser fatores que justificassem aquela diferença: o ataque mais brando não estaria conseguindo solubilizar integralmente os componentes neutralizantes da amostra.
Outra hipótese possível é a de que nem todo o cálcio e magnésio presentes no corretivo estejam associados às bases químicas efetivas como carbonato, hidróxido, óxido ou silicato mas a fosfato, sulfato ou outras bases inexpressivas. Finalmente, os constituintes neutralizantes poderiam estar aprisionados em cristais de outros componentes do corretivo, como sílica por exemplo, que só seria atingido pelo ataque mais enérgico.
MATERIAL E MÉTODOS
O material constou de amostras de calcários agrícolas comerciais recebidas para análise no laboratório do Departamento de Química da Escola Superior de Agricultura "Luiz de Queiroz". Esses calcários são moídos, cuja granulometria mínima deve ser 100% passante na peneira no 10 - ABNT (Associação Brasileira de Normas Técnicas) (2 mm de abertura de malha), 70% passante na peneira no 20 - ABNT(0,84 mm) e 50% passante na peneira no 50 - ABNT (0,3 mm) (Brasil, 1983). Parte dessas amostras foram separadas em diferentes frações granulométricas.
Foram utilizadas também amostras de calcários sedimentar e metamórfico em pedras, as quais foram moídas e separadas em diferentes frações granulométricas.
Na representação das frações granulométricas, por exemplo (-30+50), o sinal - significa menor, o sinal + significa maior e os números são os números das peneiras segundo a ABNT; assim a notação do exemplo representa a fração granulométrica cujos grânulos passam pela peneira no 30-ABNT e são retidos na peneira no 50-ABNT.
A metodologia utilizada para as determinações do poder de neutralização (PN), do cálcio (CaO) e do magnésio (MgO) foi a oficial da legislação brasileira (Brasil, 1983), que é semelhante a adotada pela AOAC (1984).
Para as determinações do resíduo insolúvel (RI) e dos sexquióxidos (R2O3) foi utilizada a metodologia de análise de calcários descrita por Kolthoff & Sandell (1967), somente que fazendo uma única desidratação para a precipitação da sílica, a qual fica contaminada, razão da designação de resíduo insolúvel (RI).
RESULTADOS E DISCUSSÃO
1. Efeito da granulometria: Amostras de calcários sedimentares foram analisadas no estado tal qual comercializados e na granulometria passante na peneira no 50 ABNT (50). Os resultados que estão mostrados na TABELA 3.
Nota-se que a granulometria tem maior influência na determinação do PN, influenciando pouco a determinação do CaO e quase nada a determinação do MgO. Por esse motivo, em geral a diferença entre o ECaCO3 calculado e o ECaCO3 determinado diminui para as amostras moídas. Portanto, a granulometria não justifica plenamente a diferença entre o ECaCO3 calculado e o ECaCO3 determinado.
2. Efeito da natureza geológica do calcário: No estudo do efeito da natureza geológica do calcário foram obtidos os resultados que estão apresentados na TABELA 4.
Também a natureza geológica dos calcários não mostra qualquer efeito na diferença entre os ECaCO3 calculado e determinado. O efeito da granulometria foi menos significativo do que nas amostras da TABELA 2, apesar das diferenças granulométricas, neste caso, terem sido bem mais acentuadas.
3. Efeito da relação CaO/MgO e dos teores de resíduo insolúvel (RI) e sexquióxidos (R2O3): No estudo do efeito da relação CaO/MgO e dos teores de RI e R2O3 foram obtidos os resultados que estão descritos na TABELA 5.
Os dados mostram que não existe qualquer correlação entre a diferença dos ECaCO3 calculados e determinados com a relação CaO/MgO ou com o teor de resíduo insolúvel ou com o teor de sexquióxidos.
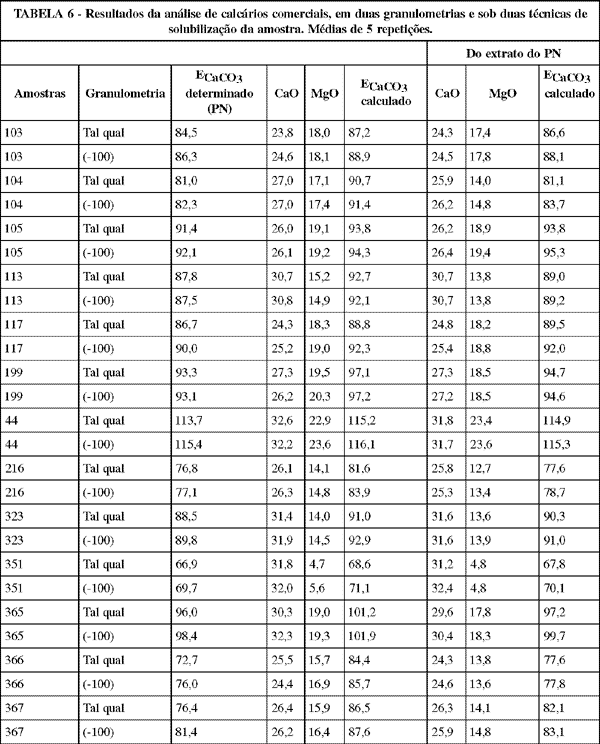
4. Efeito do processo de solubilização da amostra: Conforme já referido, o ataque da amostra para a determinação do cálcio e magnésio é muito mais enérgico do que para a determinação do PN. Na TABELA 6 estão apresentados os resultados dos teores de cálcio e de magnésio obtidos no extrato indicado para suas determinações (digestão enérgica) e os teores de cálcio e magnésio obtidos no extrato da determinação do poder de neutralização (digestão branda), acompanhados dos respectivos valores dos equivalentes em CaCO3 calculados.
Nota-se que nas amostras 103, 105, 117, 44, 323 e 351 os resultados de CaO, MgO e consequentemente de ECaCO3 calculados foram semelhantes nos dois extratos. Contudo, nas amostras 104, 113, 199, 216, 365, 366 e 367 o teor de MgO obtido no extrato do PN foi acentuadamente inferior daquele obtido no extrato indicado para essa determinação, tanto na granulometria natural da amostra como moída; já o teor de CaO foi só ligeiramente inferior. Isso permite supor que nestas últimas amostras uma fração do cálcio e principalmente do magnésio, se encontram em formas física ou química, não totalmente solubilizadas no processo de ataque da amostra empregado na determinação do PN. Embora esse ataque seja considerado brando do ponto de vista químico, é extremamente mais enérgico do que a ação solubilizante do solo sobre o corretivo. Portanto essas frações de cálcio e principalmente de magnésio não solubilizadas no extrato da determinação do PN podem ser consideradas como não aproveitáveis nem na correção da acidez dos solos e nem pelas plantas.
Outra observação interessante em relação a essas amostras é que o ECaCO3 calculado através dos teores de CaO e MgO determinados no extrato do PN é ligeiramente superior ao PN: sendo o mesmo extrato, pode-se inferir que a fração de CaO e MgO responsável por esse maior valor do ECaCO3 calculado é proveniente de cálcio e magnésio não associados à bases químicas efetivas.
CONCLUSÕES
1. A granulometria dos calcários tem influência significativa na determinação do poder de neutralização desses materiais.
2. Nem todo o cálcio e magnésio dos calcários devem estar associados a bases químicas efetivas mas também a fosfato, sulfato e outras bases de forças inexpressivas, assim como os constituintes neutralizantes podem estar aprisionados em cristais de outros componentes como sílica por exemplo, que só são atingidos por um ataque mais enérgico da amostra.
3. A avaliação química atual dos corretivos da acidez dos solos pode não estar se compatibilizando com o comportamento agrícola desses produtos.
Recebido para publicação em 28.09.95
Aceito para publicação em 20.08.96
- ALCARDE, J.C. Características de qualidade dos corretivos da acidez do solo. IN: SIMPÓSIO SOBRE "ACIDEZ E CALAGEM", XV REUNIĂO BRASILEIRA DE FERTILIDADE DO SOLO, Campinas, 1983; Anais. Sociedade Brasileira de Cięncia do Solo, 1983. p. 11-23.
- ALCARDE, J.C. Contraditória, confusa e polęmica: é a situaçăo do gesso na agricultura. - Piracicaba: POTAFÓS, 1988. p.1-3 (Informaçőes Agronômicas, 41).
- ASSOCIATION OF OFFICIAL ANALYTICAL CHEMISTS. Official Methods of Analysis. 14a. ed. Arlington: AOAC, 1984. 1141p.
- BRASIL. Ministério da Agricultura. Secretaria Nacional de Defesa Agropecuária. Análise de Corretivos, fertilizantes e inoculantes: métodos oficiais. Brasilia: LANARV, 1983. 104p.
- KOLTHOFF, I.M.; SANDELL, E.B. Textbook of quantitative inorganic analysis. 3 ed. New York: MacMillan, 1967. 759p.
Datas de Publicação
-
Publicação nesta coleção
10 Fev 1999 -
Data do Fascículo
Maio 1996
Histórico
-
Aceito
20 Ago 1996 -
Recebido
28 Set 1995