Resumos
Melasma é uma dermatose comum que cursa com alteração da cor da pele normal, resultante da hiperatividade melanocítica focal epidérmica de clones de melanócitos hiperfuncionantes, com consequente hiperpigmentação melânica induzida, principalmente, pela radiação ultravioleta. Clinicamente, caracteriza-se por manchas acastanhadas, localizadas preferencialmente na face, embora possa acometer também região cervical, torácica anterior e membros superiores.Mulheres em período fértil e de fototipos intermediários representam as populações mais acometidas. Grande parte de sua fisiopatogenia permanece desconhecida, havendo relação com fatores genéticos, hormonais, uso de medicamentos, cosméticos, endocrinopatias e fotoexposição. Os autores discutem os principais elementos relacionados à pigmentação da pele e ao desenvolvimento do melasma.
Melanose; Pigmentação da pele; Raios Ultravioleta; Transtornos da pigmentação
Melasma is a common dermatosis that involves changes in normal skin pigmentation, resulting from the hyperactivity of epidermal melanocytes. The consequent hyperpigmentation is mostly induced by ultraviolet radiation. Clinically, melasma is characterized by light to dark brown macules that usually occur on the face, although they can also affect the cervical and anterior thoracic regions and upper members.Fertile age women and those with intermediate skin phototypes are most likely to develop melasma. Most of its physiopathogenics is not yet fully understood, but there is a relation with genetic and hormonal factors, drugs and cosmetics use, endocrinopathies and sun exposure. The authors discuss the main aspects associated with skin pigmentation and the development of melasma.
Melanosis; Pigmentation disorders; Skin pigmentation; Ultraviolet rays
REVISÃO
Fisiopatologia do melasma
Luciane Donida Bartoli MiotI; Hélio Amante MiotII; Márcia Guimarães da SilvaIII; Mariângela Esther Alencar MarquesIV
IDoutora em Patologia, Dermatologista do Departamento de Dermatologia e Radioterapia da Faculdade de Medicina de Botucatu (Unesp) - Botucatu (SP), Brasil
IIProfessor Assistente Doutor do Departamento de Dermatologia e Radioterapia da Faculdade de Medicina de Botucatu (Unesp) - Botucatu (SP), Brasil
IIIProfessora Assistente Doutora do Departamento de Patologia da Faculdade de Medicina de Botucatu (Unesp) - Botucatu (SP), Brasil
IVProfessora Adjunta do Departamento de Patologia da Faculdade de Medicina de Botucatu (Unesp) - Botucatu (SP), Brasil
Endereço para correspondência/ Mailing Address : Endereço para correspondência Luciane Donida Bartoli Miot Departamento de Dermatologia da Faculdade de Medicina da Unesp, S/N. Campus Universitário de Rubião Jr. 18618-000 Botucatu SP Brasil Tel.:/Fax: 14 3882 4922 e-mail: lucianemiot@fmb.unesp.br
RESUMO
Melasma é uma dermatose comum que cursa com alteração da cor da pele normal, resultante da hiperatividade melanocítica focal epidérmica de clones de melanócitos hiperfuncionantes, com consequente hiperpigmentação melânica induzida, principalmente, pela radiação ultravioleta. Clinicamente, caracteriza-se por manchas acastanhadas, localizadas preferencialmente na face, embora possa acometer também região cervical, torácica anterior e membros superiores.Mulheres em período fértil e de fototipos intermediários representam as populações mais acometidas. Grande parte de sua fisiopatogenia permanece desconhecida, havendo relação com fatores genéticos, hormonais, uso de medicamentos, cosméticos, endocrinopatias e fotoexposição. Os autores discutem os principais elementos relacionados à pigmentação da pele e ao desenvolvimento do melasma.
Palavras-chave: Melanose; Pigmentação da pele; Raios Ultravioleta; Transtornos da pigmentação
INTRODUÇÃO
Cor da pele normal
A pele é o mais visível aspecto do fenótipo humano e sua cor é um de seus fatores mais variáveis. Pouco se conhece sobre as bases genéticas, evolutivas e os aspectos culturais relacionados ao estabelecimento dos padrões de cor da pele humana.1,2
Acredita-se que as variações, na cor da pele, sejam ganhos evolutivos e estejam relacionadas com a regulação da penetração da radiação ultravioleta (RUV).3,4
A síntese de vitamina D na pele, degradação de ácido fólico pela RUV, resistência à exposição solar direta e elementos culturais são argumentos sobre os quais tentam explicar a distribuição fenotípica da cor da pele em diferentes latitudes do planeta.5,6
A cor da pele humana normal é principalmente influenciada pela produção de melanina, um pigmento castanho denso, de alto peso molecular, o qual assume o aspecto enegrecido, quanto mais concentrado.7-9
No entanto, pigmentos exógenos amarelos - os carotenóides -, também contribuem para a coloração da pele, assim como o vermelho endógeno, da hemoglobina oxigenada nos capilares da derme e azul endógeno, da hemoglobina reduzida nas vênulas.7,9
Em humanos, a pigmentação da pele e dos cabelos é dependente da atividade melanogênica, dentro dos melanócitos, da taxa de síntese de melanina, bem como do tamanho, número, composição e distribuição de partículas do citoplasma dos melanócitos, denominadas melanossomas, além da natureza química da melanina que elas contêm.8-11
Os melanócitos e os melanossomas têm seu número relativamente constante, em diferentes etnias, como discutido adiante.9
Melanócitos
Melanócitos são células fenotipicamente importantes, responsáveis pela pigmentação da pele e dos pêlos, contribuindo para a tonalidade cutânea, conferindo proteção direta aos danos causados pela RUV.9
São células dendríticas, embriologicamente derivadas dos melanoblastos, os quais se originam da crista neural, migrando para a pele logo, após fechamento do tubo neural. Essa migração pode ocorrer para vários destinos, sendo que os sinalizadores para os quais direcionam tal processo, ainda precisam ser melhor caracterizados.8,12
Quando se tornam células completamente desenvolvidas, distribuem-se em diversos locais: olhos (epitélio pigmentar retiniano, íris e coróide), ouvidos (estrias vasculares), sistema nervoso central (leptomeninges), matriz dos pêlos, mucosas e pele.8,12
Na pele, estão localizados, na camada basal da epiderme e, ocasionalmente, na derme. Projetam seus dendritos, através da camada malpighiana, onde trans- ferem seus melanossomas aos ceratinócitos (Figura 1). Essa associação melanócito-ceratinócito é denominada: unidade epidérmico-melânica, e é constituída, nos humanos, por um melanócito e cerca de trinta e seis ceratinócitos.8,13,14
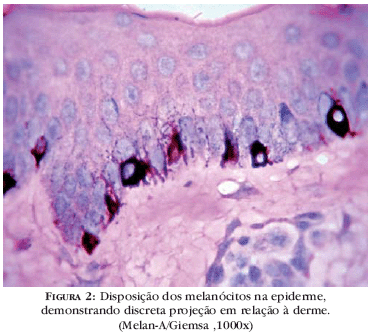
As células basais epidérmicas estão unidas às células vizinhas, por estruturas específicas, denominadas desmossomas, e à membrana basal, por hemidesmossomas. Os melanócitos não estão fixos na epiderme, identificando-se apenas, pequeno desnível na posição dos melanócitos, em relação ao alinhamento da camada basal, projetando-se, ligeiramente, em direção à derme (Figura 2).11
A densidade de melanócitos varia com os diferentes locais do corpo. Há em torno de dois mil ou mais melanócitos epidérmicos por milímetro quadrado de pele da cabeça e antebraço e cerca de mil, no restante do corpo, em todas as raças. Esta regulação exata do número de melanócitos, na epiderme, parece ser mediada pelos ceratinócitos e por mediadores específicos como o fator de crescimento de fibroblastos (FGF2).11
O número de melanócitos diminui com a idade, em áreas não fotoexpostas, na proporção de 6 a 8% por década, sendo que as diferenças raciais na pigmentação não são devidas a uma marcante variação no número de melanócitos, mas sim no seu grau de atividade (síntese de melanina e melanossomas), na proporção dos subtipos de melanina (feomelanina e eumelanina), suas distribuições e envolvimento de fatores ambientais como a exposição solar, já que estimulam diretamente a síntese de melanina.11,15
Nos melanócitos, a melanina produzida fica armazenada em estruturas intracitoplasmáticas específicas, denominadas melanossomas.
Melanossomas
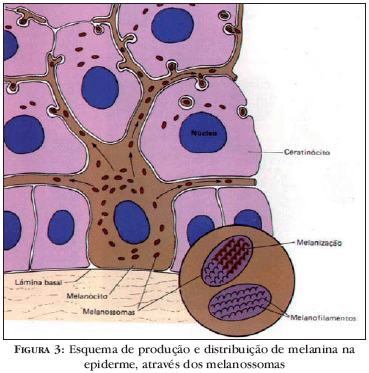
Melanossomas são organelas elípticas, altamente especializadas, nas quais ocorre síntese e deposição de melanina (Figura 3), armazenamento de tirosinase sintetizada pelos ribossomos, e representam a sede dos fenômenos bioquímicos em que originam a melanina.7
A síntese de melanina ocorre exclusivamente, nos melanossomas, sendo dependente de vários genes.
Melanossomas desenvolvem-se em uma série de estágios morfologicamente definidos (Figura 4), desde estruturas despigmentadas (estágio I) até organelas listradas repletas de melanina (estágio IV).11,16
A diferença fenotípica fundamental entre as raças mais pigmentadas e menos pigmentadas não reside na produção de melanina ou no número de melanócitos, mas, principalmente, na qualidade de seus melanossomas (Tabela 1). 16
Os melanossomas nos indivíduos negros são maiores e mais maduros do que nos brancos e são armazenados mais como unidades do que como grupamentos. Nos ceratinócitos, a degradação dos melanossomas maiores é retardada, o que também contribui para os níveis mais altos de pigmentação cutânea, nesses casos. 8 Os processos, aos quais se levam a essa diferença de comportamento, precisam ser melhores elucidados.
Nos melanossomas da pele normal, a melanina é extremamente densa, sendo um polímero nitrogenado, insolúvel e de alto peso molecular, formando um pigmento que, além de dar cor à pele, desempenha função protetora, filtrando e absorvendo as RUV. Desempenha, portanto, um importante papel fotoprotetor contra danos da RUV, como evidenciado por uma inversa correlação entre o conteúdo de melanina da pele humana e a incidência de carcinomas de pele e melanomas.11,17
Melanina
A melanina é o principal pigmento biológico envolvido na pigmentação cutânea, sendo determinante das diferenças na coloração da pele.11
O elemento inicial do processo biossintético da melanina é a tirosina, um aminoácido essencial. A tirosina sofre atuação química da tirosinase, complexo enzimático cúprico-proteico, sintetizado nos ribossomos e transferido, através do retículo endoplasmático para o Aparelho de Golgi, sendo aglomerado em unidades envoltas por membrana, ou seja, os melanossomas.11
Os três membros da família relacionada a tirosinase (tirosinase, Tyrp 1 tirosinase relacionada à proteína 1 e Dct dopacromo tautomerase) estão envolvidos no processo de melanogênese, levando a produção ou de eumelanina (marrom-preta) ou feomelanina (amarela-vermelha).18
Em presença de oxigênio molecular, a tirosinase oxida a tirosina em dopa (dioxifenilalanina) e esta em dopaquinona. A partir desse momento, a presença ou ausência de cisteína determina o rumo da reação para síntese de eumelanina ou feomelanina.19
Na ausência de cisteína (glutationa), a dopaquinona é convertida em ciclodopa (leucodopacromo) e esta em dopacromo. Há duas vias de degradação de dopacromo: uma que forma DHI (dopa,5,6 diidroxiindol) em maior proporção; e outra que forma DHICA (5,6 diidroxiindol-2-ácido carboxílico) em menor quantidade. Este processo é catalisado pela dopacro- mo tautomerase (Tyrp 2-Dct). Finalmente, estes diidroxiindóis são oxidados à melanina.19
A tirosinase relacionada à proteína 1 (Tyrp 1) parece estar envolvida na catalisação da oxidação da DHICA à eumelanina. Por outro lado, na presença de cisteína, dopaquinona rapidamente reage com tal substância para gerar 5-S-cisteinildopa, e, em menor proporção, a 2-S-cisteinildopa. Logo, as cisteinildopas são oxidadas em intermediários benzotiazínicos e, finalmente, produzem feomelanina (Figura 5).19
A eumelanina é um polímero marrom, alcalino e insolúvel e a feomelanina é um pigmento alcalino, solúvel e amarelado. Pigmentos semelhantes à feomelanina, no entanto, podem ser, estruturalmente, derivados da eumelanina, assim como esta pode ser oxidada, na presença de íons metálicos, resultando em um pigmento solúvel e mais claro. Outro pigmento sulfurado, derivado da feomelanina, pode ser encontrado em pequenas quantidades nos cabelos humanos vermelhos, é denominado tricromo. 13
Sendo assim, a melanogênese apresenta três passos distintos e importantes: o passo inicial é a produção de cisteinildopa, que continua tão intensa quanto for a quantidade de cisteína presente; o segundo passo é a oxidação da cisteinildopa para formar feomelanina - processo dependente da quantidade de cisteinildopa presente; o terceiro (e último) passo é a produção de eumelanina, onde somente tem início, após a maioria da cisteinildopa ser depletada. Entretanto, parece que a eumelanina se deposita sobre a feomelanina pré-formada e a relação entre feo e eumelanina é determinada pela atividade da tirosinase e disponibilidade de cisteína.19
A eumelanina absorve e dispersa a luz ultravioleta atenuando sua penetração na pele e reduzindo os efeitos nocivos do sol. Em outras palavras, indivíduos com maior pigmentação tendem a se queimar menos e bronzeiam mais do que indivíduos mais claros. 15,20,21
A feomelanina, por outro lado, tem um grande potencial em gerar radicais livres, em resposta à RUV, já que são capazes de causar danos ao DNA, dessa forma, podendo contribuir para os efeitos fototóxicos da RUV. Isto explica o porquê de as pessoas com pele clara, as quais contêm relativamente altas quantidades de feomelanina, apresentarem um risco aumentado de dano epidérmico, induzido por ultravioleta, inclusive neoplasias.20
Melanócitos individuais tipicamente sintetizam eumelaninas e feomelaninas, com a taxa das duas sendo determinada por um balanço de variáveis, incluindo expressão de enzimas pigmentares e a disponibilidade da tirosinase e de agentes redutores específicos na célula.9
O receptor de melanocortina do tipo 1 (MC1-R) controla a taxa de eumelanina e de feomelanina, dentro dos melanossomas. Essa proporção representa um importante determinante da sensibilidade solar no ser humano. Entretanto, é provável que a quantidade total de melanina produzida seja ainda mais importante que a relação entre os tipos de melanina.5 Sabe-se que melanócitos, derivados de pele intensamente pigmentada, apresentam uma quantidade maior de melanina total e também uma taxa maior de eumelanina do que os melanócitos, derivados de pele clara.10
A melanina total da pele resulta de uma mistura de monômeros de feomelanina e eumelanina e a proporção entre as duas determina a expressão feno- típica final da cor da pele e dos cabelos.
A redução na eumelanina e a presença predominante de feomelanina, como nos indivíduos ruivos, são reguladas em grande parte pelo MC1-R. 11
Dois tipos de pigmentação melânica são a base para a cor normal da pele:
- A cor da pele constitutiva é a cor geneticamente determinada da pele saudável, não-submetida à RUV, sobre a qual desempenha um papel essencial na fotoproteção à RUV, ao alcançar a Terra, visto que minimiza os danos ao DNA que levam ao aparecimento do câncer de pele.7,17
- A cor da pele facultativa é a cor de pele mais intensa, resultante de exposição solar ou de doenças pigmentantes, e reflete a capacidade geneticamente determinada de bronzeamento em resposta à RUV. Dessa forma, o grau de "bronzeamento" é geneticamente determinado e é a base para divisão da pele normal, em padrões de respostas adaptativas, chamadas fototipos.7
Após a síntese completa da melanina, os melanossomas, repletos desse pigmento, são injetados no interior dos ceratinócitos, da unidade epidérmicomelânica correspondente, através dos prolongamentos dendríticos dos melanócitos (atividade citocrínica Uma vez no interior dos ceratinócitos, os melanossomas tendem a distribuir-se no citoplasma, sobre a parte superior do núcleo, de forma a protegê-lo das radiações ultravioleta. Tem sido sugerido que o pigmento, no interior destas células atua, também, como varredor de radicais livres fotoproduzidos, sempre no sentido de proteger o DNA celular.12,22,23
As propriedades de fotoproteção da melanina, na pele humana, têm sido bem documentadas e ocorrem pela absorção e dispersão, tanto da luz ultravioleta quanto da luz visível. Essa absorção aumenta linearmente na faixa de 720-620 nm e então, exponencialmente, através de ondas mais curtas (300-600 nm). 17
A melanina tem grande afinidade pelo DNA, sendo capaz de produzir espécies reativas de oxigênio, em resposta à radiação ultravioleta A. Em indivíduos de pele clara, parece que a maior incidência de melanomas pode ser decorrente, não-somente da falta de proteção natural, mas sim de mutações aumentadas, promovendo a formação de feomelanina e/ou intermediários da melanina.8,11,24
Estudos ultraestruturais revelaram que eumelanossomas, onde, geralmente, são produzidos na pele morena, permanecem intactos na epiderme, após exposição à RUV, enquanto na pele clara, nenhum melanossoma intacto pode ser detectado, apos essa irradiacao.17
Os principais fatores reguladores para a quantidade e qualidade da melanina, produzida pelos melanocitos, incluem RUV, α-MSH (hormonio estimulante de melanocitos do tipo α ou melanocortina), ASP (proteina sinalizadora AGOUTI) e MC1-R.8,25
α-MSH e MC1-R
A pigmentacao melanica da pele humana sofre intenso controle hormonal. Em 1967, Snell sumarizou o prevalente, consenso acerca da acao hormonal nos melanocitos de mamiferos, particularmente, em humanos.26,27
Injecoes de α-MSH e β-MSH nos individuos humanos levaram a um escurecimento da pele, tanto que isso resultou na elevada melanogenese, dentro dos melanocitos epidermicos, e aumentou o transporte dos melanossomas, derivados de melanocitos, para os ceratinocitos, sem a necessidade de exposicao a RUV. A hiperpigmentacao cutanea foi tambem observada, quando individuos humanos foram injetados com altas doses de hormonio adrenocorticotropico (ACTH).11,26,28,29
O α-MSH e um tridecapeptideo, com uma sequencia identica aos 13 primeiros aminoacidos do ACTH. A clivagem proteolitica da proopiomelanocortina (POMC), na glandula pituitaria, e a responsavel pela origem de varios subprodutos, dentre eles: o α-MSH. E sabido tambem que POMC expressa e sofre clivagem em outros locais, incluindo o cerebro e a pele. O α-MSH foi o primeiro dos peptideos, derivados da POMC, a ser identificado na pele.20
Ceratinocitos humanos sao capazes de sintetizar α-MSH e β-MSH, em quantidades fisiologicas. O α- MSH e tambem produzido em melanocitos e celulas de Langerhans.9,11,17,25,30-34 Evidencias indicam que estes hormonios tem um papel paracrino, na regulacao das funcoes dos melanocitos. Mais de 120 genes tem sido identificados e parecem regular a pigmentacao, porem, os efeitos do α-MSH sao mediados pelo MC1-R, o qual e expresso na superficie dos melanocitos, sendo considerado o ponto chave para pigmentacao. Esta tambem presente, em outras celulas, tais como: monocitos, neutrofilos, celulas de glioma, astrocitos, macrofagos, fibroblastos, celulas endoteliais e ceratinocitos. Desde que MC1-R tenha uma distribuicao tecidual ampla, e provavel que esteja associado com um numero grande de funcoes biologicas. 9,11,17,25,30,32-35
Em 1992, Mountjoy et al.,36 da Universidade de Ciencias da Saude de Oregon, em Portland, relataram a clonagem do receptor hormonal de MC1-R, em humanos e ratos. Demonstraram tambem que mutacoes no gene deste receptor proporcionavam alteracoes na cor dos pelos em ratos. Em 1995, Valverde et al.37 relataram uma associacao semelhante entre formas aberrantes do receptor e variacoes na coloracao da pele e cabelos nas pessoas.
Apesar da identificacao de mais de 100 loci, envolvidos na pigmentacao dos vertebrados, o MC1-R e o maior determinante do fenotipo de pigmentacao. A extensao de seu locus foi, primeiramente, identificada em ratos, com base na alteracao da coloracao dos pelos. Os mutantes recessivos tinham pelos amarelados ou feomelanoticos, enquanto ratos tipo-selvagem tinham pelos escuros/marrons ou eumelanoticos.9
No inicio dos anos 90, foi realizada a caracterizacao molecular do receptor de MSH, entao, chamado de MC1-R e de seu antagonista - a AGOUTI proteina sinalizadora (ASP). Foi conhecido, por muitos anos, o envolvimento dos dois loci na regulacao qualitativa (eumelanina e feomelanina) e quantitativa da pigmentacao de mamiferos, sendo a ASP produzida nos foliculos e agindo nos melanocitos foliculares, pela inibicao da sintese de eumelanina.17,38,39 Previamente a clonagem, dois receptores de melanocortina, receptor de MSH e ACTH, foram descobertos por estudos farmacologicos e fisiologicos classicos.
O sistema melanocortina consiste de peptideos de varias formas de MSH (alfa, beta e gama) e ACTH, sendo descrita uma familia com cinco receptores de melanocortina, ligados a proteina G, com sete dominios transmembranicos (sete passagens pela membrana) e o ASP.17,38,39
O MC1-R foi o primeiro receptor de α-MSH a ser clonado e foi isolado de uma linhagem celular de melanoma.34 O gene do MC1-R humano esta localizado no cromossomo 16q24.3 e mostra uma estrutura de leitura de 951 pares de base que codificam uma proteina de 317 aminoacidos. A sequencia proteica humana demonstra todas as caracteristicas de receptores, acoplados a proteina G, incluindo a presenca de 7 fragmentos transmembrana e 2 locais de potencial N-glicosilacao. A ocorrencia de locais de ligacao especificos, de alta afinidade, na maioria dos melanocitos humanos, ja fora conhecida, antes mesmo da clonagem do gene MC1-R.25,40,41 Entretanto, o numero de locais de ligacao e variavel, podendo ser tao baixo quanto poucas centenas por celula, como detectado pela analise de Scatchard, usando probes radiomarcados. Ao MC1-R, ligam-se nao so o α-MSH, mas tambem o ACTH, β e λ MSH.34
Trata-se, entao, de um gene altamente polimorfico na populacao branca, e tais variacoes genicas estao associadas com pele clara e cabelos avermelhados, e agem na diminuicao da habilidade da epiderme em responder a RUV.
Atualmente, o gene do MC1-R e considerado um dos maiores marcadores de susceptibilidade a neoplasias malignas cutaneas, ja que variantes genicas estao associadas, com risco aumentado, para melanoma e canceres de pele nao-melanoma. 17,30,34,42-44
Outros estudos demonstraram que efelides e lentigos solares sao distintos tipos de lesoes pigmentadas, pois apresentam diferencas marcantes, nas suas etiologias, porem, variantes genicas do MC1-R sao um fator necessario para o desenvolvimento de efelides, quando desempenham um papel menos importante no caso dos lentigos.3,30,45,46
Variação relacionada ao gene MC1-R e excepcionalmente alta entre caucasianos e tem um significante impacto no fenotipo pigmentar deste grupo etnico. Cabelos vermelhos (ruivos) tem sido relacionados a alguns alelos, mas recentes estudos indicam que os mesmos genotipos podem expressar diferentes cores de cabelos, dependendo da populacao estudada.3,44
MC1-R esta expresso, abundantemente, em celulas de melanoma humano e de ratos e em niveis significativamente mais baixos em melanocitos de ratos. Mais recentemente, foi demonstrado em glandulas normais da pele humana e foliculos capilares, bem como em malformacoes e neoplasmas da pele.34
Na maioria dos individuos com pele clara, os quais nao se bronzeiam, e encontrada uma variacao na na sequencia genica do MC1-R classico, ja que normalmente confere cabelos escuros e facilidade para se bronzear.11 Desde que individuos com cabelos avermelhados e pele clara tenham predominancia de feomelanina, em cabelos e pele e/ou reduzida habilidade para sintetizar eumelanina, uma diminuicao funcional do MC1-R, com resultante reducao na atividade da tirosinase melanotropina-induzida, associada com eumelanogenese, pode ser a chave para a promocao da sintese de feomelanina dentro dos melanocitos humanos.
Sendo assim, o MC-1R dos melanocitos e, indubitavelmente, um importante elemento na regulacao da pigmentacao nos mamiferos, mas tambem um dos mais polimorficos.11,20,30,32-34,47 Sequencias genicas variantes sao encontradas, em mais de 80% dos individuos com cabelos vermelhos e pele clara, em menos de 20% dos individuos com cabelos castanhos ou pretos, e em menos de 4% daqueles que mostram uma boa resposta para se bronzear.34
O α-MSH sinaliza, atraves do MC1-R, ativando a adenilciclase (AC) e aumentando a adenosina monofosfato ciclico (AMPc) intracelular, resultando em producao do pigmento escuro de eumelanina (Figura 6). Se o MC1-R esta envolvido em outras vias sinalizadoras, ainda permanece desconhecido, mas a ativação do MC1-R influencia as quantidades relativas de feomelanina e eumelanina produzidas, sendo sua perda de atividade, associada a cabelos vermelhos ou amarelos. 20,34,38,39,48-52
Variantes do MC1-R tem sido associadas com a heranca de cabelo vermelho, na qual mais pigmento amarelo-avermelhado de feomelanina e produzido e apresentam capacidade de bronzeamento muito pequena. Variantes R160W, R151C, D294H, R142H, 86insA e 537insC de MC1-R sao os principais determinantes do fenotipo de cabelos vermelhos e pele clara. Trata-se de um fenotipo característico dos fototipos I e II, com maior chance de queimaduras solares e desenvolvimento de neoplasias cutâneas. 10,20,34
O gene murino AGOUTI, o qual foi recentemente clonado, esta localizado no cromossomo 2 e codifica a proteina ASP, composta por 131 aminoacidos, e age como antagonista competitivo de MC1-R, bloqueando sua ativacao pelo α-MSH. Entretanto, a troca entre eumelanogenese e feomelanogenese envolve a oposicao de efeitos da ASP e α-MSH, como ligantes para o MC1-R. A feomelanogenese pode ser estimulada por um tratamento in vitro com ASP recombinante purificada. Apos tratamento com ASP, a expressao de genes, codificando tirosinase e outras proteinas melanogenicas, e suprimida nos melanocitos, a qual exige outros fatores fisiologicos caracteristicos de feomelanogenese in vivo. Em melanocitos humanos normais, onde o numero de MC1-R expresso e relativamente baixo, ASP anula completamente os efeitos estimulatorios de α-MSH na proliferacao melanocitica e melanogenese. 17,25,53
A incapacidade de se bronzear nos individuos com variacao no MC1-R e consistente, com um papel critico para o MSH/AMPc nesta resposta, mas alguns estudos indicam que o dano ao DNA do melanocito pode mediar a pigmentacao induzida por RUV.54
RUV e Pigmentação
O espectro da radiacao solar e amplo, variando, desde os raios cosmicos (ultrarraios X), ate as radiacoes do infravermelho. As radiacoes de menor comprimento de onda, ate 200 nm, nao atingem a Terra, pois sao absorvidas pelo oxigenio e ozonio atmosfericos. 17,55 A RUV e a luz visivel situam-se entre 200 e 760 nm e constituem o espectro fotobiologico com o ultravioleta entre 200 e 400 nm e a visivel entre 400 e 760 nm. Alem desse limite, ate 17000 nm, esta o infravermelho, vindo a ser um indutor de calor.17,55
Os efeitos agudos da exposicao a RUV podem ser, basicamente, dois: queimadura e/ou bronzeamento. A resposta do individuo a exposicao a RUV, ou seja, o quanto consegue de bronzeamento, e um dos maiores exemplos de adaptacao ambiental dos humanos.9
Após uma unica exposicao a RUV, um aumento no tamanho dos melanocitos pode ser observado, acompanhado de um aumento da atividade da tirosinase. Exposicoes repetidas a RUV levam a um aumento no numero de melanossomas, estagio IV, transferidos aos ceratinocitos, bem como um aumento no numero de melanocitos ativos. Alem disso, a densidade dos melanocitos, em estudos comparativos, e maior nas areas fotoexpostas.16
Portanto, a RUV e um eficiente estimulante da pigmentacao da pele, em humanos, e e responsavel pela iniciacao da resposta de bronzeamento. Varios mecanismos podem estar envolvidos e acredita-se que a resposta seja resultado de uma combinacao de diferentes sinais, agindo tanto diretamente quanto indiretamente nos melanocitos. A acao indireta da RUV envolve a liberacao de mediadores dos ceratinocitos na pele.33,40
A radiacao ultravioleta B (UVB), na pele humana, induz a producao de α-MSH e ACTH nos melanocitos e ceratinocitos. O α-MSH estimula a atividade da tirosinase e a sintese de melanina in vivo e em cultura de melanocitos, via MC1-R. Outros relatos indicam que a irradiacao de melanocitos com RUV aumenta os niveis de RNAm de MC1-R. Alem disso, a sintese de muitos fatores epidermicos, incluindo α-MSH, ACTH e endotelina-1, e aumentada pela exposicao a RUV, sugerindo uma importante influencia desses mediadores na resposta dos melanocitos a luz solar. 32,56-58
O Ultravioleta C (UVC) (200-290 nm) e basicamente germicida, o UVB (290-320 nm) causa eritema, pigmentacao e, principalmente, alteracoes que induzem ao cancer cutaneo. Ja o ultravioleta A (UVA) (320- 400 nm) tem maior penetracao na pele, alem da pigmentacao e alteracoes cancerigenas, sendo o principal indutor de fotossensibilidade.55
O UVB e o principal responsavel pelas queimaduras solares, com surgimento do eritema, apos um periodo de latencia de 2 a 7 horas. Ja a UVA promove um eritema, que surge mais tardiamente, e pode tornar- se gradualmente mais intenso.55
A interacao dos hormonios e RUV pode ser ilustrada no melasma. A RUV estimula a producao de melanocortina, dentro dos melanocitos e ceratinocitos, o que justifica o envolvimento desse hormonio na patogenese do melasma, posto que se caracteriza basicamente por uma melanizacao epidermica aumentada, sem proliferacao melanocitica.11
Melasma
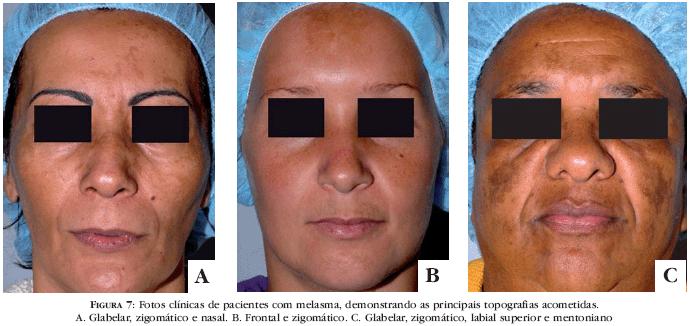
Melasma e uma hipermelanose comum, adquirida, simetrica, caracterizada por maculas acastanhadas, mais ou menos escuras, de contornos irregulares, mas limites nitidos, nas areas fotoexpostas, especialmente, face, fronte, temporas e, mais raramente, no nariz, palpebras, mento e membros superiores (Figura 7).59-62
Trata-se de doenca dermatologica facilmente diagnosticada ao exame clinico, porem, apresenta uma cronicidade caracteristica, com recidivas frequentes, grande refratariedade aos tratamentos existentes e ainda muitos aspectos fisiopatologicos desconhecidos.57
O nome melasma deriva do grego melas, significando negro. Cloasma e um termo que e usado com o mesmo sentido, sendo tambem derivado do grego cloazein, de: estar esverdeado. A denominacao melasma constitui, portanto, uma designacao mais adequada para a doenca.59
Embora possa acometer ambos os sexos e todas as racas, favorece fototipos intermediarios e individuos de origem oriental ou hispanica que habitam areas tropicais. E mais comum em mulheres adultas em idade fertil, podendo, porem, iniciar-se pos-menopausa. A idade de aparecimento situa-se entre 30-55 anos e o sexo masculino representa apenas 10% dos casos.7,57,61,63,64
Ainda que melasma seja mais frequente entre latinos, a exata prevalencia e desconhecida. Aproximadamente 66% das mulheres mexicanas desenvolvem melasma durante a gravidez, e um terco dessas mulheres mantem a pigmentacao pelo resto da vida.65-67
Para uma dimensao desse acometimento, de acordo com um censo de 2000, nos Estados Unidos, os latinos constituem 12,6% da populacao e estima-se que o numero aumente para 15,5% em 2010 e 24,4% em 2050.65,67
Não há um consenso sobre a classificacao clinica do melasma. Sao reconhecidos dois principais padroes de melasma da face: centrofacial, porque acomete a regiao central da fronte, regiao bucal, labial, regiao supralabial e regiao mentoniana; e malar, acomete regioes zigomaticas. Alguns autores acrescentam ainda um terceiro padrao, menos frequente, chamado mandibular. Ponzio & Cruz observaram em um estudo, 78,7% de melasmas centrais e 21,3% de perifericos.59,63,68
Há inúmeros fatores envolvidos, na etiologia da doença, porém nenhum deles pode ser responsabilizado isoladamente pelo seu desenvolvimento. Dentre estes: influências genéticas, exposição à RUV, gravidez, terapias hormonais, cosméticos, drogas fototóxicas, endocrinopatias, fatores emocionais, medicações anticonvulsivantes e outros com valor histórico. Porém, parece que predisposição genética e exposição às radiações solares desempenham um papel importante, tendo em vista que as lesões de melasma são mais evidentes, durante ou logo após períodos de exposição solar.7,60,62,63,68-70
Sacre et al., investigando o melasma idiopático, concluiu que as reservas tireotrófica, prolactínica e gonadotrófica apresentaram-se normais e, como observou, as funções ovariana e tireoidiana, também, normais, logo, não foi possível estabelecer correlação entre os níveis hormonais encontrados e essa forma de melasma.71
Ao contrário do que ocorre na gravidez, o melasma induzido por anovulatórios não involui com suspensão da droga e, entre as pacientes que o apresentaram pelos contraceptivos, 87% também o tinham manifestado em gestações anteriores.63
A predisposição genética tem sido sugerida pelos relatos de ocorrência familiar. Um fator racial tem sido relatado pela ocorrência comum de melasma, nos pacientes de origem hispânica. Sanchez et al. identificaram história familiar em mais que 20% dos casos estudados, e todas as pacientes referiram exacerbação pela luz solar e uso de cosméticos.59,72
Vale destacar que a melasma é uma das dermatoses inestéticas das quais determinam a grande procura ao atendimento dermatológico especializado, embora represente, somente, uma anormalidade comum e benigna da pigmentação. Talvez, isso se explique pela natureza cosmeticamente desfigurante e pelos efeitos emocionais e psicológicos nos indivíduos acometidos pelo problema, os quais, muitas vezes, em virtude da insatisfação com a aparência, acabam se privando do convívio social, inclusive com casos de suicídio relatados.65-67,69
Embora a afecção tenha uma conotação, muitas vezes, somente do ponto de vista estético, com tal preocupação, pode ser muito importante e impactante na vida social, familiar e profissional dos indivíduos acometidos, provocando efeitos psicológicos que não podem ser negligenciados.65,73
Em 2003, o MELASQoL, um novo instrumento de qualidade de vida relacionado à saúde para mulheres com melasma, foi publicado por Balkrishnan e colaboradores. Tal instrumento foi validado e demonstrou utilidade para monitorar o impacto, causado pelo melasma, na qualidade de vida dos pacientes. Os principais setores da qualidade de vida, que se mostraram afetados pelo melasma, foram: a vida social, a recreação e o lazer e o bem-estar emocional. Em 2006, tal instrumento foi traduzido para o português e adaptado culturalmente, de acordo com as regras estabelecidas pela Organização Mundial da Saúde.65-67,74
O tratamento do melasma é geralmente insatisfatório, pela grande recorrência das lesões e pela ausência de uma alternativa de clareamento definitivo. Estudos clínicos controlados indicam a fotoproteção e uso de clareadores como as medidas de primei- ra linha no seu tratamento.75-77 Entretanto, a discussao sobre as diversas modalidades terapeuticas, apesar do grande interesse clinico e academico, foge do escopo desse texto.
Sendo assim, contribuir para o entendimento do mecanismo pelos quais os melanocitos promovem uma coloracao fenotipica localizada, ou como a cor da pele, geneticamente pre-determinada, se torna alterada para uma cor induzida por fatores como: luz solar, hormonios, inflamacoes e outros. Torna-se tarefa de grande importancia, sendo que tais elucidacoes podem gerar importantes subsidios para inovacoes terapeuticas e como consequencia, melhora na qualidade de vida dos doentes.
Em conjunto, os estudos comparativos de pele, acometida por melasma, e pele adjacente normal, verificaram que a afeccao se caracteriza por hiperpigmentacao epidermica, sem aumento do numero de melanocitos ou da quantidade de melanina, em todas as camadas da epiderme, aumento no numero de melanossomas e da elastose dermica.57,78 A pigmentacao dermica nao difere na epiderme com melasma, e na pele sa adjacente, esse achado desabona a classificacao em melasma epidermico, dermico e misto visto a luz de Wood.2,57,59,63
Estudos recentes indicam que inumeros peptideos exercem uma regulacao autocrina ou paracrina dos melanocitos, na pele humana, e em diversas doencas pigmentares. Sao representados principalmente por: endotelina 1 (ET-1), fator estimulador de colonia granulocito-macrofago e fator stem cell tipo membrana (SCF). Tambem e conhecida a regulacao por oncogene- a relacionado ao crescimento, para interacoes entre melanocitos e ceratinocitos, fator de crescimento hepatocitico e fator stem cell,l tipo soluvel, para interacoes entre fibroblastos e melanocitos.1,79,80
Esta inter-relação tambem envolve alguns receptores especificos expressos nos melanocitos, como: o receptor de endotelina B, o receptor de fator stem cell e c-KIT. A up ou downregulation, dessa rede interligada, esta intrinsecamente envolvida na estimulacao das funcoes melanociticas, em varias desordens epidermicas que cursam com alteracoes na pigmentacao. 79,80
Achados imunohistoquimicos sugerem que uma forte imunorreatividade de α-MSH na pele lesada de melasma e um dos maiores fatores na genese dessa doenca. A relacao entre area fotoexposta e a maior imunorreatividade de α-MSH na pele lesada ainda nao foi elucidada. Entretanto, a existencia de um ainda desconhecido caminho sinalizador, com aumento de expressao de MC1-R, que pode desempenhar um papel significante nessa maior imunorreatividade ao α-MSH deve ser investigado. Ha evidencias de uma forte expressao de antigeno α-MSH nos ceratinocitos de pele lesada no melasma, sugerindo que α-MSH desempenha papel chave na hiperpigmentacao de pele com melasma.57,81
Dessa forma, a avaliacao da expressao de α- MSH e MC1-R na epiderme de lesoes de melasma, comparados a pele sa perilesional, permitiria uma estimativa do papel da via do MC1-R na fisiopatogenese da doenca.
Ainda o β-estradiol aumenta a expressao de α- MSH e MC1-R nos melanocitos.51 Alem disso, em estudo recente demonstrou-se uma expressao aumentada de receptores estrogenicos na pele com melasma, comparada a pele normal, porem a avaliacao foi de apenas dois pacientes e de forma qualitativa, o que nao permite ainda determinar a real funcao deste receptor e do estrogenio na fisiopatogenia do melasma.82
CONSIDERAÇÕES FINAIS
Melasma e uma doenca frequente na populacao geral, que gera grande impacto na qualidade de vida dos pacientes e movimenta grandes esforcos da pesquisa clinica e farmaceutica no desenvolvimento de tratamentos. Entretanto, o conhecimento relacionado a sua fisiopatogenia ainda e muito limitado.65,83
Investigação dos receptores de estrogenio, na epiderme e nos melanocitos das peles sa e lesada, seria esclarecedora quanto ao papel de hormonios esteroides sexuais, no processo da hiperpigmentacao localizada da doença.84-88
Pesquisa de variantes alelicas do MC1-R, que se expressem diferentemente na pele sa e lesada, poderiam justificar a pigmentacao mais efetiva, em certas areas fotoexpostas, do que em outras.30,46,89
Cultura de ceratinocitos e melanocitos, de pele sa e com melasma e de populacoes nao acometidas pela doenca, sob diferentes regimes de exposicao, permitiria um estudo comparativo da expressao de diversos genes para demonstrar as bases do comportamento fenotipico diferente desses grupos de celulas adjacentes, no mesmo tecido.90,91
A experimentação clinica com proteinas AGOUTI, em lesoes de melasma, que competem com α-MSH, nos receptores de MC1-R, poderia gerar subsidios fisiopatologicos para a compreensao do papel do sistema α-MSH/MC1-R, na fisiopatogenia da doenca.79,92
Perfis de citocinas melanogenicas sao expressas nas peles lesada e sa, assim como as celulas de origem, as decorrencias locais e os estimulos desencadeantes permitiriam uma compreensao dos elementos, envolvidos na genese do melasma.79,80,93,94
Enfim, estudos epidemiologicos de base populacional ou de subgrupos de pacientes com melasma, como gestantes, mulheres pos-menopausa ou homens tambem contribuiriam para a elaboracao de novas hipoteses sobre a historia natural e fisiopatogenese da doença.
Aprovado pelo Conselho Editorial e aceito para publicação em 30.06.2009.
- 1. Costin GE, Hearing VJ. Human skin pigmentation: melanocytes modulate skin color in response to stress. Faseb J. 2007;2:976-94.
- 2. Miot LDB, Miot HA, Silva MG, Marques MEA. Estudo comparativo morfofuncional de melanócitos em lesőes de melasma. An Bras Dermatol. 2007;82:529-64.
- 3. Sulem P, Gudbjartsson DF, Stacey SN, Helgason A, Rafnar T, Magnusson KP, et al. Genetic determinants of hair, eye and skin pigmentation in Europeans. Nat Genet. 2007;39:1443-52.
- 4. Ortonne JP [homepage on the Internet]. Skin color variations in humankind: an explanation? Nice: Pigmentary Disorders Academy; 2005 [cited 2009 Jun 23]. Available from: http://www.pigmentarydisordersacademy.org/guest_editorials_ortonne_skincolorjsp.
- 5. Jablonski NG, Chaplin G. The evolution of human skin coloration. J Hum Evol. 2000;39:57-106.
- 6. Relethford JH. Hemispheric difference in human skin color. Am J Phys Anthropol.1997;104:449-57.
- 7. Mosher DB, Fitzpatrick TB, Ortonne JP, Hori Y. Normal skin color and General Considerations of Pigmentary Disorders. In: Fitzpatrick TB, Eisen AZ, Wolff K, Freedberg IM, Austen KF. Dermatology in General Medicine. v. 1. New York: Mcgraw-Hill; 1999. p. 936-44.
- 8. Sulaimon SS, Kitchell BE. The biology of melanocytes. Vet Dermatol. 2003;14: 57-65.
- 9. Lin JY, Fisher DE. Melanocyte biology and skin pigmentation. Nature. 2007; 445:843-50.
- 10. Abdel-Malek ZA, Scott MC, Furumura M, et al. The melanocortin 1 receptor is the principal mediator of the effects of agouti signaling protein on mammalian melanocytes. J Cell Sci. 2001;114:1019-24.
- 11. Jimbow K, Quevedo Jr WC, Fitzpatrick TB et al. Biology of Melanocytes. In: Fitzpatrick TB, Eisen AZ, Wolff K, Freedberg IM, Austen KF. Dermatology in General Medicine. v. 1. New York: Mcgraw-Hill; 1999. p.192-220.
- 12. Boissy RE. The melanocyte. Its structure, function, and subpopulations in skin, eyes, and hair. Dermatol Clin. 1988;6:161-73.
- 13. Bleehen SS, Ebling FJG, Champion RH. Disorders of Skin Color. In: Champion RH, Burton JL, Ebling FJG. Eds Rook / Wilkinson / Ebling textbook of Dermatology. v. 2. Oxford: Blackwell Scientific publications; 1992. p.1561-2.
- 14. Storm CA, Elder DE. Pele. In: Rubin E, Gorstein F, Rubin R, Scwarting R, Strayer D. Patologia: Bases clínico-patológicas da medicina. vl. 1. Rio de Janeiro: Guanabara-Koogan; 2006. p.1224-91.
- 15. Jones K, Hughes J, Hong M, Jia Q, Orndorff S. Modulation of melanogenesis by aloesin: a competitive inhibitor of tyrosinase. Pigment Cell Res. 2002;15:335-40.
- 16. Bolognia JL, Orlow SJ. Melanocyte biology. In: Bolognia JL, Jorizzo JL, Rapini RP. Dermatology. v. 1. New York: Mosby; 2003.
- 17. Rouzaud F, Kadekaro AL, Abdel-Malek ZA, Hearing VJ. MC1R and the response of melanocytes to ultraviolet radiation. Mutat Res. 2005;57:133-52.
- 18. Murisier F, Beermann F. Genetics of pigment cells: lessons from the tyrosinase gene family. Histol Histopathol. 2006;2:567-78.
- 19. Ito S. A chemist's view of melanogenesis. Pigment Cell Res. 2003;16:230-6.
- 20. Thody AJ, Graham A. Does alpha-MSH have a role in regulating skin pigmentation in humans? Pigment Cell Res. 1998;1:265-74.
- 21. Wagner JK, Parra EJ, LNorton H, Jovel C, Shriver MD. Skin responses to ultraviolet radiation: effects of constitutive pigmentation, sex, and ancestry. Pigment Cell Re. 2002;15:385-90.
- 22. Hearing VJ. Biogenesis of pigment granules: a sensitive way to regulate melanocyte function. J Dermatol Sci. 2005;37:3-14.
- 23. Boissy RE. Melanosome transfer to and translocation in the keratinocyte. Exp Dermato. 2003;12 Suppl 2:5-12.
- 24. Szabo G, Hirobe T, Flynn EA, Garcia RI. The biology of the melanocyte. Prog Clin Biol Res.1988;256:463-74.
- 25. Rouzaud F, Hearing VJ. Regulatory elements of the melanocortin 1 receptor. Peptides. 2005;26:1858-70.
- 26. Slominski A, Tobin DJ, Shibahara S, Wortsman J. Melanin pigmentation in mammalian skin and its hormonal regulation. Physiol Rev. 2004;84:1155-228.
- 27. Klaus SN, Snell RS. The response of mammalian epidermal melanocytes in culture to hormones. J Invest Dermatol. 1967;48:352-8.
- 28. Barsh G, Attardi LD. A healthy tan? N Engl J Med. 2007;356:2208-10.
- 29. Wickelgren I. Skin biology. A healthy tan? Science. 2007; 315:1214-6.
- 30. Bastiaens M, ter Huurne J, Gruis N, Bergman W, Westendorp R, Vermeer BJ, et al. The melanocortin-1-receptor gene is the major freckle gene. Hum Mol Genet. 2001;10:1701-8.
- 31. Prusis P, Schioth HB, Muceniece R, Herzyk P, Afshar M, Hubbard RE, et al. Modeling of the three-dimensional structure of the human melanocortin 1 receptor, using an automated method and docking of a rigid cyclic melanocyte-stimulating hormone core peptide. J Mol Graph Model.1997;15:307-17,334.
- 32. Abdel-Malek Z, Scott MC, Suzuki I, Tada A, Im S, Lamoreux L, et al. The melanocortin-1 receptor is a key regulator of human cutaneous pigmentation. Pigment Cell Res. 2000;13 Suppl 8:156-62.
- 33. Thody AJ. alpha-MSH and the regulation of melanocyte function. Ann N Y Acad Sci. 1999;885:217-29.
- 34. Voisey J, Carroll L, van Daal A. Melanocortins and their receptors and antagonists. Curr Drug Targets. 2003;4:586-97.
- 35. Prusis P, Frandberg PA, Muceniece R et al. A three dimensional model for the interaction of MSH with the melanocortin-1 receptor. Biochem Biophys Res Commun. 1995;210:205-10.
- 36. Mountjoy KG, Robbins LS, Mortrud MT, Kalvinsh I, Wikberg JE. The cloning of a family of genes that encode the melanocortin receptors. Science. 1992;257:1248-51.
- 37. Valverde P, Healy E, Jackson I, Rees JL, Thody AJ. Variants of the melanocyte-stimulating hormone receptor gene are associated with red hair and fair skin in humans. Nat Genet. 1995;11:328-30.
- 38. Rees JL. The melanocortin 1 receptor (MC1R): more than just red hair. Pigment Cell Res. 2000;13:135-40.
- 39. Tan CP, McKee KK, Weinberg DH, MacNeil T, Palyha OC, Feighner SD, et al. Molecular analysis of a new splice variant of the human melanocortin-1 receptor. FEBS Lett.1999;451:137-41.
- 40. Rouzaud F, Costin GE, Yamaguchi Y, Valencia JC, Berens WF, Chen KG, et al. Regulation of constitutive and UVRinduced skin pigmentation by melanocortin 1 receptor isoforms. Faseb J. 2006; 20:1927-9.
- 41. Schaffer JV, Bolognia JL. The melanocortin-1 receptor: red hair and beyond. Arch Dermatol. 2001;137:1477-85.
- 42. Loir B, Perez Sanchez C, Ghanem G, Lozano JA, García-Borrón JC, Jiménez-Cervantes C. Expression of the MC1 receptor gene in normal and malignant human melanocytes. A semiquantitative RT-PCR study. Cell Mol Biol (Noisy-le-grand).1999;45:083-92.
- 43. Leonard JH, Marks LH, Chen W, Cook AL, Boyle GM, Smit DJ, et al. Screening of human primary melanocytes of defined melanocortin-1 receptor genotype: pigmentation marker, ultrastructural and UVsurvival studies. Pigment Cell Res. 2003;16:198-207.
- 44. Branicki W, Brudnik U, Kupiec T, Wolańska-Nowak P, Wojas-Pelc A. Determination of phenotype associated SNPs in the MC1R gene. J Forensic Sci. 2007;52:349-54.
- 45. Branicki W, Brudnik U, Kupiec T. J Invest Dermatol. 2004;123:414.
- 46 Motokawa T, Kato T, Hashimoto Y, Katagiri T. Effect of Val92Met and Arg163Gln variants of the MC1R gene on freckles and solar lentigines in Japanese. Pigment Cell Res. 2007;20:140-3.
- 47. Abdel-Malek Z, Suzuki I, Tada A, Im S, Akcali C. The melanocortin-1 receptor and human pigmentation. Ann N Y Acad Sci. 1999;885:117-33.
- 48. Ha T, Rees JL. Melanocortin 1 receptor: what's red got to do with it? J Am Acad Dermatol. 2001;45:961-4.
- 49. Ha T, Naysmith L, Waterston K, Oh C, Weller R, Rees JL. Defining the quantitative contribution of the melanocortin 1 receptor (MC1R) to variation in pigmentary phenotype. Ann N Y Acad Sci. 2003;994:339-47.
- 50. Scott MC, Wakamatsu K, Ito S, Kadekaro AL, Kobayashi N, Groden J, et al. Human melanocortin 1 receptor variants, receptor function and melanocyte response to UV radiation. J Cell Sci. 2002;115:2349-55.
- 51. Scott MC, Suzuki I, Abdel-Malek ZA. Regulation of the human melanocortin 1 receptor expression in epidermal melanocytes by paracrine and endocrine factors and by ultraviolet radiation. Pigment Cell Res. 2002;15:433-9.
- 52. Gantz I, Yamada T, Tashiro T, Konda Y, Shimoto Y, Miwa H, et al. Mapping of the gene encoding the melanocortin-1 (alpha-melanocyte stimulating hormone) receptor (MC1R) to human chromosome 16q24.3 by Fluorescence in situ hybridization. Genomics. 1994;19:394-5.
- 53. Hunt G, Thody AJ. Agouti protein can act independently of melanocyte-stimulating hormone to inhibit melano genesis. J Endocrinol. 1995;147:R1-4.
- 54. D'Orazio JA, Nobuhisa T, Cui R, Arya M, Spry M, Wakamatsu K, et al. Topical drug rescue strategy and skin protection based on the role of Mc1r in UV-induced tanning. Nature. 2006;443:340-4.
- 55. Sampaio SAP, Rivitti EA. Fotodermatoses. In: Sampaio SAP, Rivitti EA. Dermatologia. v. 1. Săo Paulo: Artes médicas; 1998. p. 629-42.
- 56. Funasaka Y, Chakraborty AK, Hayashi Y, Komoto M, Ohashi A, Nagahama M, et al. Modulation of melanocyte-stimulating hormone receptor expression on normal human melanocytes: evidence for a regulatory role of ultraviolet B, interleukin-1alpha, interleukin-1beta, endothelin-1 and tumour necrosis factor-alpha. Br JDermatol. 1998;139:216-24.
- 57. Kang WH, Yoon KH, Lee ES, Kim J, Lee KB, Yim H, et al. Melasma: histopathological characteristics in 56 Korean patients. Br J Dermatol. 2002;146:228-37.
- 58. Bohm M, Metze D, Schulte U, Becher E, Luger TA, Brzoska T. Detection of melanocortin-1 receptor antigenicity on human skin cells in culture and in situ. Exp Dermatol. 1999;8:453-61.
- 59. Sanchez NP, Pathak MA, Sato S, Fitzpatrick TB, Sanchez JL, Mihm MC Jr. Melasma: a clinical, light microscopic, ultrastructural, and immunofluorescence study. J Am Acad Dermatol. 1981;4:698-710.
- 60. Johnston GA, Sviland L, McLelland J. Melasma of the arms associated with hormone replacement therapy. Br J Dermatol. 1998;139:932.
- 61. Piamphongsant T. Treatment of melasma: a review with personal experience. Int J Dermatol. 1998;3:897-903.
- 62. Grimes PE. Melasma. Etiologic and therapeutic considerations. Arch Dermatol. 1995;131:1453-7.
- 63. Ponzio HAS. Contribuiçăo ŕ classificaçăo clínica e histopatológica dos melasmas [dissertaçăo]. Porto Alegre: UFRGS; 1995. p. 157.
- 64. Guevara IL, Pandya AG. Melasma treated with hydroquinone, tretinoin, and a fluorinated steroid. Int J Dermatol. 2001;40:212-5.
- 65. Balkrishnan R, McMichael AJ, Camacho FT, Saltzberg F, Housman TS, Grummer S, et al. Development and validation of a health-related quality of life instrument for women with melasma. Br J Dermatol. 2003;149:572-7.
- 66. Cestari TF, Hexsel D, Viegas ML, Azulay L, Hassun K, Almeida AR, et al. Validation of a melasma quality of life questionnaire for Brazilian Portuguese language: the MelasQoL-BP study and improvement of QoL of melasma patients after triple combination therapy. Br J Dermatol. 2006;156 Suppl 1:13-20.
- 67. Dominguez AR, Balkrishnan R, Ellzey AR, Pandya AG. Melasma in Latina patients: cross-cultural adaptation and validation of a quality-of-life questionnaire in Spanish language. J Am Acad Dermatol. 2006;55:59-66.
- 68. Ponzio HAS, Cruz MF. Acurácia do exame sob a lâmpada de Wood na classificaçăo dos cloasmas. An Brás Dermatol. 1993;68:325-8.
- 69. Wolf R, Wolf D, Tamir A, Politi Y. Melasma: a mask of stress. Br J Dermatol. 1991; 125: 192-3.
- 70. Robins AH. Melanosis after prolonged chlorpromazine therapy. S Afr Med J. 1975;49:1521-4.
- 71. Sacre RC, Fernandes NC, Vaisman M, Tendrich M. Melasma idiopático: avaliaçăo das funçőes tireoidiana, prolactínica e gonadal feminina. An Bras Dermatol. 1996;71:195-8.
- 72. Scheinfeld NS. Melasma. Skinmed. 2007;6:35-7.
- 73. Rigopoulos D, Gregoriou S, Katsambas A. Hyperpigmentation and melasma. J Cosmet Dermatol. 2007;6:195-202.
- 74. Grimes P, Nordlund JJ, Pandya AG, Taylor S, Rendon M, Ortonne JP. Increasing our understanding of pigmentary disorders. J Am Acad Dermatol. 2006;54:S255-61.
- 75. Pandya A, Berneburg M, Ortonne JP, Picardo M. Guidelines for clinical trials in melasma. Pigmentation Disorders Academy. Br J Dermatol. 2006;156 Suppl 1: 21-8.
- 76. Hexsel D, Arellano I, Rendon M. Ethnic considerations in the treatment of Hispanic and Latin-American patients with hyperpigmentation. Br J Dermatol. 2006; 156 Suppl:7-12.
- 77. Rendon M, Berneburg M, Arellano I, Picardo M. Treatment of melasma. J Am Acad Dermatol. 2006;54:S272-81.
- 78. Toyoda M, Morohashi M. Morphological alterations of epidermal melanocytes in photoageing: an ultrastructural and cytomorphometric study. Br J Dermatol. 1998;139:444-52.
- 79. Imokawa G. Autocrine and paracrine regulation of melanocytes in human skin and in pigmentary disorders. Pigment Cell Res. 2004;17:96-110.
- 80. Kang HY, Hwang JS, Lee JY, Ahn JH, Kim JY, Lee ES, et al. The dermal stem cell factor and c-kit are overexpressed in melasma. Br J Dermatol. 2006;154:1094-9.
- 81. Im S, Kim J, On WY, Kang WH. Increased expression of alpha-melanocyte-stimulating hormone in the lesional skin of melasma. Br J Dermatol. 2002;146: 165-7.
- 82. Lieberman R, Moy L. Estrogen receptor expression in melasma: results from facial skin of affected patients. J Drugs Dermatol. 2008;7:463-5.
- 83. Grimes PE, Yamada N, Bhawan J. Light microscopic, immunohistochemical, and ultrastructural alterations in patients with melasma. Am J Dermatopathol. 2005;27:96-101.
- 84. Pache M, Glatz-Krieger K, Sauter G, Meyer P. Expression of sex hormone receptors and cell cycle proteins in melanocytic lesions of the ocular conjunctiva. Graefes Arch Clin Exp Ophthalmol. 2006;244:113-7.
- 85. Matsumura R, Takeuchi S, Takahashi S. Effect of estrogen on melanocortin-3 receptor mRNA expression in mouse pituitary glands in vivo and in vitro. Neuroendocrinology. 2004;80:143-51.
- 86. Chowers I, Livni N, Frucht-Pery J, Pe'er J. Immunostaining of the estrogen receptor in conjunctival primary acquired melanosis. Ophthalmic Res. 1999;31:210-2.
- 87. Jee SH, Lee SY, Chiu HC, Chang CC, Chen TJ. Effects of estrogen and estrogen receptor in normal human melanocytes. Biochem Biophys Res Commun. 1994;199:1407-12.
- 88. Sawaya ME, Garland LD, Rothe MJ, Honig LS, Hsia SL. Oestrogen and progesterone receptors in lentigo maligna. Br J Dermatol. 1988;118:69-71.
- 89. Naysmith L, Waterston K, Ha T, Flanagan N, Bisset Y, Ray A, et al. Quantitative measures of the effect of the melanocortin 1 receptor on human pigmentary status. J Invest Dermatol.2004;122:423-8.
- 90. Carroll L, Voisey J, van Daal A. Gene polymorphisms and their effects in the melanocortin system. Peptides. 2005;26:1871-85.
- 91. Rees JL. Genetics of hair and skin color. Annu Rev Genet. 2003;37:67-90.
- 92. Carlson JA, Linette GP, Aplin A, Ng B, Slominski A. Melanocyte receptors: clinical implications and therapeutic relevance. Dermatol Clin. 2007;25:541-57, viii-ix.
- 93. Sriwiriyanont P, Ohuchi A, Hachiya A, Visscher MO, Boissy RE. Interaction between stem cell factor and endothelin-1: effects on melanogenesis in human skin xenografts. Lab Invest. 2006;86:1115-25.
- 94. Tada A, Suzuki I, Im S et al. Endothelin-1 is a paracrine growth factor that modulates melanogenesis of human melanocytes and participates in their responses to ultraviolet radiation. Cell Growth Differ. 1998;9:575-84.
Datas de Publicação
-
Publicação nesta coleção
25 Fev 2010 -
Data do Fascículo
Dez 2009
Histórico
-
Aceito
30 Jun 2009 -
Recebido
30 Jun 2009