Resumos
FUNDAMENTOS: A psoríase leva a um impacto negativo significativo na qualidade de vida e está associada a comorbidades. A atividade inflamatória das placas psoríacas se inicia, em parte, pela ativação de linfócitos Th1, que liberam citocinas pró-inflamatórias, como TNF alfa. Infliximabe neutraliza a atividade biológica do TNF alfa. Reações adversas que ocorrem durante a infusão e até 24 horas após são chamadas de agudas. Reações tardias ocorrem entre 24 horas e 14 dias após infusão. OBJETIVO: Avaliar o perfil dos pacientes com psoríase moderada a grave e resistente ao tratamento convencional, bem como as reações adversas ao infliximabe. MÉTODO: Foram tratados com infliximabe 53 pacientes: 40 homens e 13 mulheres. A dose utilizada foi 5 mg/kg nas semanas 0, 2 e 6 (fase de indução), seguida da fase de manutenção a cada oito semanas. RESULTADO: Dentre os 53 pacientes, seis se submeteram apenas à fase de indução, obtiveram Pasi 90-100 e não receberam mais a droga. Quarenta e sete pacientes continuaram recebendo a medicação por pelo menos dois, três anos. Deles, 55,3% (26) apresentaram algum efeito adverso. Os efeitos adversos precoces foram observados em 34% dos pacientes, e os tardios, em 36,1% dos pacientes. Foi encontrada uma prevalência de 57,4% de comorbidades nesses pacientes. CONCLUSÃO: O infliximabe mostrou-se seguro e eficaz no presente estudo. Dentre as comorbidades associadas aos pacientes neste estudo, a obesidade se relacionou com uma resposta mais tardia e menos eficiente. Efeitos adversos precoces e tardios, quando bem monitorados, não impedem a manutenção da terapêutica e não expõem os pacientes a riscos não controlados.
Imunidade; Psoríase; Terapêutica; Tratamento biológico
BACKGROUND: Psoriasis exerts a significant negative effect on quality of life and is associated with comorbidities. The inflammatory activity of the psoriasis plaques is partially triggered by activation of the Th1 lymphocytes, which release proinflammatory cytokines such as TNF-alpha. Infliximab neutralizes the biological activity of TNF-alpha. Adverse reactions that occur during infusion or up to 24 hours afterwards are referred to as acute reactions. Delayed reactions are those occurring between 24 hours and 14 days after an infusion. OBJECTIVE: To evaluate the profile of patients with moderate to severe psoriasis that is resistant to conventional treatment, and to assess adverse reactions to infliximab. METHODS: Fifty-three patients, 40 men and 13 women, were treated with infliximab. The dose used was 5 mg/kg in weeks 0, 2 and 6 (induction phase), followed by maintenance therapy every 8 weeks. RESULTS: Of the 53 patients, 6 participated only in the induction phase. These patients reached Psoriasis Area Severity Index (PASI) of 90-100 and opted to discontinue treatment. Forty-seven patients continued therapy with the drug for at least 2-3 years. Of these, 55.3% (n=26) experienced some type of adverse event. Acute adverse events were recorded in 34% of the patients and delayed adverse events in 36.1%. The prevalence of comorbidities was 57.4%. CONCLUSION: In the present study, infliximab was found to constitute a safe and effective form of therapy. Of the comorbidities recorded in the patients in this study, obesity was associated with a delayed and less effective response to treatment. When adequately monitored, neither acute nor delayed adverse events require discontinuation of therapy, since they do not represent an uncontrolled risk to the patient.
Biological treatment; Immunity; Psoriasis; Therapeutics
INVESTIGAÇÃO
Psoríase moderada a grave tratada com infliximabe em 53 pacientes: perfil dos pacientes, eficácia e efeitos adversos* * Trabalho realizado no Departamento de Dermatologia da Universidade de Santo Amaro (Unisa) - São Paulo (SP), Brasil.
Artur Antonio DuarteI; Flavia Barbour ChehinII
IDoutor em dermatologia; professor titular da Faculdade de Medicina Santo Amaro - Universidade de Santo Amaro (Unisa) - São Paulo (SP), Brasil
IIMédica dermatologista; colaboradora do serviço de dermatologia da Faculdade de Medicina Santo Amaro - Universidade de Santo Amaro (Unisa) - São Paulo (SP), Brasil
Endereço para correspondência Endereço para correspondência: Flavia Barbour Chehin Rua Carlos Steinen, 335, ap. 12 04004-012 São Paulo, SP E-mail: fchehin@uol.com.br
RESUMO
FUNDAMENTOS: A psoríase leva a um impacto negativo significativo na qualidade de vida e está associada a comorbidades. A atividade inflamatória das placas psoríacas se inicia, em parte, pela ativação de linfócitos Th1, que liberam citocinas pró-inflamatórias, como TNF alfa. Infliximabe neutraliza a atividade biológica do TNF alfa. Reações adversas que ocorrem durante a infusão e até 24 horas após são chamadas de agudas. Reações tardias ocorrem entre 24 horas e 14 dias após infusão.
OBJETIVO: Avaliar o perfil dos pacientes com psoríase moderada a grave e resistente ao tratamento convencional, bem como as reações adversas ao infliximabe.
MÉTODO: Foram tratados com infliximabe 53 pacientes: 40 homens e 13 mulheres. A dose utilizada foi 5 mg/kg nas semanas 0, 2 e 6 (fase de indução), seguida da fase de manutenção a cada oito semanas.
RESULTADO: Dentre os 53 pacientes, seis se submeteram apenas à fase de indução, obtiveram Pasi 90-100 e não receberam mais a droga. Quarenta e sete pacientes continuaram recebendo a medicação por pelo menos dois, três anos. Deles, 55,3% (26) apresentaram algum efeito adverso. Os efeitos adversos precoces foram observados em 34% dos pacientes, e os tardios, em 36,1% dos pacientes. Foi encontrada uma prevalência de 57,4% de comorbidades nesses pacientes.
CONCLUSÃO: O infliximabe mostrou-se seguro e eficaz no presente estudo. Dentre as comorbidades associadas aos pacientes neste estudo, a obesidade se relacionou com uma resposta mais tardia e menos eficiente. Efeitos adversos precoces e tardios, quando bem monitorados, não impedem a manutenção da terapêutica e não expõem os pacientes a riscos não controlados.
Palavras-chave: Imunidade; Psoríase; Terapêutica; Tratamento biológico
INTRODUÇÃO
A psoríase é uma dermatose frequente na prática diária no Brasil e no mundo, estimando-se que deva afetar até 3% da população mundial.1,2,3,4 É doença inflamatória crônica com predileção pela pele e articulações, de etiologia multifatorial com influência genética e ambiental, que se caracteriza pela hiperproliferação e diferenciação anormal dos queratinócitos, imunologicamente mediada (Th1) e associada a comorbidades, principalmente relacionadas às manifestações clínicas da síndrome metabólica, além das espondiloartropatias, uveítes e síndromes inflamatórias intestinais. A psoríase leva a um impacto negativo significativo na qualidade de vida do paciente e está associada à diminuição da produtividade, depressão, alcoolismo, tabagismo e aumento na prevalência de doenças neoplásicas.1,5,6
A atividade inflamatória das placas psoríacas se inicia, em parte, pela ativação de linfócitos T na epiderme e derme. Os linfócitos Th1 são os que predominam nas lesões e liberam citocinas pró-inflamatórias, como TNF alfa, interleucinas 6 e 8, além de outros.5,7 O TNF alfa parece ser o mediador pró-inflamatório com maior influência na inflamação clássica da psoríase, além de participar de várias outras reações fisiológicas. Sua inibição, consequentemente, melhora a psoríase; daí, a introdução de novas terapias dirigidas para a neutralização dessas citocinas passa a ser fundamental para o tratamento da doença.8
O infliximabe neutraliza a atividade biológica do TNF alfa pela alta afinidade aos receptores do TNF solúvel e transmembrânico, formando um complexo antígeno-anticorpo que impede a ligação da molécula do TNF alfa aos receptores da célula alvo. Consequentemente a célula deixa de ter o estímulo pró-inflamatório, ocorrendo a inibição da proliferação celular característica da psoríase e de outras doenças mediadas pelo TNF alfa, como artrite reumatoide, doença de Crohn, retocolite ulcerativa e espondilite anquilosante.7,9,10
Apesar da sua eficácia, diversos efeitos colaterais e adversos são descritos na literatura e observados na nossa prática: indução e exacerbação da psoríase,5,11 reativação de foco primário de tuberculo se,12,13 indução de pitiríase liquenoide crônica,14 formação de anticorpos anti-DNA,1 síndrome lúpuslike,15 malignidades,16 entre outros. Essas reações podem ocorrer durante e após as infusões.17 As reações infusionais ocorrem em 3-22% dos pacientes com psoríase tratados com o anti-TNF alfa monoclonal.17 Em infusão de placebos, a frequência é de aproximadamente 0-2%.9,18 A maioria dessas reações são leves ou moderadas.17
Reações adversas que ocorrem durante a infusão e até 24 horas após são chamadas de agudas, porém a maioria ocorre durante ou nas primeiras duas horas pós-infusão.17,19,20 Os sintomas incluem flushing, aperto no peito, náuseas, dispneia, cefaleia, hipo/hipertensão, sudorese, aumento da temperatura e outros sintomas de anafilaxia, como urticária e broncoespasmo.10,17,19 Reações tardias ocorrem entre 24 horas e 14 dias após infusão, sendo a maioria após cinco a sete dias. Na maioria dos casos, os sintomas incluem artralgia, mialgia, sintomas influenza-like, cefaleia, cansaço, rash e urticária.9,17,19,21
Neste estudo relataremos a experiência da infusão de infliximabe no ambulatório de dermatologia da Universidade de Santo Amaro (Unisa) em 53 pacientes.
MATERIAL E MÉTODOS
O infliximabe, droga avaliada neste estudo, é um anticorpo monoclonal quimérico com peso molecular de aproximadamente 149.100 daltons. É composto de uma região humana constante e uma região variável murina.1,17 O medicamento é comercializado em frasco estéril, na forma de um pó branco que deve ser diluído em 10 ml de água destilada, resultando em um pH de aproximadamente 7,2. Cada frasco, após a diluição, contém 100 mg de infliximabe para uso endovenoso.
A psoríase em placas é tratada com 5 mg/kg de infliximabe inicialmente nas semanas 0 (primeira aplicação), 2 (duas semanas após) e 6 (seis semanas após). Assim se completa a fase de indução, e a partir daí as infusões devem ser feitas a cada oito semanas (fase de manutenção). Nessa dose, a meia-vida do infliximabe é de 7,7 a 9,5 dias.
Foram tratados com infliximabe no serviço de dermatologia da Unisa, durante o período de março de 2003 até agosto de 2009, 53 pacientes (40 homens e 13 mulheres) conforme preconizado para o uso da droga, com tempo de infusão de aproximadamente duas horas e meia em média.
Foram incluídos todos os pacientes com psoríase moderada a grave que não obtiveram resposta satisfatória (mínimo de Pasi 50) ou que demonstraram efeitos colaterais ao tratamento sistêmico convencional (metotrexate, ciclosporina, acitretin e fototerapia) e apresentavam triagem laboratorial normal ou negativa para: hemograma, enzimas de função hepática, sorologias para HIV e hepatites B e C, radiografia do tórax, PPD e fator antinúcleo (FAN). Nesse grupo só foram incluídos pacientes com PPD menor ou igual a 5 e sem imagem radiológica pulmonar suspeita para tuberculose.
A rotina de atendimento desses pacientes na fase de manutenção era a seguinte:
exame clínico e laboratorial (hemograma, ureia, creatinina, transaminases) duas semanas antes da infusão;
exame clínico no ato da infusão;
exame clínico e laboratorial duas semanas após a infusão;
pesquisa de FAN ao término da fase de infusão e quatro semanas após a primeira, quarta e oitava manutenções.
O estudo avaliou a eficácia e os efeitos adversos precoces e tardios conforme classificação na literatura.1
O paciente com maior tempo de observação clínica já recebeu 40 aplicações (340 semanas; manutenção) e o com menor tempo de observação recebeu sete aplicações (54 semanas; manutenção). Em média os pacientes do estudo foram observados durante 171 semanas (3,1 anos).
RESULTADOS
Dentre os 53 pacientes, seis se submeteram apenas à fase de indução, obtiveram Pasi 90-100 e optaram por não mais receber a droga, mantendo-se em observação clínica: três deles foram seguidos regularmente por 24 meses com Pasi 75-90 e mantidos com medicamentos tópicos, sendo que um deles mantém Pasi 75 e recorre à fototerapia (UVB) quando surgem novas lesões; os outros três pacientes foram seguidos por três a seis meses após a indução, mantinham-se com Pasi 75-100, porém não mais retornaram ao ambulatório após esse período. Assim, ficaram em observação, recebendo a droga por pelo menos um ano e três meses, 47 pacientes. Deles, 55,3% (26) apresentaram algum efeito adverso. Os efeitos adversos precoces foram observados em 34% dos pacientes e os tardios foram observados em 36,1% dos pacientes.
Analisando o perfil dos pacientes estudados, observamos idade média de 49,2 anos, sendo que o mais jovem, no início da observação, tinha 19 anos e o mais velho, 73 anos. Foi encontrada uma prevalência de 57,4% de comorbidades nesses pacientes. As mais frequentes foram hipertensão e obesidade.
Dentre os efeitos adversos precoces, observamos: urticária em quatro pacientes, aumento da pressão arterial em cinco, taquicardia em sete, resfriamento do membro da infusão em dois, sudorese em cinco, tontura em um e cólica renal também em um. Neste, a cólica renal determinou a suspensão definitiva da medicação.
Os efeitos adversos tardios observados foram: positividade do FAN em sete pacientes, aumento transitório de enzimas hepáticas em cinco, aumento de peso não quantificado em quatro, infecção do trato urinário em dois, broncopneumonia em um, amigdalite em um, insônia em um, urticária em um. Todos os efeitos adversos tardios foram acompanhados e tratados, não necessitando da suspensão da droga.
A resposta terapêutica foi avaliada pelo Pasi atingido após a fase de indução. Apenas uma paciente permaneceu com o mesmo Pasi pré-tratamento e teve a medicação suspensa por falha terapêutica. Atingiram Pasi 100 21,2% dos pacientes, e 25,5% atingiram Pasi 90.
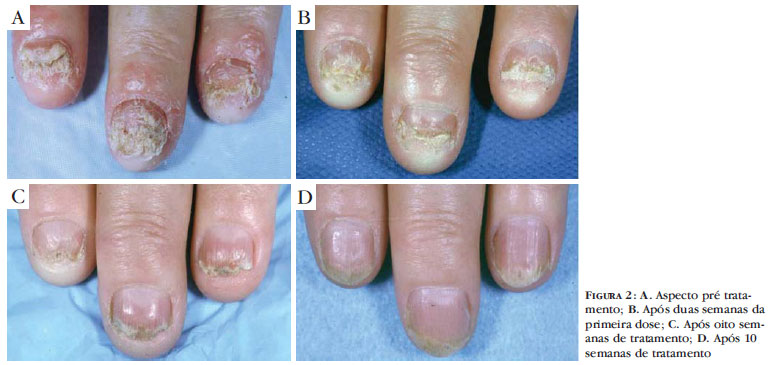
Quanto à eficácia de manutenção da resposta clínica, a droga mostrou ser de atuação rápida e efetiva, visto que apenas uma paciente não respondeu satisfatoriamente nas primeiras oito semanas. A figura 1 mostra um paciente antes e após a fase de indução do infliximabe. A figura 2 mostra paciente com psoríase ungueal com ótimo resultado após 10 semanas de tratamento.
Apesar da sua eficácia inicial, a diminuição de resposta foi observada em 44% dos pacientes (21 pacientes) entre a quarta dose de manutenção (recaída mais precoce) e a oitava dose de manutenção (recaída mais tardia), com a diminuição do Pasi obtido na fase de indução, porém ainda com resposta satisfatória (Pasi mínimo de 50); isto é, reaparecimento de lesões em placas mais discretas e em menor número que na fase pré-tratamento, principalmente entre a sétima e a oitava semanas após a infusão. A nova infusão nesses pacientes levou à melhora do quadro, porém com eficácia reduzida quando comparada com a eficácia de resposta da fase de indução. Três pacientes (6%) tiveram recaída entre a quinta e a sexta semanas após a infusão e passaram a receber a droga de manutenção a cada seis semanas, com resposta eficaz: Pasi 75. Oito pacientes (17%) - dentre eles os pacientes que obtiveram apenas Pasi 50 na fase de indução - deixaram de responder à droga entre a quinta manutenção (mais precoce) e a oitava manutenção, sendo triados para uso de outros imunobiológicos. Quinze pacientes (31,9%) mantêm-se com resposta satisfatória semelhante à obtida na fase de indução até o término desta observação com mais de 10 doses de manutenção, isto é, eficácia mantida por pelo menos 80 semanas.
DISCUSSÃO
A prevalência de comorbidades nos pacientes com psoríase selecionados para o tratamento com o infliximabe em nosso estudo atingiu 57,4%. Há, provavelmente, uma relação direta com o aumento da síntese de citoquinas pró-inflamatórias devido à ativação tipo Th1, como, por exemplo, de TNF alfa, verificado na fisiopatogenia da psoríase e das comorbidades observadas, como obesidade,22,23 hipertensão arterial, resistência à insulina, dislipidemia e espondiloartropatias.10,20 Assim, com essas associações mais frequentes, podemos também entender o risco aumentado desses pacientes à doença cardiovascular.1 O aumento do risco de doença cardíaca está especialmente relacionado com os pacientes mais jovens e com psoríase mais grave.1
A obesidade é uma das comorbidades mais prevalentes, podendo estar relacionada diretamente com a gravidade do quadro cutâneo, pois é sabido que a gordura visceral é potencial fonte de síntese de TNF alfa.22,23,24 Deve-se considerar também o impacto negativo da doença na qualidade de vida25,26 dos seus portadores, induzindo à reclusão social e a mudanças de hábitos alimentares, com consequente ganho de peso. Os pacientes com psoríase que apresentam sobrepeso têm incidência aumentada de diabetes e hipertensão, assim como um perfil aterogênico de lipoproteínas significativamente elevado.
Espondiloartropatia foi observada em 10% dos pacientes no ato do diagnóstico da psoríase moderada a grave, prevalência semelhante à encontrada na literatura, sendo que pode ocorrer acometimento mais tardio das articulações, o que levaria essa prevalência a 15-20%.1,7,11,27,28,29
Dentre as reações infusionais precoces, a urticária foi a observação mais frequente. Alguns autores não consideram que essa reação seja anafilática,17,19,20 e os poucos estudos mostraram apenas um caso com aumento de anticorpos IgE.22 Os sintomas da urticária normalmente desaparecem após diminuição da velocidade de infusão, o que não condiz com reações mediadas por IgE. Outro ponto relevante é que em uma reação anafilática é necessária a exposição prévia ao antígeno; no entanto, foram descritos casos de urticária durante a primeira infusão.20 A urticária, nesse caso, é explicada como reação anafilactoide que resulta da degranulação e ativação direta de mastócitos causadas pela droga.17 No presente estudo, os quatro pacientes que apresentaram urticária na primeira infusão obtiveram remissão completa dos sintomas após diminuição da velocidade de infusão e uma ampola de cloridrato de prometazina via intramuscular. Aos pacientes que tiveram urticária também na infusão subsequente, foram administrados preventivamente 25 mg de hidroxizine 24 horas antes da infusão seguinte, no dia da infusão e 24 horas após; assim esses pacientes deixaram de ter essa reação adversa.
Sintomas como taquicardia, sudorese, aumento da pressão arterial e resfriamento do membro que estava recebendo a infusão, assim como observados em nossa experiência clínica, são relatados como efeito adverso precoce na literatura, porém não é sabido o mecanismo pelo qual eles ocorrem. Alguns autores os incluem como reações anafilactoides, ou seja, não imunes.23 Os picos hipertensivos foram tratados com 25 mg de captopril; as demais reações, com diminuição da velocidade de infusão.17
Um efeito observado durante a infusão e não relatado na literatura é a cólica renal de forte intensidade (um paciente), sem melhora com diminuição da velocidade de infusão. Foi necessário interromper a infusão e tratar o paciente com analgésico potente. A cólica renal ocorreu durante a fase de manutenção (quarta aplicação) e recidivou em uma segunda tentativa de infusão. A investigação por imagens e exames bioquímicos não mostrou alterações renais nesse paciente.
As reações infusionais tardias são consideradas imunomediadas, geralmente por reação de hipersensibilidade tipo III.22,23
A positividade de autoanticorpos antinucleares (FAN) foi o efeito adverso tardio e a alteração laboratorial mais frequente em nosso estudo. Apenas os pacientes n. 19 e 21 não realizaram pesquisa de FAN previamente ao início das infusões. Os anticorpos antinucleares são relatados em diversos estudos sobre o infliximabe para tratamento tanto da psoríase como de outras patologias, como artrite reumatoide e doença de Crohn, mostrando prevalência aproximada de até 29% dos pacientes. A produção de anticorpos antinucleares depende das características do agente biológico usado e em princípio pode ser explicada pela alta exposição de diversos autoantígenos liberados com a apoptose de células decorrente da terapia com o infliximabe.24,25 Alguns autores se referem também à ativação de linfócitos B induzida pelas frequentes infecções bacterianas.24
Apesar da alta frequência de anticorpos antinucleares induzidos por infliximabe, poucos casos de lúpus e sintomas lúpus-like foram relatados. O estudo retrospectivo mais recente demonstrou uma incidência de lúpus sistêmico induzido por infliximabe de 0,19%.23 No grupo estudado não houve nenhuma manifestação clínica ou presença de anticorpo anti-Ds-DNA que justificasse o diagnóstico de lesão/laboratório lúpus-like. Todos os pacientes continuaram o tratamento sem intercorrência específica.
Observaram-se também infecções como efeito adverso tardio: infecção urinária, broncopneumonia e amigdalite. Foram tratadas com antibioticoterapia específica sem complicações. As infecções ocorreram, via de regra, duas a três semanas após a infusão.
O aumento de enzimas hepáticas observado em alguns pacientes foi transitório e não levou à suspensão do infliximabe. Em relação ao aumento de peso relatado por quatro pacientes, não se estabeleceu relação causal com o infliximabe.
O paciente n. 6 apresentou alopecia areata duas semanas após a 34ª dose de manutenção do infliximabe. Não há referências na literatura relacionando a alopecia areata com o infliximabe, sendo possivelmente um efeito adverso aleatório. O paciente foi tratado com propionato de clobetazol solução capilar e apresentou rápida repilação.
Quanto à eficácia, apenas uma paciente (n. 4) foi considerada não responsiva ao uso da droga, pois não houve resposta satisfatória mínima na fase de indução. Não se encontraram características clínicas e nem laboratoriais que permitissem alguma correlação com a não resposta, exceto por reação urticariforme grave na primeira infusão, que levou à diminuição substancial do tempo de infusão (três horas e meia); nas infusões seguintes, a paciente tomou previamente hidroxizine e não ocorreram novas reações. Não se observa na literatura relação entre formação de anticorpos anti-infliximabe e não resposta; de qualquer modo, não foi feita a pesquisa de anticorpo anti-infliximabe nessa paciente.
O infliximabe mostrou ser droga altamente efetiva na fase de indução e de grande valia nos pacientes graves que necessitam uma rápida resposta clínica. Na fase de manutenção, se considerarmos apenas Pasi 75 como excelência de resposta, sua eficácia chega a 30% dos pacientes, porém quando analisamos a satisfação dos pacientes em geral - Pasi 50 - podemos julgar sua eficácia em 70% aproximadamente. Devemos considerar também que seis pacientes receberam apenas a fase de indução e mantiveram-se por pelo menos seis meses sem lesão, sendo que três deles mantêm-se com Pasi 75 ou maior já há 24 meses, sem uso do infliximabe. O que leva a essa variabilidade de resposta ainda não podemos definir; mais provavelmente aspetos como genes psor estão envolvidos.27 Deve haver também influência ambiental no estímulo do fenótipo, assim como associação com a obesidade dos pacientes: todos os pacientes que deixaram de responder ao infliximabe eram obesos. Assim, o tratamento global do paciente se faz necessário. Dois dos pacientes que se submeteram apenas às doses da fase de indução e se mantêm com Pasi 75 tiveram redução de peso significativa nesse período, com dieta e prática de exercícios físicos.
CONCLUSÃO
O infliximabe mostrou, no presente estudo, ser uma droga segura e eficaz para o tratamento dos pacientes portadores de psoríase em placas que foram resistentes ou que tiveram contraindicação ao uso de drogas convencionais. A correta e cuidadosa seleção dos pacientes, assim como o acompanhamento clínico e laboratorial durante o tratamento, é fundamental tanto para o sucesso como para a segurança terapêutica.
Das comorbidades encontradas nos pacientes deste estudo, a obesidade se relacionou com respostas terapêuticas mais tardias e menos eficientes.
Assim, o tratamento global do paciente se impõe para uma melhor resposta terapêutica. Não houve correlação entre outras comorbidades e variações da resposta terapêutica.
Efeitos adversos precoces e tardios são frequentes; entretanto, quando bem monitorados, não impedem a manutenção da terapêutica e não expõem os pacientes a riscos não controlados. Apenas um efeito adverso precoce grave foi observado: cólica nefrética, que resultou na suspensão da droga. Na literatura é relatada frequência menor que 1% de reações severas o suficiente para interromper o tratamento.22
O infliximabe mostrou alta eficácia e rapidez de resposta na fase de indução, levando a Pasi 75 a 100 em mais de 70% dos pacientes. Apenas uma paciente não foi responsiva à fase de indução.
O infliximabe tem resposta satisfatória mantida a longo prazo, porém pode apresentar eficácia decrescente a partir da quarta dose de manutenção e chegar até à não resposta num número reduzido de pacientes, dentre eles os obesos.
Recebido em 26.01.2010.
Aprovado pelo Conselho Consultivo e aceito para publicação em 06.04.2010.
Conflito de interesse: Nenhum
Suporte financeiro: Nenhum
- 1. Duarte AA, Pinto JM. Artrite Psoriásica e comorbidades. p.31-6. In: Consenso Brasileiro de Psoríase 2009 - Sociedade Brasileira de Dermatologia. Rio de Janeiro: Sociedade Brasileira de Dermatologia, 2009.
- 2. Christophers E. Psoriasis -- epidemiology and clinical spectrum. Clin Exp Dermatol. 2001;26:314-20
- 3. Elder JT, Nair RP, Voorhees JJ. Epidemiology and the genetics of psoriasis. J Invest Dermatol. 1994;102:24S-7S.
- 4. Gottlieb AB. Psoriasis. Immunopathology and Immunomodulation. Dermatol Clin.2001;19:649-57.
- 5. Chan CY, Browning JC, Larsen F, Hsu S. Development of new-onset psoriasis in a patient receiving infliximab for treatment of rheumatoid arthritis. Dermatol Online J. 2008;15;14:12.
- 6. Patel RV, Clark LN, Lebwohl M, Weinberg JM. Treatments for psoriasis and the risk of malignancy. J Am Acad Dermatol. 2009;60:1001-17.
- 7. Valdés A Mdel P, Schroeder H F, Roizen G V, Honeyman M J, Sánchez M L. Efficacy of infliximab in patients with moderate and severe psoriasis treated with infliximab (Remicade). Rev Med Chil. 2006;134:326-31.
- 8. Gottlieb A, Korman NJ, Gordon KB, Feldman SR, Lebwohl M, Koo JY, et al . Guidelines of care for the management of psoriasis and psoriatic arthritis: Section 2.psoriatic arthritis:overview and guidelines of care for treatment with an emphasis on the biologics. J Am Acad Dermatol. 2008;58:851-64.
- 9. Reich K, Nestle FO, Papp K, Ortonne JP, Evans R, Guzzo C, et al. Infliximab indution and maintenance therapy for moderate-to-severe psoriasis: a phase III, multicentre, double-blind trial. Lancet. 2005;366:1367-74.
- 10. Kleyn CE, Griffiths CE. Infliximab for treatment of psoriasis. Expert Opin Biol Ther. 2006;6:797-805.
- 11. Ko JM, Gottlieb AB, Kerbleski JF. Induction and exacerbation of psoriasis with TNFblockade therapy: a review and analysis of 127 cases. J Dermatolog Treat. 2009;20:100-8.
- 12. Perlmutter A, Mittal A, Menter A. Tuberculosis and tumour necrosis factor-alpha inhibitor therapy: a report of three cases in patients with psoriasis. Comprehensive screening and therapeutic guidelines for clinicians. Br J Dermatol. 2009;160:8-15.
- 13. Doherty SD, Van Voorhees A, Lebwohl MG, Korman NJ, Young MS, Hsu S, et al. National Psoriasis Foundation consensus statement on screening for latent tuberculosis infection in patients with psoriasis treated with systemic and biologic agents. J Am Acad Dermatol. 2008;59:209-17.
- 14. Newell EL, Jain S, Stephens C, Martland G. Infliximab-induced pityriasis lichenoides chronica in a patient with psoriasis. J Eur Acad Dermatol Venereol. 2009;23:230-1.
- 15. Benucci M, Nenci G, Cappelletti C, Manfredi M. Lupus like syndrome induced by treatment with anti TNFalpha (infliximab): report of three cases. Recenti Prog Med. 2008;99:363-6.
- 16. Chaudhari U, Romano P, Mulcahy LD, Dooley LT, Baker DG, Gottlieb AB. Efficacy and safety of infliximab monotherapy for plaque-type psoriasis: a randomised trial. Lancet. 2001;357:1842-7.
- 17. Lecluse LL, Piskin G, Mekkes JR, Bos JD, de Rie MA. Review and expert opinion on prevention and treatment of infliximab-related infusion reactions. Br J Dermatol. 2008;159:527-36.
- 18. Gottlieb AB, Evans R, Li S, Dooley LT, Guzzo CA, Baker D, et al. Infliximabe indition therapy for pacients with severe plaque types psoriasis: a randomized doubleblind, placebo-controlled trial. J Am Acad dermatol. 2004;51:534-42.
- 19. Cheifetz A, Mayer L. Monoclonal antibodies, immunogenicity, and associated infusion reactions. Mt Sinai J Med. 2005;72:250-6.
- 20. Cheifetz A, Smedley M, Martin S, Reiter M, Leone G, Mayer L, et al. The incidence and management of infusion reactions to infliximab: a large center experience. Am J Gastroenterol. 2003;98:1315-24.
- 21. Gottlieb AB. Infliximab for psoriasis. J Am Acad Dermatol. 2003;49(Suppl 2):S112-17.
- 22. Moustou AE, Matekovits A, Dessinioti C, Antoniou C, Sfikakis PP, Stratigos AJ. Cutaneous side effects of anti-tumor necrosis factor biologic therapy: a clinical review. J Am Acad Dermatol. 2009;61:486-504.
- 23. Poulalhon N, Begon E, Lebbé C, Lioté F, Lahfa M, Bengoufa D, et al. A follow-up study in 28 patients treated with infliximab for severe recalcitrant psoriasis: evidence for efficacy and high incidence of biological autoimmunity. Br J Dermatol. 2007;156:329-36.
- 24. Menter A, Feldman SR, Weinstein GD, Papp K, Evans R, Guzzo C, et al. A randomized comparison of continuous VS. intermitten infliximab maintenance regimens over 1 year in the treatment of moderate to severe plaque psoriasis. J Am Acad Dermatol. 2007;56-31.e1-15.
- 25. Finlay AY, Khan GK. Dermatology life quality index (DLQI)- a simple practical measure for routine clinical use. Clin Exp Dermatol.1994;19:210-6.
- 26. Martins GA, Arruda L, Mugnaini ASB. Validação de questionários de avaliação da qualidade de vida em pacientes de psoríase. An Bras Dermatol. 2004;79:512-35.
- 27. Sterry W, Barker J, Boehncke WH, Bos JD, Chimenti S, Christophers E, et al. Biological therapies in the systemic management of psoriasis. Br J Dermatol. 2004;151(Suppl 69):3-17.
- 28. Cuchacovich R, Espinoza CG, Virk Z, Espinoza LR. Biologic therapy (TNF-alpha antagonists)-induced psoriasis: a cytokine imbalance between TNF-alpha and IFNalpha? J Clin Rheumatol. 2008;14:353-6.
- 29. Taylor W, Gladman D, Helliwell P, Marchesoni A, Mease P, Mielants H, et al. Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum. 2006;54:2665-73.
Datas de Publicação
-
Publicação nesta coleção
16 Maio 2011 -
Data do Fascículo
Abr 2011
Histórico
-
Aceito
06 Abr 2010 -
Recebido
26 Jan 2010