Resumos
OBJETIVO: Analisar as características de tendões de Aquiles de ratos após indução de processo inflamatório localizado na pata. MÉTODOS: Foram utilizados três grupos experimentais: grupo inflamado com carragenina na pata de rato (G1); grupo salina (G2) e grupo controle (G3). Após 4 horas os animais foram eutanaziados e o tendão de Aquiles foi removido. RESULTADOS:Não foram observadas diferenças significativas nas análises de proteínas não colagênicas, glicosaminoglicanos e hidroxiprolina, mas uma tendência a diminuição foi verificada em G1. Em organização de moléculas de colágeno não foram observadas diferenças entre os grupos. Com respeito à atividade de MMPs, foi observada uma presença maior da isoforma ativa da MMP-2 em G1, sugerindo que a remodelação do tecido está ocorrendo. CONCLUSÃO: Desta forma, nós concluímos que o processo inflamatório desencadeado em pata de rato pode afetar o remodelamento de tendões situados próximo ao local inflamado. Nível de Evidência I, Estudos Prognósticos - Investigação do Efeito de Característica de um Paciente Sobre o Desfecho da Doença.
Tendão do calcâneo; Inflamação; Carragenina
OBJECTIVE: To analyze the characteristics of the Achilles tendon of rats after induction of localized inflammation in the rat paw. METHODS: In our study three groups were used: inflamed group with carrageenan in rat paw (G1); saline group (G2) and control group (G3). After 4 hours the animals were euthanized and the Achilles tendon removed. RESULTS: No significant differences were observed in the analysis of non-collagenous proteins, glycosaminoglycans and hydroxyproline in the groups but a tendency of reduction was verified in G1. About the organization of collagen molecules, no differences were observed between groups. With respect to MMPs activity, a stronger presence of the active isoform of MMP-2 in G1 was observed, suggesting that the remodeling was occurring. CONCLUSION: Thus, we conclude that the inflammatory process in rat paw may affect the remodeling of tendons located near the inflamed site. Level of Evidence I, Prognostic Studies - Investigating the Effect of a Patient Characteristic on the Outcome of Disease.
Achilles tendon; Inflammation; Carrageenan
ARTIGO ORIGINAL
Alterações no tendão de Aquiles após inflamação em tecido adjacente
Cristiano Pedrozo Vieira; Flávia da Ré Guerra; Letícia Prado de Oliveira; Marcos dos Santos de Almeida; Edson Rosa Pimentel
Departamento de Anatomia, Biologia Celular, Fisiologia e Biofísica, Instituto de Biologia, Universidade Estadual de Campinas (UNICAMP), Campinas, SP, Brasil
Correspondência Correspondência: Departamento de Anatomia, Biologia Celular, Fisiologia e Biofísica, Instituto de Biologia Universidade Estadual de Campinas IB/UNICAMP, CEP: 13083-863, Campinas, SP, Brasil. E-mail: cristianubio@hotmail.com
RESUMO
OBJETIVO: Analisar as características de tendões de Aquiles de ratos após indução de processo inflamatório localizado na pata.
MÉTODOS: Foram utilizados três grupos experimentais: grupo inflamado com carragenina na pata de rato (G1); grupo salina (G2) e grupo controle (G3). Após 4 horas os animais foram eutanaziados e o tendão de Aquiles foi removido.
RESULTADOS:Não foram observadas diferenças significativas nas análises de proteínas não colagênicas, glicosaminoglicanos e hidroxiprolina, mas uma tendência a diminuição foi verificada em G1. Em organização de moléculas de colágeno não foram observadas diferenças entre os grupos. Com respeito à atividade de MMPs, foi observada uma presença maior da isoforma ativa da MMP-2 em G1, sugerindo que a remodelação do tecido está ocorrendo.
CONCLUSÃO: Desta forma, nós concluímos que o processo inflamatório desencadeado em pata de rato pode afetar o remodelamento de tendões situados próximo ao local inflamado. Nível de Evidência I, Estudos Prognósticos - Investigação do Efeito de Característica de um Paciente Sobre o Desfecho da Doença.
Descritores: Tendão do calcâneo/lesões. Inflamação. Carragenina.
ABSTRACT
OBJECTIVE: To analyze the characteristics of the Achilles tendon of rats after induction of localized inflammation in the rat paw.
METHODS: In our study three groups were used: inflamed group with carrageenan in rat paw (G1); saline group (G2) and control group (G3). After 4 hours the animals were euthanized and the Achilles tendon removed.
RESULTS: No significant differences were observed in the analysis of non-collagenous proteins, glycosaminoglycans and hydroxyproline in the groups but a tendency of reduction was verified in G1. About the organization of collagen molecules, no differences were observed between groups. With respect to MMPs activity, a stronger presence of the active isoform of MMP-2 in G1 was observed, suggesting that the remodeling was occurring.
CONCLUSION: Thus, we conclude that the inflammatory process in rat paw may affect the remodeling of tendons located near the inflamed site. Level of Evidence I, Prognostic Studies Investigating the Effect of a Patient Characteristic on the Outcome of Disease.
Keywords: Achilles tendon/injuries. Inflammation. Carrageenan.
INTRODUÇÃO
O número e a incidência de lesões tendíneas têm aumentado substancialmente nas últimas décadas.1,2 Tem sido estimado que as lesões tendíneas perfaçam de 30% a 50% de todas as lesões que são relacionadas ao esporte. Dentre estas lesões, as que acometem o tendão de Aquiles têm sido prevalentes tanto entre atletas quanto no público em geral. O tendão de Aquiles é considerado o mais forte do corpo humano,3 mas é também o mais afetado por lesões, seguido pelo tendão flexor digital.4 Geralmente, as lesões do tendão de Aquiles têm duas diferentes origens: (1) alguns sintomas são causados somente lesão induzida pela carga excessiva ou degeneração tendínea (sem qualquer doença sistêmica predisponente); e (2) algumas vezes uma doença sistêmica, tal como a artrite reumatoide, pode se manifestar com sintomas no tendão de Aquiles.3
A matriz extracelular (MEC) dos tendões é composta de colágeno (principalmente do tipo I) e elastina, ambos possuindo 65-80% e 1-2% da massa seca do tendão respectivamente. Colágeno e elastina estão embebidos em uma matriz de proteoglicanos, proteínas não colagênicas e água.
Entre os elementos que participam do processo de reparo tendíneo após uma lesão, atuando através das fases de cicatrização, estão enzimas tais como as metaloproteinases (MMPs) as quais estão envolvidas no remodelamento da MEC dos tendões.5 A MMP-2 (gelatinase) digere a gelatina, a qual é uma forma de colágeno desnaturado. É relatado na literatura que a concentração de MMP-2 está elevada após a lesão participando tanto da degradação quanto do remodelamento do colágeno.6
Tendões e ligamentos são estruturas que são afetadas por diferentes patologias tais como lesões por esforço, infecção e inflamação, podendo haver ruptura. Muitos trabalhadores e atletas que fazem esforços repetitivos precisam se afastar de suas atividades diárias quando há inflamação tendínea.7
A inflamação pode ocorrer diretamente em tendões ou ligamentos, mas em muitos casos a inflamação pode ser encontrada em tecidos adjacentes. O processo inflamatório em tecidos próximos ao tendão de Aquiles e as alterações causadas por este processo na MEC do próprio tendão ainda é pouco conhecida. Estudos recentes no tendão flexor digital profundo8 e no tendão do músculo supraspinal no ombro9 mostraram mudanças bioquímicas e estruturais na MEC destes tendões quando próximos de um sítio de inflamação. Entretanto, não há estudos demonstrando se há alterações no tendão de Aquiles quando há uma inflamação em tecidos adjacentes. Nossa análise consiste em verificar se um processo inflamatório na pata de ratos causa alterações no tendão de Aquiles.
MATERIAIS E MÉTODOS
Grupos Experimentais
O uso dos animais foi de acordo com a Convenção Européia para a Proteção dos Animais Vertebrados Utilizados para Fins Experimentais e Outros Fins Científicos e é consistente com os princípios éticos da experimentação animal adotado pelo Colégio Brasileiro de Experimentação Animal (COBEA) e foi aprovado pelo Comitê de Ética em Experimentação Animal da Universidade Estadual de Campinas, SP, Brasil e arquivado sob o nº 2259-1.
Ratos Wistar machos com 140-160g foram mantidos com livre acesso a ração e água durante o período experimental. Os grupos foram divididos em 3 Grupos: (G1) que recebeu injeção subcutânea de 1% (0,1ml) carragenina tipo IV (Sigma cod. 22039) dissolvida em salina10, (G2) que recebeu salina (NaCl 0,9%) e (G3) que não recebeu aplicação na pata direita. Depois de 4 horas de aplicação os animais foram eutanaziados por overdose de isofluorano e seus tendões foram coletados.
Quantificação de proteínas e glicosaminoglicanos sulfatados
Os tendões de Aquiles foram imersos em 50 volumes de cloridrato de guanidina 4M, e o sobrenadante foi usado para análises bioquímicas de proteínas não colagênicas pelo método de Bradford11 e dosagem de glicosaminoglicanos pelo método de dimetilmetileno blue.12
Quantificação de hidroxiprolina
Os fragmentos de tendões foram imersos em acetona por 48 horas e clorofórmio: etanol por 48 horas. Depois, os fragmentos foram hidrolisados com HCl 6N (1ml/10mg tecido) e o hidrolisado foi neutralizado com NaOH 6N e tratado com solução de cloramina T 1.41% e p-dimetilaminobenzaldeído 15%. Posteriormente, as amostras foram incubadas a 60°C por 15 minutos. A solução com hidroxiprolina foi resfriada até atingir a temperatura ambiente e as absorbâncias foram medidas em 550nm.
Zimografia para gelatinases
Os tendões foram tratados de acordo com Marqueti et al.13 Os fragmentos de tendões foram imersos em uma solução de tris-HCl 50mM (pH 7.4), NaCl 0,2M, CaCl2 10mM, e triton 0,1% e um coquetel inibidor de protease 1% (Sigma P8340) para a extração de proteínas a 4°C por 2 horas. Nos géis, foram aplicadas 20µg de proteína por amostra. O gel contendo 10% de acrilamida e 0,1% de gelatina foi mantido a 4°C e após o final da eletroforese, o gel foi lavado com triton x-100 2,5% e incubado por 21 horas em solução de tris-HCl 50mM ( pH 7.4) NaCl 0,1M e azida sódica 0,03% a 37°C. O gel foi corado com coomassie brilliant blue R 250 por 1 hora. Os géis foram lavados com uma solução contendo 50% de metanol e 10% de ácido acético, para observação das bandas negativas das proteínas correspondentes as enzimas. As bandas foram quantificadas em imagem negativa por densitometria usando o software Scion Image Alpha 4.03.2.
Análise por microscopia de luz
Os tendões foram fixados em uma solução contendo formaldeído 4% em tampão Millonig (fosfato de sódio 0.13M, NaOH 0.1M - pH 7.4) por 24 horas a temperatura ambiente. Em seguida os tendões foram lavados em água corrente durante 6 horas, desidratados em banhos de álcool, seguido de diafanização com banhos de xilol e incluídos em parafina (Histosec,Merck). Foram realizados cortes seriados longitudinais de 7µm. Para observação das fibras de colágeno, os cortes foram corados com Ponceau SS 0.025% e ácido acético 2% por 1.5 minutos e o dicroísmo linear foi observado em microscópio de polarização.14
ANÁLISE ESTATÍSTICA
Os dados foram apresentados como média ± desvio padrão. Os resultados foram obtidos com um número de cinco animais por grupo. Após a coleta dos dados, foi realizada a análise estatística de variância ANOVA, seguido pelo teste de Tukey com nível de significância p<0,05. O programa estatístico utilizado foi GraphPad Prism®, version 3.0.
RESULTADOS
Em nosso estudo, analisamos a matriz extracelular do tendão de Aquiles, após aplicação do agente inflamatório na pata de rato. Em 4 horas, um edema foi observado na pata dos animais em G1 (resultado não mostrado), confirmando que a inflamação induzida pela carragenina está ocorrendo. Este edema não foi detectado em outros grupos.
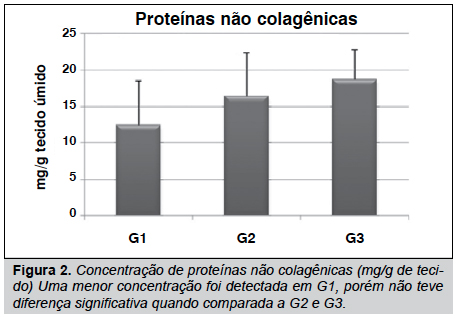
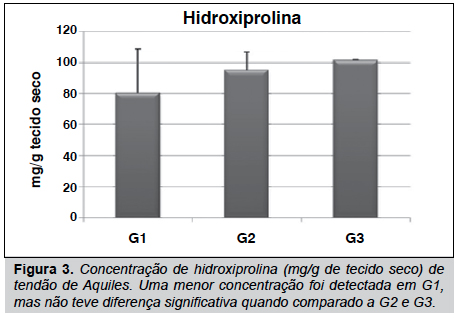
Nossos resultados mostraram que o tendão sofre algumas alterações na concentração de seus elementos estruturais, tais como hidroxiprolina, glicosaminoglicanos e proteínas não colagênicas. (Figuras 1, 2 e 3) Estes elementos mostraram menor concentração em G1 quando comparado a G2 e G3. Contudo, estes resultados não foram diferentes significativamente (p>0,05), mas isso indica uma tendência de diminuição em ratos que receberam o agente inflamatório na pata.
Como pode ser visto nas Figuras 4 e 5, a análise das bandas de MMP-2 na zimografia mostraram a isoforma ativa (62 kDa) da MMP-2 com maior atividade em G1 quando comparado a G2 e G3. A proMMP-2 teve um aumento em G1 e G2 e a atividade da MMP-2 ( isoforma ativa e intermediária) aumentou em G1 em relação a G2 e G3. A MMP-9 não foi detectada nos grupos.
Em relação ao dicroismo linear que detecta a organização das moléculas de colágeno, nenhuma organização foi observada nos grupos. (Figura 6)
DISCUSSÃO
Patologias que afetam os tendões, que incluem dor crônica e ruptura, são agora denominadas "tendinopatias". Apesar do papel da inflamação ainda ser discutido, é conhecido que as tendinopatias são primariamente condições degenerativas e frequentemente não existem células inflamatórias ao redor da lesão.15
Em nossas análises, foi observado o efeito da inflamação induzida em pata de rato na matriz extracelular do tendão de Achiles. Embora os resultados das dosagens de GAG, PNC e HO-Pro em G1, G2 e G3 não terem sido significativamente diferentes, observou-se uma menos concentração destes componentes em G1. Estudos prévios têm demonstrado um decréscimo na concentração de PNC e GAG, e mudanças estruturais no tendão flexor digital profundo (TFDP) quando analisados 4 horas após a indução da inflamação em pata de rato e até mesmo um infiltrado de células foi evidenciado no epitendão destes tendões.8 Entretanto, o tendão de Achilles não demonstrou modificações estruturais no epitendão, bem como nas fibras de colágeno que o compõe (resultados não mostrados). Sabe-se que durante um processo inflamatório um dos primeiros eventos que ocorrem é a degradação dos elementos da matriz extracelular, para posterior reorganização do tecido,16 fato que pode explicar a diminuição destes elementos na matriz extracelular.
As metaloproteinases (MMPs) é o principal grupo de enzimas responsável por regular a composição dos componentes celulares e de matriz extracelular. A expressão da maioria das MMPs normalmente é baixa nos tecidos e é induzida quando o remodelamento da matriz extracelular se faz necessário.17 MMPs são importantes reguladores do remodelamento da matriz extracelular, e seus níveis se alteram ao longo do processo de cura e inflamação18 e tem como objetivo restabelecer a homeostase através da degradação. Presume-se que a maior atividade da MMP-2 em G1 possa ser a explicação para a tendência a diminuição de HO-Pro, GAGs e PNC. A proMMP-2 aumentou em G1 e G2, entretanto em G3 a mesma permaneceu em baixa quantidade, de acordo com os resultados de densitometria. A MMP-9 é um indicador do processo inflamatório no tecido19,20 entretanto não foi detectada em nossa análise, e apesar de nossos resultados apontarem alterações com relação as gelatinases da matriz extracelular, podemos afirmar que o tendão não estava inflamado.
Acreditamos que o processo inflamatório atingiu de forma branda a matriz extracelular do TFDP do que em trabalhos anteriores9 onde foi observado no tendão supraespinhoso uma infiltração de macrófagos e desorganização das fibras de colágeno, assim como o decréscimo na presença da fibronectina. Entretanto, não foram observadas diferenças nas moléculas de colágeno em nosso estudo. O tendão de Achiles está consideravelmente distante do local de indução da inflamação aguda, o que pode indicar que a ação dos agentes inflamatórios na matriz extracelular ocorreu de forma mais fraca. Provavelmente se o processo inflamatório tivesse sido provocado mais próximo do tendão de Achiles, modificações mais intensas de seus componentes de matriz extracelular teriam sido observados, como em estudos prévios.8,9
CONCLUSÃO
Os resultados indicaram que injúrias situadas próximas ao tendão pode ocasionar modificações no processo de remodelamento do tecido tendíneo, promovendo um desbalanço entre a degradação e substituição dos elementos de matriz extracelular, o que pode ocasionar uma predisposição a futuras injúrias e mesmo levar a uma ruptura. Futuros estudos devem ser realizados de maneira a avaliar os diferentes níveis de inflamação, assim como diferentes locais adjacentes ao tendão, para observar sua influência sob a composição e organização do tendão.
AGRADECIMENTOS
Os autores agradecem ao Sr. Francisco A. Mallatesta por sua assistência técnica e a CAPES por ter financiado a bolsa ao autor Cristiano Pedrozo Vieira.
Artigo recebido em 07/12/2009, aprovado em 06/01/2010.
Todos os autores declaram não haver nenhum potencial conflito de interesses referente a este artigo.
Trabalho realizado no Departamento de Anatomia, Biologia Celular, Fisiologia e Biofísica, Instituto de Biologia, Universidade Estadual de Campinas ( UNICAMP), Campinas, SP, Brasil.
- 1. Maffulli N, Kader D. Tendinopathy of tendo Achillis. J Bone Joint Surg Br.2002;84(1):1-8.
- 2. Maffulli N. Rupture of the Achilles tendon. J Bone Joint Surg Am. 1999;81(7):1019-36.
- 3. Järvinen TA, Kannus P, Maffulli N, Khan KM. Achilles tendon disorders: etiology and epidemiology. Foot Ankle Clin. 2005;10(2):255-66.
- 4. Oliveira FS, Pinfildi CE, Parizoto NA, Liebano RE, Bossini PS, Garcia EB et al. Effect of low level laser therapy (830 nm) with different therapyregimes on the process of tissue repair in partial lesion calcaneous tendon.Lasers Surg Med. 2009;41(4):271-6.
- 5. Karousou E, Ronga M, Vigetti D, Passi A, Maffulli N. Collagens, proteoglycans, MMP-2, MMP-9 and TIMPs in human Achilles tendon rupture. Clin Orthop Relat Res.2008;466(7):1577-82.
- 6. Riley G. Matrix metalloproteinase activities and their relationship with collagen remodelling in tendon pathology. Matrix Biol. 2002;21(2):185-95.
- 7. Dario BE, Barquilha G, Marques RM. Lesões esportivas: um estudo com atletas de basquetebol Bauruense.Rev Bras Cienc Esporte. 2010;31(3):205-15.
- 8. Vieira CP, Aro AA, Almeida MS, de Mello GC, Antunes E, Pimentel ER. Effects of acute inflammation induced in the rat paw on the deep digital flexor tendon. Connect Tissue Res. 2012;53(2):160-8.
- 9. Tillander B, Franzén LE, Nilsson E, Norlin R. Carrageenan-induced subacromial bursitis caused changes in the rat's rotator cuff. J Orthop Res. 2001;19(3):441-7.
- 10. Winter CA, Risley EA, Nuss GW. Carrageenin-induced edema in hind paw of the rat as an assay for antiiflammatory drugs. Proc Soc Exp Biol Med. 1962;111:544-7.
- 11. Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 1976;72:248-54.
- 12. Farndale RW, Buttle DJ, Barrett AJ. Improved quantitation and discrimination of sulphated glycosaminoglycans by use of dimethylmethylene blue. Biochim Biophys Acta. 1986;883(2):173-7.
- 13. Marqueti RC, Parizotto NA, Chriguer RS, Perez SE, Selistre-de-Araujo HS.Androgenic-anabolic steroids associated with mechanical loading inhibit matrix metallopeptidase activity and affect the remodeling of the achilles tendon in rats. Am J Sports Med. 2006;34(8):1274-80.
- 14. Vidal BC, Mello ML. Supramolecular order following binding of the dichroic birefringent sulfonic dye Ponceau SS to collagen fibers. Biopolymers. 2005;78(3):121-8.
- 15. Riley G. Tendinopathy:from basic science to treatment. Nat Clin Pract Rheumatol. 2008;4(2):82-9.
- 16. Szabo KA, Ablin RJ, Singhingh G. Matrix metalloproteinases and the immune response. Clin Appl Immun Rev. 2004; 4:295-319.
- 17. Chakraborti S, Mandal M, Das S, Mandal A, Chakraborti T. Regulation of matrix metalloproteinases: an overview. Mol Cell Biochem. 2003;253(1-2):269-85.
- 18. Magra M, Maffulli N. Matrix metalloproteases: a role in overuse tendinopathies. Br J Sports Med. 2005;39(11):789-91.
- 19. Clutterbuck AL, Harris P, Allaway D, Mobasheri A. Matrix metalloproteinases in inflammatory pathologies of the horse. Vet J. 2010;183(1):27-38.
- 20. Marsolais D, Duchesne E, Côté CH, Frenette J. Inflammatory cells do not decrease the ultimate tensile strength of intact tendons in vivo and in vitro: protective role of mechanical loading. J Appl Physiol. 2007;102(1):11-7.
Datas de Publicação
-
Publicação nesta coleção
22 Nov 2012 -
Data do Fascículo
2012
Histórico
-
Recebido
07 Dez 2009 -
Aceito
06 Jan 2010