Resumos
OBJETIVO:Estudar química e nutricionalmente um isolado protéico de soro de leite bovino, um hidrolisado de colágeno bovino e misturas dos dois produtos visando elevado valor nutritivo e funcional. MÉTODOS: Realizaram-se análises da composição centesimal e do perfil de aminoácidos dos dois materiais protéicos, para cálculo da melhor adequação dos aminoácidos essenciais, com base no perfil recomendado pela Organização Mundial de Saúde. Os índices de valor nutritivo para o isolado de soro de leite, o hidrolisado de colágeno e as misturas foram determinados em ratos, a partir de ensaios de crescimento e de balanço de nitrogênio. Os resultados dos parâmetros nutricionais foram submetidos à análise de variância e ao teste de Tukey para a verificação de diferenças entre médias (p<0,05). RESULTADOS: O isolado protéico de soro de leite mostrou-se completo quanto aos aminoácidos essenciais pelo padrão de referência da Organização Mundial de Saúde enquanto que o hidrolisado de colágeno bovino mostrou-se deficiente em todos os aminoácidos essenciais, com agravante de completa ausência de triptofano. A caseína mostrou-se mais eficaz que o isolado de soro e as misturas quanto ao poder de promover crescimento em ratos. Não houve diferença estatística no crescimento dos ratos entre o isolado protéico de soro e a mistura 60% isolado de soro e 40% hidrolisado de colágeno. Nos demais índices de valor protéico a mistura 60% isolado de soro: 40% hidrolisado de colágeno mostrou-se igual ou superior à caseína e ao isolado (100%). CONCLUSÃO: A mistura 60% isolado de soro mais 40% hidrolisado de colágeno bovino apresentou elevado valor nutritivo e alto índice de solubilidade em água, mostrando-se promissora como ingrediente na formulação de alimentos dietéticos para idosos, inclusive pelas propriedades funcionais já descritas para essas proteínas.
Colágeno; Leite; Proteínas do leite
OBJECTIVE:The objective was the chemical and nutritional study of a bovine whey protein isolate, a bovine collagen hydrolysate and mixtures of the two products aiming at high nutritional and functional value. METHODS: Centesimal composition and amino acid analyses were performed on both proteinaceous materials for the calculation of an adequate amino acid profile based on the Food and Agriculture Organization/World Health Organization recommendation. The nutritive value indexes for the whey protein isolate, the collagen hydrolysate and mixtures of both proteins were determined in rats through growth assay and nitrogen balance. The experimental parameters from nutritional assays were submitted to analysis of variance and the Tukey test applied for differences among means (p<0.05). RESULTS: The whey protein isolate met all the requirements of the Food and Agriculture Organization/World Health Organization reference for essential amino acids while the collagen hydrolysate showed deficiency in all essential amino acids and complete absence of tryptophan. The casein showed higher efficiency than the whey isolate and mixtures of both proteins in promoting growth in the rat. There was no statistical difference in growth between the whey protein isolate and the mixture of 60% whey protein isolate and 40% collagen hydrolysate. In all other indexes of protein nutritive value the mixture 60% whey protein isolate and 40% collagen hydrolysate revealed itself equal or superior to casein and the 100% whey isolate. CONCLUSION: The protein mixture 60% whey protein isolate and 40% collagen hydrolysate showed high nutritive value and water solubility indexes, considered favorable properties as an ingredient for the formulation of dietetic products for elderly people.
Collagen; Milk proteins; Whey protein isolate
ORIGINAL ORIGINAL
Caracterização químico-nutricional de um isolado protéico de soro de leite, um hidrolisado de colágeno bovino e misturas dos dois produtos
Chemical-nutritional characterization of a whey protein isolate, a bovine collagen hydrolysate and mixtures of the two products
Fabiane La Flor Ziegler; Valdemiro Carlos Sgarbieri
Universidade Estadual de Campinas, Faculdade de Engenharia de Alimentos, Departamento de Alimentos e Nutrição. R. Monteiro Lobato, 80, Cidade Universitária, 13083-970, Campinas, SP, Brasil. Correspondência para/Correspondence to: V.C. SGARBIERI. E-mail: <sgarb@fea.unicamp.br>
RESUMO
OBJETIVO:Estudar química e nutricionalmente um isolado protéico de soro de leite bovino, um hidrolisado de colágeno bovino e misturas dos dois produtos visando elevado valor nutritivo e funcional.
MÉTODOS: Realizaram-se análises da composição centesimal e do perfil de aminoácidos dos dois materiais protéicos, para cálculo da melhor adequação dos aminoácidos essenciais, com base no perfil recomendado pela Organização Mundial de Saúde. Os índices de valor nutritivo para o isolado de soro de leite, o hidrolisado de colágeno e as misturas foram determinados em ratos, a partir de ensaios de crescimento e de balanço de nitrogênio. Os resultados dos parâmetros nutricionais foram submetidos à análise de variância e ao teste de Tukey para a verificação de diferenças entre médias (p<0,05).
RESULTADOS: O isolado protéico de soro de leite mostrou-se completo quanto aos aminoácidos essenciais pelo padrão de referência da Organização Mundial de Saúde enquanto que o hidrolisado de colágeno bovino mostrou-se deficiente em todos os aminoácidos essenciais, com agravante de completa ausência de triptofano. A caseína mostrou-se mais eficaz que o isolado de soro e as misturas quanto ao poder de promover crescimento em ratos. Não houve diferença estatística no crescimento dos ratos entre o isolado protéico de soro e a mistura 60% isolado de soro e 40% hidrolisado de colágeno. Nos demais índices de valor protéico a mistura 60% isolado de soro: 40% hidrolisado de colágeno mostrou-se igual ou superior à caseína e ao isolado (100%).
CONCLUSÃO: A mistura 60% isolado de soro mais 40% hidrolisado de colágeno bovino apresentou elevado valor nutritivo e alto índice de solubilidade em água, mostrando-se promissora como ingrediente na formulação de alimentos dietéticos para idosos, inclusive pelas propriedades funcionais já descritas para essas proteínas.
Termos de Indexação: Colágeno. Leite. Proteínas do leite.
ABSTRACT
OBJECTIVE:The objective was the chemical and nutritional study of a bovine whey protein isolate, a bovine collagen hydrolysate and mixtures of the two products aiming at high nutritional and functional value.
METHODS: Centesimal composition and amino acid analyses were performed on both proteinaceous materials for the calculation of an adequate amino acid profile based on the Food and Agriculture Organization/World Health Organization recommendation. The nutritive value indexes for the whey protein isolate, the collagen hydrolysate and mixtures of both proteins were determined in rats through growth assay and nitrogen balance. The experimental parameters from nutritional assays were submitted to analysis of variance and the Tukey test applied for differences among means (p<0.05).
RESULTS: The whey protein isolate met all the requirements of the Food and Agriculture Organization/World Health Organization reference for essential amino acids while the collagen hydrolysate showed deficiency in all essential amino acids and complete absence of tryptophan. The casein showed higher efficiency than the whey isolate and mixtures of both proteins in promoting growth in the rat. There was no statistical difference in growth between the whey protein isolate and the mixture of 60% whey protein isolate and 40% collagen hydrolysate. In all other indexes of protein nutritive value the mixture 60% whey protein isolate and 40% collagen hydrolysate revealed itself equal or superior to casein and the 100% whey isolate.
CONCLUSION: The protein mixture 60% whey protein isolate and 40% collagen hydrolysate showed high nutritive value and water solubility indexes, considered favorable properties as an ingredient for the formulation of dietetic products for elderly people.
Indexing terms: Collagen. Milk proteins. Whey protein isolate.
INTRODUÇÃO
O aumento da preocupação do consumidor com a alimentação e a saúde tem sido uma constante. O consumidor tem mostrado preferência cada vez maior por alimentos que possam trazer algum benefício adicional à sua saúde em relação aos produtos tradicionalmente comercializados. Por esta razão um grande número de alimentos transformados com características funcionais tem sido desenvolvido pela indústria de alimentos1.
O mercado mundial de alimentos funcionais foi estimado, em 2001, em US$47,6 bilhões, comparado com, aproximadamente, US$30 bilhões em 19952.
Uma pesquisa3 revelou que 86% das pessoas escolhem seus alimentos porque eles contêm ingredientes nutricionais desejáveis, 80% porque não contêm ingredientes indesejáveis e 76% escolhem alimentos fortificados com substâncias nutricionais específicas.
Avanços recentes nas pesquisas nutricionais e biomédicas têm revelado relações complexas entre nutrição e doença, sugerindo que algumas proteínas alimentícias e seus peptídios poderão ser úteis na desaceleração e/ou diminuição de riscos de um grande número de condições patológicas derivadas da má nutrição, de doenças ou de injúrias de diversas naturezas4-9.
O colágeno é a proteína mais abundante no organismo animal representando cerca de 25% de toda proteína corporal. Sua composição aminoacídica é bastante atípica sendo deficiente em todos os aminoácidos considerados nutricionalmente essenciais com o agravante de não apresentar o triptofano em sua composição10, dessa forma, o seu valor nutritivo, com base no escore de aminoácidos essenciais (EAE), poderá ser considerado zero. Por outro lado, várias pesquisas11-13 têm mostrado a importância do colágeno e seus derivados na manutenção e reconstituição da pele, dos ossos, dos tecidos cartilaginosos e da matriz extracelular.
As proteínas do soro de leite apresentam elevado valor nutritivo cuja composição de aminoácidos pode complementar a do colágeno, além de possuir propriedades funcionais importantes para a saúde humana4-6.
Nesta pesquisa o objetivo foi estudar a composição aminoacídica de um isolado protéico de soro de leite bovino, de um hidrolisado de colágeno bovino e de misturas dessas proteínas, com o propósito de estabelecer uma proporção adequada entre as duas fontes protéicas, a qual fez parte da composição de um produto formulado para atender às deficiências nutricionais e fisiológicas de idosos10.
MÉTODOS
O isolado protéico do soro de leite bovino (WPI), ALACEN 895, foi adquirido da empresa New Zealand Milk Products (NZMP), São Paulo. O hidrolisado de colágeno bovino (HCB) foi gentilmente fornecido pela empresa Gelita South América, Cotia, São Paulo, sendo um dos produtos de sua linha de produção industrial.
Caracterização química e física dos isolados protéicos
Umidade, sólidos totais, cinza e proteína (%N x F) foram determinados nas duas amostras pelos procedimentos descritos no Association of Official Analytical Chemists (AOAC)14. Para proteína empregou-se o método de Kjeldahl (semi-micro) usando-se como fator de conversão F=6,38 e 5,55 para o WPI e HCB, respectivamente. Os lipídios totais foram determinados pelo método de Bligh & Dyer15, e os carboidratos por diferença entre 100% e a soma dos demais componentes.
Os perfis de aminoácidos das duas fontes protéicas foram determinados, após hidrólise ácida (110°C, 22h, HCl 6N), em um analisador Dionex Dx-300, dotado de coluna de troca catiônica e também reação pós-coluna com ninidrina. Para a quantificação utilizou-se uma mistura padrão de aminoácidos da Pierce (EUA).
O grau de hidrólise (GH) do hidrolisado de colágeno bovino foi estabelecido pela reação colorimétrica dos aminoácidos com o ácido trinitro-benzeno sulfônico (TNBS)16, usando-se curva padrão construída com o aminoácido leucina.
O perfil de solubilidade, em água a 25°C, da mistura protéica 60% WPI: 40% HCB foi determinado na faixa de concentração (p/v) de 1,25 a 20%, pelo método de Morr et al.17.
Avaliação nutricional: ensaios com ratos
Os dois componentes protéicos, WPI e HCB e as combinações dos dois componentes em diferentes proporções foram avaliados nutricionalmente, por meio de dois ensaios com ratos: o primeiro ensaio teve a duração de 21 dias no qual foram determinadas curvas de crescimento, consumo de dieta, consumo de proteína, quociente de eficiência protéica (PER) e quociente líquido de eficiência protéica (NPR)18; no segundo ensaio, com duração de 10 dias, foram determinados o nitrogênio ingerido com a dieta (NI), o nitrogênio excretado nas fezes (NF), a digestibilidade protéica verdadeira (Dv) e calcularam-se os escores de aminoácidos essenciais corrigidos pelas digestibilidades verdadeiras (PDCAAS)18.
A ilustração gráfica do protocolo geral dos dois ensaios é mostrada na Figura 1 (A,B).
Os ratos utilizados foram da linhagem Wistar, recém desmamados, provenientes do Centro Multidisciplinar de Investigações Biológicas (CEMIB) da Universidade Estadual de Campinas. Após chegada ao laboratório de ensaio, permaneceram por 3 a 4 dias em ração comercial e água ad libitum para adaptação às condições do laboratório (20°C, desvio-padrão - DP=2), umidade do ar de 75% (DP=3) e períodos alternados de claro-escuro de 12h). Findo o período de adaptação os ratos foram pesados e descartados os que estavam muito abaixo ou acima do peso médio do grupo. Os demais animais, 6 por tratamento no primeiro ensaio e 8 por tratamento no segundo ensaio, foram distribuídos em grupos, por sorteio.
As médias dos pesos iniciais dos ratos que compuseram os grupos do primeiro ensaio variaram entre 72,3g (DP=11,3g) a 96,3g (DP=8,6), enquanto que nos grupos do segundo ensaio os pesos médios dos ratos variaram de 78,4g (DP=4,6) a 81,2g (DP=7,2).
As dietas experimentais foram preparadas com base nas recomendações do American Institute of Nutrition (AIN - 93G)19, sendo que o componente protéico foi reduzido de 17 para 12%, mantendo as dietas isoenergéticas pela adição de mais 5% de carboidrato. Durante todo o período experimental os ratos tiveram livre acesso às dietas e à água.
Foram rigorosamente seguidos os aspectos éticos específicos determinados pela Declaração de Helsinki20, bem como as normas e diretrizes vigentes no Brasil quanto à experimentação com animais de laboratório. O trabalho foi submetido a Comissão de Ética na Experimentação Animal (CEEA) no Instituto de Biologia da Unicamp recebendo o número de protocolo 1413-1.
Os resultados dos ensaios biológicos foram submetidos à análise de variância (ANOVA) e ao estudo de diferenças entre médias, detectadas pelo teste Tukey (p<0,05). Utilizou-se o programa Statistica: Basic Statistics and Tables.
RESULTADOS E DISCUSSÃO
A composição centesimal aproximada dos dois componentes protéicos, o soro de leite bovino - WPI e o hidrolisado de colágeno bovino - HCB foi de 92 e 91% de proteína, respectivamente, sem diferença estatística entre ambos. Os dois preparados se caracterizaram como isolados protéicos por conter acima de 90% de proteína. Os teores de lipídios totais e carboidratos foram muito baixos nos dois isolados, os teores de cinza foram de 1,6% no WPI e 0,4% no HCB e a umidade (~7%) foi mais elevada no HCB que no WPI (5%). Segundo US Dairy Expert Council21 o WPI apresenta em média, por 100g do produto: cálcio 600mg, potássio 300mg, sódio 250mg, fósforo 210mg, e ferro 9mg.
Os perfis de aminoácidos ácidos essenciais para os dois isolados e as respectivas misturas são comparados na Tabela 1, juntamente com seus respectivos escores de aminoácidos essenciais.
A Tabela 1 mostra que enquanto o WPI atende, segundo o padrão World Health Organization22, a todos os aminoácidos essenciais gerando um EAE igual ou superior a 1,0, o HCB mostra deficiência em todos os aminoácidos essenciais, particularmente nos sulfurados e completa ausência de triptofano, gerando EAE igual a zero, portanto, o colágeno é incapaz de promover crescimento, em animais e humanos. No WPI os aminoácidos essenciais dominantes são os sulfurados (metionina mais cisteína), o triptofano, a lisina e os de cadeias ramificadas, particularmente a leucina.
Dentre os aminoácidos não essenciais e condicionalmente essenciais predominam no WPI os ácidos glutâmico e aspártico. Os aminoácidos não essenciais: aspártico, glutâmico, prolina, glicina e alanina representaram cerca de 92% do total de aminoácidos do HCB, sendo 26,6% para a glicina, 12,3% prolina, 8,9% alanina e 18,2% para os ácidos aspártico mais glutâmico. A hidroxiprolina, componente importante do colágeno, não foi dosada no hidrolisado ácido preparado para a análise de aminoácidos.
Dados da literatura demonstraram que o WPI, por conter elevado teor de aminoácidos sulfurados, particularmente cisteína e ácido glutâmico e por apresentar na estrutura primária de algumas de suas proteínas, seqüências glu - (cys)2, que poderiam ser absorvidas como glutamil - cisteína, promoveu forte estímulo à síntese de glutationa (glutamil - cisteinil - glicina) nos tecidos4,5,23,24. Por outro lado, o fato de as proteínas do WPI apresentarem concentrações elevadas de aminoácidos de cadeias ramificadas foi considerado, por alguns autores, como de importância para a atividade atlética25, por estimular a síntese de proteínas musculares26,27 no tratamento de traumas múltiplos e da cicatrização de queimaduras. A relação metionina:cisteína próxima à unidade e a concentração relativamente baixa de aminoácidos de cadeia lateral aromática têm sido apontados como fatores nutricionais favoráveis para crianças com fenilcetonúria28.
O fato de o perfil aminoacídico do soro de leite se assemelhar ao do leite humano, permite que sua proteína, particularmente a α-lactalbumina, seja recomendada na formulação de produtos para nutrição infantil, bem como na elaboração de produtos de baixo teor energético e baixo teor de resíduos para uso pós-cirúrgico, geriátrico e em pacientes imobilizados29,30.
Embora o perfil aminoacídico do HCB seja incapaz de promover crescimento e manter o balanço de nitrogênio, como única fonte de proteína, foi o melhor substrato para a síntese do colágeno nos tecidos conjuntivos e nas cartilagens11, exatamente em virtude de sua composição aminoacídica atípica.
Oesser et al.11 demonstraram que peptídios de colágeno de até 15 - 20 kDa puderam ser absorvidos a partir do hidrolisado. Foram usados peptídios marcados com carbono-14 (14C) e hidrolisado não marcado, porém enriquecido com prolina (14C), ao mesmo nível de radioatividade, tendo-se observado que a radioatividade da prolina (-14C) livre e do hidrolisado (-14C) distribuía-se igualmente no plasma e em vários outros tecidos. Porém, nas cartilagens a radioatividade do hidrolisado (-14C) foi cerca de 2,6 vezes maior que a proveniente do aminoácido prolina (-14C), sugerindo haver uma especificidade das cartilagens pela utilização dos peptídios de colágeno, para síntese de suas proteínas. Oesser & Seifert12, em culturas de condrócitos bovino, observaram que hidrolisados de colágeno eram capazes de estimular a síntese e a secreção de colágeno tipo II no meio de cultura, enquanto que colágeno intacto não produzia esse estímulo.
A mais ampla aplicação e divulgação do hidrolisado de colágeno como ingrediente funcional tem sido na prevenção e/ou no tratamento da osteoartrite e da osteoporose13. Doses diárias de 10g têm sido usadas em estudos clínicos, mostrando eficiência na diminuição de dores articulares e melhora da mobilização de pacientes com vários graus de osteoartrite e osteoporose.
Há, portanto, suficiente informação na literatura sobre estudos, tanto in vitro como in vivo, que permitem trabalhar com a hipótese de que uma mistura nutricionalmente adequada de soro de leite bovino (WPI) e de colágeno hidrolisado (HCB) deverá apresentar benefícios aos idosos e a outros grupos em que as propriedades imunoes-timulatórias e antioxidantes das proteínas do WPI e as propriedades protetoras e reparadoras das cartilagens e da matriz extracelular dos tecidos conjuntivos, atribuídas ao colágeno, possam agir sinergisticamente beneficiando os idosos. Esse grupo comumente apresenta deficiências nutricionais associadas a deficiências imunológicas, bem como a dores articulares e à dificuldade de locomoção. Assim como os idosos, outros grupos como atletas, pacientes no pós-operatório de cirurgias de grande porte ou que sofreram traumas com lesões graves ou queimaduras, também poderiam ser beneficiados.
O hidrolisado de colágeno bovino (HCB) objeto deste estudo apresentou um grau de hidrólise de 11%, considerado grau médio. Esse material não geleifica, como a gelatina original, e apresenta elevada solubilidade em água.
A solubilidade em água da mistura 60% WPI: 40% HCB a 25°C para concentrações de 2,5 a 20% (p/v) da mistura variou entre 97 a 100%. Essa característica favorece bastante o uso desta mistura para a formulação de bebidas e de outros alimentos a serem utilizados em forma líquida.
A Figura 2 representa o ganho de peso dos ratos no período de 21 dias nas várias dietas estudadas. Não houve diferença estatística no ganho de peso entre o tratamento caseína comercial (CC) e a mistura 80% WPI: 20% HCB, por outro lado, não houve diferença também entre o tratamento 60% WPI: 40% HCB e o WPI 100%, sendo que ambos diferiram da caseína. As misturas 40% WPI: 60% HCB e 20% WPI: 80% HCB foram inferiores às demais, sendo a mistura 20% WPI: 80% HCB a que promoveu o menor crescimento.
Os tratamentos 100% HCB e a dieta isenta de proteína (aprotéica) não aparecem no gráfico da Figura 2, por terem promovido perdas significativas de peso nos animais (dados não apresentados). É interessante notar que a mistura com 40% de HCB não diferiu do WPI 100%, mas diferiu estatisticamente da caseína. Como o principal propósito do estudo foi estabelecer uma mistura que se igualasse ou mesmo se aproximasse do WPI, a mistura com 40% de HCB foi escolhida para a formulação do produto para idosos por estabelecer melhor equilíbrio entre as duas proteínas e ser mais econômica, considerando o preço e a disponibilidade relativa dos dois isolados, além do fato de que o colágeno, segundo dados da literatura, apresenta propriedades funcionais que favorecem a saúde de idosos13. O WPI é menos disponível no mercado e mais oneroso para ser produzido que o HCB.
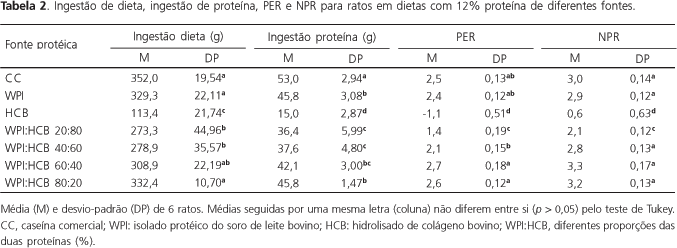
A Tabela 2 representa os dados de quociente de eficiência protéica (PER) e quociente líquido de eficiência protéica (NPR) para os tratamentos dos ensaios, a partir da ingestão protéica e do ganho de peso. Observou-se que os dois índices foram mais elevados nas misturas com 60 e 80% de WPI, porém não diferiram estatisticamente dos valores calculados para a caseína e para o WPI (100%). A mesma tendência foi observada em relação ao consumo de dieta e ingestão de proteína para os tratamentos mencionados. Os menores índices foram determinados para os ratos em HCB, sendo que os tratamentos com 20 e 40% de WPI resultaram em valores intermediários. Da mesma forma que pelo critério crescimento (Figura 2), os parâmetros NPR e PER indicaram a escolha da mistura 60% WPI : 40% HCB como a mais adequada para futuras formulações, tanto pela qualidade nutricional como pelas considerações econômicas e funcionais, já mencionadas.
Friedman31 considerou de elevado valor nutritivo proteínas com PER > 2,0, o que classifica a caseína, o WPI e as misturas com 60 e 80% WPI mais 40 ou 20% HCB como de excelente valor nutritivo.
Na Tabela 3 encontram-se os dados de digestibilidade verdadeira da proteína (Dv%) e de aminoácidos essenciais corrigidos pelas digestibilidades verdadeiras (PDCAAS), calculados com base no nitrogênio ingerido, no nitrogênio fecal total e no nitrogênio fecal endógeno. O nitrogênio fecal endógeno foi estimado para cada dieta, subtraindo-se o nitrogênio fecal do grupo em dieta aprotéica do nitrogênio fecal do grupo recebendo dieta com 12% de proteína.
O HCB e a mistura com 60% WPI apresentaram a maior digestibilidade não diferindo entre si estatisticamente (p>0,05), porém diferente de todos os demais tratamentos (p<0,05), os quais se igualaram entre si. Os índices PDCAAS (%) se igualaram à Dv para a caseína e o WPI e foi igual a zero para o HCB, em virtude da completa ausência de triptofano no hidrolisado (EAE=0), e aumentou progressivamente nos demais tratamentos em virtude da elevação do EAE pelo aumento da proporção de WPI nas misturas. Contudo não atingiram o EAE igual a 1,0, permanecendo os PDCAAS inferiores aos da CC e do WPI.
O experimento de balanço nitrogenado (Protocolo Figura 1B) teve a duração de 10 dias e consistiu na determinação do nitrogênio ingerido (NI), nitrogênio excretado nas fezes (NF) e na urina (NU). A diferença entre o NI e o total de nitrogênio excretado (NF + NU) representa o balanço de nitrogênio (BN) ou o nitrogênio retido no organismo e que depende da qualidade nutricional ou do balanço de aminoácidos essenciais absorvidos.
O BN foi superior (p<0,05) para a dieta de caseína (CC) e não diferiu entre o isolado de proteína de soro (WPI) e as misturas WPI e o hidrolisado de colágeno bovino (HCB) nas proporções 50:50% ou 60:40%. O BN variou entre 1,93g N para a CC e 1,46g N para a mistura 50:50%.
A digestibilidade, que representa o nitrogênio absorvido (% do NI), foi superior para o WPI (95,7%) e 95,1% para CC. O menor valor encontrado (93,6%) foi para a mistura 50% WPI: 50% HCB e um valor intermediário (94,4%) para a mistura 60% WPI: 40% HCB.
Os indicadores valor biológico (VB) e da utilização líquida da proteína (NPU) foram superiores (p<0,05) para a CC, que não diferiu (p>0,05) do WPI e da mistura 60% WPI: 40% HCB sendo, entretanto, superior aos da mistura 50% WPI: 50% HCB. Os valores, tanto de VB como de NPU, variaram na faixa de 80 a 90%.
A análise cuidadosa do conjunto dos dados dos dois ensaios biológicos permitiu concluir que as misturas WPI: HCB, a partir de 50% de WPI apresentou excelente valor nutritivo, se assemelhando ao WPI sendo, porém, inferior à caseína no tocante ao poder de promover crescimento em ratos. Por outro lado, testes preliminares de imunoestimulação (não apresentados) mostram a superioridade da mistura WPI: HCB 60:40 em relação à mistura 50:50 e, particularmente em relação à caseína.
A mistura 60% WPI: 40% HCB atingiu melhor o objetivo desta pesquisa, uma vez que elevou o valor nutritivo do colágeno (HCB) de, praticamente, zero para valores iguais ou superiores ao do WPI. Por outro lado, espera-se uma complementação das várias propriedades funcionais do WPI5,7-9 com as do colágeno hidrolisado (HCB)11-13, na formulação de um complemento dietético para idosos.
CONCLUSÃO
A composição em aminoácidos essenciais do isolado protéico de soro de leite bovino (WPI) atendeu completamente às recomendações da Food and Agriculture Organization/World Health Organization; a do hidrolisado de colágeno bovino (HCB) mostrou-se deficiente em todos os aminoácidos essenciais e totalmente deficiente em triptofano, resultando em escore de aminoácidos essenciais igual a zero.
No ensaio de crescimento com ratos o hidrolisado de colágeno bovino promoveu perda de peso dos animais, sendo os maiores ganhos de peso registrados para as dietas com caseína seguida pelas misturas 80% WPI: 20% HCB, 60% WPI: 40% HCB e WPI (100%).
Nos dois ensaios com ratos e para a maioria dos indicadores estudados a mistura 60% WPI: 40% HCB mostrou-se equivalente ou superior ao WPI (100%). Desta forma chegou-se à conclusão que a mistura 60% WPI: 40% HCB é a mais indicada como fonte protéica para a formulação de um produto dietético nutritivo e funcional para idosos.
AGRADECIMENTOS
A Fundação de Amparo à Pesquisa do Estado de São Paulo, pelo apoio financeiro e à empresa GELITA South America, Cotia (SP), pela doação do hidrolisado de colágeno e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico pela concessão de bolsa de mestrado para F.L.F. Ziegler, pela bolsa de produtividade em pesquisa e pelas taxas de bancada para V.C. Sgarbieri.
COLABORAÇÃO
F.L.F. ZIEGLER participou da coleta de dados, tabulação e discussão dos resultados e elaboração do artigo. V.C. SGARBIERI participou na elaboração da estratégia experimental, tabulação e discussão dos resultados e elaboração do artigo.
Recebido em: 11/12/2006
Versão final reapresentada em: 22/4/2008
Aprovado em: 26/11/2008
- 1. Bello J. Los alimentos funcionales o nutraceuticos: nueva gama de productos em la indústria alimentaria. Alimentaria: Rev Technol Hig Alim. 1995; 265:25-30.
- 2. Nutrition Business Journal 2003. Functional foods report. [cited 2004 Jan 24] Available from: <www.nutritionbusiness.com>
- 3. Sloan AE. The top 10 functional food trends: the next generation. Food Technol. 2002; 56 (4):32-57.
- 4. Sgarbieri VC. Food proteins and peptides presenting specific protection to human healthy (a review). Food for health in the pacific rim. In: Whitaker JR, Norman FH, Shoemaker CF, Singh RP, editores. Thrumbull, Conn: Food and Nutrition Press; 1999. p.335-52.
- 5. Sgarbieri VC. Propriedades fisiológicas-funcionais das proteínas do soro de leite. Rev Nutr. 2004; 17(4):397-409.
- 6. Sgarbieri VC. The role of dietary energy and of macrocomponents of foods in modulating carcinogenesis (an review). Cienc Cultura. 1999; 51(2):104-21.
- 7. Dias NFGP, Sgarbieri VC, Jacobucci HB, Rangel HA, Tanikawa C. Dietary protein, immune function and colon carcinogenesis in mouse. Lait. 2006; 86: 213-26.
- 8. Mezzaroba LFH, Carvalho JE, Ponezi AN, Antônio MA, Monteiro KM, Possenti A, et al Antiulcerative properties of bovine alpha-lactalbumin. Intern Dairy J. 2006; 16(9):1005-12.
- 9. Moreno YF, Sgarbieri VC, da Silva MN, Toro A, Vilela MN. Features of whey protein concentrate supplementation in children with rapidly progressive HIV infection. J Trop Pediatrics. 2005; 52(1):34-8.
- 10. Ziegler FLZ. Desenvolvimento de um produto dietético funcional para idosos [dissertação]. Campinas: Universidade Estadual de Campinas; 2006.
- 11. Oesser S, Adam M, Babel E, Seifert J. Oral administration of 14C-labelbed gelatin hydrolysate leads to an accumulation of radioactivity in cartilage of mice (C57/BL). J Nutr. 1999; 129(10):1891-5.
- 12. Oesser S, Seifert J. Stimulation of type II collagen biosynthesis and secretion in bovine chondrocytes cultured with degraded collagen. Cell Tissue Res. 2003; 311(3):393-9.
- 13. Moskowitz RW. Role of collagen hydrolysate in bone and joint disease. Semin Arthrites Rheum. 2000; 30(2):87-99.
- 14. Association of Official Analytical Chemists. Official Methods of Analysis. 15th ed. Washington (DC); 1990.
- 15. Bligh EG, Dyer WJ. A rapid method of total lipid extraction and purification. Can J Biochem Physiol. 1959; 37(8):911-7.
- 16. Adler-Nissen J. Determination of the degree of hydrolysis of food protein hydrolysates by trinitrobenzenesulfonic acid. J Agric Food Chem. 1979; 27(6):1256-62.
- 17. Morr CV, German B, Kinsella JE, Regenstein JP, Buren V, Kilara A, et al. Collaborative study to develop a standardized food protein solubility procedure. J Food Sci. 1985; 50(6):1715-8.
- 18. Sgarbieri VC. Proteínas em alimentos protéicos: propriedades, degradações, modificações. São Paulo; 1996. Cap. IV, p.366-78.
- 19. Reeves PG, Nielsen FH, Fahey JGC. AIN-93. Purified diets for laboratory rodents: Final report of the American Institute of Nutrition Ad Hoc Writing Committee on the formulation of the AIN-76A rodent diet. J Nutr. 1993; 123(11):1939-51.
-
20Declaração de Helsinki. 52ª Assembléia Geral da Associação Médica Mundial. Edinburgo, Escócia, outubro de 2000.
- 21. Criam MG, Munro HN. Proteins. In Olson RE, editor. Present Knowledge in nutrition. 5th ed. Washington (DC): Nutrition Foundation; 1982.
-
22World Health Organization. Report on a joint FAO/WHO Expert Consultation on Protein Quality Evaluation. Bethesda: FAO; 1990.
- 23. Bounous G, Gold P. The biological activity of undenatured dietary whey proteins: role of glutathione. Clin Invest Med. 1991; 14(4):296-309.
- 24. Marshall ND. Therapeutic applications of whey protein. Altern Med Rev. 2004; 9(2):136-56.
- 25. Criam MG, Munro HN. Proteins. In: Present Knowledge of nutrition. 5th ed. Washington (DC): The Nutrition Foundation; 1982.
- 26. Brenan MF, Cerra F, Daly JM, Fisher JE, Maclawer LL, Smith, RJ, et al. Report in a research workshop: branched chain amino acids in stress and injury. J Parent Ent Nutr. 1986; 10(5):446-52.
- 27. Alexander JW, Gottschlich MM. Nutritional immunomodulation in burn patients. Crit Care Med. 1990; 18(2):S149-53.
- 28. Hambraens L. Nutritional aspects of milk proteins. In: Fox PF, editor. Development of dairy chemistry. London: Applied Science; 1982. p.289-313.
- 29. Satterlee LD. Protein for use in foods. Food Technol. 1981; 35:53-60.
- 30. Heine WE, Klein PD, Reeds PJ. The importance of a-lactalbumin in infantile nutrition. J Nutr. 1991; 121(3):277-83.
- 31. Friedman M. Nutritional value of proteins from different food sources. A review. J Agric Food Chem. 1996; 44(1):6-29.
Datas de Publicação
-
Publicação nesta coleção
05 Jun 2009 -
Data do Fascículo
Fev 2009
Histórico
-
Aceito
26 Nov 2008 -
Recebido
11 Dez 2006